一种胰腺癌动物模型的构建方法及其应用与流程
1.本发明涉及基因工程技术领域,具体而言,涉及一种胰腺癌动物模型的构建方法及其应用。
背景技术:
2.胰腺导管癌(pdac)是一种死亡率较高的消化道恶性肿瘤,占所有恶性胰腺肿瘤的90%以上。胰腺癌诊断困难,治疗反应有限,且预后差,5年总生存率低于8%,是全球癌症死亡率第四的癌症。对患者肿瘤样本分析的结果表明,pdac的基因组结构是复杂的,其特征是染色体高度不稳定,kras、p53、smad4、cdkn2a和arid1a基因经常发生突变(最常见的是kras和p53突变),并且体细胞编码突变相对较少。在所有pdac患者中,80-90%存在kras突变,50-75%存在p53突变。通过对184个国家的数据进行分析后,研究发现全球范围内胰腺癌的发病率和死亡率呈上升趋势,尤其是在女性和50岁以上的人群中,见图1。
3.ras基因一直是人类肿瘤中最为广泛致癌基因,近30%的肿瘤患者体内都存在着ras突变。已知ras基因包括kras、nras和hras,其中kras突变最常见。从1982年发现kras突变开始,众多医药企业走上了漫长的靶向药物研发之路。截止目前,除了提交上市申请的amg510,展现很好临床疗效的mrtx849,以及novartis pharma ag/诺华的kras g12c突变的晚期实体瘤的适应症获批临床,但尚未有任何靶向kras的药物上市。
4.所有疾病的发病机制研究和药物研发离不开合适的动物模型,现有能够应用于胰腺癌药物筛选或药效评估的模型较少,且普遍存在周期长,稳定性不好且难以监测的技术难题。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种胰腺癌动物模型的构建方法及其应用。
7.本发明是这样实现的:第一方面,本发明实施例提供了一种稳定表达荧光素酶的细胞系的构建方法,其包括:将胰腺癌模型的胰腺癌细胞依次在无血清培养基、含1%~3%fbs的培养基以及含8%~12%fbs的培养基中培养后,进行luciferase病毒侵染,筛选获得稳定表达luciferase的细胞作为mpa-luciferase细胞。
8.第二方面,本发明实施例提供了一种稳定表达荧光素酶的细胞系,其由前述实施例所述的稳定表达荧光素酶的细胞系的构建方法构建获得。
9.第三方面,本发明实施例提供了一种胰腺癌动物模型的构建方法,其包括:将如前述实施例所述的稳定表达荧光素酶的细胞系导入目标动物体内,得到胰腺癌动物模型。
10.第四方面,本发明实施例提供了如前述实施例所述的稳定表达荧光素酶的细胞系或如前述实施例所述的胰腺癌动物模型的构建方法构建的胰腺癌动物模型在筛选抗胰腺癌药物中的应用。
11.第五方面,本发明实施例提供了如前述实施例所述的稳定表达荧光素酶的细胞系或如前述实施例所述的胰腺癌动物模型的构建方法构建的胰腺癌动物模型在评价药物对于胰腺肿瘤转移的影响中的应用。
12.本发明具有以下有益效果:本发明通过在自发胰腺癌的kpc模型体内获取和分离胰腺癌细胞系,并在细胞系上稳定表达了luciferase基因用于体内标记,将该细胞系导入目标动物体内,能够构建一种可视化且稳定高效的胰腺癌药物评价模型。该模型评价药物周期短,稳定性好,监测容易,成本低,且能保持胰腺癌的特性,可用于胰腺癌相关药物的筛选。
附图说明
13.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
14.图1为背景技术中不同性别和年龄组胰腺癌的全球和区域负担、危险因素和流行病学趋势;图2为b6-kraslsl-g12d、b6-p53lsl-r172h和b6-pdx1 cre模型策略示意图;图3为胰腺肿瘤组织基因型鉴定跑胶图;图4为p53
r172h
和kras
g12d
的基因测序结果;图5为mpa
kpc
瘤块的成瘤性测试(左图)和不同代次mpa
kpc
瘤块的h&e染色(右图);图6为mpa
kpc
瘤块在c57bl/6小鼠上的药效实验;图7为mpa
kpc-luciferase细胞体外活体成像图片;图8为不同克隆的mpa
kpc-luciferase细胞皮下生长情况;图9为原位胰腺成瘤性结果;图10为原位胰腺药物治疗过程体内肿瘤荧光图;图11为原位胰腺药物治疗后不同组别瘤重数据;图12为原位胰腺药物治疗后不同组别肿瘤图示。
具体实施方式
15.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
16.本发明提供了一种稳定表达荧光素酶的细胞系的构建方法,其包括:将胰腺癌模型的胰腺癌细胞依次在无血清培养基、含1%~3%fbs的培养基以及含8%~12%fbs的培养基中培养后,进行luciferase病毒侵染,筛选获得稳定表达luciferase的细胞作为mpa-luciferase细胞。
17.本文中“稳定表达luciferase的细胞”具有荧光较强的特征。
18.本发明将胰腺癌细胞依次在无血清培养基、含1%~3%fbs的培养基以及含8%~12%
fbs的培养基中培养的目的在于,先用无血清培养基清除肿瘤组织中的纤维细胞,基质细胞,使得生命力较强的肿瘤细胞存留下来,再用低血清培养基使得肿瘤细胞状态得以慢慢恢复且加固清除肿瘤组织中剩余的纤维细胞,基质细胞,最后用正常培养基培养肿瘤细胞,使得肿瘤细胞处于正常的生长状态。如果不这样进行培养,则可能导致一方面细胞系中可能混有基质细胞等杂质细胞,另外肿瘤细胞生长异常等的问题。
19.优选地,所述胰腺癌模型包括b6-kpc小鼠模型。当胰腺癌模型为b6-kpc小鼠时,mpa-luciferase细胞记为mpa
kpc-luciferase细胞。
20.所述b6-kpc小鼠是目前成功建立的一种胰腺导管癌模型小鼠,具有很多与人胰腺癌相似的特点,如胰腺内皮细胞瘤形成,强烈的免疫反应等,包含了kras和tp53基因突变。b6-kpc小鼠的p53基因含有一个显性抑制性点突变tp53r172h,kras基因含有一个条件性活化点突变(krasg12d)。kras突变基因的上游含有lox-stop-lox终止序列,在没有cre重组酶的条件下是不表达的。将cre重组酶连接到pdx1的启动子后,其将在胰腺的腺泡、胰岛和导管中表达。b6-kpc小鼠可以直接通过购买的方式获得,或者基于现有技术公开的制备方法进行制备获得,不再对制备方法进行赘述。
21.优选地,在无血清培养基中的培养条件为35~40℃,3%~7% co2,培养4~6天,优选为37℃,5% co2,培养4~6天。无血清培养基优选为dmem。
22.优选地,在含质量体积比为1%~3% fbs的培养基中的培养条件为35~40℃,3%~7% co2,培养4~6天,优选为37℃,5% co2,培养4~6天。含质量体积比为1%~3% fbs的培养基优选为dmem+2%fbs。
23.优选地,在含质量体积比为8%~12% fbs的培养基中的培养条件为35~40℃,3%~7% co2,培养4~6天,优选为37℃,5% co2,培养4~6天。含质量体积比为8%~12% fbs的培养基优选为dmem+10%fbs。
24.本发明还提供了一种稳定表达荧光素酶的细胞系,其由前述任意实施例所述的稳定表达荧光素酶的细胞系的构建方法构建获得。
25.优选地,所述细胞系为小鼠肿瘤细胞系mpa
kpc-luciferase,2022年2月23日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:c202249,保藏地址为中国.武汉.武汉大学。
26.本发明还提供了一种胰腺癌动物模型的构建方法,其包括:将如前述任意实施例所述的稳定表达荧光素酶的细胞系导入目标动物体内,得到胰腺癌动物模型。
27.在可选的实施方式中,所述导入的方法包括注射。优选地,所述注射包括胰腺原位注射、静脉注射、腹腔注射、皮下注射、皮内注射和肌肉注射中的任意一种。所述静脉注射优选为尾静脉注射。
28.优选地,所述构建方法还包括将所述细胞系培养为设定体积的瘤块后,再导入所述目标动物体内,导入时,可以对瘤块进行捣碎,然后通过注射的方式进行导入。
29.所述设定体积为600~1000mm3,例如600mm3、700 mm3、800 mm3或1000 mm3中的任意数值或任意两项之间的范围。将细胞系培养为800~1000 mm3的瘤块的方法可以选择在小鼠模型体内进行,通过皮下注射的方式,将细胞系导入皮下,培养获得对应体积的瘤块,注射量优选为(1~10)
×
105/100μl/只小鼠。
30.优选地,所述目标动物包括小鼠。
31.优选地,当目标动物为小鼠时,所述瘤块的导入量为1~9mm3。
32.本发明实施例还提供了如前述任意实施例所述的稳定表达荧光素酶的细胞系或如前述任意实施例所述的胰腺癌动物模型的构建方法构建的胰腺癌动物模型在筛选防治胰腺癌药物中的应用。
33.所述防治是指预防和/或治疗,治疗包括:治愈疾病,对病理伤害和/或临床症状具有改善效果。
34.本发明实施例还提供了如前述任意实施例所述的稳定表达荧光素酶的细胞系或如前述任意实施例所述的胰腺癌动物模型的构建方法构建的胰腺癌动物模型在评价药物对于胰腺肿瘤转移的影响中的应用。
35.以下结合实施例对本发明的特征和性能作进一步的详细描述。
36.实施例11.mpa
kpc-luciferase细胞系构建1.1 b6-b6-kpc小鼠构建方法将b6-p53r172h小鼠与b6-kraslsl-g12d小鼠配繁后获得的b6-kp小鼠,再与b6-pdx1cre小鼠配繁获得的三基因小鼠模型即b6-kpc,实现了自发胰腺癌模型构建,参照图2。
37.1.2 利用“pdx”样本库构建技术进行肿瘤体内扩库和药效研究1.2.1获取b6-b6-kpc小鼠胰腺肿瘤组织进行pcr鉴定和测序。
38.(1)pcr鉴定结果trp53的鉴定引物见表1。
39.表1鉴定引物kras的鉴定引物见表2。
40.表2 鉴定引物pdx1的鉴定引物见表3。
41.表3 鉴定引物胰腺肿瘤组织基因型鉴定跑胶图见图3。
42.(2)p53
r172h
和kras
g12d
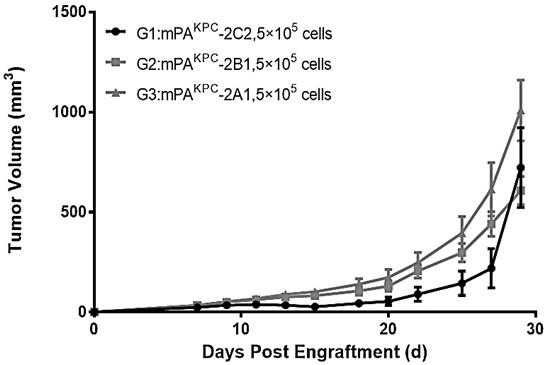
的基因测序结果见图4。
43.1.2.2获取b6-b6-kpc小鼠胰腺肿瘤组织进行体内扩增。
44.将获得的胰腺肿瘤组织命名为“mpa
kpc”,并在c57bl/6小鼠上进行皮下接种富集肿瘤细胞。
45.从图5可以看出b6-b6-kpc小鼠的mpa
kpc
瘤块皮下接种于b6小鼠上的成瘤性较均一,且不同代次之间的瘤块保留了相似的腺管结构。
46.1.2.3 mpa
kpc
瘤块的药效研究。
47.mpa
kpc
瘤块在c57bl/6小鼠上的药效实验,当肿瘤平均体积在60-100mm3时进行分组,给予不同的药物处理,通过游标卡尺测量肿瘤长经和短径,瘤体积计算方式为:肿瘤体积(mm3)= 0.5
ꢀ×ꢀ
肿瘤长径
ꢀ×ꢀ
肿瘤短径2监测肿瘤的生长,进而评价药物的药效。
48.表4 mpa
kpc
瘤块皮下药效评价方案备注:n: 动物只数;g: group;p.o.: 腹腔给药;i.p: 腹腔给药;qd,每天一次;qw,每周一次。
49.结果见图6。
50.1.3 mpa
kpc
细胞系分离培养a. 新鲜的胰腺肿瘤放在6cm培养皿中,培养皿中加有2倍双抗的dpbs将肿瘤涮洗一下,并去除肿瘤中坏死部分,取一个新的培养皿中加入3 ml dmem+双抗,将剩余组织剪成约2 mm大小的小块。此步骤保持在冰上,保持细胞活力。
51.b. 每个样品制备10ml酶消化液。
52.c. 将剪碎的肿瘤组织转移到6cm培养皿中,加入10ml胶原酶消化液,用封口膜封口。
53.d. 37度,二氧化碳培养箱中消化约50分钟。
54.e. 消化结束后倒入70μm滤网上用注射器的推杆研磨肿瘤,直至完全磨碎, 用移液枪吸取dpbs将细胞冲到50ml管中,4℃ 400
×
g,离心5分钟。
55.f. 弃上清,观察细胞沉淀,如果细胞沉淀为白色可不裂红,如果细胞沉淀为红色加入2ml 1
×
rbc裂红2min,以去除其中的红细胞。加入3倍体积全培养基终止,4℃,400
×
g,离心5分钟。
56.g. 弃上清,加入10ml完全培养基重悬细胞,吸取少量细胞计数,根据计数结果选择合适的培养皿进行铺板。
57.h. 分离的细胞先在无血清培养基中培养一代,去除成纤维细胞和基质细胞,再转为2% fbs的培养基中培养,扩增肿瘤细胞,最后换成10%fbs的完全培养基中继续扩增,冻存。
58.1.4 mpa
kpc-luciferase稳定株构建第一天感染:提前16-24h铺板,24孔每孔分别铺3
×
104个细胞,细胞汇合度达到20%-30%时加luciferase病毒(吉凯基因),每组做3个复孔:第二天:12-16h,更换常规培养基,继续培养;第3~4天:感染72h后加2μg/ml puro进行药筛;第6~7天:继续换药筛7天后检测活体成像;单克隆稀释扩增,检测单克隆活体成像;稳定株扩繁冻存。
59.mpa
kpc
细胞luciferase病毒感染实验,见表5。
60.表5 mpa
kpc
细胞luciferase病毒感染实验设计结果见表6、表7和图7。
61.表6 mpa
kpc
细胞luciferase感染光子数结果表7 mpa
kpc-luciferase单克隆细胞系光子数结果
2.mpa
kpc-luciferase细胞成瘤性测试使用6-8周龄的c57bl/6(b6)小鼠(雌鼠)进行mpa
kpc-luciferase细胞株的体内成瘤性测试。
62.2.1 皮下胰腺成瘤性方案(1)复苏细胞:将所需细胞从液氮罐中取出,于37℃水浴锅中迅速解冻,接种在15cm培养皿中培养。
63.(2)传代:mpa
kpc-luciferase属于贴壁细胞,通常情况下,每2天需要进行一次传代。
64.(3)小鼠先皮下接种对数期的mpa
kpc-luciferase细胞,获得mpa
kpc-luciferase瘤块,皮下接种方案见表8。
65.(4)挑选肿瘤生长趋势较好的单克隆,并从该组中挑选荧光较强的小鼠新鲜肿瘤冻存保种。
66.(5)除此之外,将新鲜的瘤块(捣碎后)转接到胰腺部位,构建原位胰腺癌模型。
67.表8 mpa
kpc-luciferase皮下胰腺成瘤性方案设计
组别n细胞名称细胞接种量接种方式g18mpa
kpc-2c25
×
105/100μl/只s.c.g28mpa
kpc-2b1(保藏株cctccno:c202249)5
×
105/100μl/只s.c.g38mpa
kpc-2a15
×
105/100μl/只s.c.
备注:s.c为皮下注射。
68.2.2 皮下胰腺成瘤性结果不同克隆的mpa
kpc-luciferase细胞皮下生长情况见图8。
69.表9 不同克隆的mpa
kpc-luciferase细胞皮下肿瘤光子数结果
2.3 原位胰腺成瘤性方案在皮下成瘤较好的克隆里进行挑选活体成像荧光较强的小鼠,取新鲜肿瘤生长到600-1000mm3时,剔除坏死区域,原位注射到胰腺部位,接种量为2mm*2mm*2mm,剩余肿瘤分成小块进行冻存保种记为mpa
kpc-luc-p0,除此之外,其他荧光较强肿瘤生长到600-1000mm3,剔除坏死区域,分成小块,进行冻存保种也标记为mpa
kpc-luc-p0。
70.接种当天定义为d0,在接种后第d6天进行活体成像进行分组,对于g4组分别在d14,d21,d28成像,并观测小鼠survival。
71.g1,g2,和g3组小鼠分别在各自终点时间点,用小动物活体成像仪检测肿瘤负荷,(即g1在d14成像,g2在d21成像,g3在d28成像),并在成像后第二天安乐小鼠,取胰腺组织,剥离肿瘤,一半肿瘤进行流式检测(mcd45,mcd3,mcd4,mcd8,mcd40,mf4/80,mcd25,mcd69),一半4%pfa固定,用于h&e染色。取材时观测是否有肺转移,若肺组织异常,进行固定h&e染色。若肉眼观测无异常,只将g3组小鼠肺组织固定h&e染色。
72.g5组肿瘤生长到600-1000mm3,进行一次成像,并选取荧光较强肿瘤进行药效实验的肿瘤接种,其余荧光相对较强肿瘤进行肿瘤冻存保种记为mpa
kpc-luc-p1。
73.表10原位胰腺成瘤实验组别n细胞名称取材时间细胞接种量接种方式g14mpa
kpc-2b1-713#d142mm*2mm*2mm胰腺原位g24mpa
kpc-2b1-713#d212mm*2mm*2mm胰腺原位g34mpa
kpc-2b1-713#d282mm*2mm*2mm胰腺原位g410mpa
kpc-2b1-713#-2mm*2mm*2mm胰腺原位g55mpa
kpc-2b1-713#600-1000mm32mm*2mm*2mm皮下2.4 原位胰腺成瘤性结果见图9。
74.3.mpa
kpc-luciferase原位胰腺癌药效评价给予不同的药物处理,通过小动物活体成像,监测肿瘤的生长,评价药物的药效。
75.3.1 原位胰腺药效评价方案(1)取表10中g5组mpa
kpc-luciferase瘤块先皮下接种进行肿瘤收集,待肿瘤生长到600-1000mm3时原位转接到胰腺部位,接种量2mm*2mm*2mm;
(2)在接种后第6天进行活体成像,根据成像结果第二天进行分组,并与分组当天定义为d0天,分组当天给药。
76.(3)给药体积:单药按体重调整给药体积: 10 μl/g
ꢀ×ꢀ
小鼠体重(g);两个药物联合给药时,药物不能混在一起,给药总体积按照: 10 μl/g
ꢀ×ꢀ
小鼠体重(g),每个药物配制浓度提高一倍。
77.(4)给药后,d7,d14,d21分别用小动物活体成像仪检测肿瘤负荷。
78.(5)末次给药完成后,暂定观测一周。实验终点进行整个胰腺剥离拍照、称重、肿瘤样品暂不收集。
79.表11 mpa
kpc-luciferase原位胰腺药效评价方案备注:n: 动物只数;g: group;p.o.: 腹腔给药;i.p: 腹腔给药;qd,每天一次;qw,每周一次。
80.3.2 原位胰腺药效结果结果见图10~12。mpa
kpc-luciferase原位胰腺癌模型可以用来进行胰腺癌相关药物评价,且在此模型上gemcitabine和anti-cd40都能非常好的抑制原位胰腺癌的生长,且联合效果最好。
81.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1