黄瓜苦味物质葫芦素C的转运蛋白及其应用
黄瓜苦味物质葫芦素c的转运蛋白及其应用
技术领域
1.本技术涉及黄瓜苦味物质葫芦素c的转运蛋白及其应用,属于生物技术领域。
背景技术:
2.葫芦科植物营养体及果实中的苦味成分是葫芦素,黄瓜中的苦味也是葫芦素引起的。葫芦素的种类及组成因黄瓜不同器官及不同的发育阶段而异,葫芦素b主要分布在幼苗根和未完全展开的子叶中,葫芦素c主要存在于张开的子叶和植物中。黄瓜营养体中葫芦素的含量随着植物生长而逐渐增加,果实中葫芦素的含量,随着果实的成熟逐渐下降,并且苦味多发生在瓜柄处,前端很少出现苦味。当葫芦素的浓度达到0.01mg/l时,就会明显感觉到苦味。
3.黄瓜果实苦味遗传控制比较复杂,苦味性状与代谢产物合成、调控及运输过程密不可分。1959年在美国改良长绿品种中发现了黄瓜营养体无苦味的突变体,并将该基因命名为bi,它能抑制黄瓜叶片和果实中产生葫芦素。已有研究表明,csabc1基因可能参与了葫芦素c的转运。尽管科研人员对黄瓜苦味物质葫芦素c的研究已经非常深入,然而,葫芦素c的完整的合成和转运机制还有待进一步揭示。
技术实现要素:
4.为了解决上述技术问题,本技术提供一种调控葫芦素c合成或转运的方法,其特征在于:包括调控葫芦素c转运蛋白的表达量或活性的步骤;所述葫芦素c转运蛋白的氨基酸序列如seq id no.1所示。
5.在一种实施方式中,进一步包括使用葫芦素c转运蛋白相关的生物材料,为下述a1)至a8)中的任一种:
6.a1)编码前述蛋白的核酸分子;
7.a2)含有a1)所述核酸分子的表达盒;
8.a3)含有a1)所述核酸分子的重组载体;
9.a4)含有a2)所述表达盒的重组载体;
10.a5)含有a1)所述核酸分子的重组微生物;
11.a6)含有a2)所述表达盒的重组微生物;
12.a7)含有a3)所述重组载体的重组微生物;
13.a8)含有a4)所述重组载体的重组微生物。
14.在一种实施方式中,a1)所述核酸分子的序列如seq id no.2所示。
15.在一种实施方式中,前述的方法还进一步包括对葫芦素c的合成基因和/或其(合成基因)调节因子的调控。
16.在一种实施方式中,葫芦素c的合成基因为环化酶基因bi、p450基因、乙酰基转移酶基因act。
17.在一种实施方式中,葫芦素c的合成基因的调节因子为bl、bt等。
18.本技术还提供葫芦素c转运蛋白在调控葫芦素c合成基因bi(csbi)的表达水平中的应用,该葫芦素c转运蛋白的氨基酸序列如seq id no.1所示。
19.本技术还提供一种调控植物组织或细胞苦味的方法,包括调控植物中葫芦素c转运蛋白的表达量和/或活性的步骤,该葫芦素c转运蛋白的氨基酸序列如seq id no.1所示。
20.在一些实施方式中,调控为降低或提高。
21.本技术还提供上述的转运蛋白或其相关生物材料在植物抵御外部侵食中的用途。
22.在一些实施方式中,侵食为虫类或动物的啃食。
23.本技术还提供一种减少植物细胞内毒性的方法,包括采用前述的转运蛋白或其相关生物材料将植物细胞质内合成的葫芦素c运输到细胞液泡内的步骤。
24.在一种实施方式中,本技术的植物为葫芦科植物,例如黄瓜属的植物,具体的,例如黄瓜。
25.本技术还提供前述的转运蛋白或其相关生物材料在调控葫芦素c合成或转运中的应用。
附图说明
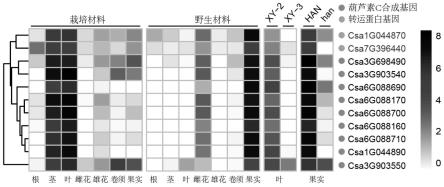
26.图1、葫芦素c合成基因和候选转运蛋白基因在不同黄瓜材料及组织中的表达情况。
27.图2、候选转运蛋白基因在aba(a)或干旱(b)处理后的材料中的表达情况。其中,每一组柱状图从左到右依次为处理组和对照组。
28.图3、候选转运蛋白与葫芦素c调控基因的互作关系。其中,a和d酵母单杂交实验;b和e烟草双荧光素酶激活实验;c和f凝胶电泳迁移实验。
29.图4、候选转运蛋白与葫芦素c合成基因成簇分布。
30.图5、候选转运蛋白基因csmate在烟草叶片中的亚细胞定位分析。
31.图6、候选转运蛋白基因csmate在黄瓜原生质体中的亚细胞定位分析。
32.图7、黄瓜子叶液泡中富集葫芦素c。
33.图8、利用酵母微粒体囊泡体系验证csmate的功能。
34.图9、利用卵母细胞表达体系验证csmate的功能。
35.图10、利用crispr-cas9技术获得csmate突变体。
36.图11、csmate突变体表型分析。其中,a:野生型材料与突变体材料液泡中葫芦素c含量比较;b:野生型材料与突变体材料中bi基因表达量比较;c:野生型材料与突变体材料子叶中葫芦素c含量比较。
37.图12、黄瓜子叶中csmate基因瞬时过表达后表型分析。其中,a:子叶中葫芦素c含量比较;b:bi基因表达量比较,每一组柱状图从左到右依次为对照(空载体)和csmate过表达。
具体实施方式
38.下述实施例中以具体试验为例,所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
39.实施例1、黄瓜中葫芦素c的转运蛋白挖掘与获得
40.1、候选基因的筛选
41.首先利用黄瓜野生材料(pi183967)和栽培材料(9930)不同组织的转录组数据,同时结合全基因组的注释信息,从1478个注释转运蛋白中筛选到两个候选转运蛋白基因(csa1g044870和csa7g396440)。这两个候选基因与黄瓜中葫芦素c合成基因共表达(图1)。随后,利用黄瓜苦味调控因子突变体的转录组数据,发现调控因子bl基因的突变体xy-3(blbl)与野生型材料xy-2(blbl)相比,候选基因在叶片中的转录水平呈现下调表达趋势。此外,调控因子bt基因的突变体han(btbt)与其野生材料han(btbt)相比,候选基因在果实中出现类似下调表达模式(图1)。候选基因在突变体中的表达模式与合成基因高度一致,说明候选基因可能受转录因子bl和bt的调控。这种共表达,共调控的模式进一步增强了候选基因的准确性。
42.2、干旱或aba等逆境胁迫诱导候选基因表达
43.干旱胁迫方法:将正常生长9天左右的黄瓜幼苗分成两组,对照组正常浇水,处理组断水;三天后,收集两组的子叶材料,提取总rna,并进行qrt-pcr分析。aba的胁迫处理:对12天正常生长状态的黄瓜幼苗叶表面喷施100μm aba溶液,对照组喷施等量无aba的溶剂;处理6小时后收集样品,提取总rna,并进行qrt-pcr分析。结果表明,干旱或aba等逆境胁迫处理可以上调候选转运蛋白基因的表达,且与葫芦素c合成基因bi表达模式高度一致(图2)。
44.总rna提取试剂盒购自华越洋,使用1μg的总rna,利用iscript cdna synthase kit(bio-rad)反转录试剂盒合成单链cdna。pcr实验使用abi7900(applied biosystems)定量仪器进行扩增。使用罗氏公司(roche)的sybr premix建立pcr反应体系。
45.3、调控因子bl和bt与候选基因csa1g044870互作
46.利用酵母单杂交体系,烟草双荧光素酶激活试验,以及凝胶电泳迁移试验,验证苦味主效调控因子bl和bt与候选转运蛋白的互作情况。
47.酵母单杂交试验:利用引物对候选基因csa1g044870和csa7g396440的启动子区域进行pcr扩增,使用in-fusion hd cloning kit(clontech)同源重组试剂盒,将扩增产物分别构建到phis2的诱饵载体上。使用同样方法将转录因子bl和bt分别克隆到pgadt7载体上。随后将构建好的重组载体phis2和pgadt7共转化到酵母菌株ah109中,对照组共转化空载的pgadt7与重组载体phis2。转化后的酵母分别在亮氨酸,色氨酸双缺陷型(sd-leu-trp)和亮氨酸,色氨酸,组氨酸三缺陷型(sd-leu-trp-his)的固体培养基上生长,三重缺陷的培养基中可加入一定量3-at(sigma)来抑制对照组中组氨酸的本底表达。30℃培养4~5天后,观察结果。结果表明,转录因子bl和bt可以直接与csa1g044870基因的启动子区域结合,但是不能与csa7g396440互作(图3)。
48.烟草双荧光素酶激活试验:利用同源重组方法(in-fusion hd cloning)将转录因子bl和bt分别构建到双元载体pcambia1300的35s启动子下游区域,即为效应蛋白载体。利用相同的方法将候选转运蛋白基因分别构建到pgreen ii 0800-luc载体上,即为报告基因载体。随后将构建好重组载体分别转化到农杆菌感受态gv3101中。不同的效应蛋白和报告基因组合对烟草进行瞬时共注射实验。对照组为空载pcambia1300与已经构建的报告基因载体。注射三天后取样,使用双荧光素酶酶报告体系的试剂盒(promega),对萤火虫荧光素酶活性(firefly luciferase)和海肾萤光素酶活性(renillia luciferase)进行测定。结
果表明,转录因子bl和bt可以直接激活csa1g044870基因的表达,但是不能激活csa7g396440基因(图3)。
49.凝胶电泳迁移试验:将转录因子bl和bt分别构建到原核表达载体pet32a上。构建好的重组质粒转化到大肠杆菌感受态bl21(de3)中,并诱导表达,纯化获得目标蛋白bl和bt。随后目标蛋白bl和bt分别与生物素标记的候选转运蛋白基因的dna探针进行孵育,电泳。结果表明,转录因子bl和bt可以直接与csa1g044870基因的启动子区域结合,但是不能与csa7g396440结合(图3)。
50.以上结果说明,转录因子bl和bt可调控csa1g044870基因表达,而且我们还发现csa1g044870基因与葫芦素c合成基因在染色体上的成簇分布(图4),进一步加强了该基因可能是葫芦素c转运蛋白。根据基因组注释信息获悉csa1g044870基因属于mate转运蛋白家族,命名为csmate基因。
51.实施例2、候选转运蛋白的亚细胞定位分析
52.对于转运蛋白而言,其不同亚细胞器膜的定位差异,与本身具有的生理功能密切相关。我们采用烟草亚细胞定位体系和黄瓜原生质体亚细胞定位体系对候选转运蛋白csmate进行亚细胞定位分析。
53.烟草亚细胞定位:将候选转运蛋白csmate构建到psuper1300载体上,并与gfp组成融合蛋白csmate-gfp。同时将已知的拟南芥液泡膜定位蛋白tpk1构建到psuper1300载体上,并与rfp组成融合蛋白tpk1-rfp。随后将重组载体分别转化到农杆菌感受态细胞gv3101中。挑取单克隆,并培养农杆菌浓度至od
600
为0.6~0.8,将分别含有csmate-gfp和tpk1-rfp的农杆菌混合,共侵染烟草叶片下表皮。侵染2~4天后,用共聚焦荧光显微镜(leica)观察荧光信号,发现gfp和rfp荧光信号重合(图5),说明csmate定位在液泡膜上。
54.黄瓜原生质体亚细胞定位:使用peg介导的瞬时转化方法将重组质粒csmate-gfp和tpk1-rfp共转化到原生质体中。具体流程:取15μg的重组质粒与200μl的原生质体悬浮液混合于2ml的离心管中,颠倒轻柔混匀;向离心管中加入200μl,40%peg4000溶液(40%peg4000,0.15m mannitol,100mm cacl2),轻柔颠倒混匀,静置8分钟左右;加入1.0ml的w5溶液,终止反应,轻柔混匀;在低温离心机中80~100 x g离心6分钟,弃掉上清,重复一遍;转化过的原生质体使用w5溶液进行重悬,放置于弱光下培养12~24小时。随后观察荧光信号,发现gfp和rfp荧光信号重合(图6),说明csmate定位在液泡膜上。
55.以上结果证明,候选转运蛋白csmate是液泡膜定位蛋白。推测,该蛋白介导葫芦素c由胞质到液泡内的运输。为了进一步验证,我们提取了黄瓜子叶中完整的液泡,并测定了液泡内葫芦素c的含量,发现液泡中富集了大量的葫芦素c(图7)。
56.实施例3、候选转运蛋白生化功能验证
57.我们利用酵母微粒体囊泡体系以及蟾蜍卵母细胞表达体系,对csmate的生化功能进行了验证。
58.酵母微粒体囊泡体系:将基因csmate构建到酵母表达载体pyes2上,随后将构建好的重组质粒转化到酵母菌株invsc1中。挑取单克隆,30℃培养,诱导表达csmate蛋白。破碎酵母细胞后,密度梯度离心获取酵母微粒体,并与葫芦素c孵育。通过pvdf滤膜真空过滤后,对微粒体囊泡表面进行清洗。最后测定微粒体囊泡内葫芦素c的含量,与对照相比,含有csmate蛋白的微粒体囊泡内葫芦素c的含量显著增加(图8),说明csmate能够介导葫芦素c
运输。
59.蟾蜍卵母细胞表达体系:将基因csmate构建到卵母细胞表达载体pgemhe上。随后利用mmessage mmachine transcription kit(invitrogen)体外转录试剂盒完成crna制备。将crna注射到每个卵母细胞中,18℃环境下放置48小时,待蛋白表达后,向培养液中添加葫芦素c。孵育1小时后,提取卵母细胞内的葫芦素c,并测定其含量。与对照相比,含有csmate蛋白的卵母细胞内葫芦素c的含量显著增加(图9),说明葫芦素c可以通过csmate蛋白运输到细胞内。
60.以上结果证明,csmate蛋白可以直接运输葫芦素c。
61.实施例4、候选转运蛋白遗传功能验证
62.为了进一步验证候选转运蛋白csmate功能,我们利用crispr-cas9的基因编辑技术,对黄瓜植株中csmate基因进行突变处理。获得了两种csmate纯合突变体植株(第一个外显子上缺失4bp和5bp,图10),分别命名为c
cr-1和c
cr-2。这两种缺失类型都导致csmate蛋白翻译提前终止。与野生型材料相比,两种突变体材料液泡中葫芦素c的含量显著降低(图11),同时还发现葫芦素c合成基因bi的表达水平也显著降低(图11),使得黄瓜子叶中整体葫芦素c含量下降明显(图11)。另外,我们利用黄瓜子叶农杆菌瞬时侵染体系,在黄瓜子叶中过表达csmate基因。与对照相比,子叶中葫芦素c含量显著升高,且bi基因表达水平显著上调(图12)。以上结果表明csmate基因参与了黄瓜植株中葫芦素c由胞质到液泡向的运输,而且该基因还对葫芦素c的合成具有调节作用。
63.综上,黄瓜中葫芦素c的合成部位是在叶片,其转运蛋白定位在液泡膜上,负责将细胞质中合成的葫芦素c运输到液泡中。黄瓜叶片中合成的葫芦素c具有抗虫、抵御食草动物的啃食等作用,黄瓜中葫芦素c转运蛋白的发现,有两点非常重要的意义:一是可以增强葫芦素c的运输,使其在液泡中的含量增加,从而增强植物的抗性;二是利用合成生物学技术合成葫芦素c时,可以表达其转运蛋白,使其运输到胞外,从而减少对细胞的毒性。
64.本技术已经尽力阐述了全部关键的技术细节,实施例仅仅为了示例本技术的构思,不应当反而成为限制本技术保护范围的理由。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1