一种提高热稳定性和抑制剂耐受性的逆转录酶突变体及其应用的制作方法
1.本发明属于生物技术领域,具体涉及一种提高热稳定性和抑制剂耐受性的逆转录酶突变体及其应用。
背景技术:
2.逆转录酶[ec 2.7.7.49]是以rna为模板指导三磷酸脱氧核苷酸合成互补dna(cdna)的dna聚合酶,大多来源于以rna为遗传物质的逆转录病毒,在真核生物中也有发现。逆转录酶是一种具有三种酶活性的多功能酶,包括rna和dna依赖性的dna聚合酶活性,以及催化rna-dna杂合链中rna降解的rnase h活性。在生物医学领域,逆转录酶被广泛用于病毒rna检测、基因表达与功能分析、cdna文库制备、rna测序等方面,是应用最为广泛的生物医药工具酶之一。
[0003]
目前,分子生物学中使用的大多数逆转录酶来源于禽成髓细胞瘤病毒(avian myeloblastosis virus,amv)或莫洛尼鼠白血病病毒(moloney murine leukemia virus,m-mlv)。amv逆转录酶是异源二聚体,热稳定性较好,但具有较强的rnase h活性,可降解rna:cdna复合物中的rna,因此产率较低,通常只能产生较短的cdna片段(《5kb)。而m-mlv逆转录酶是一种单体结构酶,生产与改造更为方便,其反应温度约为37℃。虽然m-mlv的热稳定性低于amv逆转录酶,但其rna酶h活性较低,因此具有更高的长cdna(《7kb)合成效率。使用m-mlv逆转录酶仍是市场的主流方向。
[0004]
野生型m-mlv逆转录酶最适反应温度为37℃,在此温度下单链rna容易自身配对形成发夹等复杂二级结构,阻碍逆转录反应的进行;同时,逆转录酶自身具有的rnase h活性会降解rna-dna双链中的rna,使rna模板在全长逆转录完成之前就被降解。因此第一代逆转录酶的反应时间长(60分钟),cdna产率低,持续合成能力低(不超过7kb),对逆转录抑制剂的耐受性也不好,已逐步被市场所淘汰。
[0005]
目前逆转录试剂的最主要产品为美国invitrogen公司(已被thermofisher收购)的superscript系列产品,占领了国内半数以上的市场。由于进口试剂价格昂贵,市场仍缺乏成本低、性能优良的国产逆转录试剂;所以开发一种热稳定性高、合成性能好、抑制剂耐受性能好的逆转录酶突变体十分重要。
技术实现要素:
[0006]
发明目的:针对现有技术中存在的问题,本发明提供一种提高热稳定性和抑制剂耐受性的逆转录酶突变体,并具备较高持续合成能力。
[0007]
本发明还提供所述逆转录酶突变体的应用。
[0008]
技术方案:为了实现上述目的,本发明所述一种提高热稳定性和抑制剂耐受性的逆转录酶突变体,所述逆转录酶突变体是在如seq id no.1所示氨基酸序列中取代如下位置的氨基酸,具体包括:以脯氨酸取代第139位的亮氨酸(l139p),以丙氨酸取代第197位的
苏氨酸(t197a),以半胱氨酸取代第308位的甘氨酸(g308c),以天冬酰胺取代第524位的天冬氨酸(d524g),以色氨酸取代第603位的亮氨酸(l603w)。
[0009]
作为优选,所述突变体还包括以丙氨酸取代第209位的天冬氨酸(d209a)。
[0010]
本领域的技术人员可以通过定点突变、基因合成等各种常规生物学技术得到本发明所述的逆转录酶突变体编码基因,并通过常规的重组表达和蛋白纯化技术获得本发明所述逆转录酶突变体蛋白。
[0011]
本发明通过分子模拟和定点突变,将部分已知可提升m-mlv逆转录酶热稳定性的突变位点和新发现的突变位点组合起来,设计获得了一种提高热稳定性和抑制剂耐受性,并具备较高持续合成能力的逆转录酶突变体。
[0012]
本发明所述逆转录酶突变体在60℃下仍能保持良好活性,可以合成12kb以上的cdna产物,对十二烷基琉酸钠(sds)、rna抽提剂等蛋白抑制剂的耐受性显著优于同类产品。
[0013]
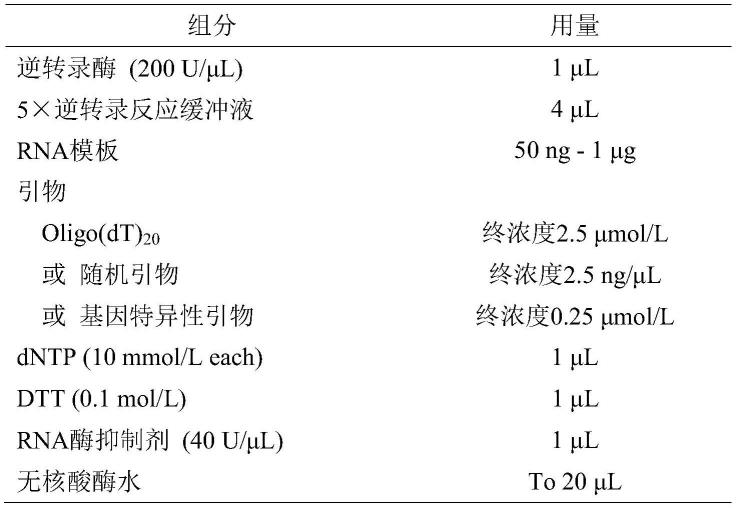
本发明还提供一种逆转录酶突变体在逆转录反应中的应用。优选的,逆转录反应体系如下表所示:
[0014]
表1逆转录反应体系
[0015][0016]
优选的,逆转录反应过程为50℃温育30min(若使用随机引物,先25℃温育5min,然后50℃温育30min)。若目的cdna长度小于3kb,温育时间可缩短为10min。反应结束后,85℃加热5min以终止反应。cdna产物可用琼脂糖凝胶电泳、荧光定量pcr等方法检测。
[0017]
有益效果:与现有技术相比,本发明具有如下优点:
[0018]
(1)本发明所述逆转录酶突变体具有高热稳定性,在50℃下活性与37℃相当,在60℃下活性也未发生显著下降;
[0019]
(2)本发明所述逆转录酶突变体的cdna持续合成能力好,在30分钟内合成长度可以达到12kb;
[0020]
(3)本发明所述逆转录突变体trizol耐受能力比市售同类产品提升30%以上,对sds的耐受能力比市售同类产品提升10倍以上。本发明所述逆转录酶性能优异,可用于各种
复杂rna模板的逆转录。
附图说明
[0021]
图1为本发明m-mlv逆转录突变体与野生型热稳定性比较。
[0022]
图2为本发明m-mlv逆转录酶突变体与野生型持续合成能力比较。
[0023]
图3为本发明m-mlv逆转录酶突变体与竞品不同抑制剂耐受性比较。
具体实施方式
[0024]
以下结合附图和实施例对本发明作进一步说明。下述实施例中的实验方法,如无特殊说明,均为常规生物学实验方法。所用的实验材料,如无特殊说明,均可以从常规生化试剂厂商购买得到。
[0025]
本发明中突变体采用常规的基因合成和蛋白表达纯化方法均可以获得,不会影响其功能和活性。
[0026]
实施例1
[0027]
突变体热稳定性鉴定
[0028]
以seq id no.1为模板,采用本领域常规的定点突变或基因合成,以及蛋白质重组表达纯化手段,分别获得两种包含不同突变位点组合的m-mlv逆转录酶突变体。一种包含l139p、t197a、g308c、d524g和l603w等5个突变位点,命名为mut1;一种包含l139p、t197a、d209a、g308c、d524g和l603w等6个突变位点,命名为mut2。
[0029]
分别选取上述突变体mut1、mut2,同时以野生型m-mlv逆转录酶为对照,以提取的1μg人总rna为模板,以oligo(dt)
20
为逆转录引物,按照表1配制逆转录反应体系,分别在37℃、50℃、60℃下反应30min。然后使用gapdh基因特异引物(seq id no.2和seq id no.3),通过染料法实时荧光定量pcr验证逆转录产物,反应程序为95℃预变性30sec,再进行95℃10s、60℃30s的35个循环。结果如图1所示,突变体mut1和mut2在50℃下逆转录产物的ct值与37℃相当,均在17-18左右,60℃下逆转录产物的ct值与37℃相比仅延后约1个循环;而野生型m-mlv逆转录酶在50℃下逆转录产物的ct值已经高于30,60℃下逆转录产物的ct值已超过35。表明两种突变体在60℃下仍具有较好活性。
[0030]
实施例2
[0031]
突变体持续合成能力鉴定
[0032]
分别取突变体mut1和mut2,以1μg人总rna为模板,以oligo(dt)
20
为逆转录引物,按照表1配制逆转录反应体系,在50℃下反应30min;同时以野生型m-mlv逆转录酶为对照,在37℃下反应30min。然后各取约100ng cdna产物,以人herc1基因cdna为模板,分别使用距离逆转录起始位点6kb、9kb、12kb的三对引物(seq id no.4-9)进行pcr扩增,扩增程序为:预变性94℃3min,再进行94℃30s、60℃30s、72℃20s的35个循环(图2a),使用琼脂糖凝胶电泳判断合成的cdna长度是否达到6kb、9kb或12kb。结果如图2b所示,突变体mut1和mut2逆转录获得的cdna长度都达到了12kb,而野生型m-mlv逆转录酶的cdna产物长度则不到9kb。说明本发明所述的m-mlv逆转录酶突变体可在30分钟内合成长度为12kb的cdna。
[0033]
实施例3
[0034]
突变体抑制剂耐受能力鉴定
[0035]
分别取突变体mut1和mut2(最适反应温度50℃),同时以野生型m-mlv逆转录酶(最适反应温度37℃)和购买的商业化的hiscript ii reverse transcriptase(竞品1,最适反应温度50℃)和transscript uni reverse transcriptase(竞品2,最适反应温度50℃)为对照,以1μg人总rna为模板,以oligo(dt)
20
为逆转录引物,按照表1配制逆转录反应体系,其中分别向反应体系中额外加入trizol(merck,货号t9424),终浓度0.03%;或sds(阿拉丁,货号s108349),终浓度0.004%,然后在各自最适温度下反应30min。cdna产物使用gapdh基因特异性引物进行荧光定量pcr检测。将无抑制剂条件下mut1突变体的相对逆转录效率定为1,比较各种逆转录酶在抑制剂存在时的逆转录效率。结果如图3所示。与竞品1、2相比,本发明所述突变体mut1和mut2在抑制剂trizol或sds存在的条件下,活性无显著下降。而两家同类竞品,在trizol存在时活性不到mut1的70%,在sds存在时活性下降到mut1的10%以下;野生型在trizol存在时,活性仅有mut1的40%左右,在sds存在时活性下降到mut1的10%以下。同时相比mut1,mut2的活性和抑制剂耐受能力更强。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1