一种针对腺病毒载体的单域重链抗体及其应用
1.本发明属于生物医学与分子生物学领域,尤其涉及一种针对腺病毒载体的单域重链抗体及其应用。
背景技术:
2.腺病毒(adenovirus,ad)属于腺病毒科,主要从五大类脊椎动物中提取,其中包括鸟类、哺乳动物、爬行动物、两栖动物和鱼类中,腺病毒的壳体直径为70-90nm,无包膜、线状双链dna病毒,由外部的衣壳蛋白和内部遗传物质组成。病毒dna被包裹于蛋白质外壳内,壳体含六邻体(hexon)、五邻体(penton,base)和纤突(fiber)三种主要的蛋白质,同时还有四种次要的衣壳蛋白iiia,vi,viii和ix。腺病毒可以承载外源基因,作为基因递送载体应用于疫苗研发。其优势包括:有多种血清型可供选择,至今已从不同物种中分离鉴定的腺病毒有100多个型别,分为7个亚群(a-g);无需免疫佐剂,同时可以很好的激发机体的天然免疫反应,使用时较为方便;宿主范围较广,对人的致病性较低,与人类基因组同源等。
3.自从发现人类腺病毒之后,研究人员经过长时间的研究,从狗、老鼠、黑猩猩以及其他哺乳动物中已分离出了非人类腺病毒。到20世纪60年代末,人们在培养腺病毒过程中发现它是可以进行重组的,这为腺病毒作为基因载体奠定了基础。随着研究的深入,发现腺病毒载体具有诸多优势,使其成为基因治疗的首选载体,包括:(1)可以通过dna重组技术对腺病毒的基因组进行编辑;(2)重组腺病毒可以进行扩增和纯化,可广泛应用于临床试验;(3)重组病毒比较稳定,病毒基因组不会快速重排;(4)腺病毒可以在hek293a细胞中进行转录和表达,并可进行包装,复制出大量高滴度病毒,非常适用于基因治疗;(5)腺病毒载体的安全性较高,迄今为止,在进行的所有基因治疗临床试验中,腺病毒载体使用率达到了25%左右。
4.当腺病毒被用作疫苗载体时,在研究过程中需要注意它在人类中是否普遍存在。预先存在的免疫力将降低疫苗的有效性。研究发现,全球最普遍的腺病毒载体人腺病毒血清型had2和had5在临床研究中显示出不同的结果,大约80%的人口具有针对had5的中和抗体。因此,科学家们试图通过使用人群中低流行率的人类腺病毒血清型和开发其他物种(如黑猩猩和恒河猴)的腺病毒来制备腺病毒载体。
5.例如在d组腺病毒(如rad26,rad48,rad24和rad49)中,针对rad26的中和抗体仅存在于南非和东南亚人群的个体中,而ad5特异性中和抗体在所有地区都检测到非常高的水平。同样,研究结果表明,与接种ad5疫苗的恒河猴相比,接种rad26的恒河猴可以诱导更高水平的干扰素γ(ifn-γ)、白细胞介素-1受体激动剂(il-1ra)、il-6和诱导蛋白-10(ip-10)细胞因子,因此rad26可以在疫苗研发领域发挥更好的作用。
6.除了研究人类腺病毒的使用外,研究人员还从非人类物种中分离出腺病毒,构建并执行临床应用。应用来自非人类物种的腺病毒的主要目的是避免对人类腺病毒血清型的现有免疫力。由非人类腺病毒引起的疾病是物种特异性的,因此这些病毒不会伤害人类。研究表明,当黑猩猩腺病毒(chad3,chad6,chad7,chad63和chad68)用于小鼠,非人灵长类动
物和人类的临床试验时,这些腺病毒载体可以逃避人类腺病毒血清型的特定免疫力。这些结果使chad63成为基因转移应用的良好候选者。
7.新型冠状病毒(2019-ncov)感染的爆发对全球公共卫生构成严重威胁,接种疫苗是预防病毒感染的有效手段。在来自不同国家的科研人员的努力下,已经开发出编码sars-cov-2主要抗原的腺病毒载体疫苗,如ad5,rad26和chadox1,并且已经在临床试验中。
8.单域抗体(single domain antibody,sdab),也可以称作单域重链抗体,只有一个重链可变区结构域,被称做vhh,可以识别和结合抗原,具有与完整的常规igg相同的结合活性。
9.目前,尚未有针对腺病毒载体的单域抗体的报道。
技术实现要素:
10.鉴于现有技术所存在的问题,本发明提供一种针对腺病毒载体的单域重链抗体及其氨基酸序列,同时提供该单域重链抗体的dna编码序列,含有该编码的载体、宿主细胞,并提出该单域重链抗体vhh在制备诊断试剂和治疗药物中的应用,以及基于该单域重链抗体的腺病毒免疫亲和纯化方法。本发明提供的单域重链抗体具有特异性好、表达量高等优点。
11.本发明解决上述技术问题的技术方案如下:
12.本发明提供一种针对腺病毒载体特异性的单域重链抗体,所述单域重链抗体的vhh包括框架区fr和互补决定区cdr;
13.所述框架区fr包括fr1、fr2、fr3和fr4;fr1的氨基酸序列包括seq id no.1所示的氨基酸序列,fr2的氨基酸序列包括seq id no.2所示的氨基酸序列,fr3的氨基酸序列包括seq id no.3所示的氨基酸序列,fr4的氨基酸序列包括seq id no.4所示的氨基酸序列;
14.所述互补决定区cdr包括cdr1、cdr2和cdr3,cdr1的氨基酸序列包括seq id no.5所示的氨基酸序列,cdr2的氨基酸序列包括seq id no.6所示的氨基酸序列,cdr3的氨基酸序列包括seq id no.7所示的氨基酸序列。
15.采用上述技术方案的有益效果包括:本发明将腺病毒载体rad26和chad63免疫成年、健康双峰驼,随后利用该骆驼外周血淋巴细胞建立了针对腺病毒载体rad26和chad63的单域重链抗体vhh基因库,试验中将腺病毒载体rad26包被在酶标板上,利用噬菌体展示技术筛选单域抗体基因库,从而获得了针对腺病毒载体rad26的特异性单域抗体基因,将此基因连接表达载体,转化至大肠杆菌,从而建立了能在大肠杆菌中高效表达的单域抗体细菌菌株。所述单域抗体能够与腺病毒载体rad26、chad63和ad5特异性结合,为其临床检测治疗提供更好的应用前景。
16.本发明提供的单域重链抗体,与传统的抗体相比,单域抗体的相对分子量较小,具有更强的组织穿透能力。它具有良好的稳定性,可以在-80℃条件下长时间储存,甚至可以承受高温,高压和极端ph环境。简单的分子结构使其更容易在酵母,大肠杆菌和其他微生物表达系统中大量表达,并且使其能够进行工业化的大规模生产。相比传统的抗体,单域抗体性能优越,不仅可以应用于诊断、治疗的实验,并且还有广阔的应用空间。
17.单域重链抗体的vhh的氨基酸序列除了包括fr1、fr2、fr3、fr4、cdr1、cdr2和cdr3的氨基酸序列还可以包括其他的氨基酸序列,例如,为便于克隆、表达等设计的氨基酸序列或其他序列。
18.进一步,所述单域重链抗体的vhh的氨基酸序列包括seq id no.8所示的氨基酸序列。
19.本发明提供一种核酸,其特征在于,编码上述单域重链抗体。
20.进一步,核酸的核苷酸序列包括seq id no.9所示的核苷酸序列;和/或包括在seq id no.9所示的核苷酸序列添加、取代、缺失或插入一个或若干个核苷酸的序列。
21.本发明提供一种载体,包括编码上述单域重链抗体的核酸。所述载体可以为克隆载体,也可以为表达载体。克隆载体上携带有编码上述单域重链抗体的核酸可以实现复制扩增的目的。通过表达载体上表达元件可以表达上述单域重链抗体。
22.本发明提供一种宿主细胞,包括上述载体。通过宿主细胞的繁殖可以实现载体上携带的单域重链抗体的核酸复制、扩增以及表达等目的。
23.本发明提供一种试剂盒,包括上述单域重链抗体。
24.例如:用于检测样品中腺病毒载体含量的试剂盒可以包括:腺病毒载体单域重链抗体。
25.还可以包括以下试剂中的一种或几种的组合:pbst、hrp标记的抗腺病毒载体单域重链抗体、tmb显色液、包被的腺病毒载体单域抗体、固相载体等。
26.本发明提供上述试剂盒的制备方法,包括将上述单域重链抗体包被的步骤。
27.例如,可以通过以下方法制备试剂盒,包括以下步骤:
28.(1)将腺病毒载体单域重链抗体包被在elisa酶标板中;
29.(2)加入倍比稀释的腺病毒载体,平行操作加入待检测的样品,在室温下轻摇;
30.(3)用pbst洗去未结合的抗原后,再加入hrp标记的抗腺病毒载体单域重链抗体,在室温下放置;
31.(4)用pbst洗去未结合的抗体后,加入tmb显色液,于酶标仪上,在od450nm波长读取吸收值;
32.(5)以将各浓度梯度的腺病毒载体标准品稀释倍数为横坐标,腺病毒载体标准品的吸收值为纵坐标做出标准曲线,然后将待检测样品的吸收值读数带入浓度标准曲线,即可判断出样品中的抗原腺病毒载体含量。
33.采用上述技术方案的有益效果包括:采用上述试剂盒和检测方法,可以测量样品中腺病毒载体含量,具有操作简单、快速、成本低廉、适合批量检测等优点。
34.本发明提供上述单域重链抗体、核酸、载体、宿主细胞和/或试剂盒在下面(1)、(2)、(3)、(4)中的应用一种或几种的组合;
35.(1)在制备检测腺病毒载体试剂或试剂盒中的应用;
36.(2)在制备腺病毒治疗性抗体药物中的应用;例如:可以利用本发明中的单域抗体作为抗体治疗药物,针对由腺病毒引起的感染进行治疗;在制备药物的时候可以根据药物的剂型添加其他组分;
37.(3)在制备腺病毒载体疫苗中的应用;例如:可以对制备的腺病毒载体疫苗进行定量,特别是对商品化的腺病毒载体疫苗中病毒具体含量的定量;在制备疫苗的过程中可以根据疫苗的需要添加其他组分;
38.(4)在制备纯化腺病毒载体试剂或试剂盒中的应用。例如:可以将单域抗体偶联到固相磁珠或琼脂微球上,然后利用单域抗体与腺病毒结合,从细胞培养收获的病毒液中纯
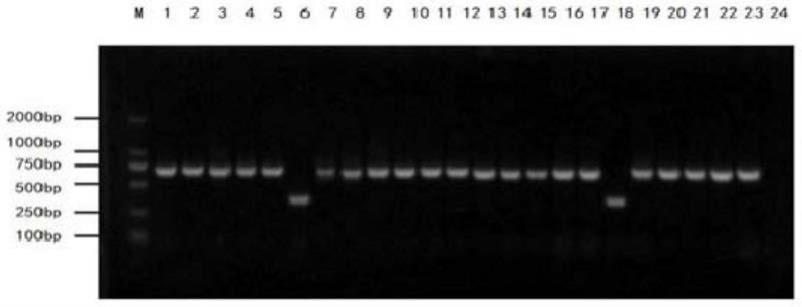
化腺病毒。
39.本发明提供一种腺病毒免疫亲和纯化方法,包括以下步骤:将包含上述的单域重链抗体固定在琼脂糖凝胶(例如:sepharose珠)。
40.采用上述技术方案的有益效果包括:可以有效的免疫亲和纯化腺病毒,具有纯化效果好等优点。
附图说明
41.图1为实施例1中,pcr扩增得到的vhh基因片段电泳图,其中,lane m:dl2000 marker,lane1-4:二轮pcr扩增vhh基因片段;
42.图2为实施例1中,对于所构建的腺病毒载体rad26特异性的单域抗体文库进行的菌落pcr电泳图,其中lane m:dl2000 marker,lane1-24:是所构建的腺病毒载体rad26单域抗体文库中随机挑取的克隆pcr检测电泳图;
43.图3为实施例3中,用phage-elisa法筛选特异性克隆结果图;
44.图4为实施例4中,表达的针对腺病毒载体rad26的单域抗体经镍柱亲和层析纯化后的sds-page电泳图,其中,lane m:protein marker(14-120kda),lane1-2:纯化产物;
45.图5为实施例5中,elisa鉴定重组单域抗体的结合活性的实验结果。
46.图6为实施例6中,以抗腺病毒载体单域抗体为核心材料制作的基于elisa技术的腺病毒载体检测试剂盒原理示意图。
47.图7为实施例7中,细胞免疫荧光检测针对腺病毒载体rad26的单域抗体与感染腺病毒的hek293a细胞的结合活性结果图;感染腺病毒的hek293a细胞用单域抗体孵育,然后用荧光标记的抗his标签抗体检测,未感染腺病毒的hek293a细胞作为阴性对照(b)。细胞核用dapi染色。合并后的图像显示腺病毒在hek293a细胞(a)中的定位,未感染腺病毒的细胞没有检测到荧光信号。
48.图8为实施例8中,使用rad26特异性单域抗体制备的免疫亲和层析柱从细胞裂解物上清中纯化腺病毒,分别用2m和4m nacl溶液洗脱结合的病毒感染hek293a细胞的荧光图,a:2m洗脱液试验组,b:4m洗脱液试验组,c:空白对照组,d:pbs缓冲液实验组。
具体实施方式
49.以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
50.如本文所用,术语“本发明单域抗体”、“本发明的抗腺病毒载体rad26单域抗体”、“本发明腺病毒载体单域抗体”、“本发明抗腺病毒特异性单域抗体”可互换使用,均指特异性识别和结合于ad5、rad26和chad63的单域抗体。
51.腺病毒载体rad26和chad63,hek293a细胞由北京交通大学何金生教授赠予,ad5载体由本实验室保存;pmecs质粒由比利时布鲁塞尔自由大学serge muydermans教授惠赠;pet-25b质粒由本实验室保存;上述材料仅可由公众非商业目的重复本发明实施例所记载的实验以证明本实施例记载的效果。
52.限制性内切酶ncoⅰ和notⅰ购自neb;感受态e.coli tg1、m13k07辅助噬菌体、hrp-anti m13单抗购自ge公司;氨苄西林、卡那霉素、iptg、pbst、多聚赖氨酸、bsa、peg 8000、
pbs、三乙胺、tris-hcl、多聚甲醛、tritonx-100、dapi均购自索莱宝公司;tmb溶液购自promega;偶联缓冲液、nhs-琼脂糖凝胶ff购自生工生物(上海)股份有限公司;dmem培养基购自thermofisher scientific;hrp标记的his-tag mouse mcab和偶联的6*his-tag小鼠单克隆抗体购自武汉三鹰抗体公司。
53.下述实施例中所涉及的仪器、试剂材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
54.本发明成功获得一组抗腺病毒载体抗体。具体地,本发明利用腺病毒载体rad26和chad63免疫骆驼,获得高质量的单域抗体基因文库。然后将腺病毒载体rad26包被在酶标板上,展示腺病毒载体rad26的正确空间结构,以此形式的抗原利用噬菌体展示技术筛选单域抗体基因库(骆驼重链抗体噬菌体展示基因库),从而获得了抗腺病毒载体rad26的单域抗体基因。实验结果表明,本发明获得的1株抗腺病毒载体rad26单域抗体,并且证明了该单域抗体能够有效地与ad5、rad26和chad63特异结合。
55.下面结合具体实施例,进一步阐述本发明。
56.实施例1.构建针对腺病毒载体rad26和chad63特异性的单域抗体文库
57.(1)腺病毒载体从原始浓度1
×
10
13
vp/ml稀释至2
×
10
11
vp/ml用于免疫接种,每次1ml,免疫一峰健康雌性双峰驼;
58.第一次和第二次免疫使用1ml,2
×
10
11
vp/ml的rad26腺病毒作为抗原免疫双峰驼,第三次和第四次免疫使用1ml,2
×
10
11
vp/ml的chad63腺病毒免疫双峰驼。
59.间隔两周免疫一次,第一次免疫前采集基础血清,最后一次免疫后一周采集血清,测定抗体效价;
60.(2)全部4次免疫结束后,提取骆驼外周血淋巴细胞并提取总rna;
61.(3)将总rna反转录成cdna;
62.(4)利用巢式pcr扩增vhh链,结果如图1显示,lane1-4为二轮pcr扩增vhh基因片段,该片段的大小约为400bp;
63.(5)利用限制性内切酶ncoⅰ和notⅰ双酶切pmecs质粒及vhh基因片段的pcr纯化产物,并连接两个片段(酶切后的5000bp左右的pmecs质粒载体和vhh基因),得到连接产物;
64.(6)连接产物电转化至感受态e.coli tg1中,构建腺病毒载体特异性单域抗体噬菌体展示文库,并测定库容,库容的大小为1.8
×
109。
65.(7)对构建的腺病毒载体特异性单域抗体噬菌体展示文库的插入率进行检测,随机挑选24个单克隆进行插入片段的pcr检测,判断vhh片段的插入率,结果如图2所示,结果显示文库的插入率达到了91.6%。
66.实施例2.筛选针对腺病毒载体rad26和chad63特异性的单域抗体
67.(1)将实施例1构建的腺病毒载体特异性单域抗体噬菌体展示文库加入到200ml的2
×
yt培养基中,细菌溶液的od 600nm值不超过0.3,然后在37℃,250r/min的振荡器中培养文库2h;
68.(2)加入m13k07辅助噬菌体,感染比例(数量比)为m13k07:tg1=20:1,37℃感染1h;
69.(3)取培养后的菌液,4℃、2 000
×
g离心10min;弃上清液,重悬,并将重悬后的溶
液接种至含氨苄西林和卡那霉素的2
×
yt(2
×
yt-ak)培养基中,37℃、220r/min恒温振荡过夜;
70.(4)次日,4℃、7197
×
g离心15min;取上清液,加入1%的bsa,4℃静置10min,再加入20%peg 8000沉淀噬菌体,4℃、7197
×
g离心25min;弃上清液,沉淀用pbs重悬,即得到噬菌体单域抗体库;
71.(5)将噬菌体单域抗体库加到以浓度为2
×
107vp/ml腺病毒载体rad26包被的96孔酶标板中,37℃结合1h;
72.(6)用100μl100 mm三乙胺洗脱结合的噬菌体,封口,室温条件下孵育10min,并用50μl 1m tris-hcl中和;
73.(7)用洗脱的重组噬菌体感染e.coli tg1(od 600nm=0.5)中,并加入辅助噬菌体m13k07进行拯救。再产生并纯化噬菌体用于下一轮的筛选,经过2轮筛选,使腺病毒载体rad26特异性噬菌体不断富集。
74.实施例3.用phage-elisa法筛选特异性单克隆
75.(1)从上述2轮筛选后含有噬菌体的细胞培养皿中随机挑取克隆分别加入到2
×
yt-ag(2
×
yt含有100μg/ml氨苄青霉素和2%葡萄糖)液体培养基中,37℃,250r/min恒温摇床过夜培养;
76.(2)次日,加入辅助噬菌体m13k07,侵染2h,14000r/min离心5min后将菌体重悬于2
×
yt-ak培养基中,37℃,250r/min恒温摇床过夜培养;
77.(3)次日,14000r/min离心5min后,收集上清液,加入1%bsa,4℃静置10min后,再加入20%peg8000,充分混匀后7197
×
g离心20min,用pbs重悬重组噬菌体;
78.(4)将重组噬菌体加到预先包被了浓度为2
×
107vp/ml腺病毒载体rad26的酶标板中,并以辅助噬菌体m13k07为阴性对照,pbs缓冲液为空白对照,室温条件下结合2h;
79.(5)每孔加入按照1:5000比例(体积比)稀释的hrp/anti-m13monoclonal conjugate(ge healthcare,usa),室温条件下结合1h;
80.(6)加入tmb溶液进行显色,2m h2so4终止反应,并测定od450nm值。将实验组/阴性对照的吸光度≥2.1判为阳性克隆孔,
81.随机挑选93个克隆(分别命名为菌株1号至93号)采用上述方法测定od450nm值,实验结果如图3所示。从图3中可以看出,其中有38个阳性克隆具有较高的od450nm值,其中菌株5号od450nm值最大。
82.(7)分别将阳性克隆菌液接种至5ml含100μg/ml的lb液体培养基中以便提取质粒并进行测序。
83.根据序列比对软件vector nti分析各个克隆株的基因序列,把cdr3序列相同的株视为同一克隆株,而其序列不同的菌株视为不同克隆株。
84.其中名称为菌株5号的克隆株的抗体的vhh链的核苷酸序列如seq id no.9所示,其抗体的vhh链的氨基酸序列如seq id no.8所示,包括4个fr和3个cdr,其中,4个fr区的氨基酸序列分别如seq id no.1、seq id no.2、seq id no.3和seq id no.4所示;3个cdr区的氨基酸序列分别如seq id no.5、seq id no.6和seq id no.7所示。
85.实施例4.抗腺病毒载体单域抗体在大肠杆菌中表达、纯化
86.(1)选取实施例3提取的phage-elisa阳性且测序正确的克隆质粒(菌株5号的克
隆质粒命名为sdad 5-pmecs),用限制性内切酶ncoⅰ和notⅰ进行双酶切,将经双酶切的单域抗体基因片段与用相同的限制性内切酶的pet-25b质粒载体进行连接,获得表达质粒(表达质粒名称为sdad5-pet-25b);
87.(3)转化至e.coli transetta(de3)感受态细胞中,并将其涂布在含有100μg/ml氨苯青霉素lb固体培养基的板上,37℃培养过夜;
88.(4)挑选单个菌落接种在5ml含有氨苄青霉素的lb培养基中,37℃培养过夜。
89.(5)接种1ml的过夜菌种至100ml lb培养基中,37℃摇床培养,培养到od600nm值达到0.4-0.6时,加入终浓度1mm iptg,30℃培养过夜。
90.(6)第二天,离心收菌,将菌体利用超声破碎仪破碎,收集破碎上清和沉淀。
91.(7)以镍柱亲和层析纯化抗体蛋白。
92.将采用上述方法进行表达和纯化获得的抗体命名为sdad 5单域抗体(下文中简称sdad 5)。表达和纯化的针对腺病毒载体sdad 5单域抗体sds-page的电泳结果如图4所示,说明已成功制备了sdad 5单域抗体。
93.实施例5.elisa鉴定重组单域抗体的结合活性
94.(1)将2
×
107vp/ml腺病毒载体rad26、chad63和ad5每孔100μl包被至96孔酶标板,4℃过夜。
95.(2)300μl pbst,3min/次,重复此过程5遍。
96.(3)然后再加入3%bsa封闭液300μl,37℃,2h。
97.(4)弃掉孔内液体,每孔加入300μl pbst,3min/次,重复此过程5遍。
98.(5)纯化后的sdad 5单域抗体(5μg/ml)为一抗,每孔100μl。同时以1:1000稀释的pet-25b空载体转化菌破碎液为阴性对照,pbs为空白对照,温度为37℃,时间为1h。
99.(6)弃掉孔内液体,每孔加入300μl pbst,3min/次,重复此过程5遍。
100.(7)二抗为将hrp标记的anti-his tag按1:10000稀释每孔100μl加入,37℃,1h。
101.(8)弃掉孔内液体,每孔加入300μl pbst,3min/次,重复此过程5遍。
102.(9)再加入tmb 100μl/孔,避光显色10min。
103.(10)加入终止液终止反应,50μl/孔。
104.(11)酶标仪od450读数,进行结果判定(当od450nm值为阴性对照值的2.1倍时即判定为阳性)。结果如图5所示,说明sdad 5可以与rad26、chad63和ad5特异性结合。
105.实施例6.经纯化后的腺病毒载体单域重链抗体在应用于检测样品中腺病毒载体含量的试剂盒方面的应用
106.如图6所示,以抗腺病毒载体单域抗体为核心材料制作的基于elisa技术的腺病毒载体检测试剂盒,包括以下步骤:
107.(1)将实施例4获得的腺病毒载体单域重链抗体(sdad 5单域抗体)包被在elisa酶标板中;腺病毒载体单域重链抗体的vhh链的核苷酸序列如seq id no.9所示,其抗体的vhh链的氨基酸序列如seq id no.8所示;
108.(2)加入倍比稀释的腺病毒载体,平行操作加入待检测的样品,在室温下轻摇1h;
109.(3)用pbst洗去未结合的抗原后,再加入hrp标记的抗腺病毒载体单域重链抗体,在室温下放置1h;
110.(4)用pbst洗去未结合的抗体后,加入tmb显色液(即上文的tmb溶液),于酶标仪
上,在od450nm波长读取吸收值;
111.(5)以将各浓度梯度的腺病毒载体标准品稀释倍数为横坐标,腺病毒载体标准品的吸收值为纵坐标作出标准曲线,然后将待检测样品的吸收值读数带入浓度标准曲线,即可判断出样品中的抗原腺病毒载体含量。
112.实施例7.免疫荧光测定胞内腺病毒与抗腺病毒载体单域重链抗体结合情况
113.(1)按每孔100μl将浓度为0.01mg/ml多聚赖氨酸溶液加入到24孔细胞培养皿中,并孵育10min,弃液体,并在超干净的工作台上干燥;
114.(2)将hek293a细胞以105细胞/孔在37℃和5%co2的24孔细胞培养皿中孵育约24h;弃去细胞培养基,并向每个孔中加入1ml dmem培养基;
115.(3)将腺病毒rad26稀释至浓度为2
×
107vp/ml,并向每个孔中加入100μl病毒稀释剂,并向对照组加入dmem,并在培养箱中培养24h;
116.(4)丢弃培养基并向每个孔中加入1ml多聚甲醛,在室温下固定20min,然后吸出固定剂,并用pbs冲洗3次,每次5min;
117.(5)向每个孔滴加100μl 0.3%tritonx-100,并在室温下孵育20min,并用pbs冲洗3次,每次5min;
118.(6)向每个孔中加入100μl 5%bsa溶液,并在室温下孵育30min,以制备的腺病毒特异性单域抗体sdab 5作为一抗,用pbs制备浓度为200μg/ml,并向每个孔中加入100μl,并在冰箱中孵育过夜;
119.(7)将24孔细胞培养皿从冰箱中取出,置于室温下复温10min,将pbst加入摇摇杯并冲洗3次,每次5min;
120.(8)将偶联的6*his-tag小鼠单克隆抗体用作二抗,浓度为1:150,每孔加入100μl,室温孵育1小时,加入pbst到振荡器中冲洗3次,每次5min,并用pbs冲洗3次,每次5min;
121.(9)荧光信号通过共聚焦显微镜检测。结果如图7所示,感染腺病毒的hek293a细胞用sdab 5号抗体孵育,然后用偶联的6*his-tag小鼠单克隆抗体检测。
122.图7为细胞免疫荧光检测针对腺病毒载体rad26的单域抗体与感染腺病毒的hek293a细胞的结合活性结果图。图7中,感染腺病毒的hek293a细胞(a),未感染腺病毒的hek293a细胞作为阴性对照(b)。图7中标示的“sdab”为感染腺病毒的hek293a细胞用sdab 5单域抗体孵育,然后用荧光标记的抗his标签抗体检测,“dapi”为细胞核用dapi染色。“merge”合并后的图像显示腺病毒在hek293a细胞(a)中的定位。
123.从图7中可以看出,制备的腺病毒载体特异性sdab 5单域抗体能够结合感染hek293a细胞的腺病毒,在荧光显微镜下观察到绿色荧光,未感染腺病毒的hek293a细胞没有检测到荧光信号,说明sdab 5单域抗体能够结合腺病毒载体。
124.实施例8用固定化抗腺病毒载体单域抗体从细胞破碎上清中免疫亲和纯化腺病毒的方法
125.(1)配制1ml偶联缓冲液用于溶解1mg的单域抗体(采用实施例4方法制备的sdad 5单域抗体);
126.(2)取1ml nhs-琼脂糖凝胶ff于重力柱内,取1mm hcl 5ml,清洗三次以便去除保存液;
127.(3)清洗后立即加入抗体偶联缓冲液,4℃振荡过夜;
128.(4)收取滤液,用5ml偶联缓冲液冲洗偶联后的凝胶;
129.(5)使用1ml的封闭缓冲液于室温振荡4h,以便封闭未被偶联的基团,去除封闭缓冲液后,用2ml偶联缓冲液清洗三次;
130.(6)将由本实验室制备的表达人egfp的重组腺病毒ad5在细胞培养液中稀释,滴度为107vp/ml,加入到制备的免疫亲和柱中,室温下结合30min;
131.(7)用2m和4m nacl溶液和pbs分别洗脱结合的病毒,并将洗脱液加入培养的hek293a细胞进行再感染;
132.(8)在共聚焦显微镜下,通过重组腺病毒表达的egfp来观察重组病毒在洗脱液和再感染细胞中的存在,实验结果如图7所示。
133.图8中,使用rad26特异性单域抗体制备的免疫亲和层析柱从细胞裂解物上清中纯化腺病毒,分别用2m和4m nacl溶液洗脱结合的病毒感染hek293a细胞的荧光图,a:2m洗脱液试验组,b:4m洗脱液试验组,c:空白对照组(即正常培养的细胞,没有添加任何病毒或洗脱物),d:pbs缓冲液实验组(即用pbs作为洗脱液的实验组)。
134.可以观察到,在2m和4m nacl溶液洗脱液感染的细胞中都检测到了绿色荧光。这些结果表明,固定化的单域抗体可以特异性地与腺病毒结合并从细胞破碎上清中分离出来,而且2m和4m的nacl溶液都可以将结合的病毒从抗体中洗脱出来。
135.以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和修饰,这些等价形式同样落于本技术所附权利要求书所限定的范围。
136.以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1