一种海绵体纤维化疾病模型建立方法与流程
1.本发明涉动物模型建立技术领域,具体地说,是关于一种海绵体纤维化疾病模型建立方法。
背景技术:
2.在ed研究领域,尚没有合适的模拟内皮-间充质细胞转化导致海绵体组织纤维化的体外疾病模型和动物模型。目前常用的通过其他途径诱导海绵体组织纤维化模型包括tgfβ诱导模型、糖尿病大鼠模型和衰老大鼠模型。
3.上述模型造模时间长,同时还会导致海绵体内皮细胞损伤和平滑肌纤维化等,致使实验引入多变量干扰,不利于开展针对内皮-间充质细胞转化这一过程的实验研究。并且模型建立时间长老年大鼠通常要12月以上才出现显著的海绵体纤维化,使用stz诱导的糖尿病大鼠模型,至少要10周才会出现明显的ed,在造模期间易受其他因素影响。
4.中国专利文献cn107929311b公开了一种2型糖尿病动物模型的建立方法,步骤如下:(1)用生理盐水配制脂多糖的溶液,浓度为100μg/ml;(2)选择4~6周龄雄鼠,用普通饲料喂养,同时注射脂多糖溶液;(3)在第28天后测量雄鼠体重;(4)测量体重后,对雄鼠进行禁食8h,并分离出血清测量血糖、胰岛素;(5)评估胰岛素抵抗能力和评价葡萄糖刺激的胰岛素分泌能力;(6)在第30天和第32天分别给予雄鼠腹腔注射一次stz溶液;(7)当随机血糖》16.8mmol/l时确定该2型糖尿病动物模型建立完毕。本发明巧妙地选用大肠埃希氏菌0111:b4亚种中的脂多糖,配合普通饲料喂养及stz注射,成功地建立起了2型糖尿病动物模型。本发明容易操作,而且建立模型的成本低廉,并且成模率高、成模周期短。
5.中国专利文献cn1713245a公开了一种建立血管性勃起功能障碍动物模型的方法,包括选择正常新西兰家兔,在常规饲料中,加入有效量的胆固醇和猪油;投药喂食一段时间后,施行双侧球囊导管髂内动脉扩张成形术,损伤髂内动脉内皮;术后通过交配试验、双核素或海绵体注射血管活性药物进行检测、鉴定。本发明建立的血管性勃起功能障碍的动物模型,为探讨勃起功能障碍的病理机制、研究治疗方法及临床新药开发及药物验证提供了必要依据。
6.而目前关于模拟内皮-间充质细胞转化导致海绵体组织纤维化的体外疾病模型和动物模型还未见报道。
技术实现要素:
7.本发明的目的是,针对现有技术中的不足,提供一种使用hippo通路抑制剂xmu-mp-1,促进内皮-间充质转化,从而导致海绵体组织纤维化疾病模型的制作方法。通过该方法制备的疾病模型可进一步用于发病机制探究和药物筛选等。
8.为实现上述第一个目的,本发明采取的技术方案是一种海绵体纤维化疾病模型建立方法,包括以下步骤:
9.(1)海绵体内皮细胞的xmu-mp-1处理:细胞培养的第5天时,加入成纤维细胞抑制
剂7-10天。当分离的细胞克隆开始相互融合时,标记和消化内皮细胞克隆传代,使用50μm浓度的xmu-mp-1进行处理;
10.(2)细胞爬片免疫荧光染色:将爬片置于培养皿中,乙醇震荡过夜,紫外线照射,pbs漂洗,用bsa的pbs封闭;
11.(3)海绵体组织xmu-mp-1处理及masson染色:海绵体组织进行体外培养,使用50μm浓度的xmu-mp-1进行处理;
12.(4)大鼠海绵体xmu-mp-1处理:选取性成熟大鼠,鼠尾注射xmu-mp-1,可得到所需的由内皮-间充质转化介导的海绵体纤维化大鼠模型:
13.作为一个优选例,步骤(1)中待细胞生长密度为50%时,使用50μm浓度的xmu-mp-1进行处理。
14.作为一个优选例,步骤(4)中所述的注射条件是按照0.05mol/千克体重、50μm浓度的剂量注射。
15.作为一个优选例,步骤(4)中注射时间是每天一次,连续7
~
14天。
16.本发明优点:
17.(1)本发明填补了目前缺乏由于内皮-间充质转化导致的海绵体纤维化模型的空白,极大地方便对于这一现象的体内、外实验的开展。
18.(2)本发明使用的xmu-mp-1针对海绵体成纤维细胞的hippo通路进行激活,对其他导致海绵体纤维化的生物过程,如成纤维-肌成纤维转化、成纤维细胞增殖等影响较小,具有靶点专一性。所以,针对内皮-间充质转化这一生物过程,使用本发明造模可排除上述干扰。
19.(3)本发明建立的体内、外造模方式,具有给药方便,剂量容易控制和造模时间短等优点。如,老年大鼠通常要12月以上才出现显著的海绵体纤维化,使用stz诱导的糖尿病大鼠模型,至少要10周才会出现明显的ed,而本发明可在2周内即可诱导海绵体纤维化。
附图说明
20.图1:a:海绵体平滑肌细胞体外培养条件下分别加入dmso(xmu-mp-1的溶剂作为阴性对照)和xmu-mp-1,诱导7天后免疫荧光染色变化。可见相比阴性对照组,xmu-mp-1处理7天后内皮细胞标志物cd31表达明显减少。
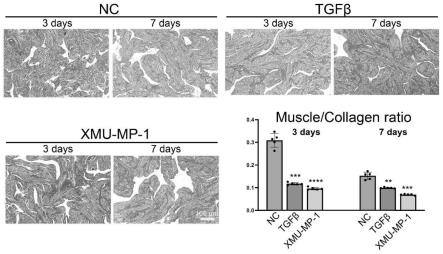
21.图2:人海绵体组织体外培养条件下使用xmu-mp-1刺激后的masson染色结果,右侧统计标明xmu-mp-1处理后能显著促进海绵体组织平滑肌与纤维蛋白比例下降。
具体实施方式
22.下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
23.实施例1
24.材料与方法
25.1、人海绵体内皮细胞分离及xmu-mp-1处理
26.大约1
×
1cm大小的新鲜海绵体组织样品首先浸入15ml pbs中,剧烈摇晃以去除残留的血液。将组织切成1
×
1mm大小的碎片,并用2.5mg/ml i型胶原酶、4mg/ml iv型胶原酶、0.1mg/ml中性蛋白酶和2mg/ml dnase i酶,37℃下消化20min。随后,将细胞悬液通过40mm尼龙网过滤,并通过macs和死细胞去除试剂盒(miltenyi biotec)对细胞进行分选以去除死细胞。洗涤消化的细胞悬液并重悬于egm-2(cc-3202;lonza)培养基中。细胞克隆在培养的第5天左右开始出现,然后加入成纤维细胞抑制剂7-10天。当分离的细胞克隆开始相互融合时,使用克隆圆筒(c7983-50ea;809sigma-aldrich)标记和消化enc克隆传代。待细胞生长密度为50%左右时,使用50μm浓度的xmu-mp-1进行处理。
27.2、细胞爬片免疫荧光染色
28.将爬片置于6cm培养皿中,75%乙醇微震荡过夜,在生物安全柜中将乙醇洗尽,紫外线照射30min,将消化好的细胞(c18-4和tcam-2)轻轻置入该培养皿中,继续培养至汇合度达70%。取出爬片,用4%多聚甲醛固定15min,pbs漂洗三次,0.5%triton x-100通透10min。pbs漂洗三遍,用5%bsa的pbs封闭60min。之后按1:500稀释一抗cd31,4℃孵育过夜。第二天用pbs漂洗爬片3次,每次10min,加入荧光二抗,在暗室中孵育60min。再用pbs漂洗3次,每次5min,于暗室用dapi室温染色5min,pbs漂洗3次,每次5min,用封片剂封片,置于荧光显微镜下观察并拍照。
29.3、海绵体组织xmu-mp-1处理及masson染色
30.从手术中获得的新鲜海绵体组织用pbs清洗两次以去除血液并使用pbs漂洗3次充分去除血液,切成大小约2mm
×
2mm的组织块,进行体外培养,培养条件为egm-2(cc-3202;lonza)+50μm浓度的xmu-mp-1。处理3天和7天后使用pbs漂洗3次,在4℃下在4%多聚甲醛中固定12h,然后包埋在石蜡中并切片。染色前,组织切片在二甲苯中脱蜡,使用梯度乙醇溶液进行再水化,并在蒸馏水中洗涤。对于masson染色,切片依次用苏木精、苯胺蓝和丽春红染色。然后,使用增加浓度的乙醇和二甲苯对切片进行脱水,并在将中性树脂应用于盖玻片之前使其干燥。使用nikon eclipse ti-s荧光显微镜(nikon)捕获图像。使用adobe photoshop cc 2018软件测量和分析图像。肌肉/胶原蛋白比率由红色区域(颜色代码=#0068b7;颜色范围=160%)除以蓝色区域(颜色代码=#b26c91;颜色范围=160%)计算。
31.4、大鼠海绵体xmu-mp-1处理
32.选取性成熟大鼠,采用鼠尾注射的给药方式,按照0.05mol/千克体重、50μm浓度的剂量注射,每天一次,连续7
~
14天,可得到所需的由内皮-间充质转化介导的海绵体纤维化大鼠模型。
33.结果
34.海绵体平滑肌细胞体外培养条件下分别加入dmso(xmu-mp-1的溶剂作为阴性对照)和xmu-mp-1,诱导7天后免疫荧光染色变化。可见相比阴性对照组,xmu-mp-1处理7天后内皮细胞标志物cd31表达明显减少(图1)。
35.人海绵体组织体外培养条件下使用xmu-mp-1刺激后的masson染色结果显示,xmu-mp-1处理后能显著促进海绵体组织平滑肌与纤维蛋白比例下降,差别具有统计学意义(图2)。
36.结论
37.本专利提供了一种使用hippo通路抑制剂xmu-mp-1,促进内皮-间充质转化,导致
海绵体组织纤维化疾病模型的方法。通过该方法制备的疾病模型可进一步用于发病机制探究和药物筛选等。本发明填补了目前缺乏由于内皮-间充质转化导致的海绵体纤维化模型的空白,极大地方便了体内、外实验的开展。
38.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1