经修饰的RNF112作为治疗ALS药物的应用的制作方法
经修饰的rnf112作为治疗als药物的应用
技术领域
1.本发明属于生物医药领域,涉及经修饰的rnf112作为治疗als药物的应用。
背景技术:
2.肌萎缩侧索硬化(als)也叫运动神经元病(mnd)。它是上运动神经元和下运动神经元损伤之后,导致包括球部(所谓球部,就是指的是延髓支配的这部分肌肉)、四肢、躯干、胸部腹部的肌肉逐渐无力和萎缩。
3.肌萎缩侧索硬化(als)是一种涉及多种分子机制的复杂性疾病,其病因和发病机制尚未阐明,有研究发现其发病与核浆转运体缺陷、rna代谢及结合蛋白的异常、蛋白的异常聚集、dna修复障碍、线粒体功能障碍和氧化应激、少突胶质细胞功能缺陷、小胶质细胞功能异常、轴突运输障碍、囊泡运输缺陷、兴奋氨基酸毒性作用等相关。
4.随着科学技术的进步,对肌萎缩侧索硬化的病因学及发病机制有了更深入的了解,科学家根据其发病机制开发了众多的治疗方式,包括药物治疗,基因治疗,干细胞治疗等。其中,唯有利鲁唑和依达拉奉通过批准,在临床上用于肌萎缩侧索硬化的治疗。利鲁唑属于苯并噻唑类,是一种谷氨酸抑制剂,它可以干扰nmda(n-methyl-d-aspartate)受体介导的反应,持续调节钠通道电流,阻滞钙通道电流,从而减少谷氨酸的突触前释放。利鲁唑在延长患者的生存期方面具有一定作用,但对延髓功能和肢体功能的作用甚微。依达拉奉是一种自由基清除剂,对肌萎缩侧索硬化有一定的疗效,但其通过静脉注射给药,不能口服,且价格昂贵,因此临床推广有局限性。而基因治疗和干细胞治疗的疗效和安全性仍存在很大的争议,目前仍在研究阶段,尚未应用于临床。
5.可见,肌萎缩侧索硬化的治疗是医学领域的难点,也是科研领域的热点。现有的治疗方法具有诸多局限性,因此,提供一种治疗肌萎缩侧索硬化的药物具有重要的现实意义。
技术实现要素:
6.本发明的研究发现,经修饰的rnf112蛋白可促进病变细胞中积累的tdp43蛋白发生特异性泛素化降解,从而治疗由于tdp43蛋白积累导致的als疾病。本发明的上述研究成果为临床治疗als疾病提供了一种候选药物。
7.根据本发明的一个方面,本发明提供了一种融合蛋白,所述融合蛋白包含rnf112蛋白序列以及识别td43的多肽。
8.优选地,rnf112蛋白序列如seq id no.1所示。
9.识别td43的多肽序列如seq id no.2所示。
10.所述融合蛋白的序列包含seq id no.3所示的氨基酸序列。
11.根据本发明的另一个方面,本发明提供了编码前面所述的融合蛋白的核酸分子。
12.所述核酸分子包括dna或rna,可为单链或双链的;可为直链、支化或环状的。
13.具体的,核酸序列如seq id no.6所示。
14.根据本发明的又一个方面,本发明提供了包含前面所述的核酸分子的载体。
15.本发明中“载体”一词指的是,可将编码某蛋白的多聚核苷酸插入其中并使蛋白获得表达的一种核酸运载工具。载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元件在宿主细胞内得以表达。举例来说,载体包括:质粒;噬菌粒;柯斯质粒;人工染色体如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。用作载体的动物病毒种类有逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。一种载体可能含有多种控制表达的元件,包括启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。载体还有可能包括协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅仅只有这些物质。
16.在本发明的具体实施方案中,所用载体是aav。
17.在某些实施方案中,本文所述的aav载体可以源自任何aav。在某些实施方案中,aav载体源自缺陷性和非致病性细小病毒腺相关的2型病毒。所有此类载体均源自仅保留转基因表达盒侧翼的aav 145bp反向末端重复序列的质粒。由于整合到转导细胞的基因组中,有效的基因转移和稳定的转基因递送是该载体系统的关键特征(wagner et al.,lancet 351:9117 1702-3(1998),kearns et al.,gene ther.9:748-55(1996))。根据本发明,也可以使用其他aav血清型,包括aav1,aav2,aav3,aav4,aav5,aav6,aav7,aav8,aav9和aav10,以及任何新颖的aav血清型。在一些实施方案中,使用嵌合aav,其中病毒核酸的ltr序列的病毒起源与衣壳序列的病毒起源异源。非限制性实例包括具有源自aav2的ltr和源自aav5,aav6,aav8或aav9的衣壳的嵌合病毒(分别为aav2/5,aav2/6,aav2/8和aav2/9)。
18.重组aav载体的构建已经在许多出版物中进行了描述,包括美国专利no.5,173,414;tratschin et al.,mol.cell.biol.5:3251-3260(1985);tratschin,et al.,mol.cell.biol.4:2072-2081(1984);hermonat&muzyczka,pnas81:6466-6470(1984);和samulski et al.,j.virol.63:03822-3828(1989)。由于整合到转导细胞的基因组中,有效的基因转移和稳定的转基因传递是该载体系统的特征。参见,例如,wagner et al.,lancet 351:9117 1702-3(1998),kearns et al.,gene ther.9:748-55(1996)。
19.根据本发明的又一个方面,本发明提供了包含前面所述的载体的微生物。
20.可用于本发明的微生物包括病毒、细菌。病毒种类包括逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。
21.根据本发明的又一个方面,本发明提供了一种经工程化改造的基因修饰细胞,所述基因修饰细胞表达前面所述的融合蛋白。
22.进一步,能够用于表达这些融合蛋白的表达系统有多种,可以是真核细胞,也可以是原核细胞,它们包括(但不限于)哺乳动物细胞、细菌、酵母、昆虫细胞等。由于本发明优化融合蛋白的氨基酸序列中包含可糖基化的氨基酸,因此哺哺乳动物细胞是表达该蛋白的优选系统。可用于大规模表达蛋白质的哺乳动物细胞有多种,例如cho细胞、293细胞、ns0细胞、cos细胞、bhk细胞等,其它许多细胞也可以用于蛋白的表达,因此都包括在本发明所能使用的细胞之列。哺乳动物细胞以外的其他表达系统,例如细菌、酵母、昆虫细胞等也可以用于表达本发明的优化融合蛋白,它们也被包含本发明所能使用的宿主细胞之列。这些表达系统的蛋白质产量比哺乳动物细胞的较高,但是所表达的蛋白质缺乏糖基化或形成的糖
链结构与哺乳动物细胞有所不同。
23.根据本发明的又一个方面,本发明提供了一种经工程化改造的基因修饰细胞,所述基因修饰细胞包含前面所述的核酸分子,前面所述的载体,或前面所述的微生物。
24.进一步,经工程化改造的基因修饰细胞可以是包装细胞,包装细胞用于形成能够感染宿主细胞的病毒颗粒。此类细胞包括可以用于包装aav和腺病毒的hek293和sf9细胞,以及可包装逆转录病毒的ψ2细胞或pa317细胞。
25.根据本发明的又一个方面,本发明提供了前面所述的基因修饰细胞的制备方法,所述制备方法包括如下步骤:
26.将前面所述的核酸分子、前面所述的载体,或前面所述的微生物导入宿主细胞中。
27.本发明中“宿主细胞”一词指的是导入载体的细胞,包括如下许多细胞类型,如大肠杆菌或枯草菌等原核细胞,如酵母细胞或曲霉菌等真菌细胞,如s2果蝇细胞或sf9等昆虫细胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细胞或人细胞的动物细胞。
28.将异源核酸引入细胞中的方法为业内已知,包括(但不限于):葡聚糖介导之转染、磷酸钙沉淀、聚凝胺介导之转染、原生质体融合、电穿孔、粒子轰击、在脂质体中囊封多核苷酸、树枝状聚合物、肽偶联物及将dna直接微注射至细胞核中。
29.根据本发明的又一个方面,本发明提供了一种药物组合物,所述药物组合物包括前面所述的融合蛋白。
30.根据本发明的又一个方面,本发明提供了一种药物组合物,所述药物组合物包括前面所述的核酸分子,前面所述的载体,或前面所述的微生物。
31.进一步,所述药物组合物还包括药学上可接受的载体。
[0032]“药学上可接受的载体”是指生产药品和调配处方时,使用的赋形剂和附加剂,是指除活性成分外,在安全性方面已进行了合理的评估,并且包含在药物制剂中的物质。同一药用载体可用于不同给药途径的药物制剂,且有不同的作用和用途。在本发明提供的药物中添加的药学上可接受的载体,能够起到赋型、或提高稳定性的作用,此外,还具有增溶、助溶或缓控释等重要功能。
[0033]
典型但非限制性的药学上可接受的载体包括:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、湿润剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏着剂、抗氧剂、螯合剂、渗透促进剂、ph调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂或释放阻滞剂中的一种或多种。填充剂包括:淀粉、预胶化淀粉、乳糖、甘露醇、甲壳素、微晶纤维素、蔗糖等;崩解剂包括:淀粉、预胶化淀粉、微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯烷酮、低取代羟丙纤维素、交联羧甲基纤维素纳等;润滑剂包括:硬脂酸镁、十二烷基硫酸钠、滑石粉、二氧化硅等;助悬剂包括:聚乙烯吡咯烷酮、微晶纤维素、蔗糖、琼脂、羟丙基甲基纤维素等;粘合剂包括,淀粉浆、聚乙烯吡咯烷酮、羟丙基甲基纤维素等;甜味剂包括:糖精钠、阿斯帕坦、蔗糖、甜蜜素、甘草次酸等;矫味剂包括:甜味剂及各种香精;防腐剂包括:尼泊金类、苯甲酸、苯甲酸钠、山梨酸及其盐类、苯扎溴铵、醋酸氯乙定、桉叶油等;基质包括:peg6000、peg4000、虫蜡等。
[0034]
本发明涉及的药物组合物的剂量水平取决于成分活性、给药途径、待治疗疾病的
严重程度以及待治疗患者的情况和前病史。
[0035]
本发明涉及的药物组合物剂型可以是药学上可接受的任意一种剂型,包括但不限于粉剂、注射剂、胶囊、片剂、缓释剂、口服液。
[0036]
本发明涉及的药物组合物的给药途径可以是一种或多种任何可能的途径,根据患者状况和其他重要参数,这些途径包括口服、注射、呼吸道、皮肤、直肠和经粘膜。
[0037]
根据本发明的又一个方面,本发明提供了一种应用,所述应用包括以下任一项:
[0038]
1)前面所述的融合蛋白、前面所述的核酸分子,前面所述的载体,或前面所述的微生物在制备促进tdp43蛋白泛素化降解的试剂中的应用;
[0039]
2)前面所述的融合蛋白、前面所述的核酸分子,前面所述的载体,或前面所述的微生物在制备治疗肌萎缩侧索硬化中的应用。
[0040]
根据本发明的又一个方面,本发明提供了一种预防或治疗als的方法,所述方法包括给有需要者施用前面所述的融合蛋白、前面所述的核酸分子,前面所述的载体,前面所述的微生物或前面所述的药物组合物。
[0041]
待施用的aav载体的有效量可以因患者而异。在一些实施方案中,有效量是由施用该组合物(aav载体)的医师确定。对治疗性多肽的血清,血浆或其他组织水平的分析以及与施用前的初始水平的比较可以确定所施用的量是否过低、在正确范围内还是过高。初次和随后施用的合适方案也是可变的,但以初次施用为代表,任选地在必要时随后进行后续施用。随后的施用可以以可变的间隔进行,范围从每天到每年到每几年。在一些实施方案中,可以推荐适当的免疫抑制技术以避免通过递送载体的免疫抑制来抑制或阻止转导。参见,例如,vilquin et al.,(1995)human gene ther.,6:1391-1401。
[0042]
可以通过任何方式施用。考虑了体内和离体方法。在一些实施方案中,静脉内注射(例如,但不限于,经由门静脉)是体内施用方法。在一些实施方案中,施用是通过标准静脉内施用。其他体内施用方式包括,例如,直接注射。离体施用方式包括将疾病相关细胞进行转导,而后将转导的细胞回输体内。
[0043]
进一步,所述方法包括对人受试者施用一剂或者多剂的1x10
11
vg/kg至1x10
14
之间,例如2x10
12
vg/kg至3x10
13
或1x10
13
至1x10
14
,或1x10
13
至5x10
13
或2x10
13
至4x10
13
vg/kg的腺病毒伴随病毒(aav)载体。
[0044]
本发明的接收所述的aav载体的受试者可以是任何人。示例性的接受者包括例如患有als的个体。
附图说明
[0045]
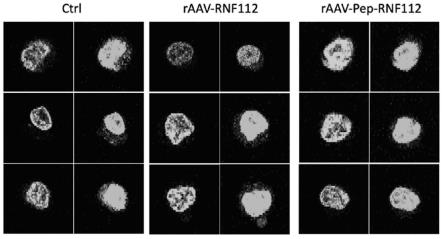
图1显示als疾病细胞模型实验结果图。
具体实施方式
[0046]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室指南(new york:cold spring harbor laboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域
熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
[0047]
实施例构建重组raav病毒
[0048]
1、实验材料
[0049]
293ft细胞(atcc,crl-3249),dmem培养基(hyclone,sh30022.01),fbs(cellmax fetal bovine serum,sa101.02),paav2/2(addgene,plasmid#104963),raav2-retro helper(addgene,plasmid#81070),paav-ef1α1.1-gfp(addgene,plasmid#122100)
[0050]
2、实验方法
[0051]
1)将修饰后的rnf112基因(peprnf112的氨基酸序列如seq id no.3所示,核酸序列如seq id no.6所示)连入paav-ef1α1.1-egfp中(启动子更换为sffv),插入位点为:spei、ecori;重组载体命名为paav-sffv-peprnf112;
[0052]
paav-sffv-peprnf112全序列如seq id no.4所示。
[0053]
2)在293ft细胞中转染paav2/2、raav2-retro helper,及paav-sffv-ef1α1.1-peprnf112,包装raav病毒,每24小时收集上清,并加入新鲜培养基,连续3天;
[0054]
3)将步骤2)中raav病毒使用akta进行纯化,获得临床级raav病毒。
[0055]
实施例2修饰后的rnf112基因对als的治疗作用
[0056]
一、als疾病细胞模型实验
[0057]
1、实验方法
[0058]
使用实施例1获得的纯化后的raav病毒感染293t-tdp43-egfp细胞模型,观察模型细胞荧光变化。
[0059]
293t-tdp43-egfp细胞模型构建方法如下:
[0060]
1)包装tdp43-egfp慢病毒
[0061]
合成tdp43-egfp核酸序列后经bsiwi、pflfi酶切位点连入plenti-ef1a载体。tdp43-egfp核酸序列如seq id no.5所示。
[0062]
慢病毒包装流程:
[0063]
通过胰酶消化收集293t细胞,用适当的完全培养基平铺细胞于10cm培养皿上(根据实验需要选择培养皿,使细胞贴壁后所占面积达到培养皿总面积的80%以上)。将细胞置于含5%co2的37℃温箱中孵育8-24h,当细胞贴壁完全后即可开始转染;
[0064]
混匀核心质粒和包装质粒:取无菌1.5ml ep管,加入400μl opti-mem培养基,加入10μg核心质粒和15μg病毒包装质粒(包含pmd2g、vsvg、rev),及75μl pei转染试剂,充分混匀,静置15-20min;
[0065]
孵育:将这400μl的混合液逐滴加入上述单层细胞的细胞培养基中,轻轻摇动平皿混匀后置于含5%co2的37℃温箱孵育;
[0066]
收取病毒上清:6-10h后吸去培养基,加入10ml 37℃预热的完全培养基,继续将细胞放置温箱孵育,40h左右可以收集含慢病毒的上清,经45μm滤膜过滤后,可用于感染或者分装后置于-80℃储存待用。
[0067]
2)使用1)中慢病毒感染293t细胞,并使用puromycin进行筛选;
[0068]
3)使用2)中细胞挑取单克隆培养作为细胞模型。
[0069]
2、实验结果
[0070]
如图1所示,对照组(ctrl)为293t表达tdp43-egfp融合蛋白的单克隆细胞株,标记为293t-tdp43-egfp,对照组左侧为pi染色,标记细胞核,右侧为egfp成像,绿色为tdp43-egfp融合蛋白在细胞内的分布情况;raav-rnf112组为293t-tdp43-egfp感染表达rnf112蛋白的raav病毒,同样左侧为pi染色细胞核,右侧为tdp43-egfp分布;raav-pep-rnf112组为293t-tdp43-egfp感染表达经修饰的rnf112蛋白的raav病毒。
[0071]
显然可见,感染未经修饰的rnf112蛋白raav病毒,293t-tdp43-egfp细胞模型胞质中荧光(对应tdp43蛋白积聚)并未明显减少;而感染经修饰rnf112蛋白(n端添加识别tdp43多肽)的raav病毒,其细胞质中tdp43-egfp蛋白积聚明显降低,说明raav病毒递送基因可减少细胞中tdp43蛋白积聚。
[0072]
二、tdp43基因缺陷als疾病小鼠模型实验
[0073]
1、实验方法
[0074]
将tdp43缺陷als疾病模型雄性小鼠(prp-tdp43a315t,杰克森实验室(jax))分为两组,第一组作为对照,尾静脉回输溶媒(dpbs),第二组为实验组尾静脉回输经实施例1获得的纯化后的raav病毒(尾静脉注射总体积为200μl raav病毒制剂,内含有109病毒颗粒,将akta纯化后的raav病毒重悬于注射用生理盐水中制备raav病毒制剂)。静脉回输后当天算第0天起,对照组小鼠存活平均为15天,实验组小鼠平均存活时间为48天。
[0075]
2、结果
[0076]
经修饰的rnf112基因可特异性诱导tdp43蛋白泛素化降解,且可以较明显延长tdp43突变als疾病模型小鼠的生存期。
[0077]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1