一种腈水合酶重组蛋白的构建方法及其应用
1.本发明属于绿色化学技术领域,涉及一种通过融合蛋白提高腈水合酶催化二腈化合物生物转化效率的方法。
背景技术:
2.大肠杆菌是一种常见的革兰氏阴性菌,通常,在实验室中可获取的大肠杆菌都具备清晰明确的遗传背景和十分强的环境适应力,同时也具有很强的代谢、繁殖能力,可以短时、高效地表达通过基因工程手段导入的基因,并分泌人们所需的表达产物,因此常被用作为基因工程的宿主细菌。但在实际试验、生产的过程中,除了产生所需的正常蛋白质产物外,大肠杆菌还会产生许多不溶性的蛋白即包涵体。包涵体是一种通常产生于大肠杆菌胞质中的极为紧密的蛋白聚集体。当使用大肠杆菌作为外源表达系统来表达外源重组蛋白时,如果蛋白的生成速率大于折叠速率,胞质中蛋白累积浓度过高,生成的肽链没有足够的时间折叠成为正确的天然形式,就会导致蛋白聚集形成包涵体并沉淀。根据外源重组蛋白种类、性质、表达速率和表达水平的不同,生成包涵体的产量也有所不同。同时,由于大肠杆菌中含有还原型谷胱甘肽,对重组蛋白二硫键的形成不利,更容易导致包涵体的形成。当外源重组蛋白大量形成包涵体时,将会失去原有的天然结构,从而导致其功能丧失。包涵体的产生大大影响了目的基因表达产物的产率,并造成了极大的浪费。近年来,相当多的研究致力于减少包涵体的产生,但是依然没有得到完美的解决。
3.腈水合酶(ec4.2.1.84,nitrile hydratase,简称nhase),是腈转化酶中的一种酶,因其可以将腈类化合物催化转化为具有高附加值的酰胺类化合物,近年来引起了人们广泛的关注。利用腈水合酶生成的丙烯酰胺、烟酰胺等酰胺类化合物也被广泛应用于化工、医药、农药等领域。在众多高附加值的酰胺类化合物之中,5-氰基戊酰胺是一种重要的的化工原料和农药中间体,可用于合成除草剂唑啶草酮(azafenidin)和6-氨基己酰胺。唑啶草酮有良好的耐低温和耐雨水冲刷效应,可在冬前气温降到很低时用药,也可在降雨频繁的春季抢在雨天间隙及时用药,因其在土壤中的半衰期仅为几个小时,故对下茬作物安全,是麦田春季化除的优良除草剂。6-氨基己酰胺是合成己内酰胺的重要中间体,己内酰胺是一种常用的有机化工原料。由于5-氰基戊酰胺作为己二腈转化为己二酰二胺的中间反应物,在工业催化中难以合成,需要高温高压等严苛条件,不仅成本高也导致了更多污染物的排放;同时传统工业催化选择性差,反应伴随着大量的副产物生成,相较之下腈水合酶作为生物催化剂,具备反应温和高效、选择性优异、绿色无污染的优势,具有良好的应用前景。
4.目前已知的腈水合酶菌种主要包括红球菌属(rhodococcus)、红假单胞菌属(rhodopseudomonas)、假单胞菌属(pseudomonas)、芽孢杆菌属(bacillus)、诺卡氏菌属(nocardia)、假诺卡氏菌属(pseudonocardia)等这些菌大多来源于工厂附近的污泥及废水之中,其生长条件苛刻且难以筛选、不易培养,因此将其基因转入基因工程菌内进行表达已成为人们当下热门的研究方向之一。本发明在研究前期,发现了一种腈水合酶基因并制备了腈水合酶基因工程菌,发现其有显著的区域选择性。然而发现在使用大肠杆菌作为外源
表达系统来表达外源重组腈水合酶蛋白时会产生大量不溶的包涵体,降低了腈水合酶的正确表达。
5.g蛋白b1免疫球蛋白结构域(gb1),是所属于g蛋白的一种小蛋白,由一个稳定的单一结构域组成,具有良好的折叠能力和稳定性。这种小蛋白没有二硫化物和辅助因子,却具有良好的高温耐受性,序列简约的特点,可以帮助重组蛋白正确折叠、促进部分蛋白可溶性表达的作用,但目前尚未发现该蛋白对于促进fe型腈水合酶可溶性表达的相关报道。
技术实现要素:
6.本发明提供了一种g蛋白b1免疫球蛋白结合结构域(gb1)在促进腈水合酶重组蛋白的可溶性表达和提高二腈化合物催化效率方面的应用。
7.本发明采用的技术方案如下:
8.一种腈水合酶重组蛋白的构建方法,是在腈水合酶重组质粒中插入gb1基因和一段柔性肽基因,利用基因工程菌表达新的腈水合酶重组蛋白。具体步骤如下:
9.步骤(1):腈水合酶重组基因的构建
10.gb1基因表达的氨基酸序列为:
11.mtyklilngktlkgettteavdaataekvfkqyandngvdgewtyddatktftvte;
12.柔性肽氨基酸序列为:ggggsggggsggggs;
13.将腈水合酶重组质粒g0130349-1作为克隆载体,利用无缝克隆技术,在腈水合酶α亚基基因的5’端插入gb1基因与柔性肽基因完成腈水合酶重组基因的构建,并将其命名为gb1-renhase-ac-his;经无缝克隆插入gb1基因可以促进腈水合酶的可溶性表达,大大减少包涵体的形成。
14.步骤(2):蛋白表达验证
15.得到的重组质粒转化入arcticexpression(de3)和bl21(de3)大肠杆菌感受态细胞中,使用lb液体培养基将其扩增后涂布于含有50μg/mg卡那霉素的lb固体平板上,37℃倒置过夜得到长有若干单克隆菌落的平板;在平板上挑取单克隆菌落接种于少量含有50μg/mg卡那霉素的lb液体培养基的试管中,37℃、220rpm振荡培养5h,培养至其od600值达到0.6-0.8时加入终浓度为1mm的异丙基硫代半乳糖苷(iptg)进行诱导16h;结束诱导后离心菌体,倒掉上清,使用pb缓冲液对菌体进行清洗与重悬,超声破碎菌体后进行sds-page检测腈水合酶蛋白表达情况;
16.步骤(3):制备菌液
17.单克隆菌落接种于含有50μg/mg卡那霉素的lb液体培养基的试管中,37℃、220rpm振荡培养5h得到种子液;并将种子液按1%体积接种量接种到含有50μg/mg卡那霉素的lb液体培养基中,37℃、220rpm培养至od值在0.6-0.8范围内,加入异丙基硫代半乳糖苷(iptg)至终浓度为0.1mm/l,16℃、200rpm下过夜诱导18小时;离心去除上清液收集菌体,并用pb缓冲液洗涤2次后进行重悬,得到待用的腈水合酶基因工程菌,并命名为gb1-renhase-arcticexpression(de3)。
18.所述的二腈化合物包括丙二腈、丁二腈、己二腈、癸二腈及对苯二腈。
19.构建的新型腈水合酶重组蛋白可以提高对二腈化合物的催化活性。
20.新型腈水合酶重组蛋白在催化二腈化合物反应中的应用。
21.新型腈水合酶重组蛋白在生产方面的应用。
22.新型腈水合酶重组蛋白在制备5-氰基戊酰胺中的应用。
23.本发明提供了gb1蛋白可以促进腈水合酶可溶性表达的分子改造策略,降低了包涵体的形成,同时提高了腈水合酶重组蛋白催化二腈化合物转化反应效率,为全细胞催化二腈化合物的工业化应用提供了理论依据。
附图说明
24.图1a为改造前renhase蛋白诱导表达sds-page电泳图:
25.lane m:蛋白marker;lane 1:阴性对照沉淀;lane 2:阴性对照上清;
26.lane 3:bl21(de3)诱导破碎沉淀;
27.lane 4:bl21(de3)诱导破碎上清;
28.lane 5:arctic expression(de3)诱导破碎沉淀;
29.lane 6:arctic expression(de3)诱导破碎上清。
30.图1b为改造后gb1-renhase-ac-his蛋白诱导表达sds-page电泳图:
31.lane m:蛋白marker;
32.lane 1:arctic expression(de3)诱导破碎上清;
33.lane 2:arctic expression(de3)诱导破碎沉淀;
34.lane 3:bl21(de3)诱导破碎上清;
35.lane 4:bl21(de3)诱导破碎沉淀;
36.lane 5:阴性对照上清;
37.lane 6:阴性对照沉淀。
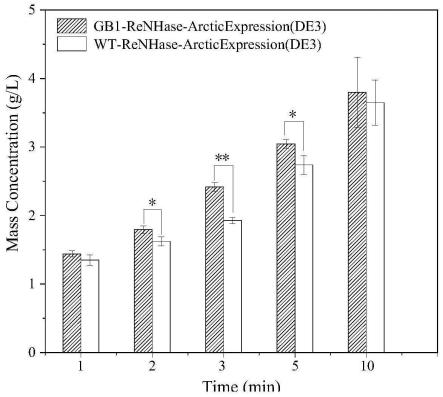
38.图2为改造后的腈水合酶基因工程菌gb1-renhase-arcticexpression(de3)与对照组wt-renhase-arcticexpression(de3)在不同时间下全细胞催化己二腈生成的5-氰基戊酰胺浓度,平行实验三次。以gb1-renhase-arctic expression(de3)和wt-renhase-arctic expression(de3)作为分组变量,对生成的5-cvam(5-氰基戊酰胺)浓度进行独立样本t检验,在2min,3min,5min反应时间下,分别满足方差齐性假设(f
2min
=0.315,p>0.05;f
3min
=0.915,p>0.05;f
5min
=1.741,p>0.05)。在此前提下,2min反应时间下的t检验结果(t=0.0253,p<0.05)显示5-cvam产物浓度均值差异显著,3min反应时间下的t检验结果(t=0.0004,p<0.01)显示5-cvam产物浓度均值差异极显著,5min反应时间下的t检验结果(t=0.0245,p<0.05)显示5-cvam产物浓度均值差异显著。
具体实施方式
39.以下结合附图和技术方案,进一步说明本发明的具体实施方式。
40.实施例1:gb1-renhase-ac-his蛋白表达验证
41.将无缝克隆连接好的腈水合酶重组基因与未改造的腈水合酶基因分别取2μl加入至50μl的感受态大肠杆菌arctic expression(de3)和bl21(de3),并在冰上静置30min,之后在42℃热激90秒后迅速置于冰上3min,加入500μl lb液体培养基,在37℃、220rpm条件下振荡活化1h。在提前制备的lb固体培养基分别吸取两支活化后的大肠杆菌100μl,并均匀涂布于平板上,在恒温摇床上倒置静止过夜培养,12h后平板上长有大量单克隆菌落。用移液
枪头分别从两种不同平板上挑取明显的单克隆菌落打入含有50μg/ml卡那霉素的lb液体培养基试管中,37℃、220rpm振荡培养至od600值在0.6-0.8之间,加入终浓度为1mm的iptg,在16℃、200rpm的条件下过夜诱导18h。次日以5000rpm转速收集菌体,倒掉上清液,用50mm pb(ph7.4)清洗两次并重悬菌体;使用超声波破碎仪300w,破碎5s,间隔5s将菌体破碎,然后在10000rpm条件下离心0.5h。将离心后的上清液和沉淀分别制备sds-page蛋白电泳样品,并在100v条件下进行sds-page蛋白电泳,1h后使用考马斯亮蓝g250染液对蛋白胶进行染色和脱色,观察并比较实验组和对照组样品条带。如图1a所示,对照组的诱导破碎沉淀中目标蛋白(约25kda)含量远远多于诱导破碎上清,证明表达的腈水合酶绝大多数以不溶的包涵体形式存;而在连接有gb1蛋白的目标蛋白亚基(约33kda)在诱导破碎上清中大量表达,目标蛋白在诱导破碎沉淀中的含量相比较上清液明显降低(图1b),说明gb1蛋白可以帮助腈水合酶正确折叠,降低包涵体的产生。
42.实施例2:基因工程菌gb1-renhase-arcticexpression(de3)全细胞催化己二腈反应
43.(1)菌液制备:挑取例一中平板上的单克隆菌落打入含有50μg/ml卡那霉素的lb液体培养基试管中,37℃、220rpm振荡培养至od600值在0.6-0.8之间,将试管中菌液转入500ml lb液体培养基中进行扩大培养,待其od600值在0.6-0.8范围内加入终浓度为1mm iptg,并于16℃、200rpm条件下进行低温诱导过夜培养18h。次日,在5000rpm、4℃条件下回收菌液并倒掉上清液,用50mm pb缓冲液(ph7.4)清洗两次并用20ml pb缓冲液重悬菌体待用;
44.(2)全细胞催化反应:在两支ep管中分别依次加入250μl 400mm己二腈,200μl 50mm pb缓冲液(ph7.4),最后分别加入8g/l dcw实验组基因工程菌gb1-renhase-arctic expression(de3)与对照组基因工程菌wt-renhase-arcticexpression(de3)各50μl并放入摇床中在200rpm、30℃及光照条件下进行全细胞催化己二腈转化反应,体系中底物己二腈反应浓度为200mm。反应1/2/3/5/10min后,加入500μl甲醇终止反应;
45.(3)高效液相色谱(hplc)分析:将上述两支试管在10000rpm转速下离心20min,过0.22μm滤膜后分别进行高效液相色谱检测。高效液相使用ultimate 5μm 4.6
×
250mm lp-c18柱,流动相为25mm磷酸水溶液和甲醇(89:11,vol:vol),检测波长200nm,柱温25℃,流速1ml/min,检测并计算实验组和对照组生成5-氰基戊酰胺的含量。
46.如图2所示,连接有gb1蛋白的腈水合酶基因工程菌gb1-renhase-ac-his在2/3/5min生成的5-氰基戊酰胺浓度分别为1.79g/l、2.42g/l、3.04g/l,相比较野生型腈水合酶基因工程菌wt-renhase-ac-his,gb1-renhase-ac-his催化己二腈生成5-氰基戊酰胺的产量在2min时提高了10.6%,在3min时提高了25.5%,在5min时提高了11.2%,随着反应时间的增加,二者在10min后将底物完全反应。该结果说明gb1蛋白可以帮助腈水合酶正确折叠,使腈水合酶基因工程菌的催化能力显著提升。将改造后的腈水合酶重组蛋白作为实验组,未改造的腈水合酶作为对照组进行sds-page分析,及全细胞催化底物己二腈转化反应,发现相较于对照组菌株,添加了gb1基因的实验组菌株腈水合酶可溶性表达明显改善,其催化底物己二腈转化效率显著提升。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1