miRNA在制备诊断非小细胞肺癌的工具中的应用
mirna在制备诊断非小细胞肺癌的工具中的应用
技术领域
1.本发明属于生物医药领域,具体涉及mirna在诊断非小细胞肺癌中的应用。
背景技术:
2.肺癌(lung cancer)是全球最为常见的呼吸道恶性肿瘤,也是最常见的肺原发性恶性肿瘤,在全球的发病率和死亡率均位居第一位,是恶性肿瘤患者的“金牌杀手”,严重威胁人类的生命健康。据报道,肺癌死亡人数占全球恶性肿瘤死亡人数的29%,且死亡人数呈逐渐上升趋势,每年肺癌的新发病例占全球恶性肿瘤的12.4%。目前,肺癌主要分为非小细胞肺癌(non-small cell lung cancer,nsclc)和小细胞肺癌(small cell lung cancer,sclc)两大类,其中约85%的肺癌为nsclc。
3.与小细胞癌相比,nsclc的癌细胞生长分裂较为缓慢,进而扩散、转移的时间相对较晚。目前,非小细胞肺癌的早期临床症状主要包括发热、胸痛、气促、咳嗽、血痰等,但上述症状很难得到人们的了解和重视,至少很多人的病情并未得到准确的诊断。在临床诊断中,其主要有效依据即为各种影像学结果的综合分析,但是其最终的诊断,必须依靠病理组织学或细胞学诊断,确诊患者为nsclc。近些年研究发现,中晚期非小细胞肺癌的预后较差,且具有易复发、微转移的特点,致使其死亡率较高。因此,为了延长肺癌患者的生存期,提高患者的生存质量,医疗界需不断探索肺癌的相关机制,寻找肺癌早期诊断的标志物。
技术实现要素:
4.本发明的第一目的是提供一种用于非小细胞肺癌早期诊断的标志物;
5.本发明的第二目的是提供一种诊断非小细胞肺癌的系统。
6.为实现上述目的,本发明采用了如下技术方案:
7.本发明一方面提供了一种用于诊断非小细胞肺癌的标志物,所述的标志物包括hsa-mir-26b和/或hsa-mir-378。
8.如本文中在诸如“a和/或b”的短语中使用的术语“和/或”旨在包括a和b两者;a或b;a(单独);以及b(单独)。同样地,在诸如“a、b和/或c”的短语中使用的术语“和/或”旨在涵盖以下实施方案的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);以及c(单独)。
9.作为一种优选的实施方案,所述的标志物包括hsa-mir-26b和hsa-mir-378。
10.本发明另一方面提供了检测样本中前面所述标志物的表达水平的试剂在制备诊断非小细胞肺癌的工具中的应用。
11.术语“表达的水平”或“表达水平”一般指生物学样品中标志物的量。“表达”一般指信息(例如基因编码和/或表观遗传信息)转化成细胞中存在并运行的结构的过程。因此,如本文中使用的,“表达”可以指转录成多核苷酸,翻译成多肽,或甚至多核苷酸和/或多肽修饰(例如多肽的翻译后修饰)。转录的多核苷酸的,翻译的多肽的,或多核苷酸和/或多肽修饰(例如多肽的翻译后修饰)的片段也应视为表达的,无论它们是源自通过可变剪接生成的
转录物或经过降解的转录物,或者是源自多肽的翻译后加工(例如通过蛋白水解)。“表达的基因”包括转录成多核苷酸(如mrna),然后翻译成多肽的基因,还有转录成rna但不翻译成多肽的基因(例如转运和核糖体rna、mirna、lncrna)。作为一种优选的实施方式,“表达的基因”指转录成rna但不翻译成多肽的基因。
[0012]“表达上调”指相对于对照诸如不具有疾病或病症(例如癌症)的个体,内部对照(例如持家型标志物),或来自一个患者组/群体的样品中标志物的中值表达水平,个体中标志物的增加的表达或增加的水平。
[0013]“表达下调”指相对于对照诸如不具有疾病或病症(例如癌症)的个体或内部对照(例如持家型标志物),或来自一个患者组/群体的样品中标志物的中值表达水平,个体中标志物的降低的表达或降低的水平。在一些实施方案中,降低的表达是很少的表达或不表达。
[0014]
作为一种优选的实施方案,所述的试剂包括:
[0015]
特异性识别标志物的探针;或
[0016]
特异性扩增标志物的引物。
[0017]
在本发明中,术语“探针”是指对应于能够特异性结合mrna的数个碱基至数百个碱基的核酸片段,例如rna或dna等。由于被标记,因而可以确认是否存在特定的mrna。探针能够以寡核苷酸(oligonucleotide)探针、单链dna(single stranded dna)探针、双链dna(double stranded dna)探针、rna探针等形式制造。在本发明中,利用与上述标志物基因互补的探针进行杂交,并且可通过是否杂交来诊断上述基因的表达水平。可以基于本技术领域中公知的技术来更改用于合适探针的选择及杂交条件,在本发明中,对此没有特别限制。
[0018]
术语“引物”是指合成的寡核苷酸,其在与多核苷酸模板形成双链体后,能够充当核酸合成的起始点,并从其3'端沿模板延伸以形成延伸的双链体。在延伸过程中添加的核苷酸的序列由模板多核苷酸的序列确定。通常,引物通过dna聚合酶延伸。引物的长度通常与其在引物延伸产物的合成中使用的相容,并且长度通常在8至100个核苷酸之间,例如10至75、15至60、15至40、18至30、20至40、21至50、22至45、25至40等。典型的引物的长度可以在10-50个核苷酸之间,例如15-45、18-40、20-30、21-25等等,以及在所述范围之间的任何长度。在一些实施方案中,引物长度通常不超过约10、12、15、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65或70个核苷酸。
[0019]
本发明的引物或探针可以使用亚磷酰胺固相载体方法或其他公知的方法化学合成。这种核酸序列可以利用本领域中公知的多种手段来进行变形。这种变形的非限制性例包括甲基化、封装、天然核苷酸的一种以上的同源物的取代以及核苷酸之间的变形,例如,变形为不带电的连接体(例:膦酸甲酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等)或带电的连接体(例:硫代磷酸酯,二硫代磷酸酯等)。
[0020]
作为一种优选的实施方案,所述的样本包括血液、血浆、血清、唾液、尿液、泪液、脑脊液或器官组织。
[0021]
作为一种更为优选的实施方案,所述的样本为血液。
[0022]
本发明另一方面提供了一种诊断非小细胞肺癌的系统,包括以下单元:
[0023]
1)检测单元:包括标志物检测模块;
[0024]
2)分析单元:将检测单元检测得到的标志物的表达水平作为输入变量,输入非小细胞肺癌的诊断模型进行分析;
[0025]
3)评估单元:输出样本对应的个体患非小细胞肺癌的风险值;
[0026]
所述的标志物包括hsa-mir-26b和/或hsa-mir-378。
[0027]“模型”是任何数学方程式,算法,分析或程序化过程或统计技术,其采用一个或多个连续或分类输入并计算输出值,有时称为“索引”,“索引值”,“预测器”,“预测值”,“概率”或“概率得分”。“公式”的非限制性示例包括和、比率以及回归算子,例如系数或指数,标志物值转换和标准化,规则和指南,统计分类模型以及对历史群体进行训练的神经网络。在组(panel)和组合构造中,特别有趣的是结构和句法统计分类算法,以及利用模式识别特征的风险指数构建方法,包括已建立的技术,例如互相关,主成分分析(pca),因子旋转,对数回归(logreg),线性判别分析(lda),特征基因线性判别分析(eigengene lineardiscriminant analysis,elda),支持向量机(support vector machines,svm),随机森林(random forest,rf),递归分区树(rpart)、xgboost(xgb)以及其他相关的决策树分类技术,shrunkencentroids(sc),stepaic,最近的kth邻居(kth-nearest neighbor),boosting,决策树(decision trees),神经网络,贝叶斯网络,支持向量机和隐马尔可夫模型(hidden markovmodels)等。还进一步实现了许多此类算法技术,以执行特征(基因座)选择和规则化(regularization)规则化,例如在岭回归(ridge regression),lasso和elastic net等中。其他技术可用于生存和事件前时间危险分析(time to event hazard analysis)中,包括本领域技术人员众所周知的cox,weibull,kaplan-meier和greenwood模型。这些技术中的许多技术都可以与标志物选择技术结合使用,例如正向选择,后向选择或逐步选择,给定大小的所有潜在标志物集或组的完整枚举,遗传算法或它们本身可以包括标志物选择方法。这些可以与信息标准结合使用,例如akaike的信息标准(akaike'sinformation criterion,aic)或贝叶斯信息标准(bayes information criterion,bic),以便量化其他标志物和模型改进之间的权衡,并有助于最小化过度拟合。生成的诊断模型可以在其他研究中进行验证,或在它们最初进行培训的研究中交叉验证,使用诸如bootstrap,leave-one-out(loo)和10倍交叉验证(10-fold cross-validation)(10倍cv)等技术进行。在各个步骤,可以根据本领域已知的技术通过值排列来估计错误发现率。
[0028]
本发明另一方面提供了标志物在构建前面所述的系统中的应用,所述的标志物包括hsa-mir-26b和/或hsa-mir-378。
[0029]
本发明另一方面提供了一种用于诊断非小细胞肺癌的工具,所述的工具包括检测样本中前面所述标志物的表达水平的试剂。
[0030]
作为一种优选的实施方案,所述的工具包括芯片或试剂盒。
[0031]
在本发明中,“芯片”也称为“阵列”,指包含连接的核酸或肽探针的固体支持物。阵列通常包含按照不同的已知位置连接至基底表面的多种不同的核酸或肽探针。这些阵列,也称为“微阵列”,通常可以利用机械合成方法或光引导合成方法来产生这些阵列,所述光引导合成方法合并了光刻方法和固相合成方法的组合。阵列可以包含平坦的表面,或者可以是珠子、凝胶、聚合物表面、诸如光纤的纤维、玻璃或任何其它合适的基底上的核酸或肽。可以以一定的方式来包装阵列,从而允许进行全功能装置的诊断或其它方式的操纵。
[0032]“微阵列”是杂交阵列原件有序排列在基质上,所述杂交阵列原件诸如聚核苷酸探针(例如寡核苷酸)或结合剂(例如抗体)。所述基质可以是固体基质,例如,玻璃或二氧化硅玻片、珠、纤维光学粘结剂或半固态基质,例如硝酸纤维素膜。核苷酸序列可以是dna、rna或
其中的任何排列。
[0033]
本发明提供了用于诊断受试者中的非小细胞肺癌的试剂盒,该试剂盒用于确定前面所述标志物的表达水平。试剂盒可以包括适于选择性检测来源于受试者的样品中用于诊断非小细胞肺癌的标志物或标志物组的存在的材料和试剂。例如,在一个实施方案中,该试剂盒可以包括与标志物特异性杂交的试剂。这类试剂可以是适于用于在mrna水平上测量标志物基因的mrna表达量的试剂,例如,探针或引物。该试剂盒可以包括用于进行测定以检测一种或多种标志物的试剂。
[0034]
在进一步的实施方案中,试剂盒可以含有标记或产品插页形式的合适操作参数的说明书。例如,说明书可以包括关于如何收集样品,如何确定样品中一种或多种标志物的水平,或如何将样品中一种或多种标志物的水平与受试者患非小细胞肺癌相关联的信息或指导。
[0035]
在另一个实施方案中,试剂盒可以含有一个或多个容器,其具有标志物样品,以用作参比标准,合适的对照,或用于测定的校准以检测测试样品中的标志物。
[0036]
本发明的优点和有益效果:
[0037]
本发明首次公开了hsa-mir-26b、hsa-mir-378的表达水平与非小细胞肺癌相关,通过检测受试者样本中hsa-mir-26b、hsa-mir-378的表达水平,可以判断受试者是否患有非小细胞肺癌以及患非小细胞肺癌的风险,具有很好的应用前景。
附图说明
[0038]
图1是hsa-mir-26b在非小细胞肺癌中差异表达的箱线图;
[0039]
图2是hsa-mir-378在非小细胞肺癌中差异表达的箱线图;
[0040]
图3是hsa-let-7b在非小细胞肺癌中差异表达的箱线图;
[0041]
图4是hsa-mir-26b用于诊断非小细胞肺癌的roc曲线图;
[0042]
图5是hsa-mir-378用于诊断非小细胞肺癌的roc曲线图;
[0043]
图6是hsa-let-7b用于诊断非小细胞肺癌的roc曲线图;
[0044]
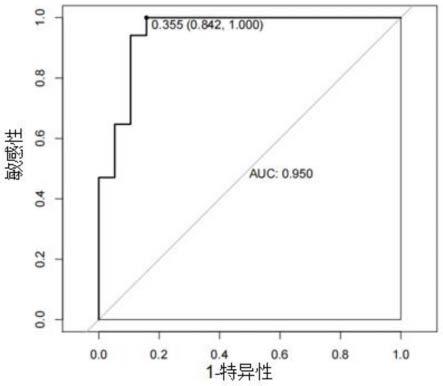
图7是hsa-mir-26b和hsa-mir-378联合用于诊断非小细胞肺癌的roc曲线图;
[0045]
图8是hsa-let-7b和hsa-mir-26b联合用于诊断非小细胞肺癌的roc曲线图;
[0046]
图9是qpcr验证hsa-mir-26b差异表达的结果图;
[0047]
图10是qpcr验证hsa-mir-378差异表达的结果图;
[0048]
图11是qpcr验证hsa-mir-26b的诊断效能的roc曲线图;
[0049]
图12是qpcr验证hsa-mir-378的诊断效能的roc曲线图。
具体实施方式
[0050]
以下结合附图对本技术的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本技术,并不用于限制本技术。
[0051]
实施例1非小细胞肺癌标志物筛选
[0052]
从geo数据库下载gse17681数据,该数据集包括17个非小细胞肺癌(nsclc)患者和19名非癌症对照的血液样本,对数据集进行取对数处理后使用r语言limma包对其进行差异分析,得到260个差异表达基因,筛选标准为:p.value《0.05。hsa-mir-26b、hsa-mir-378、
hsa-let-7b表达情况如表1、图1-3所示。
[0053]
表1本发明所涉及基因的差异表达数据
[0054]
基因aveexprtp.valuehsa-mir-26b6.937-2.6320.012hsa-mir-3783.9333.5470.001hsa-let-7b8.958-2.3060.027
[0055]
实施例2诊断效能分析
[0056]
使用r包“proc”(版本1.15.0)绘制受试者工作曲线(roc),分析auc值、敏感性和特异性,判断指标单独或者联合的诊断效能。在判断指标联合的诊断效能时,对各基因的表达水平进行logistics回归,通过拟合出的回归曲线计算出每个个体患癌与否的概率,确定不同的概率划分阈值,根据确定的概率划分阈值,计算得出联合检测方案的灵敏度、特异性以及准确性等。
[0057]
结果:
[0058]
hsa-mir-26b、hsa-mir-378、hsa-let-7b的诊断效能参见表2、图4-6,通过该结果可知hsa-mir-26b、hsa-mir-378、hsa-let-7b对于非小细胞肺癌具有很好的诊断效果。
[0059]
表2、单个基因的诊断效能
[0060]
基因auc敏感性特异性hsa-mir-26b0.8171.0000.632hsa-mir-3780.7411.0000.526hsa-let-7b0.7210.4120.947
[0061]
基因联合诊断的数据见表3、图7、图8,通过该结果可知,hsa-mir-26b+hsa-mir-378联合诊断效果优于单个标志物。
[0062]
表3、基因联合的诊断效能
[0063]
基因组auchsa-mir-26b+hsa-mir-3780.950hsa-let-7b+hsa-mir-26b0.751
[0064]
实施例3 qpcr验证
[0065]
一、实验方法:
[0066]
1、样本采集
[0067]
分别收集30例健康人血液样本和30例非小细胞肺癌患者的血液样本,写明样本的详细信息,上述所有标本的取得均通过伦理委员会的同意。
[0068]
2、rna提取
[0069]
使用promega公司的血液rna提取试剂盒提取总rna。
[0070]
3、逆转录:
[0071]
1)逆转录反应
[0072]
配制25μl反应体系,每个样品取1μg总rna作为模板rna,在pcr管中分别加入以下组分:depc水,5
×
逆转录缓冲液,10mm dntp,0.1mm dtt,30μm oligo dt,200u/μl m-mlv,模板rna。
[0073]
反应条件:42℃孵育1h,72℃10min,短暂离心。
[0074]
2)引物设计
[0075]
根据hsa-mir-26b、hsa-mir-378和u6基因的编码序列设计qpcr扩增引物。
[0076]
3)qpcr扩增检验:
[0077]
配制25μl反应体系:sybr green聚合酶链式反应体系12.5μl,正反向引物(5μm)各1μl,模板cdna 2.0μl,无酶水8.5μl。每个样本设置3个平行管,所有扩增反应均重复三次以上以保证结果的可靠性。各项操作均于冰上进行。
[0078]
以sybr green作为荧光标记物,在light cycler荧光实时定量pcr仪上进行pcr反应,通过融解曲线分析和电泳确定目的条带,δδct法进行相对定量。
[0079]
4、统计学方法
[0080]
实验采用3次重复实验,结果数据都是以平均值
±
标准差的方式来表示,使用spss13.0统计软件来进行统计分析的,两者之间的差异分析采用t检验,认为当p《0.05时差异具有统计学意义。
[0081]
二、实验结果
[0082]
如图9、图10所示,与健康人相比,hsa-mir-26b在非小细胞肺癌患者中表达显著下调,hsa-mir-378在非小细胞肺癌患者中表达显著上调,差异具有统计学意义(p《0.05)。如表4、表5、图11、图12所示,hsa-mir-26b具有较高的诊断效能(auc为0.800),hsa-mir-378具有较高的诊断效能(auc为0.831),提示hsa-mir-26b、hsa-mir-378可用于诊断非小细胞肺癌。
[0083]
表4 hsa-mir-26b用于诊断非小细胞肺癌的roc曲线下方的区域曲线下方的区域
[0084][0085]
a.按非参数假定
[0086]
b.原假设:真区域=0.5
[0087]
表5 hsa-mir-378用于诊断非小细胞肺癌的roc曲线下方的区域曲线下方的区域
[0088][0089]
a.按非参数假定
[0090]
b.原假设:真区域=0.5
[0091]
以上结合附图详细描述了本技术的优选实施方式,但是,本技术并不限于上述实施方式中的具体细节,在本技术的技术构思范围内,可以对本技术的技术方案进行多种简单变型,这些简单变型均属于本技术的保护范围。
[0092]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本技术对各种可能的组合方式不再另行说明。
[0093]
此外,本技术的各种不同的实施方式之间也可以进行任意组合,只要其不违背本技术的思想,其同样应当视为本技术所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1