具有宽响应范围和高响应速率的温敏光子晶体凝胶微球及其制备方法
1.本发明属于光子晶体材料领域,涉及具有宽响应范围和高响应速率的温敏光子晶体凝胶微球及其制备方法。
背景技术:
2.温度作为一种与人们生产生活相关的外界刺激源,其检测和感应一直被人们广泛关注和研究。在自然界中变色龙等生物可根据环境变化调整自己的肤色带来的灵感下,用直观的颜色变化来检测外界不同温度的温敏型光子晶体凝胶被设计了出来。温敏型光子晶体凝胶将温度响应型凝胶与光子晶体系统结合,通过温度变化来改变凝胶的物理或化学性质来改变光子晶体的结构色等光学性能。与片状温敏型光子晶体凝胶膜相比,温敏型光子晶体微球具有更高的响应速率,不易破损,方便储存和携带的特点。同时,温敏型光子晶体凝胶微球因其小巧的球形而不会出现凝胶膜的收缩卷曲的现象,还可以方便灵活地进行二次组装。基于以上优势,温敏型光子晶体凝胶微球有望应用于生物/化学反应等过程的可视化温度检测。因此该材料在近年来受到了越来越多的关注。
3.目前,温敏型光子晶体凝胶微球大多以n-异丙基丙烯酰胺(nipam)为功能单体,在内部镶嵌有规整排布的光子晶体结构。当外界温度变化时,聚n-异丙基丙烯酰胺(pnipam) 温敏型光子晶体微球的晶格间距随着体积的溶胀或收缩而增大或减小,衍射波长由此发生偏移,最终表现出肉眼可识别的颜色变化。目前,已报导的pnipam温敏型光子晶体微球大多具有紧密堆积或非紧密堆积的胶体晶体阵列,多孔反蛋白石等三维光子晶体结构。这些三维结构的微球的尺寸由微流控装置控制,直径在200~300μm之间,对温度具有明显的颜色响应性能,最高可响应温度在55℃左右。然而,它们大多存在着需要精确控制制备条件,制备工艺复杂繁琐以及耗时较长的问题。同时,由于凝胶微球内部的光子晶体是三维球形堆积结构的,凝胶微球球面约束所产生的曲率会使衍射光路的方向在微球的边缘处发生不同程度的变化,因而在靠近凝胶微球边缘的部分会出现多种颜色混杂的现象,即凝胶微球颜色呈现不均匀的情况。
4.有研究人员通过一维磁组装的方法制备了毫米级的光子晶体球,通过施加磁场即可诱导磁颗粒在凝胶内部组装成一维光子晶体结构,制备过程不需要精密的调控和繁琐的操作。利用该方法形成的光子晶体结构是平行于入射光的一维周期结构的集体取向,因此凝胶球可呈现出均匀的结构色。虽然该方法解决了凝胶球颜色不均匀的问题,但是,其制备的光子晶体凝胶球的温度响应范围在10~33℃之间,变色范围只能从橙红色到绿色,其温度响应范围较窄、响应速率也有待提高。
5.对于温敏型光子晶体材料而言,若能检测更宽的温度范围,则可更广泛地应用于不同反应温度的各种反应中,或者指示特定反应在不同温度下的效率或速率,以满足人们对温度检测的多样化的需求。同时,温敏型光子晶体材料具有高的温度响应速率才可以更好地满足人们对温度检测准确性和及时性的要求。因此,开发出温度响应范围宽、响应速率
高且结构色均匀的温敏光子晶体凝胶微球及其制备技术具有重要的意义。
技术实现要素:
6.针对现有的温敏光子晶体凝胶微球存在的制备过程繁琐及颜色不均,温度响应范围窄以及响应速率低的问题,本发明提供了一种具有宽响应范围和高响应速率的温敏光子晶体凝胶微球及其制备方法,以简化温敏光子晶体凝胶微球的制备工艺、提高温敏光子晶体凝胶微球结构色的均匀性并拓宽其温度检测范围和提高其温度响应速率。
7.为实现上述发明目的,本发明采用的技术方案如下:
8.一种具有宽响应范围和高响应速率的温敏光子晶体凝胶微球,该温敏光子晶体凝胶微球由聚(n-异丙基丙烯酰胺-共聚-丙烯酰胺)凝胶微球,以及镶嵌在该凝胶微球的三维高分子网络结构中的超顺磁纳米粒子组成;该凝胶微球是由n-异丙基丙烯酰胺单体和丙烯酰胺单体与交联剂四臂聚乙二醇丙烯酰胺经交联共聚形成的具有均匀交联结构的微球,超顺磁纳米粒子在凝胶微球的三维高分子网络结构中排布形成了若干条一维取向的链状结构;该温敏光子晶体凝胶微球具有均匀的结构色,在10~52℃的温度范围内实现结构色由橙黄色到蓝紫色的变化,结构色对应的波长范围在635~468nm之间,在10~55℃的温度条件下该温敏光子晶体凝胶微球在80s以内即可达到收缩平衡。
9.本发明提供的温敏光子晶体凝胶微球在温度从10~52℃的变化过程中,其结构色由橙黄色到蓝紫色连续变化,对应的波长迁移范围几乎覆盖到整个可见光波段,具有结构色变化范围宽和温度检测范围宽的特点。同时,在10~55℃的温度条件下,该温敏光子晶体凝胶微球在80s以内即可达到收缩平衡,在105s以内即可达到溶胀平衡。由于在实际应用中,通常是利用温敏光子晶体凝胶微球指示从低温到高温的变色过程,因此本发明提供的温敏光子晶体凝胶微球在80s以内即可完成在某一温度条件下的变色过程,具有温度相应速率高的特点。
10.上述温敏光子晶体凝胶微球的技术方案中,所述温敏光子晶体凝胶微球在室温(20
±
3℃) 下的水中达到溶胀平衡时的粒径为400~440μm。
11.上述温敏光子晶体凝胶微球的技术方案中,所述聚(n-异丙基丙烯酰胺-共聚-丙烯酰胺) 凝胶微球优选由n-异丙基丙烯酰胺单体、丙烯酰胺单体以及交联剂按照如下的比例经交联共聚形成的,丙烯酰胺单体与n-异丙基丙烯酰胺单体的摩尔比为(0.28~0.32):1,两种单体的摩尔量之和与交联剂的摩尔比为(280~320):1。
12.上述温敏光子晶体凝胶微球的技术方案中,所述温敏光子晶体凝胶微球中超顺磁纳米粒的含量为0.3wt.%~0.5wt.%,超顺磁纳米粒子的粒径优选为145~165nm。所述超顺磁纳米粒子为现有技术中常规的超顺磁纳米粒子,可以是高分子材料或无机材料包覆超顺磁材料形成的超顺磁纳米粒子,例如,高分子材料包覆fe3o4形成的超顺磁纳米粒子,二氧化硅或碳包覆fe3o4形成的超顺磁纳米粒子。
13.本发明还提供了上述具有宽响应范围和高响应速率的温敏光子晶体凝胶微球的制备方法,包括以下步骤:
14.(1)配制内相流体、外相流体和收集液
15.配制内相流体:将n-异丙基丙烯酰胺单体、丙烯酰胺单体、交联剂四臂聚乙二醇丙烯酰胺、光引发剂以及水溶性表面活性剂溶于乙二醇中,然后将超顺磁纳米粒子均匀分散
在所得溶液中,即得内相流体;内相流体中,n-异丙基丙烯酰胺单体的浓度2.5~4mmol/ml,丙烯酰胺单体与n-异丙基丙烯酰胺单体的摩尔比为(0.28~0.32):1,n-异丙基丙烯酰胺单体与丙烯酰胺单体的摩尔量之和与交联剂的摩尔比为(280~320):1;
16.配制外相流体:将油溶性表面活性剂异丁烯丁二酰亚胺溶于大豆油中,即得外相流体;外相流体中油溶性表面活性剂的浓度为0.025~0.04g/ml;
17.配制收集液:将油溶性表面活性剂异丁烯丁二酰亚胺溶于大豆油中,即得收集液;收集液中油溶性表面活性剂的浓度为0.025~0.04g/ml;
18.(2)制备单分散油包水乳液
19.将内相流体输入微流体装置的注射管中,将外相流体输入微流体装置的收集管中,在收集管中形成单分散的油包水乳液,采用盛有收集液的容器收集所述单分散油包水乳液;
20.(3)制备温敏光子晶体凝胶微球
21.对处于收集液中的油包水乳液施加85~90gs的外部磁场,当油包水乳液液滴出现明亮的结构色时,施加紫外光照射引发油包水乳液中的单体与交联剂交联聚合转变成凝胶微球,清洗去除凝胶微球中未反应的物质,即得温敏光子晶体凝胶微球。
22.上述温敏光子晶体凝胶微球的制备方法的技术方案中,步骤(2)中优选控制内相流体的流速为30~50μl/h,外相流体的流速为3000~5000μl/h。
23.上述温敏光子晶体凝胶微球的制备方法的技术方案中,内相流体中超顺磁纳米粒子的浓度优选为3.5~5mg/ml。
24.上述温敏光子晶体凝胶微球的制备方法的技术方案中,所述光引发剂是指在紫外光照射下能引发单体与交联剂交联聚合的物质,例如,光引发剂可以是2-羟基-2-甲基-1-苯基-1-丙酮,也可以是其他常见的光引发剂;内相流体中,光引发剂的浓度优选为30~45μl/ml,水溶性表面活性剂的浓度优选为30~45μl/ml。
25.上述温敏光子晶体凝胶微球的制备方法的技术方案中,所述微流体装置的注射管与收集管同轴设置,注射管的出口处的内径为150~200μm。一种可行的微流体装置的结构如图1所示,包括注射管、连接管和收集管,与注射泵配合使用;注射管为尾部呈圆锥形的玻璃毛细管,由圆柱形玻璃毛细管制作,其尾部被拉成圆锥形;收集管为圆柱形玻璃毛细管;连接管为中心部位设有正方形通孔的方形玻璃管;注射管的尾部插入收集管的头部并通过连接管连接;注射管、连接管和收集管同轴设置。
26.上述温敏光子晶体凝胶微球的技术方案中,所述超顺磁纳米粒子在凝胶微球的三维高分子网络结构中排布形成了若干条一维取向的链状结构,是指超顺磁纳米粒子在三维高分子网络结构排布形成了沿着制备时施加的外部磁场的磁感线方向取向的链状结构。
27.本发明提供的温敏光子晶体凝胶微球之所以具有制备工艺简单、颜色均匀、温度检测范围较宽和温度响应速率快的特点,主要原因如下:
28.一方面,本发明将微流控技术与磁诱导组装一维光子晶体结构的技术相结合。通过适当配合各相流体的组成和浓度以及微流控操作条件,通过微流体装置可控地制备出了尺寸均一的微米级的液滴,实现了凝胶微球的小尺寸化,进而使得凝胶微球具有较快的响应速率,磁诱导组装通过简单的施加磁场,即可使微米级液滴中的超顺磁纳米粒子会迅速排布成一维链状的光子晶体结构,该过程快速便捷,且形成的光子晶体结构是平行于入射
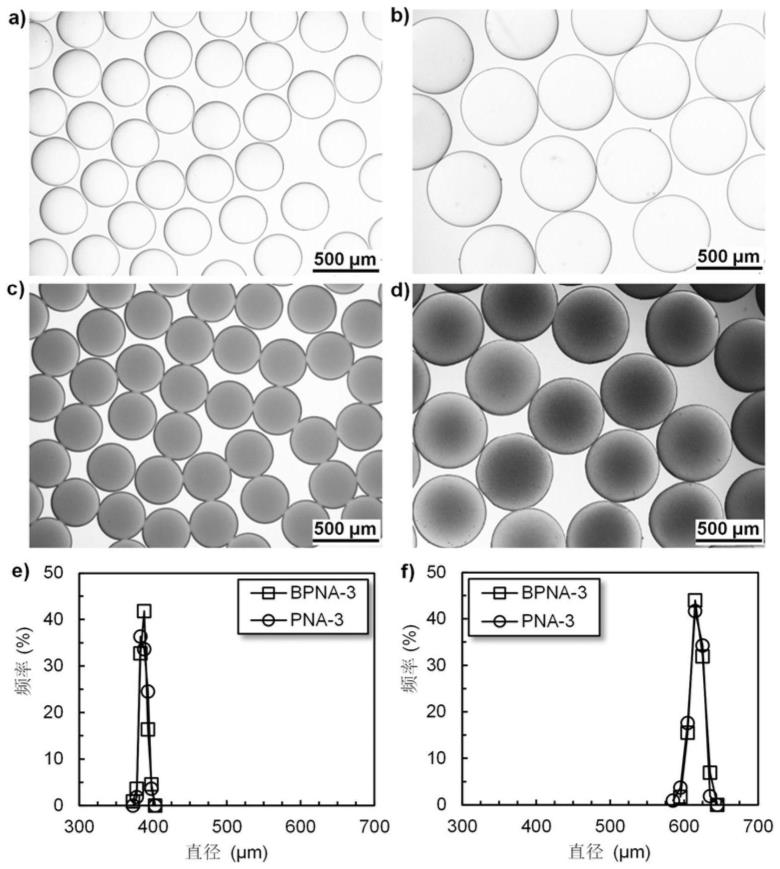
和pna-3的w/o乳液液滴模板的光学显微镜照片以及它们的粒径分布图,b),d)和f)图分别是制备得到的bpna-3和pna-3浸泡在水中的光学显微镜照片以及它们的粒径分布图。
36.图3是bpna-3和pna-3表面及断面的扫描电镜图,其中的a)b)两图是bpna-3的表面形貌,c)d)两图是bpna-3的断面形貌,e)f)两图是pna-3的表面形貌,g)h)两图是pna-3的断面形貌;a)c)e)g)图中的标尺为10μm,b)d)f)h)图中的标尺为1μm。
37.图4是pni-1和pna-1~pna-4红外光谱图。
38.图5是pni-1和pna-1~pna-4在不同温度下的数码照片,图中的标尺为2mm。
39.图6是pna-1~pna-4在不同温度下的反射光谱图,其中a)图的曲线a~i依次代表pna-1 在10、15、20、24、28、32、34、38和40℃下的反射光谱,b)图的曲线a~k依次代表pna-2 在10、15、20、24、28、32、34、38、40、44和46℃下的反射光谱,c)图的曲线a~n依次代表pna-3在10、15、20、24、28、32、34、38、40、44、46、50、52和54℃下的反射光谱,d)图的曲线a~o依次代表pna-4在10、15、20、24、28、32、34、38、40、44、46、52、 54、60和62℃下的反射光谱。
40.图7的a)c)两图是pna-5和pna-6在不同温度下反射光谱图(曲线a~g依次代表在10、 20、30、40、50、52、和54℃下的反射光谱)、b)d)两图是对应的衍射波长变化曲线和数码照片;图中的标尺为2mm。
41.图8的a)c)两图是pna-7和pna-8在不同温度下反射光谱图(曲线a~g依次代表在10、 20、30、40、50、52、和54℃下的反射光谱),b)d)两图是对应的衍射波长变化曲线和数码照片;图中的标尺为2mm。
42.图9的a)c)两图是pna-9和pna-10在不同温度下反射光谱图(曲线a~g依次代表在10、 20、30、40、50、52、和54℃下的反射光谱),b)d)两图是对应的衍射波长变化曲线和数码照片;图中的标尺为2mm。
43.图10是pna-3,pna-9和pna-10,以及pna凝胶膜的动态温敏行为。
44.图11是用pna-10和pni-2来进行颜色指示酶促反应合适温度的图,其中,条形图上方是微球在对应温度下的数码照片,上面一排数码照片对应的是pni-2微球,下面一排数码照片对应的是pna-10微球,图中的标尺为1mm。
具体实施方式
45.以下通过实施例对本发明提供的具有宽响应范围和高响应速率的温敏光子晶体凝胶微球及其制备方法作进一步说明。有必要指出,以下实施例只用于对本发明作进一步说明,不能理解为对本发明保护范围的限制,所属领域技术人员根据上述发明内容,对本发明做出一些非本质的改进和调整进行具体实施,仍属于本发明的保护范围。
46.以下各实施例和对比例中,采用的微流体装置为一级毛细管微流体装置,其结构示意图如图1所示,包括注射管1、连接管2和收集管3,与注射泵配合使用。注射管1由圆柱形玻璃毛细管制作,采用拉针仪将圆柱形玻璃毛细管的尾部拉成圆锥形,然后在砂纸上滚动打磨至锥口内径约为200μm的平口,其圆管部段的外径为960μm、内径为550μm;收集管3由圆柱形玻璃毛细管制作,将圆柱形玻璃毛细管的两端打磨平整得到,收集管的外径为960μm、内径为700μm;连接管2为方形玻璃管,将方形玻璃管的两端打磨光滑平整得到,其中心部位设有正方形通孔,通孔尺寸为1.0
×
1.0mm。注射管1、连接管2和收集管3在制作好之后放入无水乙醇中超声清洗并吹干。注射管1的尾部插入收集管2的头部并通过连接管3连接。注射
管1、连接管2和收集管3同轴设置并通过ab胶水固定在载玻片上。注射管1上可以套一个平口针头,用ab胶水固定非进口端,以便于连接注射泵,连接管2的进口端通过ab 胶水固定有平口针头,连接管2的非进口端通过ab胶水密封。各平口针头分别通过管件与注射泵连接。
47.下述各实施例和对比例中,所采用的超顺磁纳米粒子是fe3o4@pvp,其制备方法如下:
48.将0.243g葡萄糖在常温下溶于30ml乙二醇中,将所得溶液置于100℃油浴中加热,边搅拌边加入3.33g聚乙烯吡咯烷酮(pvp),继续搅拌至溶液澄清透明后,从油浴中取出并冷却至室温,然后将0.677g碾碎的六水合氯化铁加入溶液中(即葡萄糖与六水合氯化铁的摩尔比为0.54),剧烈搅拌30min使固体完全溶解,再向溶液中加入3.28g无水乙酸钠,继续剧烈搅拌40min使固体完全溶解,将所得混合反应液转移到反应釜中,在200℃反应10h,最后,分别用二次纯水和无水乙醇清洗,即得超顺磁纳米粒子fe3o4@pvp。
49.对制备的fe3o4@pvp进行sem、tem测试并统计其粒径分布,结果发现fe3o4@pvp 呈球形颗粒状,粒径较均一,其平均粒径为164nm。
50.实施例1
51.本实施例中,制备丙烯酰胺(am)含量不同的温敏光子晶体凝胶微球,具体如下:
52.将仅含nipam且不含am的温敏光子晶体凝胶微球命名为pni-1。
53.将同时含am和nipam,且am摩尔占nipam摩尔量10%、20%、30%和40%的温敏光子晶体凝胶微球分别命名为pna-1、pna-2、pna-3和pna-4。
54.(1)配制内相流体、外相流体和收集液
55.①
配制内相流体:将nipam单体、am单体、交联剂四臂聚乙二醇丙烯酰胺、光引发剂 2-羟基-2-甲基-1-苯基-1-丙酮(hmpp)以及水溶性表面活性剂曲拉通x-100溶于乙二醇中,然后加入平均粒径为164nm的超顺磁纳米粒子,充分超声使超顺磁纳米粒子均匀分散,即得内相流体。
56.将用于制备pni-1、pna-1、pna-2、pna-3和pna-4的内相流体分别命名为内相流体 pni-1、内相流体pna-1~pna-4。
57.内相流体pni-1中:nipam的浓度为3mol/l,交联剂的浓度为0.01mol/l,表面活性剂的浓度为37.6μl/ml,光引发剂的浓度为37.6μl/ml,超顺磁纳米粒子的浓度为4mg/ml。
58.内相流体pna-1~pna-4中:nipam的浓度均为3mol/l,am的浓度分别为0.3、0.6、 0.9和1.2mol/l,交联剂的浓度分别为0.011、0.012、0.013和0.014mol/l,表面活性剂的浓度均为37.6μl/ml,光引发剂的浓度均为37.6μl/ml,超顺磁纳米粒子的浓度均为4mg/ml。
59.②
配制外相流体:将油溶性表面活性剂异丁烯丁二酰亚胺(t-154)溶于大豆油中得到外相流体,外相流体中t-154的浓度为0.03g/ml。
60.③
配制收集液:将t-154溶于大豆油中得到收集液,收集液中t-154的浓度为0.03g/ml。
61.(2)制备单分散油包水(w/o)乳液
62.采用结构如图1所示的微流体装置,将以上几种内相流体用注射泵分别输入微流体装置的注射管1中,将外相流体用注射泵输入微流体装置的连接管2中,在收集管3中形成单分散w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液。
63.该步骤中控制内相流体的流速为200μl/h,外相流体的流速为2000μl/h。该步骤共
制备了5种w/o乳液。
64.(3)制备温敏光子晶体凝胶微球
65.对步骤(2)制备的5种w/o乳液(处于收集液中的w/o乳液)施加90gs方向垂直于水平面的外部磁场,w/o乳液液滴很快就出现了明亮的结构色,再施加紫外光照射引发w/o 乳液中的单体与交联剂交联聚合转变成凝胶微球,紫外光照射的时间为200s,分别用异丙醇和纯水交替洗涤6~7次,去除油相物质和未反应完全的原料,即得pni-1、pna-1、pna-2、 pna-3和pna-4,然后分别保存于纯水中。
66.对比例1
67.本对比例中,制备不含超顺磁纳米粒子的空白凝胶微球bpna-3,bpna-3的制备方法与实施例1中的pna-3的制备方法基本相同,不同之处仅在于:内相流体中不含超顺磁纳米粒子,步骤(3)不施加外部磁场而直接施加紫外光照射引发w/o乳液中的单体与交联剂交联聚合。
68.对比例2
69.本对比例中,考察内、外相流体以及收集液中是否添加表面活性剂对制备温敏光子晶体凝胶微球的影响。
70.本对比例的制备过程与实施例1的pna-3的制备方法基本相同,不同之处仅在于:内相流体、外相流体和收集液中均不含表面活性剂。
71.在实验过程中发现,步骤(2)微流体装置制备的w/o乳液在采用收集液收集后,放置 5min以内w/o乳液液滴即出现了大量的聚并现象,说明不添加表面活性剂时水油界面不稳定,剪切得到的w/o乳液液滴很快被破坏,无法合进行后续的交联聚合。
72.对比例3
73.本对比例中,考察油溶性表面活性剂的种类对制备温敏光子晶体凝胶微球的影响。
74.本对比例的制备过程与实施例1的pna-3的制备方法基本相同,不同之处仅在于:用聚甘油蓖麻醇酸酯(pgpr)替代外相流体和收集液中的油溶性表面活性剂t-154,分别配制了 pgpr浓度为0.025g/ml,0.05g/ml和0.075g/ml的三组外相流体和收集液,每组外相流体和收集液中的pgpr的浓度相同。
75.在实验过程中发现,以上述三组浓度不同的pgpr的大豆油溶液作为外相流体和收集液时,步骤(2)微流体装置制备的w/o乳液在采用收集液收集后,放置5min以内w/o乳液液滴均出现了明显的聚并现象,说明以pgpr作为油相表面活性剂无法稳定形成的w/o乳液液滴,无法进行后续的交联聚合。
76.对比例4
77.本对比例中,考察油溶性表面活性剂t-154的浓度对制备温敏光子晶体凝胶微球的影响。
78.本对比例的制备过程与实施例1的pna-3的制备方法基本相同,不同之处仅在于:配制两组不同浓度的外相流体和收集液,其中一组外相流体和收集液中t-154的浓度为0.01g/ml,另外一组外相流体和收集液中t-154的浓度为0.02g/ml。
79.在实验过程中发现,步骤(2)微流体装置制备的w/o乳液在采用收集液收集后,放置 5min以内w/o乳液液滴均出现了聚并现象,说明外相流体和收集液中t-154的浓度不合
可知,所有的微球在625cm-1
在处均出现了fe-o的特征峰,说明它们都含有四氧化三铁组分。所有微球在1387cm-1
和1368cm-1
处均出现了异丙基的对称弯曲振动,表明微球的凝胶基质中含有聚n-异丙基丙烯酰胺(pnipam)。由于这五种凝胶微球中am的含量逐渐增加,nipam 相对含量逐渐降低,因此,以1650cm-1
处的c=o峰为基准时,可以清楚地看到nipam的特征峰异丙基双峰的相对强度逐渐减弱。
91.图5是pni-1和pna-1~pna-4在由热台控制的不同温度下的数码照片,图6是是由光纤光谱仪测量的pna-1~pna-4的反射光谱图。图5显示,与pni-1类似,不同am含量的 pna-1~pna-4在升温过程中均出现了体积收缩现象,表明0%~40%摩尔分数的am与 nipam共聚后,依然具有较好的温度响应性能。随着微球的体积收缩,微球的晶格间距逐渐缩小,pna-1~pna-4的结构色不断向波长短的区域偏移。在升温过程中,pna-1~pna-4 均经历了从低温时的橙色到高温时的蓝紫色的过程,且随着am含量的增加,微球保持结构色的最高温度明显越来越高。而不含am的pni-1在34℃就失去了结构色。当am含量从 10%增加至40%时,相应的微球的最高检测温度分别为38℃,44℃,52℃和60℃。该实验结果说明微球响应的温度范围在加入am之后可以得到有效拓宽,且拓宽程度随着am含量的增加而增加。这是由于,亲水性单体am的加入量越多,其与nipam交联共聚后形成的凝胶聚合物网络越亲水,其中的高分子链与水分子之间的氢键作用越来越强,因而需要更高的温度来破坏氢键,使聚合物由亲水状态变为疏水状态。同时,am的加入使微球的温敏性有一定程度的降低,即使得微球在升温时的收缩状态减缓,因此,在结构色变化相同的情况下,微球可以检测的温度范围被拓宽了,且拓宽的程度可通过调整am的加入量进行调节。
92.由图6所示的反射光谱图可知,当am含量由0%增加至40%时,微球的波长迁移范围分别从初始的610nm(pni-1),619nm(pna-1),627nm(pna-2),635nm(pna-3) 和640nm(pna-4)迁移至最后的468nm左右。一方面,由于微球的聚合物基体的亲水性随着am含量的增加而增强,因而在低温时微球的吸水溶胀程度逐步提高,引起晶格间距小幅度增加,因此初始衍射波长越来越长;另一方面,所有微球最后均迁移至468nm左右,此时的晶格间距收缩至接近最小值,因此,am含量增加时波长迁移范围略微增加。综合考虑微球的响应范围和精度,最后选取am含量为30%的pna-3的配方进行后续试验。
93.实施例3
94.本实施例中,考察磁场强度对制备温敏光子晶体凝胶微球的影响。
95.(1)配制内相流体、外相流体和收集液
96.配制内相流体:将nipam单体、am单体、交联剂四臂聚乙二醇丙烯酰胺、光引发剂 hmpp以及水溶性表面活性剂曲拉通x-100溶于乙二醇中,然后加入平均粒径为164nm的超顺磁纳米粒子,充分超声使超顺磁纳米粒子均匀分散,即得内相流体。内相流体中:nipam 的浓度为3mol/l,am的浓度为0.9mol/l,交联剂的浓度为0.013mol/l,表面活性剂的浓度为37.6μl/ml,光引发剂的浓度为37.6μl/ml,超顺磁纳米粒子的浓度均为4mg/ml。
97.外相流体和收集液与实施例1相同。
98.(2)制备单分散w/o乳液
99.采用结构如图1所示的微流体装置,将内相流体用注射泵分别输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的连接管中,在收集管中形成单分散w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液。该步骤中控制内相流体的流速为200μ
l/h,外相流体的流速为2000μl/h。
100.(3)制备温敏光子晶体凝胶微球
101.取步骤(2)制备的处于收集液中的w/o乳液,施加110gs方向垂直于水平面的外部磁场,w/o乳液液滴很快就出现了明亮的结构色,再施加紫外光照射引发w/o乳液中的单体与交联剂交联聚合转变成凝胶微球,紫外光照射的时间为200s,分别用异丙醇和纯水交替洗涤 6~7次,去除油相物质和未反应完全的原料,即得温敏光子晶体凝胶微球,记作pna-5,将 pna-5保存于纯水中。
102.取步骤(2)制备处于收集液中的w/o乳液,施加130gs方向垂直于水平面的外部磁场, w/o乳液液滴很快就出现了明亮的结构色,再施加紫外光照射引发w/o乳液中的单体与交联剂交联聚合转变成凝胶微球,紫外光照射的时间为200s,分别用异丙醇和纯水交替洗涤6~7 次,去除油相物质和未反应完全的原料,即得温敏光子晶体凝胶微球,记作pna-6,将pna-6 保存于纯水中。
103.图7的a)c)两图是pna-5和pna-6在由热台控制的不同温度下反射光谱图、b)d)两图是对应的衍射波长变化曲线和数码照片。数码照片显示,相比较于pna-3的初始颜色为橙黄色, pna-5和pna-6的初始颜色分别是黄色和黄绿色,对应的衍射波长也由pna-3的635nm减小至pna-5的597nm和pna-6的571nm,表明在较强的磁场强度下制备的微球的初始颜色发生蓝移且波长变短。这是由于磁场强度增加时,w/o乳液液滴中相邻磁纳米颗粒之间需要降低间距来使得其表面高分子层压缩程度增加来产生更大的空间位阻力,从而才能与增强的磁吸引力之间产生新的平衡,即磁场强度增加时,微球的晶格间距降低了。由于该结构在聚合过程中被镶嵌在微球基质中,因此磁场强度越大,聚合后得到的微球的初始衍射波长越短。由于pna-5和pna-6在高温时达到的最短波长为465nm左右,与pna-3十分接近,这意味着pna-5和pna-6的波长迁移范围均比pna-3窄,即二者的变色范围受到了限制。
104.实施例4
105.本实施例中,考察交联剂的相对含量对制备温敏光子晶体凝胶微球的影响。
106.(1)配制内相流体、外相流体和收集液
107.配制内相流体:将nipam单体、am单体、交联剂四臂聚乙二醇丙烯酰胺、光引发剂 hmpp以及水溶性表面活性剂曲拉通x-100溶于乙二醇中,然后加入平均粒径为164nm的超顺磁纳米粒子,充分超声使超顺磁纳米粒子均匀分散,即得内相流体。该步骤中,配制两种交联剂相对含量不同的内相流体。
108.内相流体pna-7中:nipam的浓度为2mol/l,am的浓度为0.6mol/l,交联剂的浓度为0.013mol/l,表面活性剂的浓度为37.6μl/ml,光引发剂的浓度为37.6μl/ml,超顺磁纳米粒子的浓度均为4mg/ml。
109.内相流体pna-8中:nipam的浓度为1mol/l,am的浓度为0.3mol/l,交联剂的浓度为0.013mol/l,表面活性剂的浓度为37.6μl/ml,光引发剂的浓度为37.6μl/ml,超顺磁纳米粒子的浓度均为4mg/ml。
110.外相流体和收集液与实施例1相同。
111.(2)制备单分散w/o乳液
112.采用结构如图1所示的微流体装置,将以上两种内相流体用注射泵分别输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单
的变色情况也基本保持一致,均在10℃~52℃的升温过程中经历了由初始的橙红色逐渐变化至最后的蓝紫色的过程。图9的a)c)两图显示,pna-9和pna-10的衍射峰迁移范围分别是633nm~471nm和635nm~468nm,与pna-3十分接近。说明在以上尺寸范围内,本发明的微球的尺寸对其结构色随温度的响应情况基本没有影响。
126.对比例6
127.本对比例,采用pna-3的配方制备pna温敏光子晶体凝胶膜,步骤如下:
128.(1)以实施例1配制的内相流体pna-3作为制备pna温敏光子晶体凝胶膜的铸膜液;
129.(2)用移液枪取铸膜液100μl,注入由上下两片石英玻璃夹着300μm厚度的聚四氟乙烯片构成的模具中,然后对铸膜液施加90gs的外部磁场,待凝胶预聚液呈现出结构色后,施加紫外光照射引发铸膜液中的单体与交联剂交联聚合转变成凝胶膜,紫外光照的施加为90 s,将凝胶膜从模具中取出置于纯水中浸泡洗涤去除凝胶膜中未反应的物质,即得pna温敏光子晶体凝胶膜。将该pna温敏光子晶体凝胶膜用圆形裁刀裁成直径为10mm的圆片以进行后续的温度响应实验。
130.将pna-3,pna-9和pna-10从第在0s开始置于55℃的热水中,到第500s取出并置于10℃的冷水中,记录pna-3,pna-9和pna-10的直径随时间的变化,结果如图10的a) 图所示。
131.将对比例6制备的直径为10mm的圆片状pna温敏光子晶体凝胶膜从第0s开始置于55℃的热水,到第900s取出并置于10℃的冷水中,记录圆片状pna温敏光子晶体凝胶膜的质量随时间的变化,结果如图10的b)图所示。
132.由图10可知,pna-3,pna-9和pna-10均有在55℃时迅速收缩和在10℃迅速溶胀的过程,但由于它们的体积不同,收缩和溶胀的速率也不同。对于直径最大的pna-9,它由初始的溶胀状态收缩至最小直径用时300s,而尺寸依次缩小的pna-3和pna-10仅花费165 s和80s就基本收缩至平衡状态。在低温溶胀过程中,pna-9,pna-3和pna-10分别耗时405 s,225s和105s达到溶胀平衡。微球尺寸越大,微球内高分子聚合物收缩或舒展所致的凝胶微球的收缩或溶胀速率就越慢,因此响应速率越低。作为对比,与pna-3相同配方的圆片状 pna温敏光子晶体凝胶膜分别用时480s和600s才达到收缩和溶胀平衡,比上述具有最大直径的pna-9所花费的时间明显更长,这是由于凝胶膜的体积较大,使得其响应速率较低。
133.对比例7
134.本对比例中,制备pni温敏光子晶体凝胶微球pni-2,步骤如下:
135.(1)配制内相流体、外相流体和收集液
136.配制内相流体:将nipam单体、交联剂四臂聚乙二醇丙烯酰胺、光引发剂hmpp以及水溶性表面活性剂曲拉通x-100溶于乙二醇中,然后加入平均粒径为164nm的超顺磁纳米粒子,充分超声使超顺磁纳米粒子均匀分散,即得内相流体。内相流体中:nipam的浓度为3 mol/l,交联剂的浓度为0.01mol/l,表面活性剂的浓度为37.6μl/ml,光引发剂的浓度为37.6 μl/ml,超顺磁纳米粒子的浓度为4mg/ml。
137.外相流体与收集液与实施例1相同。
138.(2)制备单分散w/o乳液
139.采用结构如图1所示的微流体装置,将内相流体用注射泵分别输入微流体装置的注射管中,将外相流体用注射泵输入微流体装置的收集管中,在收集管中形成单分散w/o乳液,采用盛有收集液的容器收集所述单分散w/o乳液。该步骤中控制内相流体的流速为40μ
l/h,外相流体的流速为4000μl/h。
140.(3)制备温敏光子晶体凝胶微球
141.对步骤(2)所得处于收集液中的w/o乳液施加90gs方向垂直于水平面的外部磁场, w/o乳液液滴很快就出现了明亮的结构色,再施加紫外光照射引发w/o乳液中的单体与交联剂交联聚合转变成凝胶微球,紫外光照射的时间为200s,分别用异丙醇和纯水交替洗涤6~7 次,去除油相物质和未反应完全的原料,即得pni-2,置于纯水中保存。
142.采用pni-2和pna-10对酸性蛋白酶在不同温度下的相对酶活进行颜色指示,在含有酸性蛋白酶的反应液中分别加入pni-2和pna-10,在30、40、50、52、54以及56℃进行酶促反应。在各温度条件下进行酶促反应时的相对酶活(rea),以及pni-2和pna-10对应的颜色如图11所示。由于实验中的酶活在40℃时最高,因此以40℃时的酶活为基准来计算其他温度下的相对酶活。
143.由图11可知,在测试温度范围内,rea呈现先增大后减小的趋势,pni-2和pna-10分别经历了不同的颜色变化过程。在30℃和40℃时,rea从86%上升到100%,这是由于温度的升高使得酶与底物的结合程度提高,反应速率提升,因而酶活增加;此时,pna-10的结构色从黄色变化至绿色,而pni-2只在30℃下显示绿色,在40℃时即失去结构色。当温度将继续上升时,酶在高温下由于变性而活性不断降低,50℃和52℃下rea分别降至85%和80%,此时pna-10分别指示蓝绿色和蓝色。当pna-10开始失去结构色时,温度为54℃,该条件下酶活性损失严重,rea下降到67%,表明酶分解底物的反应效率显著下降。柱状图显示,rea随温度的变化情况与加入或不加入微球非常接近,说明向反应液中加入光子晶体凝胶微球对酶促反应基本无影响。
144.由以上实验结果可知,pna-10在不同温度下的颜色与酶活性有很好的对应关系,即可以通过pna-10的颜色直观判断酶反应的适宜温度,从而决定是否进行后续调整。而pni-2由于颜色指示范围较窄,在40℃时即无法呈现结构色,因而不适合指示酸性蛋白酶的适用温度。以上实验结果也证实了在制备温敏光子晶体凝胶微球时,添加适量的am单体可以拓宽微球的检测温度范围,从而可在更广泛的实际应用场景中使用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1