一种苦瓜冻干粉及其中皂苷和黄酮的结构推测方法与流程
1.本技术涉及一种苦瓜冻干粉及其中皂苷和黄酮的结构推测方法,属于苦瓜成分分析技术领域。
背景技术:
2.苦瓜的化学成分复杂,国内外学者采用不同方法对苦瓜进行了提取分离及鉴定,从苦瓜中分离出苷类、蛋白质、多肽、氨基酸、糖类、生物碱类、有机酸、脂类、萜类、微量元素等多种化学成分,其中具有降血糖作用的活性成分主要是三萜类、植物甾醇、苷类和肽类等,苦瓜皂苷对糖尿病模型兔有明显的降血糖作用,已被确定为苦瓜降血糖的有效成分之一。
3.近年来,对苦瓜活性成分研究的报道越来越多而且逐渐深入,很多学者已经从苦瓜的根、茎、叶、果肉、籽等部位分离出了多糖、皂苷、多肽等多种活性成分,这些活性成分具有降血糖、调节血脂、提高机体免疫力、抗氧化等生物活性,是近年来研究的热点。苦瓜皂苷可抑制促肾上腺皮质激素、胰高血糖素和肾上腺素引起的脂肪细胞脂解作用。然而,苦瓜皂苷中具体降糖物质、降糖效果及彼此间的关系尚不清楚,皂苷和其它降糖物质间是否存在相互作用有待进一步的研究和分析。
技术实现要素:
4.为了解决上述问题,提供了一种苦瓜冻干粉及其中皂苷和黄酮的结构推测方法,采用高效液相色谱和多级质谱从苦瓜冻干粉中分离出皂苷l、皂苷f2和山奈酚-4'-o-葡萄糖苷,并以α-葡萄糖苷为研究模型证明苦瓜皂苷和苦瓜黄酮都对α-葡萄糖苷酶有抑制活性。
5.本发明采用的技术方案如下:
6.一种苦瓜冻干粉,其中含有皂苷和黄酮,所述皂苷为皂苷l和皂苷f2,所述黄酮为山奈酚-4'-o-葡萄糖苷;
7.所述皂苷l的结构式为:
[0008][0009]
所述皂苷f2的结构式为:
[0010][0011]
所述山奈酚-4'-o-葡萄糖苷的结构式为:
[0012][0013]
一种如上述的苦瓜冻干粉中皂苷和黄酮的结构推测方法,具体步骤为:
[0014]
将样品先经过高效液相色谱分离,将分离后的样品进行一级质谱分析,推测苦瓜样品中皂苷和黄酮的种类,通过多级质谱检测验证皂苷和黄酮的种类,确定从苦瓜冻干粉中分离出来的两种皂苷分别是皂苷l和皂苷f2,从苦瓜冻干粉中分离出来的一种黄酮是山奈酚-4'-o-葡萄糖苷。
[0015]
优选地,质谱条件为:
[0016]
喷雾压力2-5kv,鞘气压力30-40arb,辅助气压力1-20arb,毛细管温度 260-400℃,加热温度200-400℃,扫描范围m/z100-1000。
[0017]
优选地,高效液相色谱条件为:
[0018]
色谱柱:hyper gold c18,
[0019]
柱温:25℃,
[0020]
流动相:0.1%甲酸水/乙腈,
[0021]
扫描波长范围:200-600nm,
[0022]
流速0.4ml/min,
[0023]
进样量5μl。
[0024]
优选地,皂苷的梯度洗脱程序为:
[0025]
0-15min,10-80%乙腈;15-18min,80%乙腈;18-18.1min,80-10%乙腈; 18.1-21min,10%乙腈;
[0026]
黄酮的梯度洗脱程序为:
[0027]
0-5min,10-60%乙腈;5-18min,60-80%乙腈;18-19min,80-95%乙腈; 19-22min,95%乙腈;22-22.1min,95-10%乙腈;22.1-25min,10%乙腈。
[0028]
优选地,苦瓜冻干粉中皂苷和黄酮的结构推测方法还包括样品原料进行检测之前的分离步骤:
[0029]
(1)苦瓜皂苷的分离:
[0030]
取适量苦瓜冻干粉,依次经过超声提取、萃取、减压浓缩和真空干燥得到苦瓜总皂苷粗品,再经xad-2大孔树脂洗脱,得到苦瓜皂苷纯品;
[0031]
(2)苦瓜黄酮的分离:
[0032]
取适量苦瓜冻干粉,回流提取,得到黄酮粗品,采用聚酸胺粉对黄酮粗品溶解液吸附后,转入层析柱,依次经过苯洗和甲醇洗,得到黄酮纯品。
[0033]
优选地,采用香草醛-高氯酸比色法分别测定步骤(1)中苦瓜总皂苷粗品和苦瓜皂苷纯品的含量;
[0034]
采用亚硝酸钠-硝酸铝-氢氧化钠比色法分别测定步骤(2)中黄酮粗品和黄酮纯品的含量。
[0035]
优选地,所述苦瓜冻干粉通过如下方法制备得到:
[0036]
将苦瓜汁经果汁酶酶解,酶解液经陶瓷膜超滤处理,超滤液浓缩,可溶性固形物达到24 brix,再经真空冷冻干燥即得所述苦瓜冻干粉。
[0037]
优选地,苦瓜冻干粉中皂苷和黄酮的结构推测方法还包括以α-糖苷酶为药理活性研究的模型,考察苦瓜冻干粉中皂苷和黄酮对α-葡萄糖苷酶的活性抑制的步骤;
[0038]
黄酮和皂苷对α-葡萄糖苷酶活性的抑制率分别达到20%-30%和 40%-50%。
[0039]
本技术的有益效果包括但不限于:
[0040]
1.本技术采用高效液相色谱和多级质谱对苦瓜冻干粉中的皂苷和黄酮进行分离并进行结构推测,分离出来的两种皂苷分别是皂苷f2和皂苷l,一种黄酮为山奈酚-4'-o-葡萄糖苷。
[0041]
2.本技术的苦瓜冻干粉中皂苷和黄酮的结构推测方法,以α-葡萄糖苷为研究模型证明苦瓜皂苷和苦瓜黄酮都对α-葡萄糖苷酶有抑制活性,且皂苷效果高于黄酮,并呈剂量依赖性,二者协同作用,有利于降低血糖。
[0042]
3.本技术的苦瓜冻干粉,经果汁酶酶解,陶瓷膜超滤处理,浓缩、干燥获得,操作简单,便于保留苦瓜中的各种营养成分,通过对苦瓜冻干粉中皂苷和黄酮的提取分离与纯化,得到了纯度较高的皂苷和黄酮,避免对结构推测过程产生干扰。
[0043]
4.本技术的苦瓜冻干粉中皂苷和黄酮的结构推测方法,可用于指导分析苦瓜冻干粉中皂苷和黄酮的种类及结构,该方法快速、准确,为苦瓜冻干粉的进一步分析和开发提供了参考。
附图说明
[0044]
此处所说明的附图用来提供对本技术的进一步理解,构成本技术的一部分,本技术的示意性实施例及其说明用于解释本技术,并不构成对本技术的不当限定。在附图中:
[0045]
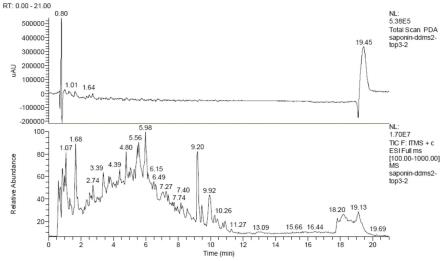
图1为本技术实施例涉及的苦瓜皂苷pda色谱图及一级质谱总离子流图。
[0046]
图2为本技术实施例涉及的苦瓜皂苷1的提取离子流图。
[0047]
图3为本技术实施例涉及的苦瓜皂苷1的一级质谱图。
[0048]
图4为本技术实施例涉及的苦瓜皂苷1的二级质谱图。
[0049]
图5为本技术实施例涉及的苦瓜皂苷1的三级质谱图。
[0050]
图6为本技术实施例涉及的苦瓜皂苷1的四级质谱图。
[0051]
图7为本技术实施例涉及的苦瓜皂苷2的提取离子流图。
[0052]
图8为本技术实施例涉及的苦瓜皂苷2的一级质谱图。
[0053]
图9为本技术实施例涉及的苦瓜皂苷2的二级质谱图。
[0054]
图10为本技术实施例涉及的苦瓜皂苷2的三级质谱图。
[0055]
图11为本技术实施例涉及的苦瓜黄酮pda色谱图及一级质谱总离子流图。
[0056]
图12为本技术实施例涉及的苦瓜黄酮的一级质谱图。
[0057]
图13为本技术实施例涉及的苦瓜黄酮的二级质谱图。
[0058]
图14为本技术实施例涉及的苦瓜黄酮的三级质谱图。
[0059]
图15为本技术实施例涉及的苦瓜黄酮的四级质谱图
[0060]
图16为本技术实施例涉及的苦瓜冻干粉各活性成分对α-葡萄糖苷酶的活性抑制图。
具体实施方式
[0061]
下面结合实施例详述本技术,但本技术并不局限于这些实施例。
[0062]
实施例1苦瓜冻干粉的制备与其中各物质含量的分析
[0063]
1、苦瓜冻干粉的制备
[0064]
苦瓜冻干粉是苦瓜汁经gfm果汁酶50℃酶解2h,酶解液经陶瓷膜超滤处理,超滤液在55℃、真空度为0.095mpa条件下,浓缩时间75min,可溶性固形物达到24
°
brix,再经真空冷冻干燥制得。
[0065]
2、苦瓜冻干粉中各物质含量的分析
[0066]
2.1通过干燥法(gb 5009.3~2010.食品中水分的测定,2010)、酸水解法(gb 5009.6~2003.食品中脂肪的测定,2003)、凯氏定氮法(gb 5009.5~2010.食品中蛋白质的测定,2010)、灰分测定法(gb 5009.4~2010.食品中灰分的测定,2010) 等方法测定了苦瓜冻干粉中水分、脂肪、蛋白质、灰分等的含量。
[0067]
2.2苦瓜冻干粉中皂苷的分离与测定
[0068]
2.2.1苦瓜总皂苷的提取与分离
[0069]
称取10g苦瓜冻干粉,按料液比1:40加入70%的乙醇,于60℃下超声辅助提取30min后过滤,将滤渣二次提取后过滤,合并两次滤液经减压浓缩后分别用石油醚、乙酸乙酯、水饱和正丁醇溶液萃取;分离出正丁醇相,经减压浓缩、真空干燥后即可得苦瓜总皂苷粗品。
[0070]
2.2.2苦瓜总皂苷含量的测定
[0071]
采用香草醛-高氯酸比色法测定苦瓜总皂苷的含量。
[0072]
取样品置于具塞试管内,挥干溶剂,再分别加体积分数为5%的香草醛-冰乙酸溶液0.2ml和高氯酸0.8ml,混匀密塞后置于60℃水浴锅中加热10min,取出冷却后加入5.0ml冰乙酸,摇匀静置,在波长560nm处测其吸光值。以空白试剂作对照。
[0073]
总皂苷=a1/a2×c×v×
100/m/1000/1000
[0074]
式中:a1─
被测液的吸光度值;a2─
标准液的吸光度值;c
─
人参皂苷标准品含量,μg;v
─
样品稀释体积;m
─
样品质量,g。
[0075]
2.2.3苦瓜皂苷的纯化
[0076]
xad-2大孔树脂预处理:本树脂使用前先用无水乙醇浸泡1~2小时进行充分活化,然后用大量清水反复洗涤4~6次,至树脂中已无明显乙醇气味方可使用。
[0077]
层析柱:2cm
×
10cm,柱体积约15ml。
[0078]
将苦瓜提取液浓缩蒸干后加蒸馏水充分溶解,取1ml溶解液上xad-2大孔树脂,用4
倍柱体积(bed volume,bv)去离子水洗柱用以除去水溶性杂质,弃去洗脱液,再用4bv70%的乙醇洗脱,收集洗脱液浓缩蒸干后得苦瓜皂苷纯品。
[0079]
纯化后的皂苷用1ml蒸馏水溶解,按照2.2.2所述方法测出纯品皂苷的含量,与上述皂苷粗品量相比得到皂苷纯度。
[0080]
2.3苦瓜冻干粉中黄酮的分离与测定
[0081]
2.3.1苦瓜黄酮的提取与分离
[0082]
称取苦瓜冻干粉10g,按料液比1:25的比例加入70%的乙醇,80℃回流提取2.5h,取出过滤后将滤渣二次提取,合并两次提取液。将提取液浓缩蒸干后即可得到黄酮粗品。
[0083]
2.3.2苦瓜黄酮含量的测定
[0084]
标准曲线制作:准确称取芦丁标准试样0.0500g,用30%乙醇溶液溶解,移入500ml容量瓶中,用30%乙醇溶液定容。分别取上述芦丁标准溶液0、1.0、 2.0、3.0、4.0、5.0、6.0于7只25ml容量瓶中,加入5%的亚硝酸钠溶液1.0ml,摇匀静置6min,再加10%硝酸铝溶液1.0ml,摇匀静置6min,再加4%氢氧化钠溶液5.0ml,用30%乙醇定容至刻度,摇匀静置12min,以试剂做空白于505nm 处测吸光值。
[0085]
称取黄酮粗品1g加70%乙醇定容至25ml,取1ml溶解液于25ml容量瓶中,加入5%的亚硝酸钠溶液1.0ml,摇匀静置6min,再加10%硝酸铝溶液 1.0ml,摇匀静置6min,再加4%氢氧化钠溶液5.0ml,用30%乙醇定容至刻度,摇匀静置12min,以试剂做空白于505nm处测吸光值。试剂为空白参比,做三次平行。
[0086]
2.3.3苦瓜黄酮的纯化
[0087]
称取黄酮粗品1g加70%乙醇定容至25ml,取溶解液1ml于蒸发皿中,加1g聚酸胺粉吸附,于水浴上挥去乙醇,然后转入层析柱。先用20ml苯洗,弃去苯液,然后用25ml甲醇洗脱黄酮,既得黄酮纯品。层析柱为实验室自制,柱体积为5ml。
[0088]
将纯化后的黄酮蒸去甲醇,加1ml70%乙醇于25ml容量瓶中,按2.3.2 方法测定黄酮含量,与上述含量相比得出黄酮纯度。
[0089]
经上述检测,苦瓜冻干粉中苦瓜皂苷的含量是1.55%,用xad-2大孔树脂纯化后可得到纯度是85%的皂苷;苦瓜黄酮的含量是2.9%,用聚酰胺柱纯化后可得纯度是84%的黄酮。苦瓜冻干粉中各物质的含量如表1所示。
[0090]
表1苦瓜冻干粉物质组成
[0091][0092]
实施例2苦瓜冻干粉中皂苷与黄酮的结构分析
[0093]
1、皂苷的结构分析
[0094]
1.1高效液相色谱分析条件为:
[0095]
检测器:uv检测器,检测参数:扫描波长范围:200-600nm;三通道检测: 220nm(channel a),254nm(channel b),280nm(channel c);色谱柱:hyper goldc18(100
×
2.1mm,3μm);柱温:25℃;流动相:0.1%甲酸水/乙腈,0-15min, 10-80%乙腈,15-18min,80%乙腈,18-18.1min,80-10%乙腈,18.1-21min, 10%乙腈;流速0.4ml/min;进样量5μl。
[0096]
1.2质谱条件为:
[0097]
hesi-ii,spray voltage:3.5kv;sheath gas pressure:35arb;aux gaspressure:10arb;capillary temp:320℃;heater temp:300℃;扫描模式:fullms and dd-msn(cid 35%);扫描范围:m/z 100-1000。
[0098]
1.3苦瓜皂苷1的图谱分析
[0099]
对皂苷样品进行质谱一级全扫描分析,结果如图1-3所示,通过对样品一级质谱数据的检索并结合文献的报道,确定苦瓜样品中皂苷的种类。苦瓜皂苷 l(c
36h58
o9)的分子量为634,由图3苦瓜皂苷1的一级质谱扫描可知,在 m/z 635处产生的峰为[m+h]
+
,与文献相一致,由此推断苦瓜皂苷1可能为苦瓜皂苷l。
[0100]
为进一步验证是否为皂苷l,进行二级质谱检测。通过图4分析可知,苦瓜皂苷1主要脱去h2o、co等分子,碎片
①
(m/z 617)为母离子脱掉一个水分子所形成,碎片
②
(m/z 473)为母离子脱掉一葡萄糖分子形成,碎片
③
(m/z 455)是在
②
的基础上脱掉一分子h2o,碎片
⑥
(m/z 407)是在
⑤
的基础上脱掉一分子h2o形成的。
[0101]
以二级质谱基峰m/z 455为母离子进行三级质谱扫描,结果如图5所示。碎片
①
(m/z437)脱水得到碎片
②
(m/z419),碎片
②
掉碳,得碎片
③
(m/z407) 碎片
③
掉分子量为78的片段,得碎片
④
(m/z309),碎片
④
去h2o得碎片
⑤ꢀ
(m/z311),碎片
⑥
(m/z 293)在
⑤
的基础上脱掉一分子h2o。
[0102]
通过图6苦瓜皂苷1的四级质谱图可以看出,碎片
①
(m/z311)脱水得到碎片
②
(m/z293),碎片
②
掉分子量为80的片段,得碎片
③
(m/z213)。
[0103]
通过多级质谱解析可知,苦瓜皂苷1与苦瓜皂苷l的结构基本一致,故可以推断此物质为苦瓜皂苷l,其结构式为:
[0104][0105]
1.4苦瓜皂苷2的图谱分析
[0106]
如图7和8所示,苦瓜皂苷f2(c
36h58
o8)的分子量为618,由图8苦瓜皂苷2的一级质谱扫描可知,在m/z 619处产生的峰为[m+h]
+
,与文献相一致,由此推断苦瓜皂苷2可能为苦瓜皂苷f2。
[0107]
为进一步验证是否为皂苷f2,进行多级质谱检测。由图9苦瓜皂苷2的二级质谱图分析可知,碎片
①
(m/z 600)为母离子脱掉一个水分子所形成,碎片
②
(m/z 457)在碎片
①
的基础上脱掉一葡萄糖分子形成,碎片
③
(m/z 439) 是在
②
的基础上脱掉一分子h2o。
[0108]
以二级碎片离子m/z 457为母离子进一步打碎扫描,得三级谱图信息,结果如图10所示。由三级质谱可知,碎片
①
(m/z 439)为母离子m/z 457脱水得的峰,碎片
②
(m/z 421)为碎片
①
脱水所得。
[0109]
通过多级质谱解析可知,苦瓜皂苷2与苦瓜皂苷f2的结构基本一致,因此可以推断此物质为苦瓜皂苷f2,其结构式为:
[0110][0111]
2、黄酮的结构分析
[0112]
2.1高效液相色谱分析条件为:
[0113]
检测器:uv检测器,检测参数:扫描波长范围:200-600nm,采用三通道检测:220nm(channel a),254nm(channel b),280nm(channel c);色谱柱:hyper gold c18(100
×
2.1mm,3μm);柱温:25℃;流动相:0.1%甲酸水/乙腈, 0-5min,10-60%乙腈,5-18min,60-80%乙腈,18-19min,80-95%乙腈,19-22min, 95%乙腈,22-22.1min,95-10%乙腈,22.1-25min,10%乙腈;流速0.4ml/min;进样量5μl。
[0114]
2.2质谱条件为:
[0115]
hesi-ii,spray voltage:3.5kv;sheath gas pressure:35arb;aux gaspressure:10arb;capillary temp:320℃;heater temp:300℃;扫描模式:fullms and dd-msn(cid 35%);扫描范围:m/z 100-1000。
[0116]
2.3苦瓜黄酮的图谱分析
[0117]
对黄酮样品进行质谱一级全扫描分析,结果如图11和12所示,由一级质谱扫描可知,此苦瓜黄酮的分子量为418,图12中m/z 419为[m+h]
+
峰。通过查阅文献,与山奈酚-4'-o-葡萄糖苷(c
21h22
o9)相符。
[0118]
为进一步验证是否为山奈酚-4'-o-葡萄糖苷,进行二级质谱检测。通过图 13分析可知,二级质谱图中碎片
①
(m/z 401)为母离子m/z 419脱去一个h2o 所得的碎片信息,碎片
②
(m/z 387)为碎片
①
脱去—ch
2+
所得。
[0119]
以二级碎片离子m/z 401为母离子进一步打碎扫描,得三级谱图信息,结果如图14所示。通过黄酮三级质谱可知碎片m/z 314、m/z 283、m/z 252分别在前一级碎片的基础上脱掉-ch
2-oh结构所得。
[0120]
图15为苦瓜黄酮的四级质谱图,碎片
②
(m/z 283)和碎片
③
(m/z 252) 为上一级碎片掉落-ch
2-oh所得,碎片
④
(m/z 179)是
③
掉落一分子葡萄糖基形成。此苦瓜黄酮与山奈酚-4'-o-葡萄糖苷的结构基本一致,故推测此化合物为山奈酚-4'-o-葡萄糖苷,其结构式为:
[0121][0122]
实施例3苦瓜冻干粉中皂苷和黄酮对α-葡萄糖苷酶活性抑制实验
[0123]
实验共分为9组。分别在96孔板中,加入58μl缓冲液(ph=6.8),再加80μl 一定浓度(0.5g/ml、1g/ml、4g/ml)的待测样品溶液和3mmol/l的还原性谷胱甘肽溶液8μl,再分别
加入60μlα-葡萄糖苷酶。于37℃水浴反应10min后迅速加入4μl pnpg,在400nm波长处测定出pnpg的量,以pnpg的量来表示α-葡萄糖苷酶的活性大小,用蒸馏水代替待测品溶液作为空白对照。每隔2min 记录一次吸光值,共记录15个值,然后做吸光度随时间变化的曲线,得出吸光度与时间成正比例关系,即吸光度随时间的延长而逐渐增大。取斜率k值,计算各个组分抑制率。每个样品同时做3个平行,取其平均值。
[0124]
抑制率=(k
空白
-k
样品组
)/k
空白
[0125]
由图16可以看出苦瓜冻干粉中黄酮和皂苷都可降低α-葡萄糖苷酶的活性,在浓度为0.5g/ml、1g/ml的黄酮作用下,对α-葡萄糖苷酶的活性影响较小,当浓度增大到4g/ml时,黄酮对α-葡萄糖苷酶活性的抑制效果显著增加,但还是小于皂苷对酶活的抑制率。因此得出结论,苦瓜冻干粉中的黄酮和皂苷均对α-葡萄糖苷酶的活性有一定的抑制作用,且皂苷对酶活的影响要大于黄酮的影响,且这种影响呈剂量依赖性。
[0126]
以上所述,仅为本技术的实施例而已,本技术的保护范围并不受这些具体实施例的限制,而是由本技术的权利要求书来确定。对于本领域技术人员来说,本技术可以有各种更改和变化。凡在本技术的技术思想和原理之内所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1