一种烟草ABA受体蛋白基因NtPYL6在调控烟草株高和叶片芸香苷含量中的应用的制作方法
一种烟草aba受体蛋白基因ntpyl6在调控烟草株高和叶片芸香苷含量中的应用
技术领域
1.本发明涉及植物基因工程技术领域,特别涉及一种烟草aba受体蛋白基因ntpyl6在调控烟草株高和叶片芸香苷含量中的应用。
背景技术:
2.脱落酸(aba)作为重要的植物体内五大激素之一,主要在细胞质中合成,参与调控了植物生长发育的各个方面,主要包括:加速器官的脱落、促进芽和种子的休眠、抑制种子的萌发、促进幼苗的生长、调控了植物的衰老、诱导次生代谢物质的积累、引起气孔关闭、增加植株抗逆性等功能。烟草作为我国重要的叶用经济作物,其叶片的衰老与烟叶生产密切相关,直接影响了烟叶的产量与品质。研究发现,在烟草叶片衰老的过程中,aba的合成和信号传递都增强了,aba信号传递正调控基因的表达量升高、负调控基因表达量降低,表明aba信号途径参与调控了烟草叶片的衰老。pyls是aba受体蛋白基因家族成员,在aba信号转导途径中扮演了重要角色,具有重要的生物学功能,所以对烟草中pyls基因的研究具有重要的理论与实践意义。
3.芸香苷又名芦丁,是典型的黄酮类化合物衍生物,可被多酚氧化酶和过氧化酶氧化而产生红色至黑褐色的醌类化合物或其聚合物,从而使得烟草叶片的颜色从黄色转化为不同程度的棕褐色或者桔黄色,烟草中芸香苷是主要的多酚类物质,其含量与烟叶的色泽、质量及香气等有关,在烟草中作为重要的潜香型物质影响了烤烟的品质。
技术实现要素:
4.本发明所要解决的技术问题是提供一种烟草aba受体蛋白基因ntpyl6在调控烟草株高和叶片芸香苷含量中的应用,为烟草aba受体蛋白研究及烟草品质调控提供材料和借鉴。
5.本发明所要解决的技术问题是通过以下技术方案来实现的:
6.一种烟草aba受体蛋白基因ntpyl6在调控烟草株高和叶片芸香苷含量中的应用。
7.优选地,上述技术方案中,ntpyl6基因的核苷酸序列如seq id no.1所示。
8.优选地,上述技术方案中,ntpyl6编码蛋白的氨基酸序列如seq id no.2所示。
9.优选地,上述技术方案中,ntpyl6基因编辑是通过crispr/cas9介导的基因编辑技术,构建了用于敲除ntpyl6基因的crispr/cas9编辑载体,经遗传转化后获得了纯合的无t-dna的ntpyl6基因发生编辑的烟草植株。
10.优选地,上述技术方案中,所述ntpyl6基因发生编辑的烟草植株的创制方法具体包括:
11.(1)选择ntpyl6基因中较特异的23nt核苷酸序列为crispr/cas9的引导序列,并将该序列片段与crispr/cas9载体进行连接、转化和pcr扩增检测,获得pcr阳性克隆,得到crispr/cas9-ntpyl6编辑载体;
12.(2)利用所构建的crispr/cas9-ntpyl6编辑载体,进行遗传转化和组培,经自交,获得无t-dna的纯合的烟草ntpyl6基因发生敲除编辑的t2代烟草植株。
13.优选地,上述技术方案中,步骤(1)中ntpyl6基因中较特异的23nt核苷酸序列如seq id no.5所示。
14.优选地,上述技术方案中,烟草品种为红花大金元。
15.优选地,上述技术方案中,ntpyl6基因发生编辑的烟草植株的株高高于对照烟草植株、叶片芸香苷含量低于对照烟草植株。
16.本发明上述技术方案,具有如下有益效果:
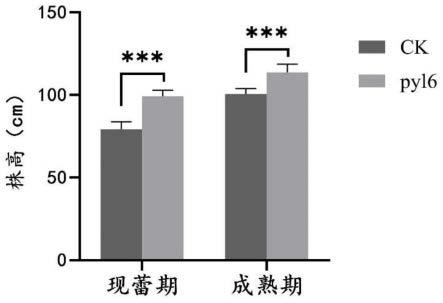
17.(1)、本发明通过crispr/cas9介导的基因编辑技术,构建了用于敲除ntpyl6基因的crispr/cas9编辑载体,经编辑素材创制和分子检测鉴定后获得了ntpyl6基因敲除的烟草植株。本发明获得的,ntpyl6基因敲除的编辑烟草植株,相比于对照烟草植株,现蕾期和成熟期的平均株高显著增高。
18.(2)、本发明利用crispr/cas9介导的基因编辑技术敲除ntpyl6基因获得了株高显著增高和芸香苷含量显著降低的编辑烟草素材,这为进一步阐明烟草成熟及芸香苷调控机理提供了理论依据,为培育株高和芸香苷含量显著改变的烟草品种提供了新的遗传材料。
附图说明
19.被结合在说明书中并构成说明书的一部分的附图示出了本发明的实施例,并且连同其说明一起用于解释本发明的原理。
20.图1为现蕾期和成熟期烟草植株株高(p<0.01)。
21.图2为各时期新鲜烟叶中芸香苷含量(p<0.01)。
具体实施方式
22.现在将参照附图来详细描述本发明的各种示例性实施例。应注意到:除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对布置、数字表达式和数值不限制本发明的范围。
23.以下实施例中所有使用的实验方法如无特殊说明,均为常规方法。以下实施例中所用的材料、试剂等,如无特殊说明,均可通过商业途径获得。
24.实施例1基因提取
25.以栽培种烟草红花大金元叶片为样品,利用rna提取试剂盒提取烟草叶片总rna,反转录为cdna备用:
26.按照植物rna提取试剂盒说明书提取烟草总rna。
27.1μg从叶片中提取总rna用于反转录,转录体系如下:
28.total rna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1μg,
29.oligo(dt)(10μm)
ꢀꢀꢀꢀꢀ
1.5μl,
30.ddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
up to 15μl。
31.将上述体系混匀后置于pcr中,70℃保温5min,去除后立即置于冰上5min,之后向体系中加入以下试剂:
[0032][0033]
上述体系放入pcr仪中,42℃65min,65℃10min,4℃保温,然后置于-20℃冰箱中保存使用。
[0034]
通过同源比对的方法,参考拟南芥基因的序列及已知烟草部分基因序列,设计扩增引物序列如下:
[0035]
f:5'-atgccttcttcacttcagctgc-3'(seq id no.3);
[0036]
r:5'-ttagtcatgagtagttaatttactc-3'(seq id no.4);
[0037]
以上述所制备cdna为模板,利用上述引物进行pcr扩增:
[0038]
扩增体系(50μl):
[0039][0040]
混匀离心后进行pcr扩增,pcr反应条件为:95℃1min;95℃15sec,55℃15sec,72℃1min,共35个循环;72℃10min;12℃hold。
[0041]
对扩增产物进行提纯后测序,获得烟草氨基酸转运相关的基因ntpyl6序列,其碱基序列如seq id no.1所示,共包括660bp个碱基。对该基因序列进行翻译后,其所编码蛋白序列如seq id no.2所示,共包括219个氨基酸,进一步对比分析表明,该蛋白含有同源性很高的序列,高度保守。
[0042]
实施例2
[0043]
利用实施例1中所获得烟草aba受体蛋白的基因ntpyl6,本发明进一步构建了crispr/cas9载体,并利用叶盘法转化获得基因编辑植株。
[0044]
利用crispr-p 2.0网站,选择ntpyl6基因中较特异的23nt核苷酸序列(seq id no.5)为crispr/cas9的引导序列,并将该序列片段与crispr/cas9载体(由西南大学提供)进行连接、转化和pcr扩增检测,pcr阳性克隆送测序公司进行测序确认,最后得到crispr/cas9-ntpyl6编辑载体。
[0045]
利用上一步所构建的crispr/cas9-ntpyl6编辑载体质粒,以红花大金元为例,进
行遗传转化和组培,以获得烟草氨基酸转运相关的基因ntpyl6发生敲除编辑的植株,相关实验过程简要介绍如下。
[0046]
将烟草种子表面消毒后点种至ms培养基上,待长到4片子叶(15-20d),移入含ms固体培养基的培养瓶中,于25
±
1℃、光照强度30-50μmol/(m2
·
s),光照时间为16h/d条件继续培养35-40d,备用。
[0047]
取出-80℃保存的lba4404电转化感受态农杆菌细胞,置于冰上冻融。待感受态刚刚解冻时,加入crispr/cas9-ntpyl6编辑载体质粒的2μl,混匀,置于冰上。后将混匀的感受态转移至预冷的电转杯中,将电转杯置于电转仪中进行转化,转化完成后加入1ml的yeb液体培养基与转化液进行混合,后置于摇床28℃,200rpm培养1.5-2h。8000rpm离心菌体弃掉上清培养基,然后用200μl的yeb液体培养基悬浮菌体,涂于含50mg/l利福平、50mg/l链霉素和50mg/l卡那霉素的yeb固体培养基上28℃倒置黑暗培养2-3d。
[0048]
在超净工作台中制作烟草叶盘成边长为1cm的方形叶盘,用ms液体制备含有crispr/cas9-ntpyl6编辑载体的农杆菌菌落成悬浮菌液(od600=0.6-0.8)。利用悬浮农杆菌菌液浸泡侵染烟草叶盘10min。之后将叶盘置于含2.0mg/l naa+0.5mg/l 6-ba的ms固体培养基上,28℃,黑暗,共培养3d。之后进行继代培养,放置于含2.0mg/l naa+0.5mg/l 6-ba+250mg/l cb+50mg/l kan的ms固体培养基上,培养条件为:28℃光照培养16h/d,光照强度30-50μmol/(m2
·
s),25℃黑暗培养8h/d,培养45-60d,直至分化芽形成,每7-10d更换一次分化培养培养基,更换3-4次;培养至分化芽形成;将已有分化芽形成的愈伤组织切下,置于含有500mg/l羧苄青霉素与50mg/l卡那霉素的ms培养基上进行培养,待愈伤组织上分化芽培养长至2-4cm高,培养条件与分化培养条件一致,培养8-14d;再生植株生根培养,将分化芽切下,插入含有500mg/l羧苄青霉素与50mg/l卡那霉素的ms培养基上进行生根培养,培养条件与分化培养条件一致,培养20-30d,再生移栽至花盆后进行培养,后进行转化植株叶片取样,送华大基因进行分子检测,确定获得ntpyl6基因编辑植株,之后进行收种获得t0代编辑植株种子。t0代种子按23倍进行自交纯合扩繁,待植株长到5-6片叶时,单株的叶片取样,送华大基因进行分子检测,确定获得ntpyl6基因发生纯合编辑的植株,之后进行自交收种获得ntpyl6基因纯合编辑的t1代的种子(t2代)。
[0049]
本发明所述的烟草aba受体蛋白基因ntpyl6的应用为在烟草植株体内降低所述ntpyl6基因的表达,可调控烟草株高和叶片芸香苷含量。现有技术领域内常用的降低基因表达或者基因沉默的方法均适用于本发明。
[0050]
实施例3
[0051]
利用实施例2中分子检测确定为ntpyl6基因纯合敲除的植株,进行收种获得基因纯合编辑素材的t1代种子。将对照红花大金元及编辑素材t2代在温室进行种植,待植株长到5-6片叶时,单株叶片取样,送华大基因进行分子检测,确定获得ntpyl6基因发生纯合编辑的t2代植株。在现蕾期及打顶后期参考行业标准《yct 142-2010烟草农艺性状调查测量方法》对编辑素材及对照的主要农艺性状和植物学性状进行调查。包括对扩繁群体的主要农艺性状(株高、节距、茎围、有效叶片数、叶长、叶宽等)、植物学性状(株型、叶形、叶色等)进行系统测量。
[0052]
对照(未编辑)及ntpyl6基因纯合编辑烟草植株现蕾期和成熟期株高比较(结果如图1所示)。与对照相比,ntpyl6基因纯合编辑烟草植株现蕾期和成熟期的株高均显著增高。
[0053]
实施例4
[0054]
利用实施例3中分子检测确定为ntpyl6基因纯合敲除的植株。然后以超高效液相-三重四级杆串联质谱法进行ntpyl6基因纯合敲除素材的成熟期叶片的类黄酮含量的检测试验。
[0055]
选择成熟期的烟株,采集5株ntpyl6基因纯合编辑的烟草植株样本及5株对照(未编辑)烟草植株样本,采集同一叶位的叶片;叶片去主筋,锡箔纸包裹液氮保存运输,实验室超低温(-70℃)保存,冻干磨粉过筛。
[0056]
分别取50mg烟叶样品,转入1.5ml乙醇-水提取液(内标:伞形花内酯75ng/ml),常温下超声1h,然后14000rpm离心机条件下离心取上清液后检测。采用的分析条件为:色谱条件beh phenyl色谱柱(2.1
×
150mm,1.7μm),流动相为0.1%甲酸水(a)和0.1%甲酸甲醇(b);洗脱梯度:0-2min内b相由5%升到15%,2-10min b相保持15%,10.01-15min b相升到100%;流速为0.3ml/min,柱温为35℃,进样量为1μl;质谱条件电喷雾电离源电离,正离子电离模式下毛细管电压为4kv,雾化气压力为40psi,干燥气流量为12l/min,干燥气温度为290℃,鞘气流量为11l/min,鞘气温度为200℃,采用实时多反应监测(dmrm)模式扫描。
[0057]
对照(未编辑)及ntpyl6基因纯合编辑烟草植株各时期叶片中芸香苷含量比较(结果如图2所示)。与对照相比,ntpyl6基因纯合编辑烟草植株各时期新鲜叶片中,芸香苷的含量显著降低。
[0058]
虽然本发明已以实施例公开如上,然其并非用于限定本发明,任何本领域技术人员,在不脱离本发明的精神和范围内,均可作各种不同的选择和修改,因此本发明的保护范围由权利要求书及其等同形式所限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1