聚电解质膜、巨噬细胞外泌体及其在促进BMSCs分化中的应用
聚电解质膜、巨噬细胞外泌体及其在促进bmscs分化中的应用
技术领域
1.本发明涉及一种聚电解质膜、巨噬细胞外泌体及其在促进骨髓间充质干细胞(bmscs)向成骨细胞分化中的应用。
背景技术:
2.生物材料的研究是人工器官和医疗器械开发的基础,随着生物技术的蓬勃发展和重大突破,生物材料已经成为了各国科学家竞相进行研究和开发的热点。生物材料的应用虽已取得极大成功,但长期临床应用仍存在不少问题,根本原因在于材料或植入体基本上是以异物存在,难以真正诱导组织再生。对生物材料表面结构和功能进行设计,使其能够针对性的激发人体相应组织和器官的再生修复功能,实现被损坏的组织或器官的永久康复,成为了当代生物材料的发展方向。
3.材料与人体接触或植入人体后对宿主的影响是一个非常复杂的过程,产生许多复杂的生物、物理、化学反应等。周围组织的愈合过程涉及到多种细胞类型在材料表面的相互作用,包括造血炎症细胞和间充质来源的干细胞等,间充质干细胞(mscs)及其成骨分化的募集是在骨生物材料界面处骨形成的关键。宿主的炎症反应,尤其是巨噬细胞活性和分泌介质功能会直接影响骨形成细胞的成骨分化。目前针对生物材料成骨诱导活性的研究多采用材料与mscs的单因素培养模型,主要关注材料表面骨形成细胞的生物学活性,并未考虑到宿主的固有炎症反应,尤其是其核心成员单核-巨噬细胞的活动,从而造成体内外成骨效果的差异。
技术实现要素:
4.本发明的目的在于提供一种聚电解质膜、巨噬细胞外泌体及其在促进骨髓间充质干细胞(bmscs)向成骨细胞分化中的应用。
5.本发明的目的通过下述技术方案实现:
6.一种聚电解质膜,是由糖胺多糖(gags)层和胶原(col)层交替吸附形成,其总层数为偶数,至少为8层以上;
7.所述的糖胺多糖为透明质酸(ha)、硫酸软骨素(cs)或肝素(hep)中的一种以上,优选肝素;
8.所述的胶原优选i型胶原(col i);
9.优选地,所述聚电解质膜的总层数为8层。
10.上述聚电解质膜的制备方法,包括以下步骤:
11.(1)将糖胺多糖溶解于nacl溶液中,配制得到糖胺多糖溶液;将胶原加入冰醋酸溶液a中,搅拌溶解并离心,取上清液,用含有nacl的冰醋酸溶液b调节浓度,得到胶原溶液;调节糖胺多糖溶液和胶原溶液的ph值为3.9~4.2;
12.优选地,所述nacl溶液浓度为0.15m,糖胺多糖溶液的浓度为0.5mg/ml,胶原溶液的浓度为0.5mg/ml;
13.所述的冰醋酸溶液a和b中,冰醋酸浓度均为0.2m;冰醋酸溶液b中含有0.15m nacl;
14.所述的离心是9000g、4℃离心10min;
15.(2)将基底在胶原溶液和糖胺多糖溶液中依次浸泡吸附,得到聚电解质膜,所述聚电解质膜的最外层是糖胺多糖层;
16.步骤(2)中,在胶原溶液中的浸泡时间为13~20min,在糖胺多糖溶液中的浸泡时间为9~15min;
17.步骤(2)中,在每种溶液中浸泡后应做清洗,洗脱液优选ph值为4的0.15m nacl溶液;
18.所述的基底为玻片、石英晶体微天平(qcm)晶片、硅片、聚乳酸膜或聚乳酸羟基乙酸多孔支架材料等。
19.上述的聚电解质膜在制备巨噬细胞外泌体中的应用,上述的聚电解质膜可以促进单核巨噬细胞(thp-1细胞)分泌外泌体。
20.一种巨噬细胞外泌体的制备方法,包括以下步骤:
21.取单核巨噬细胞(thp-1细胞),用完全培养基重悬,加入佛波酯(pma)培养2~3天后,thp-1细胞分化为m0巨噬细胞,将m0巨噬细胞接种于涂覆上述聚电解质膜的培养器皿中,培养2~3天后,离心,收集含有巨噬细胞外泌体的培养液上清液;进一步地,从培养液上清液中提取巨噬细胞外泌体;
22.所述的完全培养基是添加10%胎牛血清和1%抗生素的rpmi 1640培养基;
23.所述的抗生素为青霉素和/或链霉素;
24.所述的培养,是放置于湿度95%,温度37℃、co2浓度5%的环境中培养;
25.所述的培养器皿为孔板、培养皿或培养瓶;
26.所述提取外泌体包括以下步骤:
27.上清液以300g离心10min,取上清液再以2000g离心10min,取上清液再以10000g离心30min,取上清液以100000g离心70min,弃上清,用适量的pbs将沉淀溶解;最后以100000g离心70min,弃上清,用适量的pbs将沉淀溶解,得到巨噬细胞外泌体;
28.所述的制备方法中,优选地,加入pma培养2~3天后,吸去培养基,pbs洗涤后加入0.25%胰酶,消化几分钟;当细胞开始脱落时,立即用完全培养基终止消化,并将细胞悬液转移入离心管中,离心弃去上清,加入适量完全培养基重悬细胞后进行细胞计数;
29.所述的制备方法中,细胞的接种密度与培养器皿有关系;优选地,用完全培养基重悬后,thp-1细胞的密度为(0.5~3)
×
106个/ml;所述m0巨噬细胞的接种密度为(0.5~4)
×
106个/ml。
30.上述的巨噬细胞外泌体在促进骨髓间充质干细胞(bmscs)向成骨细胞分化中的应用,包括以下步骤:
31.将骨髓间充质干细胞(bmscs)接种于孔板中,待细胞贴壁过夜后换液,加入含有巨噬细胞外泌体的成骨诱导培养基,培养12~21天,诱导骨髓间充质干细胞向成骨细胞分化;
32.所述的巨噬细胞外泌体是含有巨噬细胞外泌体的培养液上清液,或者是从培养液上清液中提取巨噬细胞外泌体;
33.所述含有巨噬细胞外泌体的培养液上清液与成骨诱导培养基的体积比为1:1;
34.所述从培养液上清液中提取巨噬细胞外泌体在成骨诱导培养基中的浓度为20~30μg/ml;
35.所述骨髓间充质干细胞的接种密度为(0.5~4)
×
105个/ml;
36.所述的成骨诱导培养基是含有10%胎牛血清、1%抗生素、10mm beta-甘油磷酸钠、0.1μm地塞米松、50μm抗坏血酸的αmem培养基;
37.所述的抗生素为青霉素和/或链霉素。
38.一种骨修复材料,含有上述的巨噬细胞外泌体。
39.一种促进骨髓间充质干细胞向成骨细胞分化中的材料,含有上述的巨噬细胞外泌体。
40.本发明相对于现有技术具有如下的优点及效果:
41.本技术从体内组织再生修复的实际出发,从炎症反应在成骨再生中的作用的角度研究自组装聚电解质膜涂层材料对干细胞成骨的影响,通过构建不同生物大分子组成的聚电解质膜,考察其对巨噬细胞活性、极化表型、炎性因子释放、外泌体分泌等的影响;并通过将单核-巨噬细胞培养上清液及分离的外泌体分别作用于mscs,考察其对mscs成骨功能的调节作用,证实聚电解质膜材料可通过调控巨噬细胞行为影响干细胞成骨功能,并最终得到一种具有可有效调控巨噬细胞活性并促进干细胞成骨功能的聚电解质膜涂层材料。通过本方法获得的修复材料将更能反映其在体内的真实情况,从而真正地实现促进体内组织再生修复的效果。
附图说明
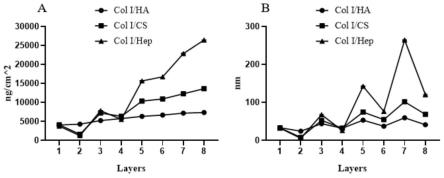
42.图1是三种聚电解质膜组装过程中的质量(a)及厚度(b)变化情况。
43.图2是组装过程中三种聚电解质膜的静态接触角(wca)变化曲线。
44.图3是原子力显微镜(afm)下三种聚电解质膜的表面形貌。
45.图4是三种聚电解质膜中i型胶原含量。
46.图5是巨噬细胞在三种聚电解质膜上的增殖行为。
47.图6是倒置荧光显微镜下巨噬细胞在三种聚电解质膜表面的粘附情况。
48.图7是扫描电子显微镜下巨噬细胞在三种聚电解质膜表面的粘附情况。
49.图8是三种聚电解质膜表面的m1型巨噬细胞的炎症因子相关mrna的表达水平;*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
50.图9是三种聚电解质膜表面的m2型巨噬细胞的炎症因子、生长因子相关mrna的表达水平;*p《0.05,**p《0.01,***p《0.001,****p《0.0001。
51.图10是三种聚电解质膜表面的m1型和m2型巨噬细胞极型相关的表面标志物相关mrna的表达水平;*p《0.05,**p《0.01。
52.图11是三种聚电解质膜表面的巨噬细胞分泌的炎症因子表达水平;*p《0.05,**p《0.01,****p《0.0001。
53.图12是三种聚电解质膜表面的巨噬细胞培养2天后的极化表型标志物inos(m1)的表达水平。
54.图13是三种聚电解质膜表面的巨噬细胞培养2天后的极化表型标志物cd206(m2)的表达水平。
55.图14是三种聚电解质膜表面的巨噬细胞培养6天后的极化表型标志物inos(m1)的表达水平。
56.图15是三种聚电解质膜表面的巨噬细胞培养6天后的极化表型标志物cd206(m2)的表达水平。
57.图16是外泌体鉴定结果,其中(a):透射电子显微镜下观察外泌体形貌;(b):标志蛋白的表达情况。
58.图17是茜素红染色观察bmscs在四种成骨诱导培养基中的成骨分化钙结节沉积情况。
59.图18是bmscs在四种成骨诱导培养基中成骨分化相关mrna的表达水平;*p《0.05,**p《0.01。
60.图19是bmscs成骨分化相关标志蛋白及通路蛋白的表达水平检测结果。
61.图20是含有外泌体的成骨诱导培养基促成骨的茜素红染色结果(a)和bmscs成骨分化相关mrna的表达水平(b、c、d);*p《0.05,****p《0.0001。
具体实施方式
62.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
63.实施例1
64.聚电解质膜的制备方法,包括以下步骤:
65.(1)糖胺多糖(gags)和i型胶原(col i)溶液的配制
66.将三种gags(ha,cs,hep)在室温复温后分别溶解于0.15m的nacl溶液中,浓度为0.5mg/ml,为糖胺多糖溶液;
67.col i(2mg/ml)首先溶于0.2m的冰醋酸中,并在4℃冰箱中搅拌过夜使得其溶解充分。待col i充分溶解后,将所得溶液离心10min(9000g,4℃)以去除杂质。离心后收集的col i溶液用含有nacl的冰醋酸溶液(0.2m)稀释至0.5mg/ml,其中nacl的浓度为0.15m,得到胶原溶液;
68.所有聚电解质溶液的ph值在使用前均调至4。
69.(2)基底的准备
70.玻片将玻片放置在特制的聚四氟乙烯支架上,浸泡在含有0.5mnaoh(溶于96%的乙醇)的溶液中,搅拌清洗2小时后将清洗液回收,玻片用去离子水充分清洗5次,每次洗10min,自然晾干备用。
71.(3)聚电解质膜的制备
72.将玻片分别浸泡在胶原溶液(col i)及糖胺多糖溶液(ha、cs、hep)中,每一层吸附之后都用洗脱液进行清洗(3
×
3min),洗脱液为ph 4的nacl溶液(0.15m)。其中聚阴离子的吸附时间为10min,而col i溶液的浸泡时间为15min。重复以上步骤,最终得到8层gag与col i交替吸附的聚电解质膜,分别命名为col i/ha,col i/cs和col i/hep;三种聚电解质膜的最外层分别是ha、cs和hep,其中奇数层为col i,偶数层为gag。
73.实施例2
74.聚电解质膜检测
75.(1)石英晶体微天平(qcm)检测
76.通过qcm检测了三种不同聚电解质膜的组装过程,并通过系统自带软件计算得到了聚电解质分子的吸附质量(a)和膜厚度(b)。
77.如图1及表1所示,三组聚电解质膜的增长行为(图1a)具有明显的差异,其中col i/ha呈现了近似线性的增长模式,且每一层聚电解质分子的吸附质量较少。而col i/cs和col i/hep整体呈现为多糖组成聚电解质膜常见的指数增长模式,在前5层时呈现阶梯状的增长,第5层后则表现为指数形式增长,两组膜尤其是col i/hep(26000ng/cm2)组聚电解质分子的吸附质量显著高于col i/ha(7400ng/cm2)组。
78.随着聚电解质分子的吸附,三组聚电解质膜厚度增长(图1b)均呈现震荡变化的趋势,且在第5层时,三组膜厚度有了明显的区别,其中col i/hep组具有最大的膜厚度约为121nm,而col i/cs与col i/hep组膜厚度分别为68nm和42nm。
79.表1不同gag组成聚电解质膜的性能参数
[0080][0081]
(2)接触角(wca)检测
[0082]
wca测试可以监测自组装过程中每一层聚电解质分子吸附后膜表面亲疏水性的变化情况。如图2所示,单纯玻片的wca在33度左右,而随着聚阳离子col i与聚阴离子ha,cs或hep的交替吸附wca值也呈现出了振荡性的改变,间接证实了聚电解质分子在玻片表面成功地进行了交替吸附。
[0083]
而且从图中可以看到,三种聚电解质膜的wca值变化呈现了相似的规律,每一层col i吸附后wca值都会升高而聚阴离子吸附后wca值出现下降,但是从第4层后col i/ha体系wca的变化趋势明显不同于cs和hep体系,其中ha体系中wca值基本维持在一个较恒定的水平,而cs和hep体系随着层数的增加wca逐渐增大,但两组样品间未见明显差异。整体来讲,三种聚电解质膜均具有一定的亲水性。
[0084]
(3)zeta电位测试
[0085]
通过固体表面zeta电位测试仪检测了三种不同gag组成聚电解质膜表面电位情况,如表1所示,三种聚电解质膜表面均呈负电位,其中col i/hep组电位最低为-58.44
±
2.91mv,而cs组电位较高为-51.08
±
1.31mv,且三组样品间电位存在显著性差异。
[0086]
(4)原子力显微镜(afm)观察结果
[0087]
通过afm观察了三种不同gag组成聚电解质膜的表面形貌,如图3所示,三种聚电解质膜表面均可见纤维状col i,但是col i/ha膜上仅可见少量稀疏交织的纤维网络,且纤维呈现带状形貌,未见col i典型的三股螺旋结构。
[0088]
相反地,在col i/cs尤其是col i/hep膜上可见大量具有三股螺旋结构的col i纤维,且纤维间相互交联形成了清晰致密的网络结构。
[0089]
此外,三种聚电解质膜上纤维直径也可见明显区别,其中hep体系中纤维直径明显较小。通过软件对三组聚电解质膜粗糙度的分析发现,col i/ha与col i/hep组具有相似的
i/hep组巨噬细胞出现明显聚集,而col i/cs组则仅可见少量巨噬细胞团,相反地,在ctrl组和col i/ha组上巨噬细胞主要呈分散状态,未见明显聚集现象。有趣的是,到第5天后各组巨噬细胞均呈现分散状态,虽然在col i/hep和col i/cs组仍可见少量的细胞团簇。
[0105]
从图7中可以看到,进一步的sem观察与显微镜下观察结果一致,在第1天时,相较于其他三组,col i/hep组巨噬细胞出现了更为明显的聚集,而到第5天时四组样品表面细胞聚集形态未见明显差异。
[0106]
通过qrt-pcr法检测不同培养时间点col i/ha,col i/cs,col i/hep以及ctrl组巨噬细胞炎症因子、生长因子以及极化表型表面标志物相关mrna的表达水平。如图8、图9、图10所示,四组样品间巨噬细胞细胞因子的分泌及表型标志物的表达在早期(第1天)具有显著的差异,且三种聚电解质膜上巨噬细胞尤其是col i/hep组细胞分泌介质及表型标志物的表达水平在不同培养时间点也具有较大差异。
[0107]
相反地,ctrl组巨噬细胞分泌的炎症因子、生长因子以及极型相关mrna表达在整个培养过程中未见明显变化。第1天时,与其他组相比,col i/hep组上m1型标志物inos及其相关炎症因子tnf,mcp和il-1明显高表达,而在3天后组间未见明显差异。此外,第1天时,与其他组相比,col i/ha组m2型相关的炎症因子il-10,生长因子fgf、vegf以及m2型标志物arg均明显高表达,而3天后组间未见明显差异。
[0108]
利用elisa技术检测col i/ha,col i/cs,col i/hep以及ctrl组上巨噬细胞分泌炎症因子水平。如图11所示,第3天时,col i/cs及col i/hep组巨噬细胞m1型相关炎症因子tnf-α和mcp-1的表达量均显著高于对照组(****p《0.0001,**p《0.01),而巨噬细胞m2型相关的炎症因子il-10在col i/hep组中的表达量明显低于其他三组(*p《0.05)。il-1β的表达量在四组样品间无明显差异。第7天时,四组样品细胞上清液中均未检测到tnf-α的表达;mcp-1在col i/cs组中表达量高于col i/hep组和对照组(*p《0.05);il-10、il-1β的表达量无明显差异。
[0109]
免疫荧光检测col i/ha,col i/cs,col i/hep以及ctrl组表面的巨噬细胞极化表型标志物的表达水平。如图12、图13、图14、图15所示,第3天,inos在hep组中的表达量显著高于其他3组,而cd206则在ha组中有较高的表达。第7天,inos表达量均有所下降,各组间无显著差异,cd206在在hep组中的表达量随着时间推移而增高,其余3组无显著变化。
[0110]
以上结果表明,三组聚电解质膜在调控巨噬细胞极化表型及其炎性因子分泌方面具有显著差异,其中col i/hep组早期促进了巨噬细胞向m1型极化,而3天后则促进了巨噬细胞由m1型向m2型的转换。相反地,在对照组及其他两组聚电解质膜上未见明显的巨噬细胞极化表型的转变。在体内,m1/m2巨噬细胞功能的良好平衡是骨愈合和再生的必要条件。事实上,巨噬细胞不仅在早期炎症中发挥重要作用,而且在骨愈合的后期也发挥着重要作用,这一作用依赖于m1/m2巨噬细胞表型的转换。其中,促炎m1巨噬细胞是启动骨再生过程所必需的,然而,促炎巨噬细胞的长期浸润则会导致慢性炎症并对骨愈合产生不良影响。因此,骨再生的关键是可促进早期促炎m1巨噬细胞转变为抗炎m2表型,并在这一过程中实现软骨内骨化。本专利中所制备的col i/hep就在巨噬细胞培养2天后发现了明显的极化表型转化,并且通过收集该时间点的上清液作用于干细胞后发现了明显的促成骨效应。
[0111]
实施例4
[0112]
一种巨噬细胞外泌体的提取方法,包括以下步骤:
[0113]
步骤(1)-(3)同实施例3;
[0114]
(4)上清液以300g离心10min,取上清液再以2000g离心10min,取上清液再以10000g离心30min,取上清液以100000g离心70min,弃上清,用适量的pbs将沉淀溶解;最后以100000g离心70min,弃上清,用适量的pbs将沉淀溶解,得到巨噬细胞外泌体;
[0115]
使用移液枪吸取15ul的外泌体溶液于铜网上静置1min。使用滤纸将铜网上的外泌体溶液吸干,然后使用移液枪吸取15ul的2%醋酸双氧铀染色液室温染色1min。使用滤纸将铜网上的外泌体溶液吸干,将染色完成的样本放于灯下烤10min,透射电子显微镜观察拍照,保存图片。
[0116]
使用western-blot技术检测外泌体表面标志蛋白cd9、cd63、cd81的表达。
[0117]
结果如下:
[0118]
如图16所示,(a)为透射电子显微镜下观察到的外泌体,可见外泌体结构清晰,呈双凹盘状囊泡状,周围背景中出现的许多细小颗粒可能是杂蛋白;(b)western-blot检测发现外泌体膜上标志蛋白cd9、cd63、cd81均有表达,符合外泌体特性。
[0119]
实施例5
[0120]
实施例3含有巨噬细胞外泌体的培养液上清液在促进骨髓间充质干细胞(bmscs)向成骨细胞分化中的应用,包括以下步骤:
[0121]
(1)细胞培养:bmscs(购自中国科学院细胞库)接种于t75培养瓶,加入完全培养基(添加10%胎牛血清和1%青霉素/链霉素的αmem培养基),放置于湿度为95%,温度为37℃,co2浓度为5%的培养箱中培养。48h后第一次换液,之后每2天换液1次;
[0122]
(2)待bmscs密度达90%左右时,使用pbs清洗细胞,吸去pbs后加入2ml 0.25%胰酶消化2~3min,当细胞开始从培养瓶中脱落时,立即用完全培养基终止消化,并将细胞悬液转移至15ml离心管中,1000rpm离心3min,用完全培养基重悬细胞后以2.5
×
105个每孔的密度接种于6孔板中,待细胞贴壁过夜后加入含有巨噬细胞外泌体的培养液上清液的成骨诱导培养基(添加10%胎牛血清、1%抗生素、10mm beta-甘油磷酸钠、0.1um地塞米松、50um抗坏血酸的αmem培养基)。其中巨噬细胞外泌体的培养液上清液与成骨诱导培养基的体积比为1:1。
[0123]
对照组所加入的培养液上清液是实施例3所得到的培养液上清液;
[0124]
步骤(2)每3天换液一次,在诱导后的第12天吸去培养基,pbs清洗2遍,75%乙醇固定15分钟,吸去乙醇,pbs清洗2遍,滴加茜素红染液覆盖细胞,染色15min,吸去染色液,pbs清洗2遍,倒置荧光显微镜下观察钙结节沉积情况。
[0125]
步骤(2)每3天换液一次,在诱导后的第3、7天收集细胞提取总rna进行qrt-pcr检测。
[0126]
步骤(2)每3天换液一次,在诱导后的第14天收集细胞提取蛋白,进行蛋白免疫印迹(western-blot)检测。
[0127]
结果如下:
[0128]
通过茜素红法检测bmscs成骨分化钙结节沉积。bmscs诱导11天后利用茜素红染液进行染色。结果如图17所示,四组样品间bmscs成骨分化具有明显差异,含空白组巨噬细胞外泌体培养液上清液处理后bmscs仅见少量细小的红染结节,而含三组聚电解质膜巨噬细胞外泌体培养液上清液显著促进了bmscs钙沉积,其中以col i/hep组尤为明显,可见大量
红染的矿物质沉积。
[0129]
通过qrt-pcr法检测bmscs成骨分化相关基因ocn,opn,runx2以及col i的mrna的表达水平。如图18所示,ocn,opn,runx2在col i/hep组中均显著升高,且主要集中在第7天,而第3天各组间无显著差异。col i在第3,7天的表达量在各组间均无显著差异。
[0130]
western-blot检测bmscs成骨分化相关标志蛋白及通路蛋白的表达水平。如图19所示,runx2、p-p38在col i/hep组中的表达高于其他三组,提示聚电解质膜col i/hep介导的炎症反应促进了bmscs的成骨分化,且该过程可能有p38的参与。
[0131]
实施例6
[0132]
实施例4的巨噬细胞外泌体在促进骨髓间充质干细胞(bmscs)向成骨细胞分化中的应用,包括以下步骤:
[0133]
步骤(1)同实施例5;
[0134]
(2)将bmscs以2.5
×
105个每孔的密度接种于6孔板中,待细胞贴壁过夜后换液,加入添加col i/hep组和对照组来源的外泌体(20~30μg/ml(通过bca定量法计算外泌体浓度))的成骨诱导培养基;
[0135]
步骤(2)诱导分化11天后茜素红染色;
[0136]
步骤(2)分别于第3、7天做成骨分化标志基因的qrt-pcr检测;
[0137]
结果如下:
[0138]
利用茜素红染色以及qrt-pcr法检测col i/hep以及ctrl组巨噬细胞来源外泌体对bmscs成骨分化的影响。如图20a所示,两组样品间bmscs成骨分化具有差异,ctrl组巨噬细胞外泌体处理后bmscs也出现红染结节,但不如col i/hep组巨噬细胞外泌体处理后bmscs出现红染结节明显,表明col i/hep组巨噬细胞外泌体更能促进成骨分化;qrt-pcr检测结果(图20b、c、d)表明,与对照组来源外泌体处理细胞相比,第3天时col i、opn基因的表达,第7天时ocn基因的表达均在col i/hep组来源的巨噬细胞外泌体刺激下更为显著。
[0139]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1