一种编码GA2ox-氧化酶的基因及其在判断芒果矮化品种中的应用的制作方法
一种编码ga2ox-氧化酶的基因及其在判断芒果矮化品种中的应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一种编码ga2ox-氧化酶的基因及其在判断芒果矮化品种中的应用。
背景技术:
2.矮化种植是农作物生产不变的发展趋势。植物矮化主要分为遗传性矮化和生理性矮化。单一基因突变属于遗传性矮化,其矮化激励多为基因合成蛋白,蛋白影响激素,激素影响表型;手环境因素影响,导致植株表型发生变化,属于生理性矮化,其矮化作用机理多为环境变化影响植物激素分泌,最终导致变化。但不论哪种矮化模式,都要通过激素来影响表型,植株生长过程中的激素多与赤霉素有关。
3.植物中参与赤霉素合成分解的酶较多,ga2ox(赤霉素2β氧化酶)就是其中之一,其是一种抑制活性赤霉素合成的酶,可以降低活性赤霉素含量,从而达到调节植物株高的目的。ga2ox调节ga代谢途径已在拟南芥中得到证实。
4.通过对比具有乔化特性和矮化特性植物材料ga2ox基因的表达量,可以预判植物其是否具有矮化特性,既省时又省力。
技术实现要素:
5.为了克服上述技术的不足,本发明提供了一种编码ga2ox-氧化酶的基因及其在判断芒果矮化品种中的应用,其可以预判芒果品种是否具有矮化特。
6.为实现上述目的,本发明提供了如下技术方案:
7.本发明的第一个目的在于提供一种编码ga2ox-氧化酶的基因,所述基因的核苷酸序列如seq id no.1所示。
8.本发明的第二个目的在于提供所述编码ga2ox-氧化酶的基因的应用,所述编码ga2ox-氧化酶的基因用于预判芒果品种是否具有矮化特性。
9.本发明的第三个目的在于提供一种ga2ox-氧化酶,所述ga2ox-氧化酶是由上述的基因编码。
10.作为优选,所述ga2ox-氧化酶的氨基酸序列如seq id no.2所示;所述ga2ox-氧化酶由341个氨基酸组成,分子量为38729.40da,理论等电点为6.56。
11.与现有技术相比,本发明具有如下有益效果:
12.(1)本发明从供试材料中获取ga2ox-氧化酶基因序列,分析该基因理化活性,把该基因作为调控矮化性状的指标。
13.(2)本发明涉及到该ga2ox-氧化酶基因克隆、与之相对应的氨基酸序列分析,通过半荧光定量方法测定ga2ox-氧化酶基因表达量,可以为早期预判供试材料是否具有矮化性状提供支持。
附图说明
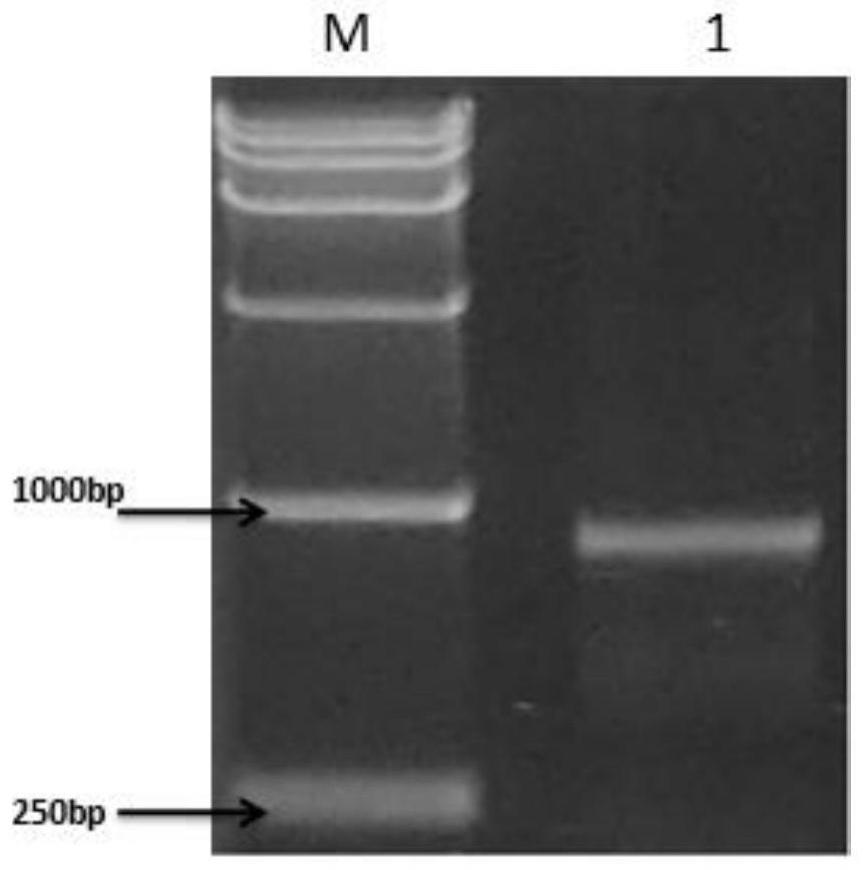
14.图1为ga2ox-氧化酶基因中间片段pcr扩增结果图;
15.图2为ga2ox-氧化酶基因3'端pcr扩增结果图;
16.图3为ga2ox-氧化酶基因5'端pcr扩增结果图;
17.图4-6为芒果ga2ox与其它植物ga2ox同源性比对结果示意图;
18.其中,dz:榴莲;hb:橡胶树;hu:锦葵;jc:麻风树;me:木薯;mg:芒果;rc:蓖麻;tc:可可;
19.图7为ga2ox编码蛋白的信号肽及跨膜结构域分析图;
20.图8为ga2ox编码蛋白二级结构分析图;
21.图9为ga2ox编码蛋白疏水性分析图;
22.图10为芒果ga2ox系统进化树;
23.图11为不同物候期金煌芒和桂七芒中ga2ox基因表达量图。
具体实施方式
24.下面结合对本发明专利的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域所属的技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
25.在实施例1中,主要仪器和试剂为:pcr仪:takara;电泳仪:bio-rad;2000分光光度计:thermo;恒温摇床;超保真dna聚合酶:neb;firstchoice rlm-race kit:thermo;2
×
taq master mix(dye plus):vazyme。
26.在实施例2中,主要仪器和试剂为:abi 7900-fast real-time pcr detection system:abi;2000分光光度计:thermo;普通pcr仪:takara;all-in-one
tm first-strand cdna synthesis kit:genecopoeia(cat.no.aort-0050);all-in-one
tm qpcr mix:genecopoeia(cat.no.aopr-0200);epcentre
tm rnase r。
27.实施例1:芒果ga2ox-氧化酶基因的克隆与序列分析
28.一、rna提取与提取
29.1.总rna提取(trizol法)
30.(1)样品处理:取80-100mg芒果叶片至冷冻研钵中,加入液氮研磨至粉末状,转移至装有1ml trizol的1.5ml离心管中,振荡混匀后室温静置约5min。
31.(2)相分离:每1ml trizol加入0.2ml氯仿,振荡混匀15s后室温静置约3min,4℃,12000rpm,离心15min。
32.(3)沉淀:转移水相至新的1.5ml离心管中,每1ml trizol加入0.5ml异丙醇,混匀后室温静置10min,4℃,12000rpm,离心10min。
33.(4)洗涤:弃上清,每1ml trizol加入1ml75%的乙醇,混匀后4℃,7500rpm,离心5min。
34.(5)溶解:弃上清,空气干燥rna沉淀约5min(注意不要完全干燥,只需沉淀泛白即可),加入depc处理水溶解rna沉淀。
35.2.纯化提取的rna
36.(1)在微量离心管中配制下列反应液,50ul体系:
[0037][0038]
(2)在37℃下反应25min后,使recombinant dnase i失活。
[0039]
(3)加入10ul 3m醋酸钠和250ul冷乙醇,-80℃放置20min。
[0040]
(4)在4℃下,12000rpm离心10min,弃上清。
[0041]
(5)加入70%冷乙醇洗净,4℃,12000rpm离心5min,弃上清,干燥沉淀即可。
[0042]
二、克隆目的基因中间片段
[0043]
2.1根据genbank中公布的植物的ga2ox基因cdna序列,经过dnaman软件比对后,根据保守区域设计一对简并引物。
[0044]
ga2ox-f:aayggygatr tbgghtggrtygaata
[0045]
ga2ox-r:tgcytyacrctytta aayctyccattwgtca
[0046]
2.2反转录中间片段
[0047]
(1)解冻first-strand cdna synthesis kit的试剂,上下轻柔颠倒混匀,短暂离心后放置冰上待用。
[0048]
(2)冰上配制rna-primer mix,在预冷的rnase-free反应管内加入以下试剂至总体积13μl;
[0049][0050]
(3)混匀rna-primer mix,进行短暂离心,65℃变性10min后立即放于冰上;
[0051]
(4)在rna-primer mix反应管内加入以下试剂至总体积25μl;
[0052][0053]
(5)混匀反应mix,短暂离心后37℃孵育1h;
[0054]
(6)反应结束后,85℃灭活处理5min,-20℃保存反转录产物待用。
[0055]
2.3中间片段分析和分离
[0056]
中间片段pcr反应体系:
[0057][0058][0059]
pcr反应程序为:94℃5min;94℃40s,58℃40s,72℃1min,35个循环;72℃10min;4℃10min;结束后将pcr反应产物在质量分数为1%的琼脂糖凝胶电泳分析,结果见图1,并进行切胶回收目的片段。
[0060]
从图1中可以看出,从芒果叶片中克隆出的ga2ox中间片段大小约为900bp。
[0061]
2.4目的片段回收
[0062]
(1)将50μl的反应体系全部加入到1%琼脂糖凝胶的点样孔中,在样品的一侧点入dna marker dm 2000。
[0063]
(2)恒压120v,电泳30min左右,根据条带移动的位置,判断何时终止跑胶。
[0064]
(3)在紫外灯下,根据marker的位置,对目的条带进行切割回收,利用dna琼脂糖胶回收试剂盒纯化目的基因全长片段。
[0065]
(4)将切割的凝胶快速放入离心管中,根据凝胶的重量,评估其体积的大小。
[0066]
(5)向凝胶中加入同体积的binding buffer,65℃,5min,至凝胶全部融化。
[0067]
(6)将融化液吸入到hibind dna mini柱子里,然后把柱子放入到离心管中,10000g,室温,离心1min。弃废液,留柱子,直至所有的融化液完成此步骤。
[0068]
(7)向柱子中加入300μl的xp2,10000g,室温,离心1min。弃废液,留柱子。
[0069]
(8)加入700μl的spw wash buffer于柱子中,10000g,室温,离心1min,弃废液。重复此步骤一次。
[0070]
(9)室温,13000g,空转2min,去除残余废液。
[0071]
(10)把柱子放入新的离心管中,将30μl的elution buffer滴入到膜中央,室温,2min,然后13000g,离心2min,洗脱dna。
[0072]
2.5t载体连接及转化
[0073]
i、连接
[0074]
pcr产物4μl,peasy-t1克隆载体1μl,轻轻混合,室温下反应5min。反应结束后,将离心管置于冰上。
[0075]
ii、转化
[0076]
(1)自-80℃冰箱中取出大肠杆菌感受态细胞dh5a,放入冰中直至完全溶解,轻轻混匀。
[0077]
(2)吸50μl感受态细胞放入灭过菌的离心管中,并向离心管中加入5μl重组质粒,
轻轻混匀,冰上静置30min。
[0078]
(3)将冰浴后的离心管置于42℃水浴中热激90s,迅速移入装有冰的冰盒中2min,加入600ul lb培养液,放到37℃恒温摇床上进行220rpm培养1h。
[0079]
(4)取50ul培养液涂于含有amp的固体lb培养基上,待其干燥后放于37℃的培养箱中倒置培养。12h-16h后检查培养皿中是否出现菌落。
[0080]
(5)挑取单克隆划线培养,用基因上下游引物做菌落pcr扩增检测。
[0081]
(6)挑取阳性单克隆进行摇菌并测序。
[0082]
三、克隆目的基因3'端
[0083]
3.1根据已经获得的目的基因中间片段设计一对3'race引物。
[0084]
ga2ox 3'gsp-1:ccgccatgtccggatattca
[0085]
ga2ox 3'gsp-2:atccaacaacacttccggct
[0086]
3.2获得3'cdna
[0087]
(1)在无rna酶的离心管中加入以下成分,于冰上操作:
[0088][0089]
(2)轻轻混匀,于42℃孵育1h,-20℃保存。
[0090]
3.3 outer 3'pcr反应体系
[0091][0092]
pcr反应程序为:94℃3min;94℃40s,60℃40s,72℃1min,35个循环;72℃10min;4℃10min。
[0093]
3.4 inner 3'pcr反应体系
[0094][0095][0096]
pcr反应程序为:94℃3min;94℃40s,60℃40s,72℃1min,35个循环;72℃10min;4℃10min;结束后将pcr反应产物在质量分数为1%的琼脂糖凝胶电泳分析,结果见图2,并进行切胶回收目的片段连接到peasy-t1克隆载体上转化感受态细胞,鉴定出阳性菌落后测序。
[0097]
从图2可以看出,根据已获得的ga2ox基因中间片段的序列信息设计特异引物ga2ox 3'gsp-1、ga2ox 3'gsp-2与各自的通用引物进行pcr扩增,得到约900bp大小的dna片段。
[0098]
四、克隆目的基因5'端
[0099]
4.1.根据已经获得的目的基因中间片段设计一对5'race引物。
[0100]
ga2ox 5'gsp-1:gcacctgcataatcaaccacc;
[0101]
ga2ox 5'gsp-2:gcttgggtactggcaaaagc。
[0102]
4.2 outer 5'pcr反应体系
[0103][0104]
pcr反应程序为:94℃3min;94℃40s,60℃40s,72℃1min,35个循环;72℃10min;4℃10min;
[0105]
4.3 inner 5'pcr反应体系
[0106][0107]
pcr反应程序为:94℃3min;94℃40s,60℃40s,72℃1min,35个循环;72℃10min;4℃10min;结束后将pcr反应产物在质量分数为1%的琼脂糖凝胶电泳分析,结果见图3,并进行切胶回收目的片段连接到peasy-t1克隆载体上转化感受态细胞,鉴定出阳性菌落后测序。
[0108]
从图3可以看出,根据已获得的ga2ox基因中间片段的序列信息设计特异引物ga2ox 5'gsp-1、ga2ox 5'gsp-2与各自的通用引物进行pcr扩增,得到约500bp大小的dna片段。
[0109]
五、基因序列拼接与分析
[0110]
5.1利用dnaman对5'端、3'端及中间片段进行拼接,得到ga2ox基因的全长序列,翻译成蛋白质序列;再用blast进行氨基酸相似性检索,结果见图4-6。
[0111]
从图4-6可以看出:ga2ox序列与橙子(xm_006467404.3)的一致性为79%;
[0112]
与柑橘(xm_006449629.2)的一致性为79%;
[0113]
与木薯(xm_021738345.1)的一致性为78%;
[0114]
与巴西橡胶树(xm_021820571.1)的一致性为78%;
[0115]
与陆地棉(xm_016896568.1)的一致性为76%;
[0116]
与中棉(xm_012597405.1)的一致性为75%。
[0117]
5.2氨基酸序列理化性质分析
[0118]
用protparam(http://web.expasy.org/protparam/)分析,ga2ox序列含有完整的开放阅读框,终止密码子分别为tga。ga2ox编码341个氨基酸,产物的分子量为38729.40da,理论等电点为6.56。其中酸性氨基酸(asp+glu)41个,碱性氨基酸(arg+lys)39个。该蛋白不稳定为不稳定蛋白,脂肪指数为80.32;亲水性总平均值为-0.301。
[0119]
用phobius(http://phobius.sbc.su.se/)在线分析,分析结果见图7。
[0120]
从图7可以看出,ga2ox编码的蛋白质可能有信号肽。同时对ga2ox蛋白序列的跨膜结构域进行预测,结果显示,整条肽链都位于细胞膜外,结合上述信号肽的预测,推断该蛋白可能在细胞质基质中合成后,经蛋白质转运,直接锚定于细胞膜外的特定部位行使功能。
[0121]
利用dnaman对ga2ox进行二级结构预测,预测结果见图8。
[0122]
从图8可以看出,在ga2ox编码蛋白中,螺旋结构占21.14%,折叠占26.67%,无规则卷曲占52.19%。
[0123]
利用dnaman预测ga2ox的疏水性,预测结果见图9。
[0124]
从图9可以看出,ga2ox多肽链第91位的谷氨酸具有最低值-3.18,亲水性最强,而
第1位的蛋亮氨酸具有最高值2.84,疏水性最强。
[0125]
为了研究mango ga2ox的进化情况,构建了ga2ox氨基酸序列的系统进化树,如图10所示。
[0126]
从图10看出,芒果ga2ox与山黄麻ga2ox(pon72625.1)、山黄麻ga2ox(pon57518.1)、川桑ga2ox(xp_010110967.1)、面包树ga2ox1(als88210.1)、面包树ga2ox2(als88211.1)、面包树ga2ox3(als88212.1)亲缘关系较近;其次为蓖麻ga2ox(xp_015574955.1)、麻风树ga2ox(np_001292962.1)、橡胶树ga2ox(xp_021649315.1)、木薯ga2ox(xp_021594037.1)、橡胶树ga2ox(xp_021676263.1)。
[0127]
实施例2:基因相对量pcr检测
[0128]
利用beacon designer设计引物,探究ga20ox基因在“金煌芒”(乔化特性)和“桂七芒”(矮化特性)不同时期中的表达情况。
[0129]
以芒果actin内参基因设计actin-f和actin-r引物。根据已克隆得到的ga20ox序列设计特异引物ga20ox-ygf和ga20ox-ygr,cdna的获得同实施例1。
[0130]
pcr定量反应步骤如下:
[0131]
1)将all-in-one
tm qpcr mix在室温下融解,轻柔地上下颠倒混匀并进行短暂离心。
[0132]
2)冰上配制pcr reaction mix,包括2
×
all-in one
tm qpcr mix 10μl、qpcr primer(1μmol/l)2μl、cdna template 2μl,加入ddh2o使终体积至20μl。在试验中设计了ntc(no template control)为阴性对照,即用水代替模板cdna,其他试剂不变,从而确保体系无污染。
[0133]
3)将反应管进行短暂离心,确保所有反应液在反应管底部。
[0134]
pcr反应程序为95℃10min;95℃10s,60℃20s,72℃15s,40个循环;72℃10min。pcr反应结束后,进行溶解曲线分析,即温度控制在72-95℃,每间隔10s升高0.5℃,最后25℃保持30s。试验设置3次重复。
[0135]
采用7300system软件和2-δδct
方法进行数据分析,结果见图11。
[0136]
由图11可知,在5个物候期时间段,具有矮化特性供试材料的ga20ox基因表达量远高于具有乔化特性种质,说明ga2ox基因具有调控植物矮化表型的作用。
[0137]
综上,本发明通过半荧光定量分析法测定ga2ox-氧化酶基因表达量可以为早期预判供试材料是否具有矮化性状提供支持。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1