拮抗性抗肿瘤坏死因子受体超家族抗体的制作方法
1.本发明涉及能够拮抗肿瘤坏死因子受体超家族成员如肿瘤坏死因子受体2的多肽,如抗体及其抗原结合片段。本发明的多肽可以用于调整调节性t细胞的活性,例如在免疫治疗领域中用于治疗细胞增殖性障碍和传染性疾病。
背景技术:
2.天然存在和基因工程化的t淋巴细胞的使用是用于改善各种人类病理学的一个突出的范例。例如,尽管用于治疗癌症的传统治疗平台包括肿瘤块的手术切除、放射疗法以及化学治疗剂的施用(shewach,chem.rev.[化学评论],109:2859-2861,2009),但近十年来已经见证了过继性免疫治疗的应在癌症治疗方案中的复兴。随着嵌合抗原受体(car-t)治疗的出现,已经出现了向患者输注自体和同种异体肿瘤反应性t细胞的新方法(june,j.clin.invest.[临床研究杂志],117:1466-1476,2007)。car-t疗法利用获得性免疫应答的资源以促进癌细胞细胞毒性并根除肿瘤物质。过继性免疫治疗中的一个常见主题是使用t细胞,这些t细胞在显示不同肿瘤抗原的细胞中表现出选择性地增强细胞毒性的能力。这种技术的实例包括肿瘤浸润淋巴细胞(dudley等人,j.immunother.[免疫治疗杂志],26:332-342,2003)以及自体或同种异体t细胞的施用,这些t细胞已被遗传地重新工程化以表现出与肿瘤特异性抗原的反应性(yee等人,pnas.[美国国家科学院院刊],99:16168-16173,2002)。
[0003]
尽管存在基于t淋巴细胞的癌症免疫治疗的希望,但是该治疗平台的发展受到免疫系统抑制对自身细胞的免疫攻击的自然倾向的阻碍。与所有有核人类细胞一样,癌细胞表达将这些细胞与外来细胞区分开的i类主要组织相容性复合体(mhc)蛋白。为了防止细胞自相残杀,已经进化出调节性t细胞(t-reg细胞),其抑制对“自身”mhc抗原表现出反应性的t细胞的活性。t-reg细胞代表了一种异质类型的t细胞,它们可以基于其独特的表面蛋白呈递来区分。t-reg细胞的最好理解的群体包括cd4+、cd25+、foxp3+t-reg细胞和cd17+t-reg细胞。这些细胞介导自体反应性t细胞的抑制的确切机制是正在进行的研究的主题,尽管已经显示某些类型的t-reg细胞抑制靶t细胞中增殖诱导性细胞因子il-2的产生并且可以借助cd25(il-2受体的亚结构域)对il-2的亲和力另外地从自体反应性细胞中隔离il-2(josefowicz等人,ann.rev.immun.[免疫学年度评论],30:531-564,2012)。
[0004]
尽管t-reg细胞在维持外周耐受中发挥重要作用,但是构成这些细胞调节自体反应性t细胞活性的能力的相同生物化学特征也通过抑制肿瘤反应性t淋巴细胞的活性来破坏过继性免疫治疗和天然免疫应答。t-reg细胞活性的化学调节剂的发展一直是许多药理学研究的主题,因为获得能够抑制t-reg介导的t细胞抑制的药剂可以极大地改善过继性癌症免疫治疗的范围和功效,并且提高免疫系统根除引起传染性疾病的致病生物体的能力。
[0005]
已经在t-reg细胞表面上将肿瘤坏死因子受体(tnfr)亚型1和2鉴定为决定细胞命运的信号转导分子。例如,tnfr1的活化增强半胱天冬酶信号级联并终止于t-reg凋亡,而tnfr2的活化通过丝裂原活化蛋白激酶(mapk)信号传导途径诱导信号传导,该信号传导途
径通过traf2/3和nfκb介导的基因的转录而策划信号传导,该基因的转录促进细胞凋亡逃逸和细胞增殖。由于其在指导细胞存活和生长中的作用,tnfr2代表了用于阻止肿瘤反应性t淋巴细胞的免疫检测的有吸引力的靶标。因此,目前需要能够阻止t-reg细胞存活和增殖的疗法,用于靶向细胞增殖性障碍如癌症和各种各样的传染性疾病的治疗。
技术实现要素:
[0006]
本发明提供了拮抗性肿瘤坏死因子受体2(tnfr2)抗体及其抗原结合片段,如特异性结合人tnfr2内的含有kcrpg序列(seq id no:19)的一个或多个残基的表位或在非人灵长类动物(例如野牛或牛,如本文所述)的tnfr2中的等效表位的那些,以及不特异性结合人tnfr2内的含有kcspg序列(seq id no:12)的表位或非人灵长类动物的tnfr2中的等效表位的那些。此外,本发明的特征在于抑制其他tnfr超家族成员的活性的抗体及其抗原结合片段,如以反平行二聚体构型结合这些蛋白质的抗体及其抗原结合片段。本文所述的抗体及其抗原结合片段可以用于治疗各种病症,包括癌症和传染性疾病。
[0007]
本文披露了能够特异性结合人tnfr2的多肽(如单链多肽、抗体或其抗原结合片段),所述多肽包含互补决定区-重链1(cdr-h1)和源自中性tnfr2抗体的cdr-h2以及具有以下氨基酸序列的cdr-h3:jz1jz2z4jz3jz5(j)2z5z2z5、jz1jz2z4z3z5(j)2z5z2z5(j)2、jrjdgjsjy(j)2fdj(seq id no:278)、jrjdgsy(j)2fd(j)3(seq id no:279)、qz1vz2z4yz3sz5wyz5z2z5(seq id no:265)或az1dz2z4z3z5spz5z2z5wg(seq id no:266),其中
[0008]
每个j独立地是天然存在的氨基酸;
[0009]
每个z1独立地是在生理ph下含有阳离子侧链的天然存在的氨基酸,如赖氨酸、精氨酸和组氨酸;
[0010]
每个z2独立地是在生理ph下含有阴离子侧链的天然存在的氨基酸,如天冬氨酸和谷氨酸;
[0011]
每个z3独立地是在生理ph下含有极性不带电荷的侧链的天然存在的氨基酸,如丝氨酸、苏氨酸、天冬酰胺和谷氨酰胺;
[0012]
每个z4独立地是甘氨酸或丙氨酸;并且
[0013]
每个z5独立地是含有疏水性侧链的天然存在的氨基酸,如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸和甲硫氨酸、色氨酸、苯丙氨酸和酪氨酸。如在本文中在多肽公式的背景下使用的,下标符号中的数字字符指明在公式中存在的前面氨基酸的量,并且上标符号中的数字字符指明在公式中存在的前面氨基酸的类型。
[0014]
本文披露了能够特异性结合人tnfr2的多肽,如单链多肽、抗体或其抗原结合片段。所述多肽(例如抗体及其抗原结合片段)可以含有以下cdr中的一个或多个或全部:
[0015]
(a)具有氨基酸序列z4jz3z5(j)2z5或z4jz3z5(j)2z5j的cdr-h1;
[0016]
(b)具有氨基酸序列(j)3z4z3j或(j)5z4z3j的cdr-h2;
[0017]
(c)具有氨基酸序列jz1jz2z4jz3jz5(j)2z5z2z5或jz1jz2z4z3z5(j)2z5z2z5(j)2的cdr-h3;
[0018]
(d)具有氨基酸序列(j)9z5或(j)5z5的cdr-l1;
[0019]
(e)具有氨基酸序列(j)6z3或(j)2z3的cdr-l2;以及
[0020]
(f)具有氨基酸序列(j)5z5(j)2z3或(j)3z5(j)4z3的cdr-l3;
[0021]
其中每个j独立地是天然存在的氨基酸;
[0022]
每个z1独立地是在生理ph下含有阳离子侧链的天然存在的氨基酸,如赖氨酸、精氨酸和组氨酸;
[0023]
每个z2独立地是在生理ph下含有阴离子侧链的天然存在的氨基酸,如天冬氨酸和谷氨酸;
[0024]
每个z3独立地是在生理ph下含有极性不带电荷的侧链的天然存在的氨基酸,如丝氨酸、苏氨酸、天冬酰胺和谷氨酰胺;
[0025]
每个z4独立地是甘氨酸或丙氨酸;并且
[0026]
每个z5独立地是含有疏水性侧链的天然存在的氨基酸,如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸和甲硫氨酸、色氨酸、苯丙氨酸和酪氨酸。
[0027]
抗体或其抗原结合片段可以含有非天然恒定区(例如,人恒定区),缺少全部或部分fc结构域,缺少全部或部分天然fc结构域,或完全缺乏fc结构域。
[0028]
此外,本文披露了能够特异性结合人tnfr2的多肽(例如,单链多肽、抗体及其抗原结合片段),其中该多肽(例如,抗体或其抗原结合片段)含有以下cdr中的一个或多个或全部:
[0029]
(a)具有氨基酸序列gjtf(j)2y(seq id no:276)或gjtf(j)2yj(seq id no:277)的cdr-h1;
[0030]
(b)具有氨基酸序列(j)3gsj或(j)5gsj的cdr-h2;
[0031]
(c)具有氨基酸序列jrjdgjsjy(j)2fdj(seq id no:278)或jrjdgsy(j)2fd(j)3(seq id no:279)的cdr-h3;
[0032]
(d)具有氨基酸序列(j)9y或(j)5y的cdr-l1;
[0033]
(e)具有氨基酸序列(j)6s或(j)2s的cdr-l2;以及
[0034]
(f)具有氨基酸序列(j)5y(j)2t或(j)3y(j)4t的cdr-l3;
[0035]
其中每个j独立地是天然存在的氨基酸。抗体或其抗原结合片段可以含有非天然恒定区(例如,人恒定区),缺少全部或部分fc结构域,缺少全部或部分天然fc结构域,或完全缺乏fc结构域。
[0036]
本发明的特征还在于能够特异性结合人tnfr2的多肽(例如,单链多肽、抗体及其抗原结合片段)。该多肽(例如,抗体或其抗原结合片段)可以含有以下cdr:
[0037]
(a)具有氨基酸序列z4fz3z5ssz5或z4yz3z5tdz5x的cdr-h1;
[0038]
(b)具有氨基酸序列ssgz4z3y(seq id no:263)或vdpeyz4z3t(seq id no:264)的cdr-h2;
[0039]
(c)具有氨基酸序列qz1vz2z4yz3sz5wyz5z2z5(seq id no:265)或az1dz2z4z3z5spz5z2z5wg(seq id no:266)的cdr-h3;
[0040]
(d)具有氨基酸序列sasssvyymz5(seq id no:267)或qninkz5(seq id no:268)的cdr-l1;
[0041]
(e)具有氨基酸序列stsnlaz3(seq id no:269)、tyz3或ytz3的cdr-l2;以及
[0042]
(f)具有氨基酸序列qqrrnz5pyz3(seq id no:270)或clqz5vnlxz3(seq id no:271)的cdr-l3;
[0043]
其中每个z1独立地是在生理ph下含有阳离子侧链的氨基酸;
[0044]
每个z2独立地是在生理ph下含有阴离子侧链的氨基酸;
[0045]
每个z3独立地是在生理ph下含有极性不带电荷的侧链的氨基酸;
[0046]
每个z4独立地是甘氨酸或丙氨酸;
[0047]
每个z5独立地是含有疏水性侧链的氨基酸;
[0048]
每个x独立地是亮氨酸或异亮氨酸。抗体或其抗原结合片段可以含有非天然恒定区(例如,人恒定区),缺少全部或部分fc结构域,缺少全部或部分天然fc结构域,或完全缺乏fc结构域。
[0049]
另一方面,本发明的特征在于能够特异性结合人tnfr2的多肽,如单链多肽、抗体或其抗原结合片段,其中该多肽(例如,单链多肽、抗体或其抗原结合片段)含有以下cdr:
[0050]
(a)具有氨基酸序列gftfssy(seq id no:23)、gytftdyx(seq id no:257),或相对于这些序列具有多达两个氨基酸取代(例如,一个或两个氨基酸取代,如保守性氨基酸取代)的氨基酸序列的cdr-h1;
[0051]
(b)具有氨基酸序列ssggsy(seq id no:24)、vdpeygst(seq id no:258),或相对于这些序列具有多达两个氨基酸取代(例如,一个或两个氨基酸取代,如保守性氨基酸取代)的氨基酸序列的cdr-h2;
[0052]
(c)具有氨基酸序列qrvdgyssywyfdv(seq id no:25)、arddgsyspfdywg(seq id no:259),或相对于这些序列具有多达两个氨基酸取代(例如,一个或两个氨基酸取代,如保守性氨基酸取代)的氨基酸序列的cdr-h3;
[0053]
(d)具有氨基酸序列sasssvyymy(seq id no:26)、qninky(seq id no:260),或相对于这些序列具有多达两个氨基酸取代(例如,一个或两个氨基酸取代,如保守性氨基酸取代)的氨基酸序列的cdr-l1;
[0054]
(e)具有氨基酸序列stsnlas(seq id no:27)、tys、yts,或相对于seq id no:27具有多达两个氨基酸取代(例如,一个或两个氨基酸取代,如保守性氨基酸取代)的氨基酸序列的cdr-l2;以及
[0055]
(f)具有氨基酸序列qqrrnypyt(seq id no:28)、clqyvnlxt(seq id no:261),或相对于这些序列具有多达两个氨基酸取代(例如,一个或两个氨基酸取代,如保守性氨基酸取代)的氨基酸序列的cdr-l3;
[0056]
其中每个x独立地是亮氨酸或异亮氨酸。抗体或其抗原结合片段可以含有非天然恒定区(例如,人恒定区),缺少全部或部分fc结构域,缺少全部或部分天然fc结构域,或完全缺乏fc结构域。在一些实施例中,氨基酸取代是保守取代。在一些实施例中,氨基酸取代是非保守取代。
[0057]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)包含以下cdr中的一个或多个:
[0058]
(a)具有氨基酸序列sasssvyymy(seq id no:26)的cdr-l1;
[0059]
(b)具有氨基酸序列stsnlas(seq id no:27)的cdr-l2;以及
[0060]
(c)具有氨基酸序列qqrrnypyt(seq id no:28)的cdr-l3。
[0061]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)包含以下cdr中的一个或多个:
[0062]
(a)具有氨基酸序列qninky(seq id no:260)的cdr-l1;
[0063]
(b)具有氨基酸序列tys或yts的cdr-l2;以及
[0064]
(c)具有氨基酸序列clqyvnlxt(seq id no:261)的cdr-l3。
[0065]
在一些实施例中,该抗体或其抗原结合片段的cdr-l2具有氨基酸序列tys。在一些实施例中,该抗体或其抗原结合片段的cdr-l2具有氨基酸序列yts。在一些实施例中,cdr-l3具有氨基酸序列clqyvnllt(seq id no:272)。在一些实施例中,cdr-l3具有氨基酸序列clqyvnlit(seq id no:273)。
[0066]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)包含以下cdr中的一个或多个:
[0067]
(a)具有氨基酸序列gftfssy(seq id no:23)的cdr-h1;
[0068]
(b)具有氨基酸序列ssggsy(seq id no:24)的cdr-h2;以及
[0069]
(c)具有氨基酸序列qrvdgyssywyfdv(seq id no:25)的cdr-h3。
[0070]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)包含以下cdr中的一个或多个:
[0071]
(a)具有氨基酸序列gytftdyx(seq id no:257)的cdr-h1;
[0072]
(b)具有氨基酸序列vdpeygst(seq id no:258)的cdr-h2;以及
[0073]
(c)具有氨基酸序列arddgsyspfdywg(seq id no:259)的cdr-h3。
[0074]
在一些实施例中,cdr-h1具有氨基酸序列gytftdyl(seq id no:274)。在一些实施例中,cdr-h1具有氨基酸序列gytftdyi(seq id no:275)。
[0075]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)含有:
[0076]
(a)具有氨基酸序列sasssvyymy(seq id no:26)的cdr-l1;
[0077]
(b)具有氨基酸序列stsnlas(seq id no:27)的cdr-l2;以及
[0078]
(c)具有氨基酸序列qqrrnypyt(seq id no:28)的cdr-l3。
[0079]
该多肽(例如,单链多肽、抗体或其抗原结合片段)可以包含:
[0080]
(a)具有氨基酸序列gftfssy(seq id no:23)的cdr-h1;
[0081]
(b)具有氨基酸序列ssggsy(seq id no:24)的cdr-h2;以及
[0082]
(c)具有氨基酸序列qrvdgyssywyfdv(seq id no:25)的cdr-h3。
[0083]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)包含:
[0084]
(a)具有氨基酸序列qninky(seq id no:260)的cdr-l1;
[0085]
(b)具有氨基酸序列tys或yts的cdr-l2;以及
[0086]
(c)具有氨基酸序列clqyvnlxt(seq id no:261)的cdr-l3。
[0087]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)含有:
[0088]
(a)具有氨基酸序列gytftdyx(seq id no:257)的cdr-h1;
[0089]
(b)具有氨基酸序列vdpeygst(seq id no:258)的cdr-h2;以及
[0090]
(c)具有氨基酸序列arddgsyspfdywg(seq id no:259)的cdr-h3。
[0091]
在一些实施例中,该多肽(例如,单链多肽、抗体或其抗原结合片段)包括含有与cdr-l2区的n-末端结合的氨基酸序列llir(seq id no:262)的框架区。在一些实施例中,该多肽(例如,抗体或其抗原结合片段)包括含有与cdr-l2区的c-末端结合的氨基酸序列tle的框架区。
[0092]
本发明的特征还在于一种多肽(例如,单链多肽、抗体或其抗原结合片段),其特异
性结合tnfr2并且含有与seq id no:4的氨基酸序列具有至少85%序列同一性的轻链氨基酸序列和非天然恒定区。在一些实施例中,该多肽(例如,抗体或其抗原结合片段)含有与seq id no:4的氨基酸序列具有至少90%(例如,95%、97%、99%或100%)序列同一性的轻链氨基酸序列。该多肽(例如,抗体或其抗原结合片段)可以另外地含有与seq id no:2具有至少85%序列同一性的重链序列。在一些实施例中,该多肽(例如,抗体或其抗原结合片段)可以含有与seq id no:2的氨基酸序列具有至少90%序列同一性的重链。例如,该多肽(例如,抗体或其抗原结合片段)可以含有与seq id no:4的氨基酸序列具有至少85%序列同一性的轻链和与seq id no:2的氨基酸序列具有至少85%序列同一性的重链。任选地,该多肽(例如,抗体或其抗原结合片段)可以含有与seq id no:4的氨基酸序列具有至少90%序列同一性的轻链和与seq id no:2的氨基酸序列具有至少90%序列同一性的重链。
[0093]
另一方面,本发明提供了含有第一多肽结构域和第二多肽结构域的构建体,每个结构域都含有本发明的单链多肽。第一和第二多肽结构域可以是相同的。在一些实施例中,第一和第二多肽结构域可以是不同的。第一和第二多肽结构域可以通过接头(如含有酰胺键或二硫键的接头)结合。这些构建体可以缺少鼠fc结构域。
[0094]
本发明的实施例的特征还在于以下抗体或其抗原结合片段,该抗体或其抗原结合片段与包含seq id no:11、19、20和34-117中任一个的氨基酸序列的肽以小于约100nm的kd特异性结合,并且不与包含seq id no:7的氨基酸56-60(kcspg)的肽结合,且含有非天然恒定区(例如,含有人恒定区),缺少全部或部分fc结构域,缺少全部或部分天然fc结构域,或完全缺少fc结构域。本发明的特征还在于能够特异性结合人tnfr2的抗体或其抗原结合片段,其中该抗体或其抗原结合片段与包含seq id no:7的氨基酸142-146(kcrpg)中的一个或多个的肽特异性结合并且不与包含seq id no:7的氨基酸56-60(kcspg)的肽结合,并且含有非天然恒定区(例如,含有人恒定区),缺少全部或部分fc结构域,缺少全部或部分天然fc结构域,或完全缺少fc结构域。该抗体或其抗原结合片段可以与含有seq id no:7的氨基酸142-146(kcrpg)中的一个或多个的肽以小于约10nm的kd特异性结合。任选地,该抗体或其抗原结合片段可以与seq id no:7的氨基酸142-149(kcrpgfgv)内的表位特异性结合。可替代地或另外地,该抗体或其抗原结合片段可以与seq id no:7的氨基酸137-144(caplrkcr)内的表位特异性结合。在一些情况下,该抗体或其抗原结合片段可以与包含seq id no:7的氨基酸150-190(rpgtetsdvvckpcapgtfsnttsstdicrphqicnvvai)内的至少五个不连续或连续残基的表位特异性结合。该抗体或其抗原结合片段可以任选地与seq id no:7的氨基酸161-169(ckpcapgtf)内的表位结合。在其他情况下,该抗体或其抗原结合片段可以与包含seq id no:7的氨基酸75-128(cdscedstytqlwnwvpeclscgsrcssdqvetqactreqnrictcrpgwycal)内的至少五个不连续或连续残基的表位结合。具体地,该抗体或其抗原结合片段可以与seq id no:7的氨基酸80-86(dstytql)、91-98(peclscgs)和116-123(rictcrpg)的一个或多个内的表位结合。
[0095]
在一些实施例中,该抗体或其抗原结合片段与seq id no:7的氨基酸112-131(reqnrictcrpgwycalskq)内的表位结合。该抗体或其抗原结合片段可以与seq id no:7的氨基酸120-139(crpgwycalskqegcrlcap)内的表位结合。另外地或可替代地,该抗体或其抗原结合片段可以与seq id no:7的氨基酸128-147(lskqegcrlcaplrkcrpgf)内的表位结合。在一些实施例中,该抗体或其抗原结合片段与seq id no:7的氨基酸136-155
(lcaplrkcrpgfgvarpgte)内的表位结合。
[0096]
本发明的抗体和抗原结合片段可以抑制tnfr2信号传导。在一些实施例中,该抗体或其抗原结合片段降低或抑制选自下组的一个或多个基因的表达,该组由以下组成:chuk、nfkbie、nfkbia、map3k11、traf2、traf3、relb和ciap2/birc3。在一些实施例中,该抗体或其抗原结合片段抑制nfκb活化。例如,本发明的拮抗性tnfr2抗体或其抗原结合片段可以降低或抑制chuk、nfkbie、nfkbia、map3k11、traf2、traf3、relb或ciap2/birc3中的一个或多个的表达或翻译后修饰(例如,磷酸化),例如,相对于从未用本发明的拮抗性tnfr2抗体或其抗原结合片段处理的样品分离的这些分子中的一个或多个的表达或翻译后修饰(例如,磷酸化)降低或抑制1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。可以用于确定表达水平和磷酸化状态的示例性测定是本领域已知的,并且包括用于确定蛋白质含量的western印迹测定和用于确定mrna含量的定量逆转录聚合酶链式反应(rt-pcr)实验。在优选的实施例中,抗tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)是显性tnfr2拮抗剂,并且因此即使在tnfr2激动剂(如tnfα)或生长促进剂(如il-2)存在下也能够抑制tnfr2活化。
[0097]
本发明的拮抗性tnfr2多肽(例如,抗体或其抗原结合片段)能以不大于约10nm、不大于1nm的kd,或在具体情况下以约621pm的kd结合tnfr2。例如,本发明的拮抗性tnfr2多肽(例如,抗体或其抗原结合片段)可以结合如本文所述的tnfr2或其表位,kd为从约1pm至约900pm的(例如,约1pm,2pm、3pm、4pm、5pm、6pm、7pm、8pm、9pm、10pm、20pm、30pm、40pm、50pm、60pm、70pm、80pm、90pm、100pm、110pm、120pm、130pm、140pm、150pm、160pm、170pm、180pm、190pm、或200pm、300pm、310pm、320pm、330pm、340pm、350pm、360pm、370pm、380pm、390pm、400pm、410pm、420pm、430pm、440pm、450pm、460pm、470pm、480pm、490pm、500pm、510pm、520pm、530pm、540pm、550pm、560pm、570pm、580pm、590pm、600pm、610pm、620pm、630pm、640pm、650pm、660pm、670pm、680pm、690pm、700pm、710pm、720pm、730pm、740pm、750pm、760pm、770pm、780pm、790pm、800pm、810pm、820pm、830pm、840pm、850pm、860pm、870pm、880pm、890pm或900pm)。在一些实施例中,该多肽(例如,抗体或其抗原结合片段)以约44pm(例如44.4pm)的kd结合tnfr2。在某些情况下,本发明的tnfr2抗体或其抗原结合片段可以结合tnfr2来以至少约104m-1
s-1
的k
on
(并且在一些实施例中,以约3.6x105m-1
s-1
的k
on
)形成抗体-抗原复合物。例如,本发明的拮抗性tnfr2抗体或其抗原结合片段可以结合tnfr2,从而以从约1x104m-1
s-1
至约1x107m-1
s-1
的k
on
(例如,约1x104m-1
s-1
、5x104m-1
s-1
、1x105m-1
s-1
、5x105m-1
s-1
、1x106m-1
s-1
、5x106m-1
s-1
或1x107m-1
s-1
)形成抗体-抗原复合物。在一些实施例中,该抗体或其抗原结合片段可以结合tnfr2,从而以约5x106m-1
s-1
(例如,4.98x106m-1
s-1
)的k
on
形成抗体-抗原复合物。本发明的抗体或其抗原结合片段可以结合tnfr2以形成抗体-抗原复合物,其中该复合物以不大于约10-3
s-1
的k
off
解离。在一些实施例中,该复合物以不大于约10-4
s-1
的k
off
(例如,以约3.0x10-5
s-1
的k
off
)解离。例如,本发明的拮抗性tnfr2抗体或其抗原结合片段可以结合tnfr2以形成抗体-抗原复合物,其中该复合物以从约1x10-5
s-1
至约1x10-3
s-1
(例如,约1x10-5
s-1
、5x10-5
s-1
、1x10-4
s-1
、5x10-4
s-1
或1x10-3
s-1
)的k
off
解离。在一些实施例中,该抗体或其抗原结合片段结合tnfr2以形成抗体-抗原复合物,其中该复合物以不大于约2.3x10-4
s-(例如,约2x10-4
s-)的k
off
解离。在一些实施例中,该复合物以约
2.21x10-4
s-的k
off
解离。
[0098]
本发明的拮抗性tnfr2多肽(例如,抗体及其抗原结合片段)可能能够降低或抑制t-reg细胞群的增殖,并且可以任选地在tnfr2激动剂(如tnfα)的存在下进行。在一些实施例中,该抗体或其抗原结合片段能够降低或抑制表达tnfr2的癌细胞群的增殖,并且可以任选地在tnfr2激动剂(如tnfα)的存在下进行。例如,癌细胞可以是霍奇金淋巴瘤细胞、皮肤非霍奇金淋巴瘤细胞、t细胞淋巴瘤细胞、卵巢癌细胞、结肠癌细胞、多发性骨髓瘤细胞或肾细胞癌细胞。在一些实施例中,该抗体或其抗原结合片段能够降低或抑制髓源性抑制细胞群的增殖,并且可以任选地在tnfr2激动剂(如tnfα)的存在下进行。在一些实施例中,该抗体或其抗原结合片段能够选择性地降低或抑制表达cd25
高
(cd25
hi
)的t-reg细胞群(如表达cd25
高
和cd45ra
低
(cd45ra
low
)的t-reg细胞群)的增殖。例如,该抗体或其抗原结合片段能够降低表达cd25
高
和cd45ra
低
的t-reg细胞群(即,活化的t-reg细胞群,或at-reg细胞)的增殖例如1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多,该降低是相对于不表达cd25
高
和cd45ra
低
蛋白的t-reg细胞群,如表达cd25
中
(cd25
med
)和cd45ra
高
蛋白的t-reg细胞群(即,静息的t-reg细胞群,或rt-reg细胞)而言的。
[0099]
本发明的拮抗性tnfr2多肽(例如,抗体或其抗原结合片段)可以另外地与癌细胞(如肿瘤细胞)表面上的tnfr2结合。癌细胞上tnfr2的结合可以抑制或降低癌细胞的增殖或可以促进癌细胞的凋亡。
[0100]
本发明的拮抗性tnfr2多肽(如单链多肽、抗体或其抗原结合片段)还可以结合髓源性抑制细胞(mdsc;例如,表达选自下组的全部蛋白或蛋白亚组和小分子的细胞,该组由以下组成:b7-1(cd80)、b7-h1(pd-l1)、ccr2、cd1d、cd1d1、cd2、cd31(pecam-1)、cd43、cd44、补体成分c5ar1、f4/80(emr1)、fcγriii(cd16)、fcγrii(cd32)、fcγriia(cd32a)、fcγriib(cd32b)、fcγriib/c(cd32b/c)、fcγriic(cd32c)、fcγriiia(cd16a)、fcγriiib(cd16b)、半乳凝素-3、gp130、gr-1(ly-6g)、icam-1(cd54)、il-1ri、il-4rα、il-6rα、整合素α4(cd49d)、整合素αl(cd11a)、整合素αm(cd11b)、m-csfr、mgl1(cd301a)、mgl1/2(cd301a/b)、mgl2(cd301b)、一氧化氮、psgl-1(cd162)、l-选择素(cd62l)、涎免凝集素-3(cd33)、转铁蛋白受体(tfr)、vegfr1(flt-1)以及vegfr2(kdr或flk-1))表面上的tnfr2。特别地,mdsc不表达选自下组的蛋白质,该组由以下组成:b7-2(cd86)、b7-h4、cd11c、cd14、cd21、cd23(fcεrii)、cd34、cd35、cd40(tnfrsf5)、cd117(c-kit)、hla-dr以及sca-1(ly6)。mdsc上tnfr2的结合可以抑制或降低mdsc的增殖或可以促进mdsc的凋亡。
[0101]
本发明的拮抗性tnfr2多肽(如单链多肽、抗体或其抗原结合片段)可以证明在tnfr2激动剂(如tnfα)或激动性tnfr2抗体或生长促进分子(如il-2)存在下减弱t-reg和/或癌细胞增殖的能力。这些抗体或其抗原结合片段可以结合tnfr2并稳定该受体的二聚体、反平行二聚体构象并预防在nfκb信号传导期间发生的磷酸化和其他翻译后修饰。
[0102]
本发明的拮抗性tnfr2多肽(如单链多肽、抗体或其抗原结合片段)可以减少患者(如人类患者)或样品内的t-reg或癌细胞的总量(例如分离自正在经受如本文所述的癌症或传染性疾病的治疗的患者(如人类患者)的样品,相对于从未经受此类治疗的患者分离的样品,或相对于从接受该治疗之前的患者分离的样品)。
[0103]
在一些实施例中,该拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)
例如通过t-reg细胞或癌细胞(如霍奇金淋巴瘤细胞或皮肤非霍奇金淋巴瘤细胞、t细胞淋巴瘤细胞、卵巢癌细胞、结肠癌细胞、多发性骨髓瘤细胞或肾细胞癌细胞)降低tnfr2的表达。
[0104]
本发明的拮抗性tnfr2多肽(如单链多肽、抗体及其抗原结合片段)可以抑制患者(例如,人类患者)或样品(例如,从经受如本文所述的癌症或传染性疾病的治疗的人类患者分离的样品)中t-reg细胞群的增殖或减少t-reg细胞群的总量。
[0105]
本发明的特征还在于通过以下来鉴定tnfr2拮抗剂多肽(例如,单链多肽、抗体或其抗原结合片段)的方法:
[0106]
(a)将抗体或其片段的异质混合物暴露于具有seq id no:11、19、20和34-117中任一项的氨基酸序列的至少一种肽,或含有seq id no:7的位置80与130之间的约10至约30个之间的连续或不连续氨基酸的肽;并且
[0107]
(b)保留特异性结合所述肽的抗体或其片段,并去除不特异性结合所述肽的抗体或其片段,由此产生包含至少一种tnfr2拮抗剂抗体或其抗原结合片段的富集的抗体混合物。
[0108]
在一些实施例中,可以确定富集的抗体混合物中一种或多种抗体或其抗原结合片段的氨基酸序列。任选地,该多肽可以与表面结合,并且在一些实施例中,该抗体或其抗原结合片段可以在噬菌体、细菌细胞或酵母细胞的表面上表达。在替代的情况下,该抗体或其抗原结合片段被表达为与核糖体非共价结合或与mrna或cdna共价结合的一条或多条多肽链。在特定情况下,可以将该肽与可检测标记(如荧光分子、表位标签或放射性标记)缀合。在一些情况下,该荧光分子可以是绿色荧光蛋白、青色荧光蛋白、黄色荧光蛋白、红色荧光蛋白、藻红蛋白、别藻蓝蛋白、赫斯特(hoescht)、4',6-二脒基-2-苯基吲哚(dapi)、碘化丙啶、荧光素、香豆素、若丹明、四甲基若丹明或花菁。在某些实施例中,该表位标签可以是麦芽糖结合蛋白、谷胱甘肽-s-转移酶、聚组氨酸标签、flag标签、myc-标签、人流感血球凝集素(ha)标签、生物素或链霉亲和素。另外,在一些实施例中,以上步骤(a)和(b)可以顺序地重复一次或多次。
[0109]
本发明的特征还在于通过以下来产生tnfr2拮抗剂抗体或其抗原结合片段的方法:用包含seq id no:11、19、20和34-117中任一项的序列的肽或包含seq id no:7的位置80与130之间的约10至约30个之间的连续或不连续氨基酸的肽免疫非人哺乳动物,并且收集含有tnfr2拮抗剂抗体或其抗原结合片段的血清。可以免疫的示例性非人哺乳动物包括兔、小鼠、大鼠、山羊、豚鼠、仓鼠、马和绵羊。在一些实施例中,用于免疫的肽可以含有氨基酸序列kcrpg(seq id no:19)。在一些情况下,用于免疫的肽可以含有氨基酸序列caplrkcr(seq id no:11)。任选地,该肽可以含有氨基酸序列kcrpgfgv(seq id no:20)。
[0110]
本发明的特征在于通过任何上述方法产生的抗体或其抗原结合片段。在一些实施例中,该抗体或其抗原结合片段可以是单克隆抗体或其抗原结合片段、多克隆抗体或其抗原结合片段、人源化抗体或其抗原结合片段、灵长化抗体(primatized antibody)或其抗原结合片段、双特异性抗体或其抗原结合片段、多特异性抗体或其抗原结合片段、双可变免疫球蛋白结构域、单价抗体或其抗原结合片段、嵌合抗体或其抗原结合片段、单链fv分子(scfv)、双抗体、三抗体、纳米抗体、抗体样蛋白质支架、结构域抗体、fv片段、fab片段、f(ab’)2分子以及串联scfv(tafv)。在一些实施例中,该抗体或其抗原结合片段是f(ab’)2分
子。在一些实施例中,该抗体或其抗原结合片段具有选自由igg、iga、igm、igd和ige组成的组的同种型。
[0111]
在一些实施例中,本发明的抗体或其抗原结合片段可以与治疗剂如细胞毒性剂缀合。
[0112]
本发明的特征在于编码本发明的抗体或其抗原结合片段的多核苷酸,以及含有这种多核苷酸的载体。该载体可以是表达载体(如真核表达载体)或病毒载体(如腺病毒(ad,如血清型5、26、35或48腺病毒)、逆转录病毒(如γ-逆转录病毒或慢病毒)、痘病毒、腺伴随病毒、杆状病毒、单纯疱疹病毒或牛痘病毒(如改性牛痘安卡拉(mva))。本发明的特征还在于宿主细胞,如含有本发明的载体的原核细胞和真核细胞(例如哺乳动物细胞)。
[0113]
本发明的特征还在于通过以下来产生本发明的多肽(例如,单链多肽、构建体、抗体或抗原结合片段)的方法:在宿主细胞中表达编码该单链多肽、构建体、抗体或抗原结合片段的多核苷酸,并从宿主细胞培养基中回收该单链多肽、抗体或其抗原结合片段。
[0114]
本发明的特征还在于通过向需要治疗的人施用本发明的单链多肽、构建体、抗体或其抗原结合片段、多核苷酸、载体或宿主细胞来抑制由调节性t细胞介导的免疫应答的方法,以及来治疗人的细胞增殖性障碍的方法。此外,本发明的特征还在于含有本发明的单链多肽、构建体、抗体或其抗原结合片段、多核苷酸、载体或宿主细胞的组合物,用于抑制由调节性t细胞介导的免疫应答,以及用于治疗人的细胞增殖性障碍。
[0115]
在一些实施例中,细胞增殖性障碍为癌症,如白血病、淋巴瘤、肝癌、骨癌、肺癌、脑癌、膀胱癌、胃肠癌、乳腺癌、贲门癌、宫颈癌、子宫癌、头颈癌、胆囊癌、喉癌、唇癌和口腔癌、眼癌、黑素瘤、胰腺癌、前列腺癌、结直肠癌、睾丸癌或咽喉癌。在特定情况下,细胞增殖性障碍可以是选自下组的癌症,该组由以下组成:急性淋巴母细胞性白血病(all)、急性髓性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性髓性白血病(cml)、肾上腺皮质癌、aids相关性淋巴瘤、原发性cns淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎样/横纹肌样瘤、基底细胞癌、胆管癌、肝外癌、尤因肉瘤家族、骨肉瘤和恶性纤维组织细胞瘤、中枢神经系统胚胎性肿瘤、中枢神经系统生殖细胞肿瘤、颅咽管瘤、室管膜瘤、支气管肿瘤、伯基特淋巴瘤、类癌瘤、原发性淋巴瘤、脊索瘤、慢性骨髓组织增殖性赘生物、结肠癌、肝外胆管癌、原位导管癌(dcis)、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、输卵管癌、骨纤维组织细胞瘤、胃肠类癌瘤、胃肠间质瘤(gist)、睾丸生殖细胞瘤、妊娠滋养细胞疾病、神经胶质瘤、儿童脑干神经胶质瘤、毛细胞白血病、肝细胞癌、朗格汉斯细胞组织细胞增多症、霍奇金淋巴瘤、下咽癌、胰岛细胞瘤、胰腺神经内分泌肿瘤、肾母细胞瘤及其他儿童肾脏肿瘤、朗格汉斯细胞组织细胞增多症、小细胞肺癌、皮肤t细胞淋巴瘤、眼内黑色素瘤、梅克尔细胞癌、间皮瘤、转移性鳞状颈癌、中线道癌(midline tract carcinoma)、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞瘤、骨髓增生异常综合征、鼻腔和鼻窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤(nhl)、非小细胞肺癌(nsclc)、上皮性卵巢癌、生殖细胞卵巢癌、低恶性潜能卵巢癌、胰腺神经内分泌肿瘤、乳头瘤样增生、副神经节瘤、鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、胸膜肺母细胞瘤、原发性腹膜癌、直肠癌、成视网膜细胞瘤、横纹肌肉瘤、唾液腺癌、卡波西肉瘤、横纹肌肉瘤、塞扎莱综合征、小肠癌、软组织肉瘤、喉癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管的移行细胞癌、尿道癌、子宫内膜子宫癌(endometrial uterine cancer)、子宫肉瘤、阴道癌、外阴
癌以及瓦尔登斯特伦巨球蛋白血症(macroglobulinemia)。
[0116]
本发明的特征还在于通过以下来治疗霍奇金淋巴瘤或皮肤非霍奇金淋巴瘤、t细胞淋巴瘤、卵巢癌、结肠癌、多发性骨髓瘤或肾细胞癌的方法:向患者(例如,哺乳动物患者,如人类患者)施用本发明的拮抗性tnfr2多肽(例如,单链多肽、构建体、抗体或其抗原结合片段)、多核苷酸、载体或宿主细胞。例如,本发明提供了通过向患者(例如,哺乳动物患者,如人类患者)施用本发明的拮抗性tnfr2抗体或其抗原结合片段来治疗卵巢癌的方法。另外,本发明的特征在于含有本发明的单链多肽、构建体、抗体或其抗原结合片段、多核苷酸、载体或宿主细胞的组合物,用于治疗患者(例如,人类患者)的霍奇金淋巴瘤或皮肤非霍奇金淋巴瘤、t细胞淋巴瘤、卵巢癌、结肠癌、多发性骨髓瘤或肾细胞癌。
[0117]
本发明的特征还在于通过以下来治疗患者(例如,人类患者)的传染性疾病的方法:向需要治疗的人施用本发明的单链多肽、构建体、抗体或其抗原结合片段、多核苷酸、载体或宿主细胞,以及含有本发明的单链多肽、构建体、抗体或其抗原结合片段、多核苷酸、载体或宿主细胞的用于治疗患者(例如,人类患者)的传染性疾病的组合物。在一些实施例中,该传染性疾病可以由病毒、细菌、真菌或寄生虫引起。例如,可以根据本发明的方法治疗的病毒感染包括丙型肝炎病毒、黄热病病毒、卡达姆病毒、科萨努尔森林病病毒、兰加特病毒、鄂木斯克出血热病毒、玻瓦桑病毒、皇家农场病毒、喀什病毒、蜱传脑炎病毒、纽多佛病毒、索夫吉病毒、羊跳跃病病毒、根岸病毒、米班病毒、索马里兹礁病毒、秋列尼病毒、阿罗阿病毒、登革病毒、凯杜古病毒、卡西帕科利病毒、库坦戈病毒、日本脑炎病毒、墨累谷脑炎病毒、圣路易斯脑炎病毒、乌苏图病毒、西尼罗河病毒、雅温德病毒、科科贝拉病毒、巴加扎病毒、伊利乌斯病毒、以色列火鸡脑膜炎病毒、恩塔亚病毒、坦布苏病毒、齐卡病毒、班齐病毒、博博衣病毒、边山病毒、朱格拉病毒、萨沃亚病毒、赛皮克病毒、乌干达s病毒、韦塞尔斯布朗病毒、黄热病病毒、恩德培蝙蝠病毒、横须贺病毒、阿波依病毒、牛骨山脊病毒、胡蒂亚帕病毒、摩多克病毒、萨尔别霍病毒、圣帕利塔病毒、布卡拉沙蝙蝠病毒、凯里岛病毒、达卡尔蝙蝠病毒、蒙太拿鼠耳蝠脑白质炎病毒、金边蝙蝠病毒、里约布拉沃病毒、塔马纳蝙蝠病毒、细胞融合剂病毒、伊皮病毒、拉沙病毒、淋巴细胞性脉络丛脑膜炎病毒(lcmv)、莫巴拉病毒、莫佩亚病毒、阿马帕里病毒、弗莱克索病毒、瓜纳里托病毒、胡宁病毒、拉蒂诺病毒、马邱波病毒、奥利华斯病毒、巴拉那病毒、皮钦德病毒、皮里陶病毒、萨比亚病毒、塔卡里伯病毒、太米阿米病毒、怀特沃特阿罗约病毒、查帕雷病毒、卢约病毒、汉坦病毒、辛诺柏病毒、道格比病毒、布尼奥罗病毒、裂谷热病毒、拉克罗斯病毒、加利福尼亚脑炎病毒、刚果出血热(cchf)病毒、埃博拉病毒、马尔堡病毒、委内瑞拉马脑炎病毒(vee)、东方马脑炎病毒(eee)、西方马脑炎病毒(wee)、辛德毕斯病毒、风疹病毒、塞姆利基森林病毒、罗斯河病毒、巴马森林病毒、奥奈氏病毒和基孔肯亚病毒、天花病毒、猴痘病毒、牛痘病毒、单纯疱疹病毒、人疱疹病毒、巨细胞病毒(cmv)、eb病毒(ebv)、水痘带状疱疹病毒、卡波希氏瘤相关疱疹病毒(kshv)、流感病毒、严重急性呼吸综合征(sars)病毒、狂犬病病毒、水泡性口炎病毒(vsv)、人呼吸道合胞病毒(rsv)、新城疫病毒、亨德拉病毒、尼帕病毒、麻疹病毒、牛瘟病毒、犬瘟热病毒、仙台病毒、人副流感病毒(例如,1、2、3和4)、鼻病毒、腮腺炎病毒、脊髓灰质炎病毒、人肠道病毒(a、b、c和d)、甲型肝炎病毒、柯萨奇病毒、乙型肝炎病毒、人乳头状瘤病毒、腺相关病毒、星状病毒、jc病毒、bk病毒、sv40病毒、诺沃克病毒、轮状病毒、人类免疫缺陷病毒(hiv)、i型和ii型人t-淋巴细胞病毒以及传染性海绵状脑病(如慢性消耗病)。
[0118]
在一些实施例中,可以根据本发明的方法治疗的细菌感染包括由属于选自下组的属的细菌引起的那些,该组由以下组成:沙门氏菌属、链球菌属、芽孢杆菌属、李斯特菌属、棒状杆菌属、诺卡氏菌属、奈瑟氏菌属、放线菌、莫拉氏菌属、enterobacteriacece(例如,大肠杆菌,如o157:h7)、假单胞菌属、埃希氏菌属、克雷伯菌属、沙雷氏菌属、肠杆菌属、变形杆菌属、沙门氏菌属、志贺氏菌属、耶尔森菌属、嗜血杆菌属、博德特菌属、军团菌属、巴氏杆菌属、弗朗西斯氏菌属、布鲁氏菌属、巴尔通氏体属、梭菌属、弧菌属、弯曲杆菌属以及葡萄球菌属。另外,可以根据本发明的方法治疗的寄生虫感染包括由以下各项引起的那些:痢疾内变形虫、兰伯贾第虫、鼠隐孢子虫(cryptosporidium muris)、冈比亚锥虫、罗德西亚锥虫、克鲁兹锥虫、墨西哥利什曼原虫、巴西利什曼原虫、热带利什曼原虫、杜氏利什曼原虫、弓形虫、间日疟原虫、卵形疟原虫、三日疟原虫、恶性疟原虫、阴道毛滴虫和组织滴虫(histomonas meleagridis)。示例性的蠕虫寄生虫包括毛首鞭形线虫、蛔虫、蛲虫、十二指肠钩虫、美洲板口线虫(necator americanus)、粪类圆线虫、斑氏线虫和麦地那龙线虫、曼氏裂体吸虫、埃及裂体吸虫、日本裂体吸虫、肝片吸虫、大片吸虫(fasciola gigantica)、异形吸虫属(heterophyes)、卫氏并殖吸虫(paragonimus westermani)、猪肉绦虫、牛肉绦虫、短膜壳绦虫或细粒棘球绦虫。
[0119]
本发明的特征还在于试剂盒,如含有本发明的单链多肽、构建体、抗体或抗原结合片段(例如,拮抗剂tnfr2抗体)、本发明的多核苷酸、本发明的载体或本发明的宿主细胞的试剂盒。在一些情况下,本发明的试剂盒可以含有用于将本发明的载体转染到本发明的宿主细胞中的说明书。任选地,试剂盒可以含有用于在本发明的宿主细胞中表达本发明的单链多肽、构建体、抗体或抗原结合片段的说明书(以及任选地,可以使用的试剂)。本发明的试剂盒还可以含有用于向人类患者施用本发明的抗体或抗原结合片段、本发明的多核苷酸、本发明的载体或本发明的宿主细胞的说明书。任选地,试剂盒可以含有用于制造或使用本发明的抗体或抗原结合片段、本发明的多核苷酸、本发明的载体或本发明的宿主细胞的说明书。
[0120]
另外地,本发明的特征在于以反平行二聚体构象特异性结合肿瘤坏死因子受体超家族(tnfrs)成员的多肽(例如,单链多肽、抗体或其抗原结合片段)。该多肽(例如,单链多肽、抗体或其抗原结合片段)可以任选地含有非天然恒定区。例如,该单链多肽、抗体或其抗原结合片段可以例如在tnfrs成员激动剂(如同源tnfrs成员配体)存在下抑制tnfrs成员的三聚化。该单链多肽、抗体或其抗原结合片段可以抑制细胞(如真核细胞(例如,哺乳动物细胞,如人或牛细胞))中的nfκb信号传导。在一些实施例中,该单链多肽、抗体或其抗原结合片段降低或抑制选自下组的一个或多个基因的表达,该组由以下组成:chuk、nfkbie、nfkbia、map3k11、traf2、traf3、relb和ciap2/birc3。该tnfrs成员可以例如选自下组,该组由以下组成:tnfr1、tnfr2、fas、dcr3、dr3、trail-r1(dr4)、trail-r2(dr5)、trail-r3、trail-r4、dr6、edar、cd271、opg、rank、ltβr、tweak-r、hvem、cd27、cd30、cd40、cd137、ox40、gitr、bcma、taci、baffr、edar2、troy和relt。例如,本发明的多肽(例如,单链多肽、抗体或其抗原结合片段)能以反平行二聚体构象结合tnfr2,例如由此阻止tnfα介导的三聚化和这种受体的活化。
[0121]
另外地,本发明的特征是通过以下来治疗患者(例如人类患者)中通过tnfrs成员的信号转导介导的疾病的方法:向人施用以如上所述的反平行二聚体构象特异性结合
tnfr2成员的单链多肽、抗体或其抗原结合片段。此外,该方法的特征在于包含以反平行二聚体构象特异性结合tnfrs成员的单链多肽、抗体或其抗原结合片段的组合物,用于治疗患者(例如人类患者)中由通过tnfrs成员的信号传导介导的疾病。在一些实施例中,该tnfrs成员是tnfr1、tnfr2、fas、dcr3、dr3、trail-r1(dr4)、trail-r2(dr5)、trail-r3、trail-r4、dr6、edar、cd271、opg、rank、ltβr、tweak-r、hvem、cd27、cd30、cd40、cd137、ox40、gitr、bcma、taci、baffr、edar2、troy或relt。在一些实施例中,该tnfrs成员是tnfr2。由通过tnfrs成员(如tnfr2)的信号传导介导的疾病可以是癌症。例如,所述癌症可以是霍奇金淋巴瘤、皮肤非霍奇金淋巴瘤、t细胞淋巴瘤、卵巢癌、结肠癌、多发性骨髓瘤或肾细胞癌。
[0122]
定义
[0123]
如本文所使用的,术语“约”是指在所描述的值以上或以下不超过10%的值。例如,术语“约5nm”表示从4.5nm至5.5nm的范围。
[0124]
如本文所使用的,术语“抗体”(ab)是指与特定抗原特异性结合或具有免疫反应性的免疫球蛋白分子,并且包括抗体的多克隆、单克隆、基因工程化和其他修饰形式(包括但不限于嵌合抗体,人源化抗体,异源偶联抗体(例如,双特异性、三特异性和四特异性抗体,双抗体,三抗体和四抗体))以及抗体的抗原结合片段(包括例如fab'、f(ab')2、fab、fv、rigg和scfv片段)。此外,除非另有说明,否则术语“单克隆抗体”(mab)意指包括能够特异性结合靶蛋白的完整分子以及抗体片段(例如像,fab和f(ab')2片段)。fab和f(ab')2片段缺少完整抗体的fc片段(从动物循环中更快地清除),并且可以具有比完整抗体更少的非特异性组织结合(参见wahl等人,j.nucl.med.[核医学杂志]24:316,1983;将其通过引用结合在此)。
[0125]
如本文所使用的,术语“抗原结合片段”是指保留特异性结合靶抗原的能力的一个或多个抗体片段。抗体的抗原结合功能可以由全长抗体的片段执行。抗体片段可以是fab、f(ab’)2、scfv、smip、双抗体、三抗体、亲和体、纳米抗体、适体或结构域抗体。涵盖术语抗体的“抗原结合片段”的结合片段的实例包括但不限于:(i)fab片段,一种由v
l
、vh、c
l
和ch1结构域组成的单价片段;(ii)f(ab')2片段,一种包含由二硫键在铰链区连接的两个fab片段的双价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的v
l
和vh结构域组成的fv片段,(v)包含vh和v
l
结构域的dab;(vi)由vh结构域组成的dab片段(ward等人,nature[自然]341:544-546,1989);(vii)由vh或v
l
结构域组成的dab;(viii)分离的互补决定区(cdr);以及(ix)两个或更多个分离的cdr的组合,所述cdr可以任选地由合成接头连接。此外,虽然fv片段的两个结构域v
l
和vh是通过独立的基因编码的,但是这两个结构域可以使用重组方法通过接头接合,该接头能够使其制成其中v
l
和vh区配对以形成单价分子的单蛋白质链(称为单链fv(scfv);参见,例如,bird等人,science[科学]242:423-426,1988,以及huston等人,proc.natl.acad.sci.usa[美国国家科学院院刊]85:5879-5883,1988)。这些抗体片段可以使用本领域技术人员已知的常规技术获得,并且这些片段被筛选用于与完整抗体相同的方式使用。可以通过重组dna技术、完整免疫球蛋白的酶促或化学裂解,或在一些实施例中通过本领域已知的化学肽合成程序来产生抗原结合片段。
[0126]
如本文所使用的,术语“抗-肿瘤坏死因子受体2抗体”、“tnfr2抗体”、“抗-tnfr2抗体部分”和/或“抗-tnfr2抗体片段”等包括任何包含能够特异性结合tnfr2的免疫球蛋白分子的至少一部分(例如但不限于重链或轻链的至少一个互补决定区(cdr)或其配体结合部
分、重链或轻链可变区、重链或轻链恒定区、框架区或其任何部分)的含蛋白质或肽的分子。tnfr2抗体还包括抗体样蛋白支架(如第十纤连蛋白iii型结构域(
10
fn3)),其含有与抗体cdr在结构和溶剂可及性上相似的bc、de和fg结构环。
10
fn3结构域的三级结构类似于igg重链可变区的三级结构,并且通过将
10
fn3的bc、de和fg环的残基用来自tnfr2单克隆抗体的cdr-h1、cdr-h2或cdr-h3区的残基替换,本领域技术人员可以将例如tnfr2单克隆抗体的cdr接枝到纤连蛋白支架上。
[0127]
如本文所所用的,术语“拮抗剂tnfr2抗体”和“拮抗性tnfr2抗体”是指能够抑制或减少tnfr2的活化和/或减弱由tnfr2介导的一种或多种信号转导途径的tnfr2抗体。例如,拮抗性tnfr2抗体可以抑制或减少调节性t细胞群的生长和增殖。拮抗性tnfr2抗体可以通过阻断tnfr2结合tnfα来抑制或减少tnfr2活化。以此方式,拮抗性tnfr2抗体可以阻断tnfr2的三聚化,否则这种三聚化会被与tnfα相互作用所诱导,从而导致tnfr2活性的抑制。
[0128]
如本文所所用的,术语“双特异性抗体”是指对至少两种不同的抗原具有结合特异性的单克隆的,通常是人或人源化的抗体。在本发明中,结合特异性之一可以针对tnfr2而被检测,另一个可以针对任何其他抗原,例如针对细胞表面蛋白、受体、受体亚基、组织特异性抗原、病毒衍生的蛋白、病毒编码的包膜蛋白、细菌衍生蛋白或细菌表面蛋白等而被检测。
[0129]
如本文所使用的,术语“嵌合”抗体是指以下抗体,其具有源自一种来源生物(如大鼠或小鼠)的免疫球蛋白的可变序列以及源自不同生物体(例如,人)的免疫球蛋白的恒定区。用于生产嵌合抗体的方法是本领域已知的。参见,例如,morrison,1985,science[科学]229(4719):1202-7;oi等人,1986,biotechniques[生物技术]4:214-221;gillies等人,1985,j.immunol.methods[免疫学方法杂志]125:191-202;美国专利号5,807,715、4,816,567和4,816,397;通过引用结合在此。
[0130]
如本文所使用的,术语“互补决定区”(cdr)指在轻链和重链可变结构域中均发现的高变区。可变结构域的更高保守性的部分称为框架区(fr)。如本领域所理解的,描绘抗体的高变区的氨基酸位置可以根据上下文和本领域已知的各种定义而变化。可变结构域内的一些位置可以被视为杂合高变位置,因为这些位置可以被认为是在一组标准下的高变区之内,而被认为在不同组的标准下的高变区之外。这些位置中的一个或多个也可以在延伸的高变区中找到。本发明包括在这些杂合高变的位置中包含修饰的抗体。天然重链和轻链的可变结构域各自包含主要采用β-片层构型的四个框架区,其通过三个cdr连接,这三个cdr形成连接β-片层结构的环,并且在一些情况下形成β-片层结构的一部分。每条链中的cdr通过fr区按顺序fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4紧密保持在一起,并且与来自其他抗体链的cdr促成了抗体的靶结合位点的形成(参见kabat等人,sequences of proteins of immunological interest,national institute of health,bethesda,md.1987[具有免疫学兴趣的蛋白的序列,国立卫生研究院,贝塞斯达,马里兰州,1987];通过引用结合在此)。如本文所使用的,除非另有说明,根据kabat等人的免疫球蛋白氨基酸残基编号系统进行免疫球蛋白氨基酸残基的编号。
[0131]
如本文所使用的,术语“保守性突变”、“保守性取代”或“保守性氨基酸取代”是指将一个或多个氨基酸置换为表现出相似物理化学性质(如极性、静电荷和空间体积)的一个或多个不同氨基酸。对于下表1中的二十种天然存在的氨基酸中的每一种,总结了以下这些
性质。
[0132]
表1.天然存在的氨基酸的代表性物理化学性质
[0133][0134][0135]
从该表应理解,保守氨基酸家族包括(i)g、a、v、l和i;(ii)d和e;(iii)c、s和t;(iv)h、k和r;(v)n和q;以及(vi)f、y和w。因此,保守性突变或取代是将一个氨基酸用相同氨基酸家族的一个成员取代(例如,ser取代thr或lys取代arg)。
[0136]
如本文所使用的,术语“缀合物”是指通过一个分子的反应性官能团与另一个分子的适当反应性官能团进行化学键合而形成的化合物。
[0137]
如本文所使用的,术语“衍生抗体”是指通过化学反应而被修饰以便切割残基或向分离的抗体添加非天然化学部分的抗体。衍生抗体可以通过糖基化、乙酰化、聚乙二醇化、磷酸化、酰胺化、通过添加已知的化学保护/阻断基团衍生化、蛋白水解裂解、连接到细胞配
体或其他蛋白而获得。多种化学修饰中的任一种可以通过已知的技术(包括但不限于特定化学裂解、乙酰化、衣霉素的代谢合成等)使用已建立的程序来进行。此外,衍生物可以例如使用琥珀阻抑技术以包含一个或多个非天然氨基酸(参见,例如,美国专利号6,964,859;通过引用结合在此)。
[0138]
如本文所使用的,术语“双抗体”是指包含两条多肽链的二价抗体,其中每条多肽链包括通过接头接合的vh和v
l
结构域,所述接头太短(例如,由五个氨基酸组成的接头)而不允许vh和v
l
结构域在同一肽链上进行分子内缔合。这种配置迫使每个结构域与另一条多肽链上的互补结构域配对,从而形成同源二聚体结构。因此,术语“三抗体”是指包含三条肽链的三价抗体,每一条肽链含有通过接头接合的一个vh结构域和一个vl结构域,所述接头极其短(例如,由1-2个氨基酸组成的接头)而不允许vh和vl结构域在同一肽链上进行分子内缔合。为了折叠成其天然结构,以这种方式配置的肽典型地三聚化从而将相邻肽链的vh和vl结构域在空间上彼此邻近地安置以允许适当的折叠(参见holliger等人,proc.natl.acad.sci.usa[美国国家科学院院刊]90:6444-48,1993;通过引用结合在此)。
[0139]
如本文所使用的,tnfr2的“显性拮抗剂(dominant antagonist)”是即使在tnfr2激动剂(如tnfα或il-2)存在下也能够抑制tnfr2活化的拮抗剂(例如,拮抗性多肽,如单链多肽、抗体或其抗原结合片段)。例如,如果在tnfr2激动剂(例如,tnfα或il-2)存在下拮抗剂的ic
50
相对于在不存在tnfr2激动剂(如tnfα或il-2)下的相同测定中测量的拮抗剂的ic
50
增加小于200%(例如,小于200%、100%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、1%或更少),则tnfr2拮抗剂是显性拮抗剂。可以通过测量对tnfr2+细胞(如t-reg细胞、表达tnfr2的癌细胞或髓源性抑制细胞)群的增殖的抑制,以及通过测量对nfκb信号传导的抑制来评估对tnfr2活化的抑制(例如,通过监测选自下组的一种或多种基因在常规基因表达测定中的表达的降低,该组由以下组成:chuk、nfkbie、nfkbia、map3k11、traf2、traf3、relb和ciap2/birc3)。本文(例如分别在实例9和12中)描述了可以用于监测tnfr2活化的细胞增殖测定和基因表达测定。
[0140]
如本文所使用的,“双重可变域免疫球蛋白”(“dvd-ig”)是指经由接头组合两种单克隆抗体的靶结合可变结构域以产生四价双重靶向单药剂抗体。(gu等人,meth.enzymol.[酶学方法],502:25-41,2012;通过引用并入本文)。用于本发明的dvd的轻链中的适合的接头包括在gu等人的第30页上的表2.1中鉴定的那些:短的k链接头adaap(seq id no:118)(鼠)和tvaap(seq id no:119)(人);长的κ链接头adaaptvsifp(seq id no:120)(鼠)和tvaapsvfifpp(seq id no:121)(人);短的λ链接头qpkaap(seq id no:122)(人);长的λ链接头qpkaapsvtlfpp(seq id no:123)(人);短-gs接头ggsgg(seq id no:124)、中-gs接头ggsggggsg(seq id no:125)以及长-gs接头ggsggggsggggs(seq id no:126)(全部gs接头都是鼠或人的)。用于dvd的重链中的适合的接头包括在gu & ghayur,2012,methods in enzymology[酶学方法]502:25-41(通过引用并入本文)的第30页上的表2.1中鉴定的那些:短的接头akttap(seq id no:127)(鼠)和astkgp(seq id no:128)(人);长的接头akttapsvyplap(seq id no:129)(鼠)和astkgpsvfplap(seq id no:130)(人);短-gs接头ggggsg(seq id no:131)、中-gs接头ggggsggggs(seq id no:132)以及长-gs接头ggggsggggsgggg(seq id no:133)(全部gs接头都是鼠或人的)。
[0141]
如本文所使用的,术语“内源的”描述在特定生物体(例如,人)中或在生物体内的
特定位置(例如,器官、组织、或细胞,如人类细胞)中天然发现的分子(例如,多肽、核酸或辅因子)。
[0142]
如本文所使用的,术语“外源的”描述在特定生物体(例如,人)中或在生物体内的特定位置(例如,器官、组织、或细胞,如人类细胞)中未天然发现的分子(例如,多肽、核酸或辅因子)。外源性材料包括从外部来源提供给生物体或从其提取的培养物质的那些外源性材料。
[0143]
如本文所使用的,术语“框架区”或“fw区”包括与cdr相邻的氨基酸残基。fw区残基可以存在于例如以下中:人抗体、啮齿动物来源的抗体(例如,鼠抗体)、人源化抗体、灵长化抗体、嵌合抗体、抗体片段(例如,fab片段)、单链抗体片段(例如,scfv片段)、抗体结构域以及双特异性抗体等等。
[0144]
如本文所使用的,术语“融合蛋白”是指经由共价键与另一分子连接的蛋白质。可以通过例如一种蛋白质的n-末端与另一种蛋白质的c-末端之间的酰胺键形成反应来化学合成融合蛋白。可替代地,可以通过例如由载体或细胞的基因组表达编码融合蛋白的多核苷酸,在细胞(例如,真核细胞或原核细胞)中重组表达含有与一种蛋白共价结合的另一种蛋白的融合蛋白。融合蛋白可以含有与接头共价结合的蛋白质,而接头又与另一个分子共价结合。可以用于形成融合蛋白的接头的实例包括含有肽的接头,如含有天然存在或非天然存在的氨基酸的那些接头。在一些实施例中,希望在接头中包含d-氨基酸,因为这些残基不存在于天然存在的蛋白质中并且因此对被内源性蛋白酶降解更具抗性。可以使用本领域熟知的各种策略并且取决于接头的反应性组分来制备接头,可以通过酶水解、光解、酸性条件下的水解、碱性条件下的水解、氧化、二硫键还原、亲核切割或有机金属切割来切割接头(leriche等人,bioorg.med.chem.[生物有机化学与医药化学],20:571-582,2012]。
[0145]
如本文所所用的,术语“异种特异性抗体”是指对至少两种不同的抗原具有结合特异性的单克隆的,优选地是人或人源化的抗体。传统上,异种特异性抗体的重组生产基于两个免疫球蛋白重链-轻链对的共表达,其中这两条重链具有不同的特异性(milstein等人,nature[自然]305:537,1983)。类似的方法例如披露于wo 93/08829;美国专利号6,210,668、6,193,967、6,132,992、6,106,833、6,060,285、6,037,453、6,010,902、5,989,530、5,959,084、5,959,083、5,932,448、5,833,985、5,821,333、5,807,706、5,643,759、5,601,819、5,582,996、5,496,549、4,676,980;wo 91/00360;wo 92/00373;ep 03089;traunecker等人,embo j.[欧洲分子生物学学会杂志]10:3655(1991);suresh等人,methods in enzymology[酶学方法]121:210(1986);通过引用结合在此。异种特异性抗体可以包括在多特异性抗体中加强正确链缔合的fc突变,如通过klein等人,mabs 4(6):653-663,2012所描述的;通过引用结合在此。
[0146]
如本文所使用的,术语“人抗体”是指其中在人类中基本上蛋白质的每个部分(例如,cdr,框架,c
l
,ch结构域(例如ch1、ch2、ch3),铰链,(v
l
,vh))实质上都是非免疫原性的抗体,只有很小的序列变化或变异。(例如,通过重组表达),或者通过能够功能性地表达重排的人免疫球蛋白(例如,重链和/或轻链)基因的非人动物或原核或真核细胞,可以在人细胞中产生人抗体。此外,当人抗体是单链抗体时,其可以包括没有在天然人抗体中发现的接头肽。例如,fv可以包含接头肽,如两个至约八个甘氨酸或其他氨基酸残基,该接头肽连接重链的可变区和轻链的可变区。这种接头肽被认为是人类来源的。人抗体可以通过在本领域
中已知的多种方法来制造,包括使用衍生自人免疫球蛋白序列的抗体文库的噬菌体展示方法。参见美国专利号4,444,887以及4,716,111;以及pct公开wo 1998/46645、wo 1998/50433;wo 1998/24893;wo 1998/16654;wo 1996/34096;wo 1996/33735;以及wo 1991/10741;通过引用结合在此。人抗体还可以使用转基因小鼠来产生,这些转基因小鼠不能表达功能内源性免疫球蛋白,但是可以表达人免疫球蛋白基因。参见,例如pct公开wo 98/24893;wo 92/01047;wo 96/34096;wo 96/33735;美国专利号5,413,923;5,625,126;5,633,425;5,569,825;5,661,016;5,545,806;5,814,318;5,885,793;5,916,771;以及5,939,598;通过引用并入本文)。
[0147]
如本文所使用的,术语“人源化”抗体是指嵌合免疫球蛋白、免疫球蛋白链或其片段(如fv、fab、fab'、f(ab')2或抗体的其他靶结合的亚结构域)的非人(例如,鼠)抗体形式,其含有衍生于非人免疫球蛋白的最小序列。通常,人源化抗体将包含基本上全部的至少一个以及典型地两个可变结构域,其中全部或基本上全部cdr区对应于非人免疫球蛋白中的那些。全部或基本上全部的fr区还可以是人免疫球蛋白序列中的那些。人源化抗体还可以包含免疫球蛋白恒定区(fc)的至少一部分,典型地是人免疫球蛋白共有序列的一部分。抗体人源化的方法是本领域已知的。参见,例如,riechmann等人,nature[自然]332:323-7,1988;美国专利号5,530,101;5,585,089;5,693,761;5,693,762;以及6,180,370至queen等人;ep 239400;pct公开wo 91/09967;美国专利号5,225,539;ep 592106;以及ep 519596;通过引用结合在此。
[0148]
如本文所使用的,术语“疏水性侧链”是指由于例如存在于侧链内的化学部分的空间或电子特性而在水中相对表现出低溶解度的氨基酸侧链。含有疏水性侧链的氨基酸的实例包括含有不饱和脂肪族烃的那些,如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸和甲硫氨酸,以及含有在生理ph下为静电中性的芳族环系统的氨基酸,如色氨酸、苯丙氨酸和酪氨酸。
[0149]
如本文所使用的,术语“单克隆抗体”是指来源于单个克隆(包括任何真核、原核、或噬菌体克隆)的抗体,而不是产生其的方法。
[0150]
如本文所使用的,术语“多特异性抗体”是指对多于一种靶抗原表现出亲和性的抗体。多特异性抗体可以具有与全免疫球蛋白分子相似的结构,并且包括fc区,例如iggfc区。这样的结构可以包括但不限于igg-fv、igg-(scfv)2、dvd-ig、(scfv)
2-(scfv)
2-fc和(scfv)
2-fc-(scfv)2。在igg-(scfv)2的情况下,scfv可以连接到重链或轻链的n-末端或c-末端。kontermann,2012,mabs[单克隆抗体]4(2):182-197;yazaki等人,2013,protein engineering,design & selection[蛋白质工程、设计与选择]26(3):187-193;以及grote等人,2012,proetzel和ebersbach(编辑),antibody methods and protocols,methods in molecular biology[抗体方法和工具,分子生物学方法]第901卷,章16:247-263(通过引用结合在此)已经综述了包含fc区并且抗tnfr2抗体或其抗原结合片段可以掺入其中的示例性多特异性分子。在一些实施例中,基于igg或dvd或scfv的片段,抗体片段可以是没有fc区的多特异性分子的组分。缺少fc区且抗体或抗体片段可以掺入其中的示例性多特异性分子包括scfv二聚体(双抗体)、三聚体(三抗体)和四聚体(四抗体),fab二聚体(通过粘附性多肽或蛋白质结构域而缀合)和fab三聚体(化学共轭的);并且描述于hudson和souriau,2003,nature medicine[自然医学]9:129-134中;通过引用结合在此。
[0151]
如本文所使用的,术语“髓源性抑制细胞”或“mdsc”是指调节多种效应细胞和抗原呈递细胞(如t细胞、nk细胞、树突细胞以及巨噬细胞等等)的活性的免疫系统的细胞。髓源性抑制细胞通过其基因表达谱来区分,并且表达选自下组的全部或一部分蛋白质和小分子,该组由以下组成:b7-1(cd80)、b7-h1(pd-l1)、ccr2、cd1d、cd1d1、cd2、cd31(pecam-1)、cd43、cd44、补体成分c5ar1、f4/80(emr1)、fcγriii(cd16)、fcγrii(cd32)、fcγriia(cd32a)、fcγriib(cd32b)、fcγriib/c(cd32b/c)、fcγriic(cd32c)、fcγriiia(cd16a)、fcγriiib(cd16b)、半乳凝素-3、gp130、gr-1(ly-6g)、icam-1(cd54)、il-1ri、il-4rα、il-6rα、整合素α4(cd49d)、整合素αl(cd11a)、整合素αm(cd11b)、m-csfr、mgl1(cd301a)、mgl1/2(cd301a/b)、mgl2(cd301b)、一氧化氮、psgl-1(cd162)、l-选择素(cd62l)、涎免凝集素-3(cd33)、转铁蛋白受体(tfr)、vegfr1(flt-1)以及vegfr2(kdr或flk-1)。特别地,mdsc不表达选自下组的蛋白质,该组由以下组成:b7-2(cd86)、b7-h4、cd11c、cd14、cd21、cd23(fcεrii)、cd34、cd35、cd40(tnfrsf5)、cd117(c-kit)、hla-dr以及sca-1(ly6)。
[0152]
如本文所使用的,术语“中性tnfr2多肽”是指结合tnfr2的多肽(如单链多肽、抗体或抗体片段),并且不对tnfr2活化发挥拮抗或激动作用。例如,例如像通过测量表达tnfr2的细胞群(例如,t-reg细胞、tnfr2+癌细胞和/或mdsc)的增殖,和/或通过测量一种或多种nfκb靶基因(如chuk、nfkbie、nfkbia、map3k11、traf2、traf3、relb和/或ciap2/birc3)的表达所评估的,如果该多肽结合tnfr2并且既不增强也不抑制tnfr2活化,则tnfr2多肽是中性tnfr2多肽。例如分别在实例9和12中描述了用于测量细胞增殖和基因表达的示例性测定。
[0153]
如本文所使用的,术语“非天然恒定区”是指源自不同于抗体可变区的来源的抗体恒定区,或者是具有不同于天然抗体恒定区序列的氨基序列的人为产生的合成多肽的抗体恒定区。例如,含有非天然恒定区的抗体可以具有源自非人来源(例如,小鼠、大鼠或兔)的可变区和源自人来源的恒定区(例如,人抗体恒定区)。
[0154]
如本文所使用的,术语“百分比(%)序列同一性”是指在为达到最大百分比序列同一性而比对序列和引入空位(如果需要的话)(例如,为了最佳比对,可以在候选和参比序列中的一个或两个中引入空位,并且出于比较的目的,可以忽略非同源序列)之后,候选序列的氨基酸(或核酸)残基与参比序列的氨基酸(或核酸)残基相同的百分比。出于确定百分比序列同一性的目的,可以用本领域技术中的多种方式来实现比对,例如使用公众可得的计算机软件,如blast、align或megalign(dnastar)软件。本领域技术人员可以确定用于测量比对的适当参数,包括需要在被比较序列的全长范围实现最大比对的任何算法。例如,用于与候选序列进行比较而比对的参比序列可以显示候选序列在候选序列的全长或候选序列的连续氨基酸(或核酸)残基的选定部分上表现出从50%至100%的序列同一性。出于比较目的而比对的候选序列的长度可以是例如参比序列的长度的至少30%(例如30%、40%、50%、60%、70%、80%、90%或100%)。当候选序列中的位置被与在参比序列中的相应位置相同的氨基酸残基占据时,则这些分子在那个位置是相同的。
[0155]
如本文所使用的,术语“灵长化抗体”是指包含来自灵长类动物来源的抗体的框架区和来自非灵长类动物来源的抗体的其他区域(如cdr和恒定区)的抗体。用于生产灵长化抗体的方法是本领域已知的。参见,例如美国专利号5,658,570;5,681,722;以及5,693,780;通过引用结合在此。
[0156]
如本文所使用的,在多核苷酸片段的背景下的术语“有效地连接”旨在是指两个多
核苷酸片段被连接,使得由这两个多核苷酸片段编码的氨基酸序列保留在框架内。
[0157]
如本文所使用的,术语“药代动力学特征”是指在将药物给予患者后药物随时间的吸收、分布、代谢和清除。
[0158]
如本文所使用的,tnfr2的“隐性拮抗剂(recessive antagonist)”是在tnfr2激动剂(如tnfα或il-2)存在下抑制tnfr2活化至显著更低的程度的拮抗剂(例如,拮抗性多肽,如单链多肽、抗体或其抗原结合片段),这是相对于如在不存在tnfr2激动剂(如tnfα或il-2)下测量的相同拮抗剂的抑制程度而言的。例如,如果在tnfr2激动剂(例如,tnfα)或il-2存在下拮抗剂的ic
50
相对于在不存在tnfr2激动剂(如tnfα或il-2)下的相同测定中测量的拮抗剂的ic
50
增加例如10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多,则tnfr2拮抗剂是隐性拮抗剂。可以通过测量对tnfr2+细胞(如t-reg细胞、表达tnfr2的癌细胞或髓源性抑制细胞)群的增殖的抑制,以及通过测量对nfκb信号传导的抑制来评估对tnfr2活化的抑制(例如,通过监测选自下组的一种或多种基因在常规基因表达测定中的表达的降低,该组由以下组成:chuk、nfkbie、nfkbia、map3k11、traf2、traf3、relb和ciap2/birc3)。本文(例如分别在实例9和12中)描述了可以用于监测tnfr2活化的细胞增殖测定和基因表达测定。
[0159]
如本文所使用的,术语“调控序列”包括控制抗体链基因的转录或翻译的启动子、增强子和其他表达控制元件(例如,聚腺苷酸化信号)。这样的调控序列例如描述于goeddel,gene expression technology:methods in enzymology 185(academic press,san diego,ca,1990)[基因表达技术:酶学方法185(学术出版社,加利福尼亚州圣迭哥),1990];通过引用结合在此。
[0160]
如本文所使用的,术语“scfv”是指单链fv抗体,其中来自抗体的重链和轻链的可变结构域已经连接形成一条链。scfv片段含有单一多肽链,该单一多肽链包含由接头分开的抗体轻链的可变区(vl)(例如,cdr-l1、cdr-l2和/或cdr-l3)和抗体重链的可变区(vh)(例如,cdr-h1、cdr-h2和/或cdr-h3)。连接scfv片段的vl和vh区的接头可以是由蛋白原氨基酸组成的肽接头。可以使用替代性接头以增加scfv片段对蛋白水解降解的抗性(例如,含有d-氨基酸的接头),目的是增强scfv片段的溶解性(例如,亲水接头,如含聚乙二醇的接头或含有重复的甘氨酸和丝氨酸残基的多肽),以改善分子的生物物理稳定性(例如,含有形成分子内或分子间二硫键的半胱氨酸残基的接头),或减弱scfv片段的免疫原性(例如,含有糖基化位点的接头)。scfv分子是本领域已知的并描述于例如以下各项中:us专利5,892,019,flo等人,(gene[基因]77:51,1989);bird等人,(science[科学]242:423,1988);pantoliano等人,(biochemistry[生物化学]30:10117,1991);milenic等人,(cancer research[癌症研究]51:6363,1991);以及takkinen等人,(protein engineering[蛋白质工程]4:837,1991)。scfv分子的vl和vh结构域可以来源于一个或多个抗体分子。本领域普通技术人员还将理解,本发明的scfv分子的可变区可以被修饰,使得它们在氨基酸序列上与它们所源自的抗体分子不同。例如,在一个实施例中,可以进行导致氨基酸残基处的保守取代或改变的核苷酸或氨基酸取代(例如,在cdr和/或框架残基中)。可替代地或另外,使用本领域认可的技术对cdr氨基酸残基进行突变以优化抗原结合。scfv片段例如描述于wo 2011/084714中;通过引用结合在此。
[0161]
如本文所使用的,短语“特异性结合”是指结合反应,其决定抗原在蛋白质和其他
生物分子的异质群体中的存在,所述蛋白质和其他生物分子例如由抗体或其抗原结合片段特殊识别。与抗原特异性结合的抗体或其抗原结合片段将以小于100nm的kd与抗原结合。例如,与抗原特异性结合的抗体或其抗原结合片段将以高达100nm(例如,1pm至100nm之间)的kd与抗原结合。不显示与特定抗原或其表位特异性结合的抗体或其抗原结合片段将显示对该特定抗原或其表位的大于100nm(例如,大于500nm、1μm、100μm、500μm或1mm)的kd。可以使用多种免疫测定方式来选择与特定蛋白或碳水化合物进行特异性免疫反应的抗体。例如,常规地使用固相elisa免疫测定法来选择与蛋白质或碳水化合物进行特异性免疫反应的抗体。参见,harlow & lane,antibodies,a laboratory manual,cold spring harbor press,new york(1988)[抗体,实验室手册,冷泉港出版社,纽约(1988)]以及harlow & lane,using antibodies,a laboratory manual,cold spring harbor press,new york(1999)[使用抗体,实验室手册,冷泉港出版社,纽约(1999)],其描述了可以用于确定特异免疫反应性的免疫测定方式和条件。
[0162]
如本文所使用的,术语“受试者”和“患者”是指接受对如本文所述的特定疾病或病症(如癌症或传染性疾病)的治疗的生物体。受试者和患者的实例包括接受疾病或病症(例如细胞增殖性障碍,如癌症或传染性疾病)的治疗的哺乳动物,如人、灵长类动物、猪、山羊、兔、仓鼠、猫、狗、豚鼠、牛科家族成员(如家牛、野牛、水牛、麋鹿和牦牛等)、牛、绵羊、马和野牛等。
[0163]
如本文所使用的,术语“转染”是指通常用于将外源dna引入原核或真核宿主细胞的多种技术中的任何一种,例如电穿孔、脂质转染、磷酸钙沉淀、deae-葡聚糖转染等。
[0164]
如本文所使用的,术语“治疗(treat)”或“治疗(treatment)”是指治疗性治疗,其中目的是预防或减缓(减少)不希望的生理变化或紊乱,如细胞增殖性障碍(如癌症或传染性疾病)的进展。有益的或所希望的临床结果包括但不限于症状的减轻、疾病的程度减弱、疾病状态稳定(即,未恶化)、疾病进展的延迟或减慢、疾病状态的改善或缓和、以及缓解(无论是部分缓解或完全缓解),无论是可检测的或不可检测的。需要治疗的那些包括已患有病症或障碍的那些以及易于患上病症或障碍的那些或打算预防病症或障碍的那些。
[0165]
如本文所使用的,术语“肿瘤坏死因子受体超家族”、“tnfr超家族”或“tnfrs”是指具有羧基末端胞内结构域和氨基末端胞外结构域的i型跨膜蛋白(由共同的富含半胱氨酸结构域(crd)表征)。tnfr超家族包括由于与tnf超家族中的一个或多个配体结合的结果而介导细胞信号传导的受体。tnfr超家族可以分为两个亚群:含有细胞内死亡结构域的受体和缺少该结构域的受体。死亡结构域是在受体活化后传播凋亡信号转导级联的80个氨基酸的基序。含有细胞内死亡结构域的示例性tnfr超家族成员包括tnfr1,而tnfr2代表不含该结构域的tnfr超家族蛋白。该tnfr超家族的成员包括tnfr1、tnfr2、rank、cd30、cd40、淋巴毒素β受体(lt-βr)、ox40、fas受体、诱饵受体3(dcr3)、cd27、4-1bb、死亡受体4(dr4)、死亡受体5(dr5)、诱饵受体1(dcr1)、诱饵受体2(dcr2)、护骨蛋白、tweak受体、taci、baff受体、疱疹病毒进入介体、神经生长因子受体、b细胞成熟抗原、糖皮质激素诱导的相关tnfr、troy、死亡受体6(dr6)、死亡受体3(dr3)以及外胚层发育异常蛋白a2受体。
[0166]
如本文所使用的,术语“可变区cdr”包括如使用基于序列或结构的方法鉴定的cdr或互补决定区中的氨基酸。如本文所使用的,术语“cdr”或“互补决定区”是指在重链和轻链多肽两者的可变区内发现的非连续抗原结合位点。以下已经描述了这些特定区域:kabat等
人,j.biol.chem.[生物化学杂志]252:6609-6616,1977;和kabat等人,sequences of proteins of immunological interest,fifth edition,u.s.department of health and human services,nih publication no.91-3242,1991[免疫感兴趣的蛋白质序列,第五版,美国卫生与公共服务部,nih公开号91-3242,1991];chothia等人(j.mol.biol.[分子生物学杂志]196:901-917,1987);以及maccallum等人(j.mol.biol.[分子生物学杂志]262:732-745,1996);其中所述定义包括相互比较时氨基酸残基的重叠或亚组。在某些实施例中,术语“cdr”是基于序列比较由kabat定义的cdr。
[0167]
如本文所使用的,术语“载体”包括核酸载体,例如dna载体,如质粒、rna载体、病毒或其他适合的复制子(例如,病毒载体)。已经开发了多种载体用于将编码外源蛋白质的多核苷酸递送到原核或真核细胞中。这样的表达载体的实例例如披露于wo 1994/11026中;通过引用结合在此。本发明的表达载体含有多核苷酸序列以及例如用于表达蛋白质和/或将这些多核苷酸序列整合到哺乳动物细胞基因组中的附加序列元件。可以用于表达本发明的抗体和抗体片段的某些载体包括含有指导基因转录的调控序列(如启动子和增强子区域)的质粒。用于表达抗体和抗体片段的其他有用的载体含有多核苷酸序列,其增强这些基因的翻译速率或改善由基因转录产生的mrna的稳定性或核输出。这些序列元件包括例如5'和3'非翻译区、内部核糖体进入位点(ires)和聚腺苷酸化信号位点,以便指导表达载体上携带的基因的有效转录。本发明的表达载体还可以含有以下多核苷酸,该多核苷酸编码用于选择含有这种载体的细胞的标记。适合的标记的实例包括编码抗生素(如氨苄青霉素、氯霉素、卡那霉素或诺尔丝菌素)抗性的基因。
[0168]
如本文所使用的,术语“vh”是指抗体的免疫球蛋白重链(包括fv、scfv或fab的重链)的可变区。对“vl”的引用是指免疫球蛋白轻链(包括fv、scfv、dsfv或fab的轻链)的可变区。抗体(ab)和免疫球蛋白(ig)是具有相同结构特征的糖蛋白。尽管抗体展现与特异性靶的结合特异性,但免疫球蛋白包括抗体和其他缺乏靶特异性的抗体样分子两者。天然抗体和免疫球蛋白通常是约150,000道尔顿的杂四聚体糖蛋白,由两条一致轻(l)链和两条一致重(h)链构成。天然抗体的每条重链具有在氨基末端的可变结构域(vh),随后是多个恒定结构域。天然抗体的每条轻链具有在氨基末端的可变结构域(vl)和在羧基末端的恒定结构域。
附图说明
[0169]
图1a和1b显示拮抗性tnfr2抗体tnfrab1的重链和轻链的dna和氨基酸序列。图1a显示编码tnfrab1的重链的dna序列(上图)和该重链的氨基酸序列(下图)。三个互补决定区(cdr)的氨基酸序列以粗体显示。图1b显示编码tnfrab1的轻链的dna序列(上图)和该轻链的氨基酸序列(下图)。三个cdr的氨基酸序列以粗体显示。
[0170]
图2a和2b显示人tnfr2(seq id no:7)的氨基酸序列。值得注意的是,在本文中对人tnfr2进行编号,从位置1处的n-末端甲硫氨酸开始并且以位置461处的c-末端丝氨酸结束(seq id no:7)。在图2a和2b中示出的tnfr2编号方案的背景下,对tnfr2内的氨基酸位置的所有提及都进行了描述。(图2a)阴影残基kcrpgfgv(seq id no:20)定义了拮抗性tnfr2抗体tnfrab1特异性结合的表位。值得注意的是,tnfrab1选择性结合该区域内的残基而不结合下划线的残基kcspg(seq id no:12)的能力促进了tnfr2信号传导的拮抗作用。本发明
的抗体对下划线残基区域内或附近的残基的较差(或缺乏)亲和性与这些抗体的拮抗活性一致,因为与含有下划线残基的表位的结合已经与tnfr2抗体之间的抑制活性的衰减相关。tnfrab1另外结合包含阴影残基ckpcapgtf(seq id no:21)的表位。尽管这些残基在具有kcrpg基序的一级序列中不是连续的,但它们可能在空间上接近tnfr2的三维三级结构,并且可以被适当地定位用于与本发明的拮抗性tnfr2抗体相互作用(参见图4)。(图2b)阴影残基caplrkrcr(seq id no:11)定义了拮抗性tnfr2抗体tnfrab2特异性结合的表位。tnfrab2可以另外结合一个或多个包含残基dstytql(seq id no:8)、peclscgs(seq id no:9)和rictcrpg(seq id no:10)的区域,它们可以是非连续表位的部分。尽管这些残基在一级序列中不是连续的,但它们可能在空间上接近tnfr2的三维三级结构,并且可以被适当地定位用于与本发明的拮抗性tnfr2抗体相互作用。
[0171]
图3a和3b是显示从酶联免疫吸附测定(elisa)实验获得的原始数据的表格,进行这些实验以确定tnfrab1和tnfrab2对tfnr2内的各种连续和不连续表位的亲和力(参见实例1)。原始发光值显示在表格的第四列(右)中。所示的肽序列代表那些含有在tnfr2内的构象表位的一部分的序列,所述构象表位与tnfrab1(图3a)或tnfrab2(图3b)相互作用。具有单个数字代码“2”的氨基酸残基表示在肽合成期间用乙酰氨基甲基(acm)部分在硫醇位置进行化学保护的半胱氨酸残基。这些残基不与含溴甲基的亲电子试剂反应,并且因此在肽合成的环化和双环化阶段不交联。表中的第三列表示肽支架的一般结构。“cys.s”表示27个残基的肽,其中该肽的位置1-11和17-27代表来源于tnfr2的11个残基的肽,该肽含有在天然蛋白质中形成二硫键的半胱氨酸残基(基于可用于uniprot条目p20333的信息)。将序列gly-gly-ser-gly-gly掺入该组肽的位置12-16中。不形成二硫键的天然cys残基用乙酰氨基甲基(acm)保护基保护,并用单个数字代码“2”表示。
[0172]
图4是说明tnfr2内可以与拮抗剂tnfr2抗体(如tnfrab1和tnfrab2)相互作用的构象表位以及不与拮抗剂tnfr2抗体相互作用的残基的示意图。kcspg基序以放大形式显示在图的左上角;kcrpg基序以放大形式显示在图的右边。蛋白质的外表面表示tnfr2的范德瓦尔斯表面。图4提供了tnfr2的x射线晶体结构分离的tnfr2单体(pdb id:3alq,mukai等人,sci.signal.[科学信号],3:ra83,2010)。
[0173]
图5是显示tnfrab1抑制体外培养的t-reg细胞的生长的图。数值代表相对于在将细胞暴露于特定条件后保留在培养物中的未处理的对照细胞,活t-reg细胞的分数。在远左侧显示的条表示用200u/ml下的il-2(对照)、tnfα(20ng/ml)、tnfr2激动剂(2.5μg/ml)、拮抗性tnfr2抗体tnfrab1(2.5μg/ml)、或拮抗性tnfr2抗体tnfrab2(2.5μg/ml)处理的t-reg细胞。左侧第二个显示的条显示用tnfrab1处理细胞时t-reg存活力的剂量依赖性变化。右侧第二个显示的条显示tnfrab1抑制tnfα的生长促进活性的能力。用恒定浓度的tnfα(20ng/ml)和不同浓度的tnfrab1(从0.0008至25μg/ml)处理t-reg细胞。tnfrab1能够以浓度依赖性方式抑制tnfα诱导的增殖,这表明tnfrab1拮抗tnfr2。远右侧显示的条显示了tnfα对t-reg细胞生长的影响。用20ng/ml tnfα孵育t-reg细胞导致相对于未处理的细胞的大约130%的增殖。
[0174]
图6a是显示tnfα以剂量依赖性方式诱导t-reg细胞增殖的能力的图。图6b是显示il-2以剂量依赖性方式诱导at-reg细胞增殖的能力的图。新鲜分离的人cd4+细胞与tnfα和il-2(200u/ml)一起孵育长达48小时,以剂量依赖性方式诱导t-reg细胞扩增,并且il-2的
存在对于促进t-reg扩增是重要的。图6c是显示tnfα和显性拮抗性tnfr2抗体tnfrab1和tnfrab2对t-reg细胞增殖的影响的图。x轴上的值表示相对于用il-2处理的样品,t-reg细胞的量的百分比变化。图6d和6e是显示为了确定tnfrab2对t-reg细胞增殖的影响而进行的重复实验的结果的图。图6f和6g是显示为了确定tnfrab1对t-reg细胞增殖的影响而进行的重复实验的结果的图。
[0175]
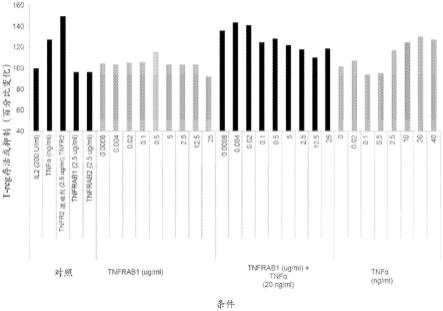
图7a是显示tnfα对cd4+t-reg细胞的增殖的影响的图。x-轴上的值表示相对于用il-2处理,用tnfα处理时t-reg细胞的量的百分比变化。图7b是显示在存在和不存在tnfα下,tnfrab1主要抑制t-reg细胞增殖的能力的图。图7c是显示在存在和不存在tnfα下,tnfrab2抑制t-reg细胞增殖的能力的图。图7d和7e是显示在存在和不存在tnfα下,tnfr2显性拮抗剂对t-reg细胞增殖的影响的图。
[0176]
图8a是显示tnfrab1和tnfrab2通常抑制t-reg细胞增殖的能力的图。图8b是显示相对于用il-2处理而诱导的效应,tnfrab1和tnfrab2对t-reg细胞增殖的影响的图。图8c是显示tnfrab1和tnfrab2对总t-reg量的影响的图。图8d是显示相对于用il-2处理而诱导的效应,tnfrab1和tnfrab2对总t-reg量的影响的图。图8e是表示tnfrab1和tnfrab2对以高亲和力状态表达cd25(cd25
高
)和以低亲和力状态表达cd45ra(cd45ra
低
)的活化的t-reg细胞(at-reg细胞)的影响的图。图8f是显示tnfrab1和tnfrab2对表达cd45ro
高
和cd25
高
的t-reg细胞群的作用的图。图8g是显示tnfrab2对表达cd25
高
的cd4+t细胞的影响的图。图8h是表示tnfrab2对表达cd25
高
的t-reg细胞的影响的图。这些数据表明,虽然用tnfrab1或tnfrab2处理后抑制了活化的细胞(at-reg)和静息的细胞(rt-reg)的增殖,但拮抗性tnfr2抗体优先抑制at-reg细胞的增殖。
[0177]
图9a是一系列二维流式细胞术图,其显示了指导t-reg细胞生长的药剂(例如,tnfα、il-2和tnfr2激动剂)以及tnfr2拮抗剂tnfrab2对各种表型的t-reg细胞的增殖的影响。用tnfr2拮抗剂抗体处理优先抑制表达cd25
高
的t-reg细胞的增殖。显示了在用il-2(200u/ml)、tnfα(20ng/ml)或tnfr2拮抗剂抗体(12.5μg/ml)单独孵育长达48小时后,表达tnfr2的cd4+、cd25
h1
+细胞的比例。图9b是显示tnfrab1对tnfr2的分泌的作用的图,以pg/ml为单位显示。图9c是显示如通过羧基荧光素(cfse)标记所测量的tnfrab2对cd8+t细胞计数的影响的一系列一维流式细胞术图。
[0178]
图10a是显示全长tnfrab1(igg)以及tnfrab1的f(ab’)2片段抑制t-reg细胞增殖的能力的图。图10b是显示全长tnfrab2(igg)以及tnfrab2的f(ab’)2片段抑制t-reg细胞增殖的能力的图。这些数据证明,这些拮抗性tnfr2抗体的fab区域与tnfr2的特异性结合可能负责调节t-reg细胞生长,而不是这些抗体的fc区域的非特异性结合。用il-2(200u/ml)加上tnfrab1或tnfrab2的完整抗体或f(ab’)2片段将新鲜分离的cd4+细胞孵育长达48小时,在存在或不存在tnfα(20ng/ml)下产生类似的对t-reg细胞的剂量依赖性抑制。图10c是显示剂量-反应测定的结果的图,其中在抗-igg抗体存在下用tnfrab1处理t-reg细胞。图10d是显示剂量-反应测定的结果的图,其中在抗-igg抗体存在下用tnfrab2处理t-reg细胞。由tnfr2拮抗剂抗体诱导的t-reg细胞生长的剂量依赖性抑制不受抗igg分子的存在的影响,这表明由tnfrab1或tnfrab2介导的非特异性交联不负责这些抗体对t-reg细胞增殖的抑制作用。交联抗体(2.5μg/ml)与tnfr2拮抗剂抗体(0.02-25μg/ml)的共孵育不影响抗体以剂量依赖性方式抑制t-reg增殖的能力。数据呈现为一个单一的代表性实例。
[0179]
图11a是显示在tnfrab1表达后进行的sds-page分析的结果的聚丙烯酰胺凝胶的图像。图11b是显示在tnfrab2表达后进行的sds-page分析的结果的聚丙烯酰胺凝胶的图像。显示了对减少的和未减少的tnfr2拮抗剂抗体(2.5μg)的分析。图11c是显示在tnfrab1的f(ab’)2片段表达后进行的sds-page分析的结果的聚丙烯酰胺凝胶的图像。图11d是显示在tnfrab2的f(ab’)2片段表达后进行的sds-page分析的结果的聚丙烯酰胺凝胶的图像。显示了对在f(ab')2片段制备中消化之前和之后的tnfr2拮抗剂抗体的分析。
[0180]
图12a是显示tnfr2拮抗剂抗体对tnfα和淋巴毒素表达的影响的图。图12b是显示tnfr2拮抗剂抗体对foxp3和cd25表达的影响的图。图12c是显示tnfr2拮抗剂抗体对促进nfκb活化的基因的表达的影响的图:保守的螺旋-环-螺旋遍在蛋白激酶(chuk)、b-细胞抑制剂ε中的κ轻多肽基因增强子的核因子(nfkbie)、b细胞抑制剂α中的κ轻多肽基因增强子的核因子(nfkbia)、丝裂原活化蛋白激酶11(map3k11)、tnfα受体相关因子2(traf2)、tnfα受体相关因子3(traf3)、转录因子relb和含有蛋白质3的杆状病毒iap重复序列(ciap2/birc3)。在用il-2(50u/ml)与tnfα(20ng/ml)或tnfr2拮抗剂(2.5μg/ml)联合培养3小时后,使用实时pcr分析来检测从新鲜cd4+细胞分离的rna。图12d是显示如使用基于细胞的elisa测定法所测量的tnfrab1抑制nfκb活化的能力的图。图12e是显示如使用基于细胞的elisa测定法所测量的tnfrab2抑制nfκb活化的能力的图。磷酸化的rela/nfκb p65被用作nfκb活性的标记。相对于用tnfα处理,用拮抗性tnfr2抗体处理t-reg细胞导致减弱的nfκb活化。使用基于细胞的elisa,在用il-2(200u/ml)和各种浓度的tnfα(0.2-20ng/ml)或tnfr2拮抗剂抗体(0.02-25μg/ml)孵育新鲜的cd4+细胞10分钟后测量磷酸化rela/nfκb p65。rela/nfκb p65的磷酸化被tnfα诱导并被tnfr2拮抗剂mab以剂量依赖性方式抑制。
[0181]
图13a是显示tnfrab1和tnfrab2与tnfr2结合的动力学和热力学参数的表。缔合速率常数以m-1
s-1
为单位显示,解离速率常数以s-1
为单位显示,并且平衡常数以m为单位显示。图13b是显示tnfrab1和tnfrab2对人tnfr2内的各种线性肽序列的亲和力的表。相对亲和力被表示为一系列“+”符号,使得较高数量的该符号表示升高的亲和力值。来源于elisa结合实验的原始数据在“阅读”一列中提供。图13c是显示tnfα对tnfrab1和tnfrab2对人tnfr2内的各种线性肽序列的亲和力的影响的表。相对亲和力被表示为一系列“+”符号,使得较高数量的该符号表示升高的亲和力值。来源于elisa结合实验的原始数据在“阅读”一列中提供。
[0182]
图14a和14b是显示为了确定温和地抑制tnfr2活性的隐性tnfr2拮抗剂抗体(隐性拮抗剂tnfr2抗体a)对t-reg细胞增殖的影响而进行的重复实验的结果的图。图14c和14d是显示为了确定温和地抑制tnfr2活性的第二隐性tnfr2拮抗剂(隐性拮抗剂tnfr2抗体b)对t-reg细胞增殖的影响而进行的重复实验的结果的图。这些隐性拮抗剂抗体针对tnfr2的外部区域升高,以防止导致nfκb活化的tnfr2三聚化。
[0183]
图15a是显示人tnfr2的反平行二聚体和平行二聚体的三维结构的结构模型。图15b是显示tnfα-tnfr2复合物的三维结构的结构模型。阴影残基代表tnfrab1结合的人tnfr2内的氨基酸。蛋白质在范德瓦尔斯表面下以带状形式表现。本文所述的数据清楚地显示,对于完整抗体或其f(ab’)2片段以反平行构象与tnfr2结合,tnfr2受体将在指定的氨基酸基序处结合该抗体或其片段。平行二聚体的结合位点彼此太接近,并且因此会阻止抗体结合。此外,三聚体tnfα-tnfr2复合物掩盖了由拮抗性tnfr2抗体结合的表位,因为这些残基位于三聚体结构的内部。图15c是显示作为含有三聚体tnf的三聚体的已知和公开的
tnfr2的三聚体结构模型的图像。此结构中还显示了阴影残基,其表示被隐性拮抗剂tnfr2抗体a和b结合的人tnfr2内的氨基酸。
[0184]
图16a是显示tnfrab1对从表现有卵巢癌的患者分离的t-reg细胞(灰色阴影)和从未表现有卵巢癌的受试者分离的t-reg细胞(黑色阴影)的增殖的影响的图。图16b是显示tnfrab2对从表现有卵巢癌的患者分离的t-reg细胞(灰色阴影)和从未表现有卵巢癌的受试者分离的t-reg细胞(黑色阴影)的增殖的影响的图。
[0185]
图17a是显示tnfrab1对从未表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图。图17b是显示tnfrab2对从未表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图。图17c是显示tnfrab1对从表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图。图17d是显示tnfrab2对从表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图。图17e是显示tnfrab1对从未表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图(相对于图17a的重复数据集)。图17f是显示tnfrab2对从未表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图(相对于图17b的重复数据集)。图17g是显示tnfrab1对从表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图(相对于图17c的重复数据集)。图17h是显示tnfrab2对从表现有卵巢癌的受试者分离的t-reg细胞的增殖的影响的图(相对于图17d的重复数据集)。
[0186]
图18a是以反平行二聚体构象显示的tnfrs成员,即人死亡受体3(dr3)的结构模型。dr3的四个富含半胱氨酸的结构域由罗马数字i-iv表示。该结构模型复制自tengchuan,original archival copy of thesis,structural characterization of tnf receptors and ligands,chicago,il,2008[论文的原始档案副本,tnf受体和配体的结构表征,伊利诺伊州芝加哥,2008],将其披露通过引用以其整体结合在此。图18b是显示处于反平行二聚体构象的tnfr1的结构模型。在这个模型中,一个tnfr1单体的n-末端位于另一个tnfr1单体的中心附近。图18c是显示处于替代性反平行二聚体构象的tnfr1的结构模型。在这个模型中,tnfr1单体的n-末端和tnfr1单体的c-末端彼此接近。图18b和18c复制自naismith等人,structure[结构]4:1251-1262(1996),将其披露通过引用以其整体结合在此。
具体实施方式
[0187]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)通过结合该受体(例如,在t-reg细胞、表达tnfr2的癌细胞、或髓源性抑制细胞(mdsc)的外表面上)抑制表达tnfr2的细胞上的tnfr2的活化,并且因此阻止蛋白质募集其同源配体tnfα。tnfα通过核化tnfr2蛋白的三聚体来增强tnfr2信号传导。正是这种三聚化事件使得各个tnfr2蛋白紧密接近并经由mapk/nfκb/traf2/3途径启动信号传导,这最终导致细胞生长并逃离细胞凋亡。结合tnfr2的多肽(例如,单链多肽、抗体和抗体片段)可以通过结合受体并阻止tnfα引发这种结构改变来拮抗这种相互作用。例如,这可能发生的一种机制是通过形成反平行的tnfr2二聚体,其是该受体的非活性结构形式。
[0188]
本发明的多肽(例如,单链多肽、抗体和抗原结合片段)可以用于抑制肿瘤坏死因子受体超家族(tnfrs)的其他成员的活性。例如,本发明的抗体及其抗原结合片段能以反平行二聚体构象结合tnfrs成员,如dr3或tnfr1。通过结合处于反平行二聚体结构的tnfrs成员,抗体或其抗原结合片段与tnfrs成员形成复合物,其中结合同源配体(如在tnfr2的情况
下的tnfα)的受体残基被螯合在该复合物的内部。因此,本发明的抗体或其抗原结合片段可以通过与tnfrs成员形成复合物来阻止tnfrs成员的配体介导的三聚化并由此阻止tnfrs成员的激活,从而在空间上阻止内源性配体进入受体内的其同源结合位点。已知采用反平行二聚体构象的示例性tnfrs成员包括:tnfr1、tnfr2、fas、dcr3、dr3、trail-r1(dr4)、trail-r2(dr5)、trail-r3、trail-r4、dr6、edar、cd271、opg、rank、ltβr、tweak-r、hvem、cd27、cd30、cd40、cd137、ox40、gitr、bcma、taci、baffr、edar2、troy和relt等等。因此,本发明的多肽(例如,单链多肽、抗体和抗原结合片段)可用于以反平行二聚体构象结合tnfrs成员如tnfr2,以抑制tnfrs成员在靶细胞(如t-reg细胞、tnfr2+癌细胞或髓源性抑制细胞)中的活性。例如,本发明的拮抗性多肽(如单链多肽、抗体或其抗原结合片段)能以反平行二聚体构象结合dr3(例如,如图18a所示)和/或以反平行二聚体构象结合tnfr1(例如,如图18b所示)。如图18a和18b所示,本发明的拮抗性多肽(例如,单链多肽、抗体和抗原结合片段)能以反平行构象结合tnfrs成员如dr3和/或tnfr1(如图18a和18b所示),从而使同源配体结合位点在空间上难以接近,并减弱tnfrs成员介导的信号传导。例如,本发明的拮抗性dr3抗体或其抗原结合片段可以结合dr3氨基酸序列(基因库
tm
(genbank
tm
)登录号aaq88676.1)的残基138-150内的表位。本发明的拮抗性tnfr1抗体或其抗原结合片段可以结合tnfr1氨基酸序列(基因库
tm
登录号np_001056)的残基185-197内的表位。
[0189]
本发明的多肽(例如,单链多肽、抗体和抗原结合片段)可以是显性拮抗剂(例如,显性tnfr2拮抗性多肽,如单链多肽、抗体或其抗原结合片段)。显性拮抗性tnfr2多肽是即使在激动剂(如tnfα或il-2)存在下也能够结合tnfr2(例如,处于反平行二聚体构象)并抑制tnfr2介导的信号转导的那些。例如,在tnfr2激动剂存在下,显性拮抗性tnfr2多肽可以抑制细胞(如t-reg细胞、表达tnfr2的癌细胞、或髓源性抑制细胞)群的增殖例如1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多,相对于没有用显性拮抗性tnfr2多肽处理的这样的细胞群。相反,隐性拮抗性tnfr2多肽能够结合tnfr2并抑制tnfr2介导的信号传导,但这些多肽的能力在tnfr2激动剂存在下减弱。例如,如在t-reg细胞死亡测定、tnfr2+癌细胞死亡测定或髓源性抑制细胞死亡测定中在tnfr2激动剂(如tnfα或il-2)存在下测量的隐性拮抗性tnfr2多肽的ic
50
可以被增强例如1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多,相对于显性拮抗性tnfr2多肽的ic
50
。本文例如在以下的实例9中描述了可以用于测量tnfr2抗体的拮抗作用的细胞死亡测定的实例。因此,本发明的显性拮抗性tnfr2多肽(如单链多肽、抗体或其抗原结合片段)可以用于抑制表达tnfr2的细胞(例如,t-reg细胞、tnfr2+癌细胞(如卵巢癌细胞)或髓源性抑制细胞)的增殖,即使在生长诱导信号(如tnfα或il-2)存在下。
[0190]
本发明的多肽(例如,单链多肽、抗体和抗原结合片段)可以用于减弱t-reg细胞的活性(例如,增殖),t-reg细胞通常伴随t细胞介导的对自身细胞的细胞毒性,如t淋巴细胞对肿瘤细胞的攻击。可以将拮抗性tnfr2多肽施用于哺乳动物受试者(如人)(例如,通过本文所述的多种给药途径中的任一种),以延长适应性免疫应答(如针对癌细胞或致病生物的应答)的持续时间。以这种方式,本发明的拮抗性tnfr2多肽可以与现有技术协同增强针对癌症和传染性疾病的基于t淋巴细胞的疗法。例如,可以施用本发明的tnfr2拮抗剂来抑制
t-reg细胞活性,由此增强肿瘤反应性t细胞的细胞毒性效应。tnfr2拮抗剂还可以与现有策略协同促进肿瘤反应性t细胞存活(如淋巴细胞耗竭和生长因子疗法),并进而延长体内抗肿瘤反应性的持续时间。拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)还可以用于治疗哺乳动物受试者(例如人)中的各种传染性疾病,因为对t-reg生长和增殖的抑制促进能够对致病生物发起攻击的cd8+t淋巴细胞的活性。此外,本发明的拮抗性tnfr2多肽(如单链多肽、抗体及其抗原结合片段)可以用于治疗农业农场动物(例如,牛科哺乳动物、猪、牛、马、绵羊、山羊、猫、狗、兔、仓鼠、豚鼠或其他非人哺乳动物)中的多种传染性疾病,如结核分枝杆菌。
[0191]
拮抗性tnfrs成员多肽
[0192]
tnfrs成员蛋白表现出以tnfr2为代表的构象性质。例如,已知这些受体采用反平行二聚体构象,并且在通过与同源配体结合而诱导的三聚化时被活化。tnfrs成员蛋白的氨基酸序列和三维结构是本领域已知的。例如,未连接配体的tnfα受体的结构研究揭示了这些蛋白质采用反平行二聚体构象,如例如描述于naismith等人,j.biol.chem.[生物化学杂志]290:13303(1995),将其披露通过引用以其整体结合在此。此外,已经显示人死亡受体3(dr3)采用反平行二聚体构象(tengchuan,original archival copy of thesis,structural characterization of tnf receptors and ligands,chicago,il,2008[论文的原始档案副本,tnf受体和配体的结构表征,伊利诺伊州芝加哥,2008],将其披露通过引用以其整体结合在此)。类似地,已知trail受体形成反平行二聚体(shirley等人,rec.pat.anticanc.drug disc.[专利记录与抗肿瘤药物发现]6:311(2011),将其披露通过引用以其整体结合在此)。另外地,traf6已经显示采用这一结构构象(marienfeld等人,mol.cell.biol.[分子细胞生物学]26:9209(2006);yin等人,biochem.[生物化学]48:10558(2009);以及yin等人,nat.struct.mol.biol.[自然结构与分子生物学]16:658(2009),将每个文献的披露通过引用以其整体结合在此)。已经显示ngfr采用反平行二聚体构象(bibel等人,genes dev.[基因与发育]14:2919(2000),将其披露通过引用以其整体结合在此)。另外,已知cd40表现这一结构基序(smulski等人,j.biol.chem.[生物化学杂志]288:10914(2013),将其披露通过引用以其整体结合在此)。另外,cd137已经显示以反平行二聚体状态存在(vinay等人,cd137 pathway:immunology and diseases,new york,ny,2006[cd137途径:免疫学与疾病,纽约州纽约,2006],将其披露通过引用以其整体结合在此)。另外,fas、cd40、ox40和cd27已经显示采用反平行二聚体构象(tartaglia等人,j.biol.chem.[生物化学杂志]267:4304(1992),将其披露通过引用以其整体结合在此)。还已经发现baff-r表现这一结构基序(kim等人,nat.struct.biol.[自然结构生物学]10:342(2003),将其披露通过引用以其整体结合在此)。
[0193]
与人tnfr2内的kcrpgfgv(seq id no:20)、ckpcapgtf(seq id no:21)、caplrkcr(seq id no:11)、dstytql(seq id no:8)、peclscgs(seq id no:9)或rictcrpg(seq id no:10)基序中的一种或多种共享序列或结构同源性的tnfrs成员蛋白内的氨基酸序列结合的多肽(例如,单链多肽、抗体和抗原结合片段)能以反平行二聚体构象结合并稳定tnfrs成员蛋白。例如,在tnfr成员蛋白内与人tnfr2内的上述氨基酸序列之一具有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位可以使用本领域已知的常规蛋白质序列比对技术来鉴定。然后可以使用如本文所述的各种文库筛选和体外展示技
术(例如,参见下文的实例15)来开发结合这些同源表位中的一个或多个的拮抗性tnfrs成员多肽。以这种方式开发的拮抗性tnfrs成员多肽(例如,单链多肽、抗体和抗原结合片段)能以反平行二聚体构象结合tnfrs成员蛋白,由此使同源配体结合位点在空间上不可及,并且因此阻止受体三聚化和活化。具体而言,与tnfrs成员特异性结合并稳定反平行二聚体构象的单链多肽、抗体或其抗原结合片段仅对单一tnfrs成员具有结合特异性,并且不与其他tnfrs成员交叉反应。
[0194]
拮抗性tnfr2多肽
[0195]
本发明的抗tfnr2多肽(例如,单链多肽、抗体和抗原结合片段)能够与tnfr2相互作用并抑制其活性。因此,本发明的抗tnfr2抗体可以选择性拮抗tnfα-tnfr2相互作用而不是促进tnfr2信号传导。这对于治疗性应用例如癌症免疫疗法是特别重要的,因为tnfr2与tnfα缔合后的活化导致mapk和traf2/3信号级联的传播和nf-κb介导的参与t-reg细胞生长和从细胞凋亡逃逸的基因转录的活化(faustman等人,nat.rev.drugdisc.[自然评论:药物发现],9:482-493,2010)。本发明的tnfr2多肽能以高亲和力结合tnfr2,并且可以空间上隔绝受体与tnfα,而不是允许tnfα与tnfr2结合启动tnfr2信号传导,例如通过以反平行二聚体构象结合tnfr2,其中tnfα结合位点在空间上不可及。因此,本发明的抗体可以用于抑制t-reg细胞生长和增殖,并且可以施用于哺乳动物受试者(如患有细胞增殖性障碍或传染性疾病的人类患者),以增强患者中的免疫应答(例如,针对癌性细胞或致病生物的免疫应答)的效力。
[0196]
本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段可以另外结合并灭活癌细胞(如肿瘤细胞)表面上的tnfr2。例如,本文所述的拮抗性tnfr2单链多肽、抗体及其抗原结合片段可以结合霍奇金淋巴瘤细胞或皮肤非霍奇金淋巴瘤细胞、t细胞淋巴瘤细胞、卵巢癌细胞、结肠癌细胞、多发性骨髓瘤细胞或肾细胞癌细胞等的表面上的tnfr2。本发明的拮抗性tnfr2单链多肽、抗体及其抗原结合片段直接在癌细胞上结合tnfr2的能力提供了另一途径,通过这一途径这些分子可以减弱癌细胞存活和增殖。例如,本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段,如含有tnfrab1或tnfrab2的一个或多个重链和/或轻链cdr(或与tnfrab1或tnfrab2的重链和/或轻链cdr具有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的cdr)的抗体或其抗原结合片段,可以直接在癌细胞(例如,皮肤t细胞淋巴瘤细胞、卵巢癌细胞、结肠癌细胞或多发性骨髓瘤细胞,如卵巢癌细胞)的表面上结合tnfr2以降低细胞增殖的能力。
[0197]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)可以表明即使在tnfr2激动剂(如tnfα)或激动性tnfr2抗体或生长促进分子(如il-2)存在下减弱t-reg和/或癌细胞增殖的能力。不受机制的限制,本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段可以表现归功于这些抗体或其抗原结合片段结合tnfr2并稳定这种受体的二聚的反平行二聚体构象的能力的这一性质。这种结构配置不能增强nfκb信号传导。通过将tnfr2维持在非活性结构状态,本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段可以阻止tnfr2激动剂恢复细胞生长。
[0198]
拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)可以展示的另一性质是不仅降低t-reg细胞、tnfr2+癌细胞、和/或mdsc增殖,而且还降低样品(例如,在患者如人类患者中的)中的t-reg细胞、tnfr2+癌细胞、和/或mdsc的总量的能力。本发明的拮抗性tnfr2
单链多肽、抗体或其抗原结合片段能够降低在用拮抗剂tnfr2多肽处理的样品(如从经受如本文所述的癌症或传染性疾病的治疗的人类患者分离的样品)中的t-reg细胞、癌细胞(如皮肤t细胞淋巴瘤细胞、卵巢癌细胞、结肠癌细胞、肾细胞癌细胞或多发性骨髓瘤细胞等)、和/或mdscmdsc的总量例如1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、50%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多,相对于未用拮抗剂tnfr2抗体或其抗原结合片段处理的样品。
[0199]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)减弱t-reg和/或癌细胞生长的能力可能是由于这些多肽降低样品(例如,从经受如本文所述的癌症或传染性疾病的治疗的人类患者分离的样品)中的可溶性tnfr2的量的能力。可溶性tnfr2可以由例如t-reg细胞分泌,并且可以干扰tnfr2拮抗剂在t-reg细胞、tnfr2+癌细胞或mdsc的表面上通过结合和螯合细胞外环境中的这些拮抗剂而定位于tnfr2的能力。通过减少tnfr2分泌,本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段可以使得t-reg细胞、tnfr2+癌细胞、和/或mdsc越来越容易受治疗性分子(如拮抗性tnfr2抗体或其抗原结合片段,和/或本文描述的或本领域已知的可以与本发明的组合物和方法结合使用的另外的抗癌剂)的影响。
[0200]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)能够抑制样品(例如,从经受如本文所述的癌症或传染性疾病的治疗的人类患者分离的样品)中的t-reg细胞群的增殖或减少其总量,并且可以选择性作用于处于活跃分裂状态的t-reg细胞。本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段可以选择性靶向表达cd25
高
和cd45ra
低
的活性t-reg细胞,而不靶向例如表达cd25
中
和cd45ra
高
的静息t-reg细胞。例如,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)能够降低表达cd25
高
和cd45ra
低
的t-reg细胞群的增殖例如1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或更多,该降低是相对于不表达cd25
高
和cd45ra
低
蛋白的t-reg细胞群,如表达cd25
med
和cd45ra
高
蛋白的t-reg细胞群而言的。
[0201]
本发明的拮抗性tnfr2抗体能以与这样的抗体的抗原结合片段所表现的相似的效力抑制例如t-reg、癌细胞和/或mdsc生长。例如,去除本发明的拮抗性tnfr2抗体的fc区可以不改变该分子减弱样品(例如,从经受如本文所述的癌症或传染性疾病的治疗的人类患者分离的样品)中的t-reg细胞和/或癌细胞的增殖或减少其总量的能力。本发明的拮抗性tnfr2抗体及其抗原结合片段可以通过不同于抗体依赖性细胞毒性(adcc)的途径起作用,其中需要fc区募集效应子蛋白以诱导细胞死亡。此外,拮抗性tnfr2抗体或其抗原结合片段可以在交联剂存在下不易受到抑制能力的损失的影响。因此,本发明的拮抗性tnfr2抗体或其抗原结合片段可以在各种同种型(如igg、iga、igm、igd或ige)中或以各种形式(如单克隆抗体或或其抗原结合片段、多克隆抗体或其抗原结合片段、人源化抗体或其抗原结合片段、灵长化抗体或其抗原结合片段、双特异性抗体或其抗原结合片段、多特异性抗体或其抗原结合片段、双可变免疫球蛋白结构域、单价抗体或其抗原结合片段、嵌合抗体或其抗原结合片段、单链fv分子(scfv)、双抗体、三抗体、纳米抗体、抗体样蛋白质支架、结构域抗体、fv片段、fab片段、f(ab’)2分子以及串联scfv(tafv))展示治疗活性。
[0202]
拮抗性tnfr2多肽的特异性结合性质
[0203]
本发明的单链多肽、抗体或抗体片段与人tnfr2的特异性结合可以通过各种已建立的方法中的任一种来确定。可以通过各种测量来定量表示亲和力,包括实现体外tnfα-tnfr2相互作用的半数最大抑制所需的抗体浓度(ic
50
)和多肽-tnfr2复合物解离的平衡常数(kd)。描述tnfr2与本发明的多肽的相互作用的平衡常数kd是tnfr2-抗体复合物解离成溶剂分离的tnfr2和不相互作用的抗体分子的反应的化学平衡常数。
[0204]
本发明的多肽(例如,单链多肽、抗体和抗原结合片段)包括以小于100nm(例如,95nm、90nm、85nm、80nm、75nm、70nm、65nm、60nm、55nm、50nm、45nm、40nm、35nm、30nm、25nm、20nm、15nm、10nm、5nm、4nm、3nm、2nm或1nm)的kd值与tnfr2特异性结合的那些多肽。在一些实施例中,本发明的抗体是以小于1nm(例如,990pm、980pm、970pm、960pm、950pm、940pm、930pm、920pm、910pm、900pm、890pm、880pm、870pm、860pm、850pm、840pm、830pm、820pm、810pm、800pm、790pm、780pm、770pm、760pm、750pm、740pm、730pm、720pm、710pm、700pm、690pm、680pm、670pm、660pm、650pm、640pm、630pm、620pm、610pm、600pm、590pm、580pm、570pm、560pm、550pm、540pm、530pm、520pm、510pm、500pm、490pm、480pm、470pm、460pm、450pm、440pm、430pm、420pm、410pm、400pm、390pm、380pm、370pm、360pm、350pm、340pm、330pm、320pm、310pm、300pm、290pm、280pm、270pm、260pm、250pm、240pm、230pm、220pm、210pm、200pm、190pm、180pm、170pm、160pm、150pm、140pm、130pm、120pm、110pm、100pm、90pm、80pm、70pm、60pm、50pm、40pm、30pm、20pm、10pm、5pm或1pm)的kd值与tnfr2特异性结合的那些抗体。
[0205]
本发明的多肽(例如,单链多肽、抗体和抗原结合片段)还可以通过多种体外结合测定来表征。可以用于确定tnfr2单链多肽、抗体或其片段的kd或ic
50
的实验的实例包括例如表面等离子共振、等温滴定量热法、荧光各向异性和基于elisa的测定等。elisa代表用于分析抗体活性的特别有用的方法,因为这样的测定通常需要最小浓度的抗体。在典型的elisa测定中分析的常见信号是发光,其通常是与特异性结合第一抗体(例如,本发明的tnfr2抗体)的第二抗体缀合的过氧化物酶的活性的结果。本发明的多肽能够结合tnfr2及其衍生的表位(如含有人tnfr2中的一个或多个seq id no:7的残基142-146(kcrpg,如图2a和2b所示)的表位)以及来源于tnfr2的分离的肽,所述分离的肽以可以模拟天然蛋白质中这些氨基酸的构象的方式在结构上预组织各种残基。例如,本发明的多肽可以结合含有seq id no:11、19、20和34-117中任一个的氨基酸序列的肽或者在seq id no:7的位置80和130之间含有约10至约30个之间的连续或不连续氨基酸的肽。在直接elisa实验中,可以定量该结合,例如通过分析在将hrp底物(例如,2,2'-连氮基-二-3-乙基苯并噻唑啉磺酸酯)与hrp缀合的二级抗体结合的抗原-抗体复合物一起孵育时出现的发光。例如,当在hrp底物(参见,例如实例3)存在下与表面固定化抗原和hrp缀合的第二抗体一起孵育时,本发明的多肽可以诱导约400个吸光度单位或更多的发光应答。在一些实施例中,观察到的发光可以是从约400至约900个吸光度单位(例如,400-900个吸光度单位、500-800个吸光度单位或600-700个吸光度单位)。在特定情况下,观察到的发光可以是从约600至约900个吸光度单位(例如,600-900个吸光度单位或700-800个吸光度单位)。
[0206]
拮抗性tnfr2多肽的动力学性质
[0207]
除了tnfr2-多肽相互作用的热力学参数外,还可能定量表征本发明的单链多肽、抗体或抗体片段与tnfr2的动力学缔合和解离。这可以例如通过根据已建立的程序监测抗
体-抗原复合物形成的速率来完成。例如,可以使用表面等离子共振(spr)来确定抗体-tnfr2复合物的形成(k
on
)和解离(k
off
)的速率常数。这些数据还能够计算抗体-tnfr2复合物解离的平衡常数(kd),因为该单分子解离的平衡常数可以表示为k
off
与k
on
值之比。spr是一种特别有利于确定受体-抗体相互作用的动力学和热力学参数的技术,因为该实验不需要通过附着化学标记来修饰一个组分。而是,该受体通常被固定在用增加浓度的抗体溶液脉冲处理的固体金属表面上。抗体-受体结合诱导入射光在金属表面的反射角度的失真,并且随着抗体被引入系统,折射率随时间的这种变化可以拟合建立的回归模型,以便计算抗体-受体相互作用的缔合和解离速率常数。
[0208]
本发明的多肽(例如,单链多肽、抗体和抗原结合片段)在与tnfr2相互作用时表现出高k
on
和低k
off
值,这与高亲和力受体结合一致。例如,本发明的多肽可以在大于104m-1
s-1
(例如,1.0x104m-1
s-1
、1.5x104m-1
s-1
、2.0x104m-1
s-1
、2.5x104m-1
s-1
、3.0x104m-1
s-1
、3.5x104m-1
s-1
、4.0x104m-1
s-1
、4.5x104m-1
s-1
、5.0x104m-1
s-1
、5.5x104m-1
s-1
、6.0x104m-1
s-1
、6.5x104m-1
s-1
、7.0x104m-1
s-1
、7.5x104m-1
s-1
、8.0x104m-1
s-1
、8.5x104m-1
s-1
、9.0x104m-1
s-1
、9.5x104m-1
s-1
、1.0x105m-1
s-1
、1.5x105m-1
s-1
、2.0x105m-1
s-1
、2.5x105m-1
s-1
、3.0x105m-1
s-1
、3.5x105m-1
s-1
、4.0x105m-1
s-1
、4.5x105m-1
s-1
、5.0x105m-1
s-1
、5.5x105m-1
s-1
、6.0x105m-1
s-1
、6.5x105m-1
s-1
、7.0x105m-1
s-1
、7.5x105m-1
s-1
、8.0x105m-1
s-1
、8.5x105m-1
s-1
、9.0x105m-1
s-1
、9.5x105m-1
s-1
或1.0x106m-1
s-1
)的tnfr2存在下表现出k
on
值。当与tnfr2结合时,本发明的多肽表现出低k
off
值,因为抗体能够以高亲和力与不同的tnfr2表位相互作用。这些表位内的残基与tfnr2形成强烈的分子间接触,这用于减缓多肽-tnfr2复合物的解离。这种高受体亲和力表现为低k
off
值。例如,当与tnfr2复合时,本发明的抗体可以表现出小于10-3
s-1
(例如,1.0x10-3
s-1
、9.5x10-4
s-1
、9.0x10-4
s-1
、8.5x10-4
s-1
、8.0x10-4
s-1
、7.5x10-4
s-1
、7.0x10-4
s-1
、6.5x10-4
s-1
、6.0x10-4
s-1
、5.5x10-4
s-1
、5.0x10-4
s-1
、4.5x10-4
s-1
、4.0x10-4
s-1
、3.5x10-4
s-1
、3.0x10-4
s-1
、2.5x10-4
s-1
、2.0x10-4
s-1
、1.5x10-4
s-1
、1.0x10-4
s-1
、9.5x10-5
s-1
、9.0x10-5
s-1
、8.5x10-5
s-1
、8.0x10-5
s-1
、7.5x10-5
s-1
、7.0x10-5
s-1
、6.5x10-5
s-1
、6.0x10-5
s-1
、5.5x10-5
s-1
、5.0x10-5
s-1
、4.5x10-5
s-1
、4.0x10-5
s-1
、3.5x10-5
s-1
、3.0x10-5
s-1
、2.5x10-5
s-1
、2.0x10-5
s-1
、1.5x10-5
s-1
或1.0x10-5
s-1
)的k
off
值。
[0209]
拮抗性tnfr2多肽结合的tnfr2内的表位
[0210]
伴随着多肽-tnfr2复合物形成的快速起始和这些复合物的缓慢解离的本发明的多肽(例如,单链多肽、抗体和抗原结合片段)对tnfr2的高亲和力使得这些多肽非常适合作为t-reg细胞生长和增殖抑制剂的治疗应用。例如,高k
on
值表明本发明的多肽(例如,单链多肽、抗体和抗原结合片段)能够定位于表达tnfr2的细胞(例如,t-reg细胞)的表面并且与tnfr2快速缔合,由此阻止否则可能由tnfα诱导的受体活化(例如,通过抑制由tnfα引起的tnfr2的三聚化)。此外,多肽-tnfr2复合物的缓慢解离可以表明该复合物在体内的长半衰期,这导致表达tnfr2的细胞的生长的稳定的、持续的下调(例如,t-reg生长的持续下调)。tnfr2结合的这些理想热力学和动力学参数与本发明的多肽与tnfr2缔合时建立的强分子间接触一致。
[0211]
在开发能够拮抗tnfr2的抗tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)中的困难之一已经阐明了tnfr2内的参与拮抗性复合物形成的表位而不是促进信号转导的表位。tnfr2一级结构内发现的各种离散的肽片段凭借这些残基在受体的天然构象中的空间
取向而结合本发明的拮抗性抗体。值得注意的是,因为许多分离的线性tnfr2衍生的肽似乎不与拮抗性tnfr2多肽(例如,单链多肽、抗体和抗体片段)相互作用,这是由于这些肽当在结构上预组织于全长蛋白质中时并且在溶液中分离时展现出的不同的构象,所以这些残基很难鉴定。使用衍生自tnfr2的不同区域的受限环肽和双环肽的表位作图分析表明,本发明的拮抗性tnfr2抗体以构象依赖性方式结合来自tnfr2氨基酸序列的不同区域的表位。结合本发明的拮抗性tnfr2多肽并促进受体拮抗作用的特别重要的表位是那些含有位于人tnfr2内的seq id no:7的位置142-146处的kcrpg基序(seq id no:19)的一个或多个残基的表位。这些残基中的一个或多个属于更大的表位(例如,seq id no:7的残基142-149,示于图2a中,和seq id no:7的残基137-144,示于图2b中),其可以与本发明的拮抗性tnfr2抗体相互作用。选择性结合拮抗性tnfr2多肽的那些残基的知识可以用于使用文库筛选技术(例如,本文所述的或本领域已知的那些技术)来鉴定和设计广泛的拮抗性tnfr2抗体及其抗原结合片段。例如,可以使用含有kcrpg序列内的一个或多个残基的结构固定的(structurally rigidified)肽(例如,具有seq id no:42、50、52-54和61-63的序列的肽)来筛选和选择以高亲和力和选择性结合这些表位的多肽(例如,单链多肽、抗体和抗体样支架)。
[0212]
tnfr2内的几个不同的残基结合拮抗性tnfr2多肽(如本发明的单链多肽、抗体和抗体片段),并建立与这些抗体的强分子间接触。值得注意的是,本发明的功能性拮抗性tnfr2多肽选择性结合包含人tnfr2内的seq id no:7的氨基酸142-146(kcrpg,seq id no:19)的一个或多个残基的表位。该表位的空间取向示于图4中。本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)能够选择性结合含有一个或多个这些残基的tnfr2的表位,并且明显不表现出与含有人tnfr2内的seq id no:7的残基56-60(kcspg,seq id no:12)的表位特异性结合。例如,本发明的多肽(例如,单链多肽、抗体和抗体片段)不表现出与包含人tnfr2内的seq id no:7的残基48-67(qtaqmccskcspgqhakvfc,seq id no:18)中的一个或多个或全部的表位特异性结合,以及不表现出与与该序列展现至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位特异性结合,并且不表现出与含有相对于该序列的保守性氨基酸取代的表位(只要表位中存在氨基酸序列kcspg)特异性结合。已经显示表现出以下能力的多肽缺乏抑制(拮抗)活性:结合包含人tnfr2内的seq id no:7的氨基酸142-146的一个或多个残基的表位和包含人tnfr2内的seq id no:7的残基56-60的表位。像这样,tnfr2抗体区分这些表位并与包含人tnfr2内的seq id no:7的残基142-146中的一个或多个的表位特异性相互作用并且不参加与由人tnfr2内的seq id no:7的残基56-60组成的表位的特异性结合的能力表征了拮抗tnfr2信号传导的本发明的多肽(例如,单链多肽、抗体和抗原结合片段)。
[0213]
可以用于预测本发明的tnfr2单链多肽、抗体或抗体片段的抑制活性的一个示例性程序是比较该多肽对含有kcrpg基序的肽(例如,具有序列kqegcrlcaplrkcrpgfgv,seq id no:17的线性肽)的亲和力与同一抗体或抗体片段对含有kcspg序列的肽(例如,具有序列qtaqmccskcspgqhakvfc,seq id no:18的线性肽)的亲和力。例如,拮抗性tnfr2抗体tnfrab1特异性结合由人tnfr2内的seq id no:7的残基130-149(kqegcrlcaplrkcrpgfgv,seq id no:17)所限定的肽片段,以比由人tnfr2内的seq id no:7的残基48-67(qtaqmccskcspgqhakvfc,seq id no:18)所限定的肽片段大40倍的亲和力。本发明的拮抗
性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)以比同一单链多肽、抗体或抗原结合片段对含有人tnfr2的kcspg序列(seq id no:12)的肽的亲和力大至少10倍的亲和力结合含有kcrpg序列(seq id no:19)的一个或多个残基的表位。例如,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体及其抗原结合片段)以比同一单链多肽、抗体或抗原结合片段对含有人tnfr2的kcspg序列(seq id no:12)的肽的亲和力大10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1000倍或大于1000倍的亲和力结合含有人tnfr2的kcrpg序列(seq id no:19)的一个或多个残基的表位。以相似的亲和力(例如,亲和力小于10倍差异)结合含有kcrpg序列(人tnfr2内的seq id no:7的氨基酸142-146)的一个或多个残基的表位和含有kcspg基序(人tnfr2内的seq id no:7的氨基酸56-60)的表位的多肽(例如,单链多肽、抗体或其抗原结合片段)不被认为是本发明的拮抗性tnfr2多肽。
[0214]
除了seq id no:7的氨基酸142-146的一个或多个残基之外,本发明的多肽还可以结合包含来自人tnfr2内的seq id no:7的位置130-149(kqegcrlcaplrkcrpgfgv,seq id no:17)的至少五个连续或不连续残基的更大表位或与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位的一个或多个残基。例如,本发明的拮抗性tnfr2抗体或抗体片段可以特异性结合含有人tnfr2内的seq id no:7的残基142-149(kcrpgfgv,seq id no:20)的表位,或与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位(只要该表位中存在kcrpg序列的一个或多个残基)。另外地或可替代地,本发明的拮抗性tnfr2抗体可以特异性结合含有人tnfr2内的seq id no:7的残基137-144(caplrkcr,seq id no:11)的表位,或与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位(只要该表位中存在kcrpg序列的一个或多个残基)。
[0215]
本发明的拮抗性tnfr2单链多肽、抗体和抗体片段可以任选地结合由人tnfr2内的seq id no:7的位置150-190(arpgtetsdvvckpcapgtfsnttsstdicrphqicnvvai,seq id no:22)的至少五个连续或不连续残基组成的下游表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。例如,在一些实施例中,本发明的拮抗性tnfr2多肽可以特异性结合包含来自人tnfr2内的seq id no:7的位置161-169(ckpcapgtf,seq id no:21)的残基的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。
[0216]
除了与kcrpg基序(seq id no:19)的一个或多个残基相互作用之外,本发明的拮抗性tnfr2多肽还可以特异性结合人tnfr2内的包含来自人tnfr2内的seq id no:7的位置75-128(cdscedstytqlwnwvpeclscgsrcssdqvetqactreqnrictcrpgwycal,seq id no:13)的至少五个连续或不连续残基的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。本发明的抗tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)还可以特异性结合人tnfr2内的包含来自人tnfr2内的seq id no:7的位置75-91(cdscedstytqlwnwvp,seq id no:14)的至少五个连续或不连续残基的表位,以及与该序列表现有至少85%序列
同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。在一些实施例中,本发明的抗tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)可以特异性结合包含人tnfr2内的seq id no:7的位置80-86(dstytql,seq id no:8)处的残基的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)还可以特异性结合包含来自人tnfr2内的seq id no:7的位置86-103(lwnwvpeclscgsrcssd,seq id no:15)的至少五个连续或不连续残基的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。在一些实施例中,本发明的多肽(例如,单链多肽、抗体和抗原结合片段)可以特异性结合包含来自人tnfr2内的seq id no:7的位置91-98(peclscgs,seq id no:9)的残基的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。本发明的多肽(例如,单链多肽、抗体和抗原结合片段)还可以特异性结合包含来自人tnfr2内的seq id no:7的位置111-128(treqnrictcrpgwycal,seq id no:16)的至少五个连续或不连续残基的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。在一些实施例中,本发明的多肽(例如,单链多肽、抗体和抗原结合片段)可以特异性结合包含来自人tnfr2内的seq id no:7的位置116-123(rictcrpg,seq id no:10)的残基的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。例如,本发明的拮抗性tnfr2单链多肽、抗体和抗体片段可以特异性结合含有人tnfr2内的seq id no:7的残基116-123(rictcrpg,seq id no:10)和人tnfr2内的seq id no:7的残基137-144(caplrkcr,seq id no:11)的表位。
[0217]
本发明的拮抗性tnfr2多肽可以结合seq id no:7的氨基酸112-131(reqnrictcrpgwycalskq)内的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。另外地或可替代地,本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段可以结合seq id no:7的氨基酸120-139(crpgwycalskqegcrlcap)内的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。本发明的拮抗性tnfr2多肽可以结合seq id no:7的氨基酸128-147(lskqegcrlcaplrkcrpgf)内的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。本发明的拮抗性tnfr2多肽可以任选地结合seq id no:7的氨基酸136-155(lcaplrkcrpgfgvarpgte)内的表位,以及与该序列表现有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的表位以及含有相对于该序列的保守性氨基酸取代的表位。
[0218]
与来自非人类动物的tnfr2结合的拮抗性tnfr2多肽
[0219]
除了与人tfnr2内的含有kcrpg基序的表位结合之外,本发明的拮抗性tnfr2多肽
(例如,单链多肽、抗体和抗原结合片段)还包括特异性结合来源于非人类动物(如非人哺乳动物,例如在牛、野牛、小鼠或大鼠等)的tnfr2内的含有等价基序的表位的那些。以下表2中示出了来源于示例性非人哺乳动物的tnfr2中的等同于人kcrpg基序的序列的位置:
[0220]
表2.等同于来自非人哺乳动物的tnfr2中的kcrpg的序列的位置
[0221][0222]
可以被本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)结合的、源自以上讨论的非人哺乳动物的tnfr2内的表位总结于以下序列比对中。该序列比对显示来源于人、牛、野牛、小鼠和大鼠的tnfr2的部分序列,以及与人kcrpg基序等同的表位(以灰色突出显示)。
[0223][0224]
拮抗性tnfr2抗体tnfrab1
[0225]
本发明的代表性拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以基于tnfrab1,在本文中也称为tnfr2拮抗剂1,其是拮抗tnfrα-tnfr2相互作用并且能够抑制tnfα介导的t-reg细胞增殖的鼠抗体(参见,例如图5)。表现出与tnfrab1基本相似的特异性结合特性的tnfrab1的可变区(例如,重链和轻链cdr)及其变体可以用于制备本发明的拮抗性tnfr2抗体或其抗原结合片段,例如通过使用本领域已知的或本文所述的方法用非天然恒定区(例如,来自人抗体的恒定区)替换tnfrab1的小鼠恒定区。
[0226]
本发明的多肽(例如,单链多肽、抗体和抗原结合片段)可以表现出与tnfrab1相同
或相似的结合特性。这些特性如下:在tnfr2存在下,tnfrab1表现出4.98x106m-1
s-1
的高k
on
值以及2.21x10-4
s-1
的低k
off
以及与tnfr2复合时约44.4pm的kd。伴随着tnfrab1-tnfr2复合物的快速形成和缓慢解离的tnfrab1对tnfr2的高亲和力与基于该蛋白质-蛋白质相互作用的强分子间接触一致。tnfrab1与tnfr2的一级结构内的不同表位结合,所述不同表位在受体的天然构象中空间排列。已经鉴定kcrpgfgv基序(seq id no:20),并且特别是kcrpg序列(seq id no:19)为与tnfrab1建立强分子间接触的功能表位的特别重要的成分,如通过表位作图分析所确定的(图2和3)。这些残基与本发明的抗tnfr2多肽的相互作用选择性地促进拮抗活性。值得注意的是,包含人tnfr2内的seq id no:7的氨基酸残基56-60(kcspg,seq id no:12)的tnfr2表位明显不是被tnfrab1或本发明的拮抗性tnfr2多肽特异性结合的构象表位的一部分,因为与这两种表位的特异性结合已经显示导致拮抗活性的丧失或显著降低。因此,特异性结合这两种表位(kcspg和至少含有kcr序列的表位,并且更具体地,人tnfr2的kcrpg序列)的tnfr2多肽(例如,单链多肽、抗体和抗原结合片段)不被认为是本发明的拮抗性tnfr2多肽。
[0227]
除了结合包含在序列kcrpgfgv(seq id no:20)内的表位之外,tnfrab1还与包含在由人tnfr2内的seq id no:7的位置161-169所限定的序列内的下游表位结合(ckpcapgtf,seq id no:21)。本发明的抗tnfr2单链多肽、抗体和抗体片段还可以结合该表位或tnfr2内含有该表位的更大区域(例如,包含来自人tnfr2内的seq id no:7的位置150-190(arpgtetsdvvckpcapgtfsnttsstdicrphqicnvvai,seq id no:22)的至少五个连续或不连续残基的序列)。
[0228]
tnfrab1含有两条重链以及两条轻链,如图1a和1b中所示。tnfrab1的重链含有以下氨基酸序列(cdr以粗体表示):
[0229]
evqlqesggglvkpggslklscaasgftfssyvmswvrqtpekrlewvatissggsytyypdsvkgrftisrdnakntlylqmsslrsedtamyycarqrvdgyssywyfdvwgagtavtvss(seq id no:2)
[0230]
tnfrab1轻链的序列如下(cdr以粗体表示):
[0231]
divltqspaimsaspgekvtitcsasssvyymywfqqkpgtspklwiystsnlasgvpvrfsgsgsgtsysltisrmeaedaatyycqqrrnypytfgggtkleikra
[0232]
(seq id no:4)
[0233]
拮抗性tnfr2抗体tnfrab2
[0234]
本发明的代表性拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以基于tnfrab2,在本文中也称为tnfr2拮抗剂2,一种借助特异性结合该受体内的各种表位而选择性结合并抑制tnfr2的抗体。例如,本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段可以表现出与tnfrab2相同或相似的结合特性。这些特性如下:在tnfr2存在下,tnfrab2表现出3.6099x105m-1
s-1
的高k
on
值以及2.24x10-4
s-1
的低k
off
以及与tnfr2复合时约621pm的kd。含有人tnfr2内的seq id no:7的残基137-144(caplrkcr,seq id no:11)的表位已经被鉴定为与tnfrab2建立强分子间接触的功能表位的特别重要的成分,如通过表位作图分析所确定的(参见,例如实例1以及图2b和3b)。本发明包括特异性结合该表位的tnfr2抗体和抗体片段。
[0235]
除了结合含有残基caplrkcr(seq id no:11)的表位,tnfrab2还结合包含人tnfr2内的seq id no:7的位置80-86(dstytql,seq id no:8)内的、人tnfr2内的seq id no:7的
位置91-98(peclscgs,seq id no:9)内的、以及人tnfr2内的seq id no:7的位置116-123(rictcrpg,seq id no:10)内的一个或多个残基的表位。本发明的tnfr2单链多肽、抗体和抗体片段还可以结合这些表位中的一个或多个。可以使用tnfrab2特异性结合的表位的知识来设计和鉴定本发明的多肽。例如,可以使用本文所述的或本领域已知的多种体外肽展示技术或组合抗体文库筛选中的任一种,以筛选能够以高亲和力和选择性结合这些表位的多肽(例如,单链多肽、抗体及其抗原结合片段)。
[0236]
此外,本发明的tnfr2多肽包括那些含有tnfrab2的一个或多个重链和轻链cdr或重链和轻链可变区以及与tnfrab2非原生的恒定区(例如,来自人抗体的恒定区)的多肽。tnfrab2的重链和轻链cdr如下所示:
[0237]
tnfrab2 cdr-h1:gytftdy(l/i)(seq id no:257)
[0238]
tnfrab2 cdr-h2:vdpeygst(seq id no:258)
[0239]
tnfrab2 cdr-h3:arddgsyspfdywg(seq id no:259)
[0240]
tnfrab2 cdr-l1:qninky(seq id no:260)
[0241]
tnfrab2 cdr-l2:tys或yts
[0242]
tnfrab2 cdr-l3:clqyvnl(l/i)t(seq id no:261)
[0243]
如上所示,tnfrab2的cdr-h1序列可以在该区域的第八位含有亮氨酸或异亮氨酸残基。类似地,tnfrab2 cdr-l2可以包括tys或yts三肽,并且tnfrab2 cdr-l3可以在该区域的第八位含有亮氨酸或异亮氨酸残基。值得注意的是,tnfrab2的cdr-l2侧翼为n-末端框架残基llir(seq id no:262)和c-末端框架残基tle。因此,本发明的拮抗性tnfr2抗体或其抗原结合片段包括含有tnfrab2的一个或多个上述cdr以及侧翼该拮抗性tnfr2抗体或其抗原结合片段的cdr-l2序列的n-末端llir(seq id no:262)和c-末端tle残基的那些。
[0244]
tnfr2亲和力和拮抗作用的分子决定簇
[0245]
值得注意的是,拮抗性tnfr2抗体tnfrab1和tnfrab2的cdr之间有明显的序列相似性。对这两种抗体的cdr共有的残基的分析提供了对结合tnfr2并表现出拮抗作用的抗体的分子特征的深刻理解。表位作图分析显示tnfrab1和tnfrab2均以反平行二聚体构型与tnfr2结合。这些抗体结合tnfr2内的含有seq id no:7的残基142-146的表位,并且不结合含有seq id no:7的残基56-60的表位。相应的cdr-h和cdr-l区域之间的结构相似性为预测可以保留或增强tnfr2亲和力和拮抗作用的残基取代提供了基础。对这些抗体的重链和轻链cdr序列的检查表明,在相应的cdr序列内保存有若干个残基和物理化学特征,而这些cdr内的其他位置可以显著变化而不丧失亲和力和拮抗功能。例如,tnfrab1和tnfrab2的cdr-h1序列如下所示:
[0246]
gftfssy
ꢀꢀꢀꢀꢀꢀꢀ
(tnfrab1 cdr-h1,seq id no:23)
[0247]
gytftdy(l/i)
ꢀꢀ
(tnfrab2 cdr-h1,seq id no:257)
[0248]
g-tf—-y
‑ꢀꢀꢀꢀꢀ
(共有序列)
[0249]
序列比对揭示了共有的gxtfxxy基序,其中“x”表示任何氨基酸。这些cdr-h1序列的特征在于在第一位置处的保守的甘氨酸残基以及分别在第三、第四和第七位置处的保守的苏氨酸、苯丙氨酸和酪氨酸残基。对这些序列的检查表明,该cdr-h1区域在其余位置上容许取代。不同极性的侧链在第二位置处是容许的,例如含有未取代的和疏水的苯基部分的苯丙氨酸和含有质子羟基取代基的酪氨酸都分别在tnfrab1和tnfrab2的cdr-h1区域的这
个位置被发现。此外,尽管tnfrab1的cdr-h1中的第五和第六位置被极性丝氨酸残基占据,但是这些位置的特征在于含有另外的疏水性甲基取代基的苏氨酸和在生理ph下在tnfrab2中为阴离子的天冬氨酸。这种多样性表明,这些位置可以被不同的静电特性的氨基酸取代,而不丧失tnfr2亲和力和拮抗作用。
[0250]
对tnfrab1和tnfrab2的cdr-h2区域的序列分析类似地揭示了贯穿这些区域的不同位置处的一组保守的氨基酸:
[0251]
ssg—gsy
ꢀꢀ
(tnfrab1 cdr-h2,seq id no:24)
[0252]
vdpeygst
ꢀꢀꢀꢀꢀꢀ
(tnfrab2 cdr-h2,seq id no:258)
[0253]
‑‑‑‑‑
gs
‑ꢀꢀꢀꢀꢀꢀ
(共有序列)
[0254]
该序列比对的分析表明,cdr-h2序列在cdr-h2区域的c-末端表现出保守的gs基序,具有在其余位置处容许的可变的分子大小、极性和静电电荷的侧链。此外,tnfrab1和tnfrab2的相应cdr-h3序列的比对如下所示:
[0255]
qrvdgyssywyfdv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(tnfrab1 cdr-h3,seq id no:25)
[0256]
arddg-s-yspfdywg
ꢀꢀꢀꢀꢀꢀꢀꢀ
(tnfrab2 cdr-h3,seq id no:259)
[0257]-r-dg-s-y
‑‑
fd
‑‑‑ꢀꢀꢀꢀꢀꢀꢀꢀ
(共有序列)
[0258]
对tnfrab1和tnfrab2的cdr-h3序列的类似分析揭示了整个cdr中保守的精氨酸、天冬氨酸、甘氨酸、丝氨酸、酪氨酸和苯丙氨酸残基。值得注意的是,在其余位置上容许具有不同空间和静电性质的残基。例如,cdr-h3序列的第一位置容许具有不同大小和形成氢键倾向的氨基酸残基,因为tnfrab1中cdr-h3的第一位置的特征在于含有具有氢键供体和受体部分的甲酰胺侧链的极性谷氨酰胺残基,而在tnfrab2中的相应位置发现带有未官能化的甲基侧链的丙氨酸残基。此外,以上cdr-h3序列中的第三位置的特征在于在tnfrab1中的疏水性缬氨酸和在tnfrab2的相应位置中的阴离子型天冬氨酸部分。
[0259]
类似的分析揭示了tnfrab1和tnfrab2的cdr-l序列共有的分子特征。例如,tnfrab1和tnfrab2的cdr-l1序列如下所示:
[0260]
sasssvyymy
ꢀꢀꢀꢀꢀꢀꢀ
(tnfrab1 cdr-l1,seq id no:26)
[0261]
q-n
‑‑
ink-y
ꢀꢀꢀꢀꢀꢀꢀ
(tnfrab2 cdr-l1,seq id no:260)
[0262]yꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(共有残基)
[0263]
对这些序列的检查揭示了含有羟基的酪氨酸残基在cdr-l1的最终位置上是特征性的,而在其余位置处容许不同物理化学性质的残基。类似地,对tnfrab1和tnfrab2的cdr-l2区的分析揭示了在这两个区域的最终位置处的保守氨基酸:
[0264]
stsnlas
ꢀꢀꢀꢀꢀꢀꢀ
(tnfrab1 cdr-l2,seq id no:27)
[0265]
ty
‑‑‑‑
s或
ꢀꢀꢀꢀꢀ
(tnfrab2 cdr-l2)
[0266]
yt
‑‑‑‑s[0267]sꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(共有残基)
[0268]
对以上序列比对的分析表明丝氨酸残基在这些cdr-l2序列的第三位置处是特征性的,而在其余残基处广泛容许取代。类似地,tnrab1和tnfrab2的cdr-l3序列如下:
[0269]
q-qrrnypy
‑‑‑‑‑‑
t
ꢀꢀꢀꢀꢀꢀ
(tnfrab1 cdr-l3,seq id no:28)
[0270]
clq
‑‑‑
yvnl(l/i)t
ꢀꢀꢀꢀꢀꢀ
(tnfrab2 cdr-l3,seq id no:261)
[0271]
‑‑‑‑‑‑y‑‑‑‑‑‑‑‑
t
ꢀꢀꢀꢀꢀꢀ
(共有序列)
[0272]
对tnfrab1和tnfrab2的cdr-l3序列的分析揭示了对这些区域内不同位置上的酪氨酸和苏氨酸残基的偏爱,而在其他位置上容许具有宽范围物理化学特征的氨基酸,包括具有阳离子侧链(arg)、构象限制性侧链(pro)和不同极性的侧链(例如,gln、asn、leu和val)的残基。以上cdr-h和cdr-l序列的共有结构特征共同提供了对以下残基的深刻理解:对于以反平行二聚体构型选择性结合tnfr2的kcrpg表位的一个或多个残基(seq id no:7的位置142-146,如seq id no:19中所示)是重要的那些残基,并证明了某些氨基酸可以在保持亲和力和拮抗活性的同时变化。
[0273]
因此,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以具有含有以上共有序列的重链和轻链cdr。例如,本发明的tnfr2拮抗剂可以具有具有氨基酸序列z4jz3z5(j)2z5或z4jz3z5(j)2z5j的cdr-h1;具有氨基酸序列(j)3z4z3j或(j)5z4z3j的cdr-h2;具有氨基酸序列jz1jz2z4jz3jz5(j)2z5z2z5或jz1jz2z4z3z5(j)2z5z2z5(j)2的cdr-h3;具有氨基酸序列(j)9z5或(j)5z5的cdr-l1;具有氨基酸序列(j)6z3或(j)2z3的cdr-l2;以及具有氨基酸序列(j)5z5(j)2z3或(j)3z5(j)4z3的cdr-l3;其中每个j独立地是天然存在的氨基酸;每个z1独立地是在生理ph下含有阳离子侧链的天然存在的氨基酸;每个z2独立地是在生理ph下含有阴离子侧链的天然存在的氨基酸;每个z3独立地是在生理ph下含有极性不带电荷的侧链的天然存在的氨基酸;每个z4独立地是甘氨酸或丙氨酸;并且每个z5独立地是含有疏水性侧链的天然存在的氨基酸。
[0274]
在一些实施例中,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以具有具有氨基酸序列gjtf(j)2y(seq id no:276)或gjtf(j)2yj(seq id no:277)的cdr-h1;具有氨基酸序列(j)3gsj或(j)5gsj的cdr-h2;具有氨基酸序列jrjdgjsjy(j)2fdj(seq id no:278)或jrjdgsy(j)2fd(j)3(seq id no:279)的cdr-h3;具有氨基酸序列(j)9y或(j)5y的cdr-l1;具有氨基酸序列(j)6s或(j)2s的cdr-l2;以及具有氨基酸序列(j)5y(j)2t或(j)3y(j)4t的cdr-l3;其中每个j独立地是天然存在的氨基酸。
[0275]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以具有具有氨基酸序列z4fz3z5ssz5或z4yz3z5tdz5x的cdr-h1;具有氨基酸序列ssgz4z3y(seq id no:263)或vdpeyz4z3t(seq id no:264)的cdr-h2;具有氨基酸序列qz1vz2z4yz3sz5wyz5z2z5(seq id no:265)或az1dz2z4z3z5spz5z2z5wg(seq id no:266)的cdr-h3;具有氨基酸序列sasssvyymz5(seq id no:267)或qninkz5(seq id no:268)的cdr-l1;具有氨基酸序列stsnlaz3(seq id no:269)、tyz3或ytz3的cdr-l2;以及具有氨基酸序列qqrrnz5pyz3(seq id no:270)或clqz5vnlxz3(seq id no:271)的cdr-l3;其中每个z1独立地是在生理ph下含有阳离子侧链的氨基酸;每个z2独立地是在生理ph下含有阴离子侧链的氨基酸;每个z3独立地是在生理ph下含有极性不带电荷的侧链的氨基酸;每个z4独立地是甘氨酸或丙氨酸;每个z5独立地是含有疏水性侧链的氨基酸;并且每个x独立地是亮氨酸或异亮氨酸。
[0276]
在一些实施例中,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以具有具有氨基酸序列gftfssy(seq id no:23)、gytftdyx(seq id no:257)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-h1;具有氨基酸序列ssggsy(seq id no:24)、vdpeygst(seq id no:258)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-h2;具有氨基酸序列qrvdgyssywyfdv(seq id no:25)、arddgsyspfdywg(seq id no:259)或相对于这些序列具有多达两个氨基酸取代的氨基酸序
列的cdr-h3;具有氨基酸序列sasssvyymy(seq id no:26)、qninky(seq id no:260)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-l1;具有氨基酸序列stsnlas(seq id no:27)、tys、yts或相对于seq id no:27具有多达两个氨基酸取代的氨基酸序列的cdr-l2;以及具有氨基酸序列qqrrnypyt(seq id no:28)、clqyvnlxt(seq id no:261)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-l3。
[0277]
衍生自tnfrab1和/或tnfrab2的人源化、灵长化和嵌合抗体
[0278]
本发明的抗体包括含有tnfrab1的一个或多个cdr,或与相对于这些cdr含有保守突变的这些cdr或序列中的任一项表现出至少85%序列同一性(例如90%、95%、97%、99%或100%序列同一性)的cdr的人类人源化、灵长化和嵌合抗体。本发明的抗体包括含有tnfrab2的一个或多个cdr,或与相对于这些cdr含有保守突变的这些cdr或序列中的任一项表现出至少85%序列同一性(例如90%、95%、97%、99%或100%序列同一性)的cdr的人类人源化、灵长化和嵌合抗体。例如,本发明的抗体还包括含有一个或多个与以上cdr相同(除保守性氨基酸取代外)的cdr的人类人源化、灵长化和嵌合抗体。在一些实施例中,人源化、灵长化或嵌合抗体可以含有tnfrab1的一个或多个cdr或与相对于这些cdr含有保守突变的tnfrab1的cdr或序列中的任一项表现出至少85%序列同一性(例如90%、95%、97%、99%或100%序列同一性)的cdr,以及tnfrab2的一个或多个cdr或与相对于这些cdr含有保守突变的tnfrab2的cdr或序列中的任一项表现出至少85%序列同一性(例如90%、95%、97%、99%或100%序列同一性)的cdr。例如,可以通过将任何以上cdr掺入人抗体的框架区(例如,fw1、fw2、fw3和fw4)中来产生本发明的拮抗性tnfr2抗体。可以用于开发含有以上cdr中的一个或多个的人源化抗tnfr2抗体的示例性框架区包括但不限于美国专利号7,732,578、美国专利号8,093,068和wo 2003/105782中描述的那些;通过引用结合在此。
[0279]
可以用于设计本发明的人源化抗体的一种策略是将拮抗性tnfr2抗体(如tnfrab1或tnfrab2)的重链可变区和轻链可变区的序列与共有人抗体的重链可变区和轻链可变区进行比对。共有人抗体重链和轻链序列是本领域已知的(参见例如,“vbase”人类种系序列数据库;还参见kabat等人,sequences ofproteins of immunological interest,fifth edition[免疫学感兴趣的蛋白质的序列,第五版],u.s.department of health and human services[美国卫生和公共服务部],nih公开号91-3242,1991;tomlinson等人,j.mol.biol.[分子生物学杂志]227:776-98,1992;以及cox等人,eur.j.immunol.[欧洲免疫学杂志]24:827-836,1994;通过引用结合在此)。以这种方式,可以通过序列比对来鉴定可变结构域框架残基和cdr(参见kabat,同上)。可以用拮抗性tnfr2抗体(如tnfrab1或tnfrab2)的一个或多个相应的cdr取代共有人抗体的重链和/或轻链可变结构域的一个或多个cdr,以产生人源化tnfr2抗体。共有人抗体的示例性可变结构域包括以下重链可变结构域:
[0280]
evqlvesggglvqpggslrlscaasgftfsdyamswvrqapgkglewvavisengsdtyyadsvkgrftisrddskntlylqmnslraedtavyycardrggavsyfdvwgqgtlvtvss(seq id no:32)
[0281]
和轻链可变结构域:
[0282]
diqmtqspsslsasvgdrvtitcrasqdvssylawyqqkpgkapklliyaasslesgvpsrfsgsgsgtdftltisslqpedfatyycqqynslpytfgqgtkveikrt(seq id no:33)
[0283]
其在美国专利号6,054,297中进行了鉴定;通过引用结合在此(cdr以粗体显示,且
根据chothia等人,j.mol.biol[分子生物学杂志],196:901-917,1987的方法而确定)。可以例如通过使用本领域已知的或本文描述的方法在宿主细胞中重组表达编码人源化抗体的重链和轻链的多核苷酸来进行这些氨基酸取代。
[0284]
类似地,该策略还可以用于产生灵长化的抗tnfr2抗体,因为可以用tnfrab1和/或tnfrab2的一个或多个相应的cdr替换灵长类动物抗体共有序列的重链和/或轻链可变结构域的cdr。共有灵长类动物抗体序列是本领域已知的(参见例如,美国专利号5,658,570;5,681,722;以及5,693,780;通过引用结合在此)。
[0285]
在一些实施例中,除了来自tnfr2抗体例如tnfrab1或tnfrab2)的cdr序列之外,还可以期望的是将特定框架残基导入人抗体的重链和/或轻链可变结构域。例如,美国专利号6,054,297确定了几个实例,其中可以有利于在所得的人源化抗体中保留来自特定抗体重链或轻链可变区的某些框架残基。在一些实施例中,框架残基可以参与与抗原的非共价相互作用,并从而有助于抗体对靶抗原的亲和力。在其他情况下,单独的框架残基可以调节cdr的构象,并从而间接影响抗体与抗原的相互作用。可替代地,某些框架残基可以形成vh与vl结构域之间的界面,并且因此可以有助于整体抗体结构。在其他情况下,框架残基可以构成功能性糖基化位点(例如,asn-x-ser/thr),其可以决定与碳水化合物部分进行连接后的抗体结构和抗原亲和力。在如上所述的那些情况下,可以有利于在本发明的拮抗性抗体及其抗原结合片段(如人源化抗体)中保留tnfr2抗体(例如,tnfrab1或tnfrab2)的某些框架残基,因为各种框架残基可以促进抗体或其抗原结合片段的高表位亲和力和改善的生物化学活性。
[0286]
本发明的抗体还包括抗体片段、fab结构域、f(ab’)分子、f(ab’)2分子、单链可变片段(scfv)、串联scfv片段、双抗体、三抗体、双重可变结构域免疫球蛋白、多特异性抗体、双特异性抗体、以及含有tnfrab1或tnfrab2的一个或多个cdr(例如,含有seq id no:23-28中任一项的氨基酸序列的cdr)或与这些cdr中的任一项表现出至少85%序列同一性(例如,90%、95%、97%、99%或100%序列同一性)的cdr的异种特异性抗体。本发明的抗体及其抗原结合片段包括还含有相对于tnfrab1或tnfrab2的cdr序列具有一至三个氨基酸取代(例如,保守性或非保守性取代)的cdr的那些。可以使用本文描述的或本领域已知的技术例如通过将编码这些蛋白质的多核苷酸掺入用于在真核或原核细胞中转染的表达载体中重组表达这些分子,或例如通过本文描述的或本领域已知的固相肽合成方法化学合成这些分子。
[0287]
本发明的抗体另外包括抗体样支架,所述抗体样支架含有tnfrab1或tnfrab2的一个或多个cdr,或与相对于tnfrab1或tnfrab2的cdr序列含有一至三个之间的氨基酸取代(例如,保守性或非保性守取代)的这些cdr或序列中的任一项表现出至少85%序列同一性(例如90%、95%、97%、99%或100%序列同一性)的cdr。抗体样支架的实例包括含有第十纤连蛋白iii型结构域(
10
fn3)的蛋白质,该第十纤连蛋白iii型结构域含有类似于标准抗体的bc、de和fg结构环。已经显示,
10
fn3结构域的三级结构类似于igg重链的可变区的三级结构,并且本领域技术人员可以通过用tnfrab1和/或tnfrab2cdr的残基替换
10
fn3的bc、de和fg环的残基,将例如tnfrab1和/或tnfrab2的一个或多个cdr,或与相对于这些cdr含有保守氨基酸取代的这些cdr或序列中的任一项具有至少85%序列同一性(例如90%、95%、97%、99%或100%序列同一性)的序列接枝到纤连蛋白支架上。这可以通过在原核或真核细胞中
重组表达经修饰的
10
fn3结构域来实现(例如,使用本文所述的载体和技术)。wo 2000/034784、wo 2009/142773、wo 2012/088006以及美国专利号8,278,419报道了使用
10
fn3结构域作为用于将来自抗体的cdr接枝到bc、de和fg结构环上的抗体样支架的实例;通过引用结合在此。
[0288]
拮抗性tnfr2单链多肽
[0289]
本发明的tnfr2拮抗剂可以处于单链多肽的形式,如含有本文所述的单克隆tnfr2拮抗剂抗体(例如,tnfrab1或tnfrab2)的一个、两个或三个重链cdr,和/或本文所述的单克隆tnfr2拮抗剂抗体(例如,tnfrab1或tnfrab2)的一个、两个或三个轻链cdr的单链多肽。单链多肽可以处于抗体片段的形式,例如本文所述或本领域已知的抗体片段,如scfv片段。可替代地,单链多肽可以含有本文所述的一个或多个cdr,这些cdr使用本领域已知的常规成键技术(例如,通过酰胺键、硫醚键、碳-碳键或通过接头,如本文所述或本领域已知的肽接头或多价亲电子试剂(例如,双(溴甲基)芳烃衍生物,如双(溴甲基)苯或双(溴甲基)吡啶))彼此共价结合。
[0290]
例如,本发明的拮抗性tnfr2单链多肽可以具有一个或多个重链和轻链cdr,这些cdr含有促进与tnfr2表位(如kcrpg基序(seq id no:19))的选择性结合并诱导tnfr2拮抗作用的上述共有序列。例如,本发明的拮抗性tnfr2单链多肽可以具有具有氨基酸序列z4jz3z5(j)2z5或z4jz3z5(j)2z5j的cdr-h1;具有氨基酸序列(j)3z4z3j或(j)5z4z3j的cdr-h2;具有氨基酸序列jz1jz2z4jz3jz5(j)2z5z2z5或jz1jz2z4z3z5(j)2z5z2z5(j)2的cdr-h3;具有氨基酸序列(j)9z5或(j)5z5的cdr-l1;具有氨基酸序列(j)6z3或(j)2z3的cdr-l2;和/或具有氨基酸序列(j)5z5(j)2z3或(j)3z5(j)4z3的cdr-l3;其中每个j独立地是天然存在的氨基酸;每个z1独立地是在生理ph下含有阳离子侧链的天然存在的氨基酸;每个z2独立地是在生理ph下含有阴离子侧链的天然存在的氨基酸;每个z3独立地是在生理ph下含有极性不带电荷的侧链的天然存在的氨基酸;每个z4独立地是甘氨酸或丙氨酸;并且每个z5独立地是含有疏水性侧链的天然存在的氨基酸。
[0291]
在一些实施例中,本发明的拮抗性tnfr2单链多肽可以具有具有氨基酸序列gjtf(j)2y(seq id no:276)或gjtf(j)2yj(seq id no:277)的cdr-h1;具有氨基酸序列(j)3gsj或(j)5gsj的cdr-h2;具有氨基酸序列jrjdgjsjy(j)2fdj(seq id no:278)或jrjdgsy(j)2fd(j)3(seq id no:279)的cdr-h3;具有氨基酸序列(j)9y或(j)5y的cdr-l1;具有氨基酸序列(j)6s或(j)2s的cdr-l2;和/或具有氨基酸序列(j)5y(j)2t或(j)3y(j)4t的cdr-l3;其中每个j独立地是天然存在的氨基酸。
[0292]
本发明的拮抗性tnfr2单链多肽可以具有具有氨基酸序列z4fz3z5ssz5或z4yz3z5tdz5x的cdr-h1;具有氨基酸序列ssgz4z3y(seq id no:263)或vdpeyz4z3t(seq id no:264)的cdr-h2;具有氨基酸序列qz1vz2z4yz3sz5wyz5z2z5(seq id no:265)或az1dz2z4z3z5spz5z2z5wg(seq id no:266)的cdr-h3;具有氨基酸序列sasssvyymz5(seq id no:267)或qninkz5(seq id no:268)的cdr-l1;具有氨基酸序列stsnlaz3(seq id no:269)、tyz3或ytz3的cdr-l2;和/或具有氨基酸序列qqrrnz5pyz3(seq id no:270)或clqz5vnlxz3(seq id no:271)的cdr-l3;其中每个z1独立地是在生理ph下含有阳离子侧链的氨基酸;每个z2独立地是在生理ph下含有阴离子侧链的氨基酸;每个z3独立地是在生理ph下含有极性不带电荷的侧链的氨基酸;每个z4独立地是甘氨酸或丙氨酸;每个z5独立地是含有疏水性侧
链的氨基酸;并且每个x独立地是亮氨酸或异亮氨酸。
[0293]
在一些实施例中,本发明的拮抗性tnfr2单链多肽可以具有具有氨基酸序列gftfssy(seq id no:23)、gytftdyx(seq id no:257)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-h1;具有氨基酸序列ssggsy(seq id no:24)、vdpeygst(seq id no:258)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-h2;具有氨基酸序列qrvdgyssywyfdv(seq id no:25)、arddgsyspfdywg(seq id no:259)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-h3;具有氨基酸序列sasssvyymy(seq id no:26)、qninky(seq id no:260)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-l1;具有氨基酸序列stsnlas(seq id no:27)、tys、yts或相对于seq id no:27具有多达两个氨基酸取代的氨基酸序列的cdr-l2;和/或具有氨基酸序列qqrrnypyt(seq id no:28)、clqyvnlxt(seq id no:261)或相对于这些序列具有多达两个氨基酸取代的氨基酸序列的cdr-l3。
[0294]
单链多肽可以通过多种重组和合成技术产生,如通过本文所述的或本领域已知的重组基因表达或固相肽合成方法。例如,本领域技术人员可以设计编码例如以上cdr中的两个或多个的多核苷酸,所述多核苷酸在框内彼此有效地连接以产生含有这些cdr的连续的单链肽。任选地,可以通过间隔物,例如通过框架区(例如,本文所述的框架序列或人抗体的种系共有序列的框架区)或柔性接头(如本文所述的或本领域已知的聚甘氨酸或甘氨酸/丝氨酸接头)来分开cdr。当通过化学合成方法来产生时,天然化学连接可以任选地被用作合成长肽(例如,大于50个氨基酸)的策略。天然化学连接方案是本领域中已知的并且已经被dawson等人(science[科学],266:776-779,1994)描述;通过引用结合在此。在下面的部分中提供了用于产生单链多肽、全长抗体和抗体片段的技术的详细描述。
[0295]
核酸和表达系统
[0296]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以通过多种已经建立的技术中的任何一种来制备。例如,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以通过在宿主细胞中重组表达一种或多种免疫球蛋白轻链和重链基因来制备。例如,为了表达重组抗体,可以用一个或多个携带编码免疫球蛋白抗体轻链和重链dna片段的表达载体转染宿主细胞,使得轻链和重链在宿主细胞表达,并且任选地被分泌到其中培养宿主细胞的培养基中,从该培养基可以回收抗体。标准重组dna方法用来获得抗体重链及轻链基因,将这些基因整合到重组表达载体中并将载体导入宿主细胞,如在molecular cloning;a laboratory manual,second edition(sambrook,fritsch and maniatis(eds),cold spring harbor,n.y.,1989)[分子克隆:实验室手册,第二版,sambrook、fritsch和maniatis编辑,冷泉港实验室,纽约,1989];current protocols in molecular biology(ausubel et al.,eds.,greene publishing associates,1989)[现行分子生物学方案,ausubel等人编辑,格林出版联合公司,1989];以及在美国专利号4,816,397中所描述的那些;通过引用结合在此。
[0297]
用于表达拮抗性tnfr2多肽的载体
[0298]
病毒基因组提供了可用于将外源基因有效递送到细胞(例如,真核或原核细胞)基因组中的丰富载体来源。病毒基因组是用于基因递送的特别有用的载体,因为包含在这种基因组内的多核苷酸通常通过通用的或专门的转导被整合到靶细胞的基因组中。这些过程
作为天然病毒复制周期的一部分发生,并且不需要添加蛋白质或试剂来诱导基因整合。病毒载体的实例包括逆转录病毒、腺病毒(例如ad5、ad26、ad34、ad35和ad48)、细小病毒(例如腺伴随病毒)、冠状病毒、负链rna病毒如正粘病毒(例如流感病毒)、弹状病毒(例如狂犬病和水泡性口炎病毒)、副粘病毒(例如麻疹和仙台病毒)、正链rna病毒(如细小核糖核酸病毒和α病毒)以及双链dna病毒(包括腺病毒、疱疹病毒(例如单纯疱疹病毒1型和2型、eb病毒、巨细胞病毒)和痘病毒(例如牛痘、改性牛痘安卡拉(mva)、鸡痘和金丝雀痘))。用于递送编码本发明的抗体轻链和重链或抗体片段的多核苷酸的其他病毒包括例如诺沃克病毒、披膜病毒、黄病毒、呼肠孤病毒、乳多孔病毒、嗜肝dna病毒和肝炎病毒。逆转录病毒的实例包括:禽白血病肉瘤,哺乳动物c型病毒、b型病毒、d型病毒,htlv-blv组,慢病毒,泡沫病毒(coffin,j.m.,retroviridae:the viruses and their replication,in fundamental virology,third edition,b.n.fields,et al.,eds.,lippincott-raven publishers,philadelphia,1996)[coffin,j.m.,逆转录病毒科:病毒及其复制,基础病毒学,第三版,b.n.fields等人编辑,利平科特-雷文出版商,费城,1996]。其他实例包括鼠白血病病毒、鼠肉瘤病毒、小鼠乳腺肿瘤病毒、牛白血病病毒、猫白血病病毒、猫肉瘤病毒、禽白血病病毒、人t细胞白血病病毒、狒狒内源性病毒、长臂猿白血病病毒、梅森辉瑞(mason pfizer)猴病毒、猿猴免疫缺陷病毒、猿猴肉瘤病毒、劳斯肉瘤病毒和慢病毒。载体的其他实例例如由mcvey等人(美国专利号5,801,030)描述;通过引用结合在此。
[0299]
基因组编辑技术
[0300]
除了病毒载体之外,已经开发了用于将基因(例如,编码抗体轻链和重链、单链多肽、单链可变片段(scfv)、串联scfv、fab结构域、f(ab’)2结构域、双抗体和三抗体等的那些基因)掺入靶细胞基因组中用于多肽表达的多种另外的方法。一种可以用于将编码抗tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)的多核苷酸掺入原核或真核细胞的这种方法包括转座子。转座子是编码转座酶的多核苷酸,并且包含在5'和3'位置处侧翼为切除位点的感兴趣的多核苷酸序列或基因。一旦转座子被递送到细胞中,转座酶基因的表达便开始并从转座子产生切割感兴趣的基因的活性酶。该活性由转座酶对转座子切除位点的位点特异性识别所介导。在一些实施例中,这些切除位点可以是末端重复序列或反向末端重复序列。一旦从转座子中切除,感兴趣的基因可以通过转座酶催化切割存在于细胞核基因组内的相似切除位点而整合到原核或真核细胞的基因组中。这允许编码例如抗tnfr2抗体或其片段或结构域的基因在切除位点处被插入切割的核dna中,并且随后将感兴趣的基因连接到原核或真核细胞基因组的dna的磷酸二酯键的连接完成了掺入过程。在一些实施例中,转座子可以是逆转录转座子,使得编码抗体的基因首先被转录成rna产物并且然后在掺入原核或真核细胞基因组之前逆转录成dna。示例性转座子系统包括piggyac转座子(详细描述于wo 2010/085699中)和睡美人(sleeping beauty)转座子(详细描述于us 20050112764中);通过引用结合在此。
[0301]
用于将编码抗tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)的核酸分子整合到原核或真核细胞基因组中的另一种有用的方法是规律间隔成簇短回文重复序列(crispr)/cas系统,其是最初随着细菌和古细菌中针对病毒感染的适应性防御机制演变而来的系统。该crispr/cas系统由质粒dna内的回文重复序列和相关的cas9核酸酶组成。这种dna和蛋白质的总体首先通过将外源dna掺入到crispr基因座中而指导靶序列的位点特异
性dna切割。反过来,含有这些外源序列的多核苷酸和crispr基因座的重复-间隔子元件在宿主细胞中转录以产生指导rna,其随后可以与靶序列退火并将cas9核酸酶定位于该位点。以这种方式,可以在外源多核苷酸中产生高度位点特异性的cas9介导的dna切割,因为使cas9亲密接近靶dna分子的相互作用受rna:dna杂交的管理。因此,理论上可以设计crispr/cas系统来切割任何感兴趣的靶dna分子。这种技术已被开发以编辑真核基因组(hwang等人,nat.biotech.[自然生物技术],31:227-229,2013),并且可以用作位点特异性编辑真核或原核基因组的有效手段,以便在掺入编码本发明的抗tnfr2多肽的多核苷酸之前切割dna。在美国专利号8,697,359中已经描述了使用crispr/cas调节基因表达,将该专利通过引用结合在此。
[0302]
用于在掺入编码本发明的tnfr2抗体或抗体片段的多核苷酸之前位点特异性切割基因组dna的替代方法包括使用锌指核酸酶和转录激活子样效应物核酸酶(talen)。不像crispr/cas系统,这些酶不含有定位到特定靶序列的指导性多核苷酸。靶特异性是由这些酶内的dna结合结构域控制的。urnov等人(nat.rev.genet.[自然遗传学综述],11:636-646,2010)和joung等人(nat.rev.mol.cell.bio.[分子细胞生物学自然评论]14:49-55,2013)描述了用于基因组编辑应用中的锌指核酸酶和talen;通过引用结合在此。可以用于将编码本发明的抗体的多核苷酸掺入原核或真核细胞基因组的另外基因组编辑技术包括使用arcus
tm
大范围核酸酶,其可以被合理设计以位点特异性切割基因组dna。这些酶用于将编码本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或抗体片段)的多核苷酸掺入原核或真核细胞基因组中的用途是特别有利的,鉴于已经针对这种酶建立的结构-活性关系。因此可以在某些氨基酸位置修饰单链大范围核酸酶以产生在所需位置选择性切割dna的核酸酶。这些单链核酸酶已经广泛描述于例如美国专利号8,021,867和8,445,251中;通过引用结合在此。
[0303]
多核苷酸序列元件
[0304]
为了表达本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗体片段),例如可以将如以上所述获得的编码部分或全长轻链和重链的多核苷酸或其cdr插入到表达载体中,使得所述基因有效地连接到转录和翻译控制序列。选择表达载体及表达控制序列以使其可与所使用的表达宿主细胞相容。可以将编码例如tnfr2抗体的轻链和重链的多核苷酸插入到不同的载体中,或者任选地,可以使用本文所述或本领域已知的已建立的技术将这两种多核苷酸掺入到相同的表达载体中。
[0305]
除了编码抗体的重链和轻链的多核苷酸(或编码单链多肽或抗体片段(如scfv分子)的多核苷酸)之外,本发明的重组表达载体还可以携带控制抗体链基因在宿主细胞中表达的调控序列。表达载体的设计(包括调控序列的选择)可以取决于此类因素,如待转化的宿主细胞的选择或所希望的蛋白质的表达水平。例如,用于哺乳动物宿主细胞表达的合适调控序列包括指导蛋白在哺乳动物细胞中高水平表达的病毒元件,如源自巨细胞病毒(cmv)(如cmv启动子/增强子)、猿猴病毒40(sv40)(如sv40启动子/增强子)、腺病毒(例如,腺病毒主要晚期启动子(admlp))和多瘤病毒的启动子和/或增强子。对于病毒调控元件及其序列的进一步描述,参见例如美国专利号5,168,062;美国专利号4,510,245和美国专利号4,968,615。
[0306]
除了抗体链或cdr基因以及调控序列之外,本发明的重组表达载体携带还可以携
带另外的序列,如在宿主细胞中调节载体复制的序列(例如,复制起点)和选择性标记基因。选择性标记基因促进其中已经引入载体的宿主细胞的选择(参见例如,美国专利号4,399,216;4,634,665以及5,179,017)。例如,通常,选择性标记基因对其中已经引入载体的宿主细胞赋予对细胞毒性药物(如g418、嘌呤霉素、杀稻瘟菌素、潮霉素或氨甲蝶呤)的抗性。合适的选择性标记基因包括二氢叶酸还原酶(dhfr)基因(用于在用甲氨蝶呤选择/扩增的dhfr”宿主细胞中使用)和neo基因(用于g418选择)。为了表达tnfr2抗体或tnfr2抗体片段的轻链和重链,可以通过标准技术将含有编码重链和轻链的多核苷酸的表达载体转染到宿主细胞中。
[0307]
编码经修饰的拮抗性tnfr2多肽的多核苷酸
[0308]
在一些实施例中,拮抗性tnfr2多肽(例如,本发明的单链多肽、抗体或抗体片段)可以与tnfrab1或tnfrab2类似,但在一个或多个cdr的序列中具有不同的特征。在其他情况下,本发明的多肽可以与tnfrab1或tnfrab2类似,但在一个或多个框架区中具有不同的特征。例如,tnfrab1或tnfrab2的一个或多个框架区可以被人抗体的框架区取代。示例性框架区包括例如us 7,829,086中描述的人框架区和ep 1945668中描述的灵长类动物框架区;通过引用结合在此。可替代地,本发明的多肽(例如,单链多肽、抗体或其抗原结合片段)可以与tnfrab1或tnfrab2类似,但在一个或多个cdr的序列以及一个或多个框架区中表现出差异。为了产生编码这样的tnfr2拮抗剂多肽的核酸,编码例如轻链可变区和重链可变区的至少一个或两个中的一个或多个cdr的dna片段可以通过化学合成(例如,通过固相多核苷酸合成技术)、体外基因扩增(例如,通过聚合酶链式反应技术)、或通过在宿主生物体中多核苷酸的复制来产生。例如,编码本发明的抗tnfr2多肽的核酸可以通过扩增和修饰编码轻链和重链可变序列的种系dna或cdna来获得,以便将tnfrab1或tnfrab2的cdr掺入共有抗体的框架残基中。在一些实施例中,人源化拮抗性tnfr2抗体可以包括tfnrab1的一个或多个cdr或与相对于tnfrab1的cdr序列含有一至三个氨基酸取代(例如,保守性或非保守性取代)的这些cdr或序列中的任一个具有至少85%序列同一性(例如,90%、95%、97%、99%或100%序列同一性)的其变体,和fnrab2的一个或多个cdr或与相对于tnfrab2的cdr序列含有一至三个氨基酸取代(例如,保守性或非保守性取代)的这些cdr或序列中的任一个具有至少85%序列同一性(例如,90%、95%、97%、99%或100%序列同一性)的其变体。这可以例如通过对种系dna或cdna进行定点诱变并使用聚合酶链式反应(pcr)根据已建立的程序扩增所得的多核苷酸来实现。人重链和轻链可变区基因的种系dna序列是本领域已知的(参见,例如,“vbase”人类种系序列数据库;还参见kabat等人,sequences of proteins of immunological interest,fifth edition[免疫学感兴趣的蛋白质的序列,第五版],u.s.department of health and human services[美国卫生和公共服务部],nih公开号91-3242,1991;tomlinson等人,j.mol.biol.[分子生物学杂志]227:776-798,1992;以及cox等人,eur.j.immunol.[欧洲免疫学杂志]24:827-836,1994;通过引用结合在此)。编码含有tnfrab1和tnfrab2的一个或多个cdr的人重链和轻链可变区的嵌合核酸构建体可以例如使用本领域已知的已建立的克隆技术来产生。此外,可以合成编码tnfrab1或tfnrab2的重链或轻链可变区的多核苷酸,并用作诱变的模板以使用常规诱变技术产生如本文所述的变体。可替代地,可以直接合成编码该变体的dna片段(例如,通过已建立的固相核酸化学合成程序)。
[0309]
一旦获得编码tnfrab1、tnfrab2、tnfrab1相关或tfnrab2相关的cdr或vh和vl区段的dna片段,则可以通过标准重组dna技术进一步操作这些dna片段例如以将可变区基因转化为全长抗体链基因、fab片段基因或scfv基因。在这些操纵中,编码vl或vh的dna片段有效地连接到编码另一种蛋白质的另一个dna片段,例如抗体恒定区或柔性接头。
[0310]
可以例如通过将编码vh的dna有效地与编码重链恒定区结构域(ch1、ch2、ch3以及任选地,ch4)的另一个dna分子连接来将编码本发明的抗tnfr2抗体的vh区的分离的dna转化成全长重链基因(以及fab重链基因)。人类重链恒定区基因的序列是本领域已知的(参见例如,kabat等人,sequences of proteins of immunological interest,fifth edition[免疫学感兴趣的蛋白质的序列,第五版],u.s.department of health and human services[美国卫生和公共服务部],nih公开号91-3242,1991),并且通过标准pcr扩增可以获得涵盖这些区域的dna片段。重链恒定区可以是igg1、igg2、igg3、igg4、iga、ige、igm或igd恒定区,并且在某些实施例中是igg1恒定区。对于fab片段重链基因,编码vh的dna可以有效地连接到仅编码重链ch1结构域的另一dna分子。
[0311]
可以通过将编码vl的dna有效地连接至编码轻链恒定区cl的另一dna分子来将编码本发明的抗tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)的vl区的分离的dna转化为全长轻链基因(以及fab轻链基因)。人类轻链恒定区基因的序列是本领域已知的(参见例如,kabat等人,sequences of proteins of immunological interest,fifth edition[免疫学感兴趣的蛋白质的序列,第五版](u.s.department of health and human services[美国卫生和公共服务部],nih公开号91-3242,1991)),并且例如通过在编码这些区域的多核苷酸的原核或真核细胞中扩增、通过pcr扩增或通过化学多核苷酸合成可以获得涵盖这些区域的dna片段。轻链恒定区可以是κ或λ恒定区,但在某些实施例中是κ恒定区。为了产生scfv基因,编码vh和vl的dna片段有效地连接至编码柔性接头的另一片段,例如编码柔性亲水性氨基酸序列(如氨基酸序列(gly4ser)3)的多核苷酸,使得vh和v
l
序列可以被表达为连续的单链蛋白,其中v
l
和vh区通过接头连接(参见,例如,bird等人,science[科学]242:423-426,1988;huston等人,proc.natl.acad.sci.usa[美国国家科学院院刊]85:5879-5883,1988;mccafferty等人,nature[自然]348:552-554,1990)。
[0312]
重组dna技术还可以用来去除对于结合tnfr2不必需的编码轻链或重链之一或两者的一些或全部dna。本发明的多肽也包括这样的截短的dna分子表达的分子。此外,可以产生双功能多肽(例如双功能抗体),其中一条重链和一条轻链来源于tnfrab1和/或tnfrab2,并且另一条重链和轻链对tnfr2以外的抗原具有特异性。这样的抗体可以例如通过标准化学交联方法(例如,通过形成二硫键)通过将tnfrab1和/或tnfrab2的重链和轻链与第二抗体的重链和轻链进行交联来产生。双功能抗体还可以通过在原核或真核细胞中表达经工程化以编码双功能抗体的核酸分子来制备。
[0313]
可以通过突变轻链和/或重链cdr中的氨基酸残基来产生双重特异性抗体,即,使用同一结合位点结合tnfr2和不同抗原的抗体。在一些实施例中,可以通过突变抗原结合位点周围的氨基酸残基来产生结合两种抗原(如tnfr2和第二细胞表面受体)的双特异性抗体(bostrom等人,science[科学]323:1610-1614,2009)。双功能抗体可以通过表达被工程化以编码双特异性抗体的多核苷酸来制备。
[0314]
本发明的修饰的拮抗性tnfr2抗体和抗体片段还可以通过化学合成来产生(例如,
通过solid phase peptide synthesis[固相肽合成],第二版,1984,the pierce chemical co.[皮尔斯化工有限公司],rockford[罗克福德],111;通过引用结合在此)。变体抗体还可以使用无细胞合成平台来产生(参见,例如,chu等人,biochemia no.2,2001(roche molecular biologicals)[生物化学号2,2001(罗氏分子生物公司)];通过引用结合在此)。
[0315]
用于表达拮抗性tnfr2多肽的宿主细胞
[0316]
有可能在原核或真核宿主细胞中表达本发明的多肽(例如,单链多肽、抗体及其抗原结合片段)。在一些实施例中,在用于优化正确折叠和有免疫活性的抗体的分泌的真核细胞(例如,哺乳动物宿主细胞)中进行多肽(例如,单链多肽、抗体或其抗原结合片段)的表达。用于表达本发明的重组多肽(例如,单链多肽、抗体或其抗原结合片段)的示例性哺乳动物宿主细胞包括中国仓鼠卵巢(cho细胞)(包括urlaub和chasin(1980,proc.natl.acad.sci.usa[美国国家科学院院刊]77:4216-4220)描述的dhfr cho细胞,与例如kaufman和sharp(1982,mol.biol.[分子生物学]159:601-621)描述的dhfr选择性标记一起使用)、nso骨髓瘤细胞、cos细胞、293细胞以及sp2/0细胞。可以用于表达单链多肽、抗体及其片段的另外的细胞类型包括细菌细胞,如bl-21(de3)大肠杆菌细胞,其可以用含有外源dna的载体根据已建立的方案来转化。可以用于表达多肽的另外的真核细胞包括酵母细胞,如酿酒酵母的营养缺陷型菌株,其可以根据本领域已知的已建立的程序被转化并选择性生长于不完全培养基中。当将编码抗体基因(例如编码一个或多个cdr、抗体重链或抗体轻链的基因)的重组表达载体引入哺乳动物宿主细胞中时,通过将宿主细胞培养足以允许在宿主细胞中表达该抗体或将该抗体分泌到其中生长宿主细胞的培养基中的时间段来产生抗体。
[0317]
可以使用标准蛋白质纯化方法从培养基回收多肽(例如,单链多肽、抗体及其抗原结合片段)。宿主细胞还可以用来产生完整抗体的部分,如fab片段或scfv分子。本发明还包括其中根据本领域已知的已建立的方案来改变以上程序的方法。例如,可以期望的是,用编码本发明的抗tnfr2抗体的轻链或重链(但不是两者)的dna转染宿主细胞以产生抗体的抗原结合片段。
[0318]
一旦通过重组表达产生了本发明的抗tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段),则可以通过本领域已知的任何方法纯化,如用于纯化免疫球蛋白分子的方法,例如通过层析法(例如离子交换、亲和力(特别是在蛋白质a或蛋白质g选择后对tnfr2的亲和力)以及尺寸分级柱层析法)、离心、差别溶解度,或者通过用于纯化蛋白质的任何其他标准技术。此外,本发明的抗tnfr2多肽(例如,单链多肽、抗体及其抗原结合片段)可以与本文所述的或本领域另外已知的异源多肽序列融合以促进纯化或产生治疗性缀合物(参见下文的“抗体缀合物”)。
[0319]
一旦分离,如果需要,抗tnfr2抗体或其抗原结合片段可以进一步被纯化,例如通过高效液相层析(参见,例如,fisher,laboratory techniques in biochemistry and molecular biology(work and burdon,eds.,elsevier,1980)[生物化学和分子生物学实验室技术(work和burdon编辑,爱思唯尔出版公司,1980)];通过引用结合在此),或通过凝胶过滤层析法,如在superdex
tm
75柱(pharmacia biotech ab公司,乌普萨拉(uppsala),瑞典)上进行。
[0320]
用于拮抗性抗tnfr2多肽的产生和亲和力成熟的平台
[0321]
促进受体拮抗作用的tnfr2的表位作图
[0322]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体及其抗原结合片段)可以通过筛选功能性分子的多肽(例如,单链多肽、抗体及其抗原结合片段)的文库来产生,其能够结合tnfr2内的选择性促进受体拮抗作用而不是受体活化的表位。从tnfr2蛋白中分离的线性肽可以不采用与位于该蛋白质内的那些肽序列相同的三维构象。tnfr2提供了结构固定的框架,该框架偏离各个肽片段的构象,并通过建立分子内接触(例如,氢键、偶极-偶极相互作用、盐桥)和通过差别定位暴露于溶剂的各种区域(这取决于这些区域的相对亲水性和亲油性)来增强这些空间取向(mukai等人,sci.signal.[科学信号],3:ra83-ra83,2010)。可以通过将tnfr2表位(例如,促进受体拮抗作用的表位)的氨基酸残基掺入结构上预组织的肽支架(如环状、双环、三环或四环肽)来实现tnfr2内的肽片段的构象约束。诸如这些的环状肽和多环肽将肽片段局限于不同的三维构象。这可以通过利用已建立的化学合成方法(例如,利用如本文所述的固相肽合成)合成从tnfr2分离的肽表位并将半胱氨酸残基掺入该肽链内的n-末端和c-末端位置或各种内部位置处的序列中而实现。掺入在硫醇部分处用保护基团化学保护的半胱氨酸残基可以是有利的,所述保护基团可以在不同于用于去除正在合成的肽内的其他保护基团的那些条件并且不同于用于组装肽链的那些条件的条件下去除。半胱氨酸硫醇的示例性正交保护基团包括4-甲基三苯甲基基团和4-甲氧基三苯甲基基团,它们每一个都可以使用稀释的三氟乙酸来去除(实例例如描述于isidro-llobet等人,chem rev.[化学综述],109:2455-2504,2009)。
[0323]
在将半胱氨酸残基引入衍生自tnfr2内的表位的合成肽片段后,可以通过用多价亲电子试剂如双(溴甲基)或三(溴甲基)芳烃衍生物处理该肽来使该肽环化。可以使用替代性多价硫醇反应性亲电子试剂,例如1,5-二氟-2,4-二硝基苯、无环二溴烷烃以及其他(参见,例如,jo等人,j.am.chem.soc.[美国化学会志],134:17704-17713,2012;通过引用结合在此)。在一些实施例中,防止合成肽片段中的半胱氨酸残基参与环化反应可以是有利的。例如,可以期望的是合成含有多个半胱氨酸残基的多环肽,使得仅有选择的半胱氨酸硫醇参与分子内交联过程。为了防止这些另外的cys硫醇基团在偶联反应中的不希望的参与,简单的方法是例如在肽合成的过程期间使用fmoc-cys(acm)(fmoc-乙酰氨基甲基-l-半胱氨酸)用于引入受保护的cys残基。可替代地,可以使用fmoc-cys(stbu)-oh和/或相应的叔丁氧基羰基(boc)保护的氨基酸。该acm或stbu基团在正常的tfa脱保护-裂解反应过程期间不被去除,但在acm基团的情况下需要氧化(例如,碘i2)处理或在stbu基团的情况下需要还原处理(例如,β-巯基乙醇(过量)或1,4-二硫代苏糖醇(过量))以得到还原的巯基形式的肽,其可以直接使用或随后氧化成相应的半胱氨酰肽。在一个实施例中,使用含有至少一种cys衍生物(如cys(acm)或cys(stbu))的肽来允许cys-硫醇基团的选择性脱保护。cys-硫醇基团的选择性脱保护使得cys-硫醇基团可用于在期望的时刻进行反应,如在完成肽链组装之后和在去保护肽内的其他残基之前(参见,例如,wo 2008/013454;通过引用结合在此)。
[0324]
作为实例,含有从tnfr2分离的各个片段和来自tnfr2的不同区域的片段的组合的环状肽和多环肽的文库可以通过如上所述的那些技术合成,以在肽支架内的不同位置掺入半胱氨酸残基,并使用不同的亲电子交联剂(参见,例如,实例1和图3,seq id no:34-117)。可以将这些肽固定在固体表面上,并使用基于elisa的筛选平台使用已建立的程序筛选结合拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段,如tnfrab1或tnfrab2)的分
子。使用该测定,例如以高亲和力与tnfrab1和/或tnfrab2特异性结合的肽因此在tnfr2的表位内含有优先结合tnfrab1和/或tnfrab2的的残基并且可以在结构上预组织这些残基,使得它们类似于天然蛋白质中相应的肽的构象。由此获得的环状肽和多环肽(例如,具有seq id no:11、19、20和34-117中任一个的序列的肽,或在seq id no:7的位置80与130之间含有约10至约30个之间的连续或不连续氨基酸的肽)可用于筛选抗体及其抗原结合片段的文库,以鉴定本发明的抗tnfr2多肽。此外,由于这些受约束的肽充当促进受体拮抗作用的tnfr2内的表位的替代物,因此使用该筛选技术产生的多肽(例如,单链多肽、抗体及其抗原结合片段)可以结合tnfr2中的相应表位,并且预期会对受体活性产生拮抗作用。
[0325]
筛选拮抗性tnfr2多肽的文库
[0326]
用于高通量筛选能够结合tnfr2内的表位(例如,由具有seq id no:11、19、20和34-117中任一个的序列的肽,或在seq id no:7的位置80与130之间含有约10至约30个之间的连续或不连续氨基酸的肽呈现的表位)的分子的多肽(例如,单链多肽、抗体或抗体片段)的文库的方法包括但不限于展示技术,包括噬菌体展示、细菌展示、酵母展示、哺乳动物展示、核糖体展示、mrna展示以及cdna展示。使用噬菌体展示来分离结合生物相关分子的配体的用途已经例如综述于felici等人(biotechnol.annual rev.[生物技术年鉴]1:149-183,1995),katz(annual rev.biophys.biomol.struct.[生物物理学与生物分子结构年鉴]26:27-45,1997),以及hoogenboom等人(immunotechnology[免疫技术]4:1-20,1998)中。已经构建了几个随机化的组合肽文库来选择结合不同靶标(例如,细胞表面受体或dna)的多肽(由kay(perspect.drug discovery des.[药物发现与设计展望]2,251-268,1995);kay等人(mol.divers.[分子多样性]1:139-140,1996)综述)。蛋白质和多聚体蛋白质已经成功地被噬菌体展示为功能性分子(参见ep 0349578 a、ep 4527839 a、ep 0589877 a;chiswell和mccafferty(trends biotechnol.[生物技术趋势]10,80-84,1992)。此外,功能性抗体片段(例如,fab、单链fv[scfv])已被表达(mccafferty等人(nature[自然]348:552-554,1990),barbas等人(proc.natl.acad sci.usa[美国国家科学院院刊]88:7978-7982,1991),clackson等人(nature[自然]352:624-628,1991))。这些参考文献通过引用以其整体结合在此。
[0327]
(i)噬菌体展示技术
[0328]
作为实例,可以使用噬菌体展示技术来筛选能够结合含有tnfr2内的表位的环状肽或多环肽的功能分子的多肽(如单链多肽、抗体及其抗原结合片段)文库,该多肽促进受体拮抗作用(例如,具有seq id no:11、19、20和34-117中任一个的序列的肽,并且特别是含有如seq id no:42、50、52-54和61-63中的kcrpg基序的那些)。例如,编码含有随机化高变区的单链抗体片段(如scfv片段)的多核苷酸文库可以使用已建立的程序获得(例如,固相多核苷酸合成或易错pcr技术,参见mccullum等人(meth.mol.biol.[分子生物学方法]634:103-109,2010;通过引用结合在此)。随后可以将这些随机化的多核苷酸掺入病毒基因组中,使得由这些基因编码的随机化抗体链在丝状噬菌体的表面上表达,例如通过抗体链与外壳蛋白(例如,在m13噬菌体表面上的piii外壳蛋白)之间的共价键。这提供了抗体链的基因型和表型之间的物理连接。以这种方式,可以针对外部抗体链结合tnfr2表位的能力来筛选在高变区中展示含有随机突变的不同抗体链的噬菌体文库(例如,具有seq id no:11、19、20和34-117中任一项的序列的肽,或在seq id no:7的位置80与130之间含有约10至约
30个之间的连续或不连续氨基酸的肽),这些表位已经使用已建立的程序被固定至表面。例如,通过在肽和表位标签(例如,生物素)之间形成共价键并将肽在微量滴定板的孔中孵育,可以将含有kcrpg基序的环状肽(如由seq id no:42、50、52-54和61-63所表示的那些)物理结合到微量滴定板的表面,所述微量滴定板先前已经涂有以高亲和力结合与肽连接的标签的互补标签(例如,亲和素)。合适的表位标签包括但不限于麦芽糖结合蛋白、谷胱甘肽-s-转移酶、聚组氨酸标签、flag-标签、myc-标签、人流感血球凝集素(ha)标签、生物素、链霉亲和素。含有由这些分子呈现的表位的肽能够被固定在含有这样的互补分子(分别如麦芽糖、谷胱甘肽、含镍复合物、抗flag抗体、抗myc抗体、抗ha抗体、链霉亲和素或生物素)的表面上。以这种方式,噬菌体可以与含有固定的tnfr2衍生的肽的表面一起孵育一段适合的时间,以允许抗体与受约束的肽结合并且在适当的缓冲系统(例如,包含生理盐浓度、离子强度并通过缓冲剂维持在生理ph的的一个系统)存在下。然后可以洗涤该表面(例如,用含有0.1%tween-20的磷酸盐缓冲液)以去除不呈现抗体链的噬菌体,所述抗体链以大于特定阈值的亲和力与tnfr2衍生肽相互作用。
[0329]
可以通过调节洗涤步骤的条件(例如,通过包括弱酸性或碱性组分,或通过包括低浓度的其他tnfr2衍生肽以与固定的肽竞争抗原结合位点)来调整在该初始淘选(即,筛选)步骤之后剩余的多肽的亲和力。以这种方式,在洗涤步骤之后保持与微量滴定板的表面结合的噬菌体群体富集了结合促进受体拮抗作用的tnfr2衍生肽表位的噬菌体。然后可以通过从含有这些肽的表面洗脱噬菌体(例如,通过改变环境ph、离子强度或温度)以减小蛋白质-蛋白质相互作用强度来扩增剩余的噬菌体。然后可以例如通过感染细菌细胞来扩增分离的噬菌体,并且可以任选地通过另外的重复筛选对所得的噬菌体进行淘选,从而进一步富集携带更高亲和力的抗tnfr2多肽的那些噬菌体群体。在这些淘选阶段之后,随后可以分离展示高亲和力的抗体或其抗原结合片段的噬菌体,并且可以对这些噬菌体的基因组进行测序以鉴定所编码的抗体的多核苷酸和多肽序列。诸如这种的噬菌体展示技术可以用于产生例如可用作tnfr2拮抗剂的抗体链,如scfv片段、串联scfv片段以及本发明的其他抗原结合片段。用于鉴定以高亲和力结合特定抗原的抗体链及其抗原结合片段的示例性噬菌体展示方案是充分确立的并且描述于例如美国专利号7,846,892;wo 1997/002342;美国专利号8,846,867和wo 2007/132917中;通过引用结合在此。可以使用类似的噬菌体展示技术来产生结合促进受体拮抗作用的tnfr2内的表位的本发明的抗体样支架(例如,
10
fn3结构域)(例如,由具有seq id no:11、19、20和34-117中任一个的序列的肽呈现的表位,并且特别是含有如在seq id no:42、50、52-54和61-63中的kcrpg基序的那些)。用于鉴定抗体样支架蛋白的示例性噬菌体展示方案描述于例如wo 2009/086116中;通过引用结合在此。
[0330]
(ii)基于细胞的展示技术
[0331]
利用溶剂暴露的多肽(例如,单链多肽、抗体或其抗原结合片段)的基因型和表型之间的连接的其他体外展示技术包括酵母和细菌展示。本领域建立了酵母展示技术,并且其通常是有利的,因为大量的抗体(通常多达30,000个)可以呈现于单个酵母细胞的表面上(参见,例如,boder等人(nat biotechno.[自然生物技术]15:553,1997);通过引用结合在此)。比丝状噬菌体更大的酵母细胞能够实现另外的筛选策略,因为可以使用流式细胞术来分析并分选酵母文库。例如,可以使用已建立的程序来产生表达含有随机化高变区的多肽(如单链多肽、抗体或抗体片段)的细菌细胞或酵母细胞的文库(参见,例如,参见美国专利
号7,749,501和us 2013/0085072;将其各自的传授内容通过引用结合在此)。例如,表达编码初始scfv片段的多核苷酸的酵母细胞大型文库可以使用已建立的程序来制备(de bruin等人,nat biotechnol[自然生物技术]17:397,1999;通过引用结合在此)。然后可以在淘选步骤期间将表达这些多核苷酸的酵母细胞与以下两种不同的荧光分子一起孵育:一种染料,结合抗体内的保守残基并因此反映展示的抗体的量;以及另一种染料,以不同波长发荧光并结合抗原并因此指示结合的抗原的量。在这些情况下,使用含有seq id no:11、19、20和34-117中任一个的序列的环状肽或多环肽(并且特别是含有如seq id no:42、50、52-54和61-63中的kcrpg基序的那些)是有用的,所述环状肽或多环肽已经任选地在预期不会干扰抗体-抗原结合的残基处与表位标签(例如,生物素)缀合。这能够使用互补标签(例如,亲和素)标记的荧光染料定位于抗体-抗原复合物。这对选择的进展产生了极大的灵活性和即时反馈。与噬菌体展示相比,通过归一化抗体展示水平,可以容易地选择具有更高亲和力而不是更高表达水平的抗体。实际上,有可能区分和分选其亲和力仅相差两倍的抗体(vanantwerp和wittrup(biotechnol prog[生物技术进展]16:31,2000))。
[0332]
(iii)核苷酸展示技术
[0333]
利用随机化多核苷酸文库的体外翻译的显示技术也为产生本发明的抗tnfr2抗体提供了强有力的方法。例如,编码单链多肽、抗体或其抗原结合片段的、在指定高变区内含有突变的随机化dna文库可以例如使用如本文所述的已建立的基于pcr的诱变技术来获得。这些文库的多核苷酸可以含有转录调节序列(如启动子和转录终止序列),并且可以另外编码增加所得mrna构建体的翻译速率的序列(例如,ires序列、5'和3’utr、聚-腺苷酸化段等)。可以将这些多核苷酸文库在含有rna聚合酶和rna核苷三磷酸(ntp)的适当缓冲的溶液中孵育,以使dna序列能够转录成感受态的mrna分子,所述mrna分子随后可以被大的和小的核糖体亚基、氨酰trna分子以及溶液中存在的翻译起始和延伸因子翻译(例如,使用体外蛋白质合成试剂盒,new england)。设计的mrna修饰可以使抗体产物通过与嘌呤霉素的化学结合而能够保持与mrna模板的共价结合(例如,参见keefe(curr.protoc.mol.biol.[当代分子生物学方案],第24章,第24.5单元,2001);通过引用结合在此)。因此,这种基因型-表型连接可以用于选择结合tnfr2衍生肽(例如,具有seq id no:11、19、20和34-117中任一个的序列的肽,并且特别是含有如seq id no:42、50、52-54和61-63中的kcrpg基序的那些)的抗体,该选择通过将mrna:抗体融合构建体与固定到表面的肽一起孵育进行并以与噬菌体展示技术类似的方式进行淘选(参见,例如,wo 2006/072773;通过引用结合在此)。
[0334]
任选地,可以使用类似的技术产生本发明的多肽(例如,单链多肽、抗体或其抗原结合片段),除了多肽产物可以非共价结合至核糖体-mrna复合物而不是经由嘌呤霉素接头共价结合。被称为核糖体展示的这一平台已经例如描述于美国专利号7,074,557中;通过引用结合在此。可替代地,可以使用cdna展示来产生抗体,该cdna展示是一种类似于mrna展示的技术,除了cdna而不是mrna通过嘌呤霉素接头共价结合抗体产物之外。cdna展示技术提供了能够在日益严格的条件下执行淘选步骤的优点,例如在以下条件下:其中调节盐浓度、离子强度、ph和/或环境的温度以筛选对tnfr2衍生肽具有特别高亲和力的抗体。这是由于双链cdna相比单链mrna的更高的天然稳定性。cdna展示筛选技术例如描述于ueno等人(methods mol.biol.[分子生物学方法],805:113-135,2012)中;通过引用结合在此。
[0335]
除了产生本发明的抗tnfr2多肽之外,体外展示技术(例如,本文所述的那些和本领域已知的那些)还提供了用于改善本发明的抗tnfr2多肽的亲和力的方法。例如,不是筛选含有完全随机化高变区的单链多肽、抗体及其片段的文库,而是可以筛选特征为在高变区内的特定位点处具有靶向突变的单链多肽、抗体及其抗原结合片段的更窄文库。这可以例如通过组装编码抗体或其抗原结合片段的多核苷酸的文库来实现,所述多核苷酸仅在高变区内的特定位点处编码随机突变。然后可以在例如丝状噬菌体、细菌细胞、酵母细胞、哺乳动物细胞中或体外使用例如核糖体展示、mrna展示或cdna展示技术来表达这些多核苷酸,来筛选以改善的结合亲和力特异性结合tnfr2表位(例如,含有seq id no:11、19、20和34-117中任一个的序列的肽,并且特别是含有如在seq id no:42、50、52-54和61-63中的kcrpg基序的那些)的多肽(如单链多肽、抗体或其抗原结合片段)。酵母展示特别适用于亲和力成熟,并且之前已经用于提高单链抗体的亲和力至48fm的kd(boder等人(proc natl acad sci usa[美国国家科学院院刊]97:10701,2000))。
[0336]
可以用于本发明的拮抗性tnfr2抗体的产生和亲和力成熟的另外的体外技术包括筛选能够特异性结合tnfr2衍生多肽(例如,具有seq id no:11、19、20和34-117中任一个的氨基酸序列的肽,如seq id no:42、50、52-54和61-63)的功能性分子的多肽(如单链多肽、抗体或其抗原结合片段)的组合文库。组合多肽文库如抗体或抗体片段文库可以例如通过在真核或原核细胞中表达编码抗体或其抗原结合片段的随机化高变区的多核苷酸来获得。这可以例如使用本文所述的或本领域已知的基因表达技术来实现。可以例如通过蛋白质a或蛋白质g选择、尺寸分级柱层析法、离心、差异溶解度和/或通过用于纯化蛋白质的任何其他标准技术来纯化抗体的异质混合物。可以例如通过将这些抗体的异质混合物与固定在表面上的源自tnfr2的肽(例如,固定到固相树脂的表面或微量滴定板的孔中的具有seq id no:11、19、20和34-117中任一个的氨基酸序列的肽)一起孵育一段足以允许抗体-抗原结合的时间来筛选如此获得的组合文库的文库。可以通过用适当的缓冲液(例如,在生理ph(约7.4)下缓冲且含有生理盐浓度和离子强度并且任选地含有洗涤剂如tween-20的一种溶液)洗涤所述表面来去除非结合的抗体或其片段。随后可以例如使用基于elisa的检测方案来检测保持结合的抗体(参见,例如,美国专利号4,661,445;通过引用结合在此)。
[0337]
用于筛选特异性结合tnfr2衍生肽的那些多肽的组合文库的另外的技术(例如,含有seq id no:11、19、20和34-117中任一个的氨基酸序列的肽,如seq id no:42、50、52-54和61-63)包括筛选单链多肽或抗体片段的一珠一化合物文库。单链多肽和抗体片段可以在固体珠上化学合成(例如,使用已建立的分离-和-聚池固相肽合成方案),该固体珠由亲水的水可溶胀性材料组成,使得每个珠展示单个抗体片段。然后可以将异质珠混合物与tnfr2衍生肽一起孵育,该tnfr2衍生肽任选地用可检测部分(例如,荧光染料)标记或与表位标签(例如,生物素、亲和素、flag标签、ha标签)缀合,该表位标签稍后可以通过用互补标签(例如,分别是亲和素、生物素、抗flag抗体、抗ha抗体)处理来检测。含有特异性结合tnfr2衍生肽(例如,含有seq id no:11、19、20和34-117中任一个的氨基酸序列的肽,如seq id no:42、50、52-54和61-63)的抗体片段的珠可以通过分析珠的荧光特性随后与荧光标记的抗原或互补标签一起孵育来鉴定(例如,通过共焦荧光显微镜或通过荧光激活的珠粒分选;参见例如,muller等人(j.biol.chem.[生物化学杂志],16500-16505,1996);通过引用结合在此)。因此,含有特异性结合tnfr2衍生肽的抗体片段的珠可以与不含有高亲和力抗体片段
的珠分开。可以通过本领域已知的技术,包括例如埃德曼降解、串联质谱、基质辅助的激光解吸飞行时间质谱(maldi-tof ms)、核磁共振(nmr)和2d凝胶电泳等来确定特异性结合tnfr2衍生肽的抗体片段的序列(参见,例如,wo 2004/062553;通过引用结合在此)。
[0338]
多肽的阴性筛选
[0339]
除了上述用于筛选特异性结合源自人tnfr2的含有kcr或kcrpg基序的表位的单链多肽、抗体或抗体片段的方法之外,还可以另外进行阴性筛选以消除也可以结合含有kcspg序列的表位的单链多肽、抗体或抗体片段。例如,可以针对也特异性结合源自人tnfr2的含有kcspg基序的肽(如含有seq id no:7的残基48-67(qtaqmccskcspgqhakvfc,seq id no:18)的肽)的单链多肽、抗体或抗体片段,来筛选由于任何上述筛选技术而分离的单链多肽、抗体或抗体片段的混合物。这可以使用任何上述方法或其变体来实现,例如,使得筛选的单链多肽、抗体或抗体片段是先前鉴定为能够特异性结合含有kcrpg序列(例如,至少kcr序列)的一个或多个残基的那些。用于阴性筛选的示例性技术包括以上所述的或本领域已知的那些技术,如噬菌体展示、酵母展示、细菌展示、核糖体展示、mrna展示、cdna展示或基于表面的组合文库筛选(例如,以elisa格式)。这种筛选技术代表了鉴定拮抗性tnfr2单链多肽、抗体和抗体片段的有用策略,因为能够结合含有kcspg序列、和kcrpg序列的一个或多个残基的tnfr2表位的多肽已经显示缺乏或具有显著降低的拮抗活性。
[0340]
非人哺乳动物的免疫
[0341]
可以用于产生本发明的拮抗性tnfr2抗体或抗体片段的另一策略包括对非人哺乳动物进行免疫。为了产生本发明的拮抗性tnfr2抗体及其片段,可以被免疫的非人哺乳动物的实例包括兔、小鼠、大鼠、山羊、豚鼠、仓鼠、马和绵羊、以及非人灵长类动物。例如,用于免疫灵长类动物的已建立的程序是本领域已知的(参见,例如,wo 1986/6004782;通过引用结合在此)。免疫代表通过利用b淋巴细胞的抗原特异性产生单克隆抗体的稳健方法。例如,单克隆抗体可以通过kohler-millstein程序(例如,描述于ep 0110716;通过引用结合在此)来制备,其中用呈递促进受体拮抗作用的tnfr2衍生抗原的肽(例如,含有seq id no:11、19、20和34-117中任一个的氨基酸序列的肽,如seq id no:42、50、52-54和61-63)免疫来自非人动物(例如,灵长类动物)的脾细胞。可以从动物的血清中分离通过免疫产生的克隆扩增的b淋巴细胞并随后与骨髓瘤细胞融合以形成杂交瘤。杂交瘤是用于抗体生产的特别有用的药剂,因为这些永生化细胞可以提供抗原特异性抗体的持久供应。随后可以使用本领域已知的技术分离来自这样的杂交瘤的抗体,例如通过使用试剂如蛋白质a或蛋白质g通过亲和层析从细胞培养基中纯化抗体。
[0342]
拮抗性tnfr2多肽缀合物
[0343]
在将本发明的拮抗性tnfr2多肽给予哺乳动物受试者(例如人)之前,希望的是将该多肽(例如,单链多肽、抗体或其抗原结合片段)与第二分子缀合例如以调节体内多肽的活性。可以使用本领域熟知的多种已建立的缀合策略中的任何一种,将拮抗性tnfr2单链多肽、抗体及其片段缀合至该多肽的轻链或重链的n-末端或c-末端处的其他分子。可以用于将拮抗性tnfr2单链多肽、抗体或其片段共价系拴至另一分子的反应性官能团对的实例包括但不限于硫醇对、羧酸和氨基基团、酮和氨基基团、醛和氨基基团、硫醇和α、β-不饱和部分(如马来酰亚胺或脱氢丙氨酸)、硫醇和α-卤代酰胺、羧酸和酰肼、醛和酰肼、以及酮和酰肼。
[0344]
拮抗性tnfr2单链多肽、抗体及其片段可以通过如所述的化学缀合直接共价附加到另一个分子上。可替代地,可以从细胞(例如,真核细胞或原核细胞)重组表达含有拮抗性tnfr2单链多肽、抗体及其片段的融合蛋白。这可以例如通过将编码该融合蛋白的多核苷酸掺入细胞的核基因组(例如,使用本文所述的或本领域已知的技术)来实现。任选地,本发明的单链多肽、抗体及其片段可以通过在抗体和接头之间形成共价键而连接至第二分子。然后,该接头可以随后与另一个分子缀合,或者该接头可以在与抗tnfr2单链多肽、抗体或其片段连接之前与另一个分子缀合。可以用于形成缀合物的接头的实例包括多肽接头,如那些含有天然存在或非天然存在的氨基酸的接头。在一些实施例中,希望在接头中包含d-氨基酸,因为这些残基不存在于天然存在的蛋白质中并且因此对被内源性蛋白酶降解更具抗性。可以使用化学合成技术(如本文所述的那些),或通过在细胞(例如,原核或真核细胞)中重组表达编码该融合蛋白的多核苷酸来制备含有多肽接头的融合蛋白。可以使用本领域熟知的各种策略并且取决于接头的反应性组分来制备接头,可以通过酶水解、光解、酸性条件下的水解、碱性条件下的水解、氧化、二硫键还原、亲核切割或有机金属切割来切割接头(leriche等人,bioorg.med.chem.[生物有机化学与医药化学],20:571-582,2012]。
[0345]
药物-多肽缀合物
[0346]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)可以另外与治疗剂(如细胞毒性分子)缀合、混合或分开给予。本发明的缀合物可适用于治疗或预防与异常细胞增殖相关的疾病,如本文所述的癌症。可以与拮抗性tnfr2多肽缀合、混合或分开给予的示例性细胞毒性剂包括但不限于抗肿瘤剂,如:阿西维辛;阿柔比星;盐酸阿考达唑;阿克罗宁;阿多来新;阿霉素;阿地白介素;六甲蜜胺;安波霉素;阿美蒽醌乙酸盐;氨鲁米特;安吖啶;阿那曲唑;安曲霉素;天冬酰胺酶;曲林菌素;阿扎胞苷;阿扎替派;阿佐霉素;巴马司他;苯佐替派;比卡鲁胺;盐酸双蒽生;二甲磺酸双奈法德;比折来新;硫酸博来霉素;布喹那钠;溴匹立明;白消安;放线菌素c;卡普睾酮;喜树碱;卡醋胺;卡贝替姆;卡铂;卡莫司汀;盐酸卡柔比星;卡折来新;西地芬戈;苯丁酸氮芥;西罗霉素;顺铂;克拉屈滨;考布他汀a-4;甲横酸克立那托;环磷酰胺;阿糖胞苷;达卡巴嗪;daca(n-[2-(二甲基-氨基)乙基]吖啶-4-甲酰胺);更生霉素;盐酸柔红霉素;道诺霉素;地西他滨;右奥马铂;地扎胍宁;甲磺酸地扎胍宁;地吖醌;多西他赛;多拉司他汀;多柔比星;盐酸阿霉素;屈洛昔芬;柠檬酸屈洛昔芬;丙酸屈他雄酮;达佐霉素;依达曲沙;盐酸依氟鸟氨酸;玫瑰树碱;依沙芦星;恩洛铂;恩普氨酯;依匹哌啶;盐酸表柔比星;厄布洛唑;盐酸伊索比星;雌莫司汀;雌莫司汀磷酸钠;依他硝唑;乙碘油i 131;依托泊苷;磷酸依托泊苷;氯苯乙嘧胺;盐酸法倔唑;法扎拉滨;芬维a胺;氟尿苷;磷酸氟达拉滨;氟尿嘧啶;5-fdump;氟西他滨;磷喹酮;福司曲星钠;吉西他滨;盐酸吉西他滨;金au 198;高喜树碱;羟基脲;盐酸伊达比星;异环磷酰胺;伊莫福新;干扰素α-2a;干扰素α-2b;干扰素α-nl;干扰素α-n3;干扰素β-1a;干扰素γ-1b;异丙铂;盐酸伊立替康、醋酸兰瑞肽;来曲唑;亮丙瑞林乙酸盐;盐酸利阿唑;洛美曲索钠;洛莫司汀;盐酸洛索蒽醌;马索罗酚;美坦辛;盐酸氮芥;醋酸甲地孕酮;乙酸甲烯雌醇;美法仑;美诺立尔;巯基嘌呤;甲氨蝶呤;甲氨蝶呤钠;氯苯氨啶;美妥替哌;米丁度胺;米托克星;丝裂红素;米托洁林;米托马星;丝裂霉素;米托司培;米托坦;盐酸米托蒽醌;麦考酚酸;诺考达唑;诺拉霉素;奥马铂;奥昔舒仑;紫杉醇;培门冬酶;培利霉素;戊氮芥;peploycinsulfate;培磷酰胺;哌泊溴烷;哌泊舒凡;盐酸吡罗蒽醌;普卡霉素;普洛美坦;卟吩姆钠;甲基丝裂霉素;泼尼莫司
汀;盐酸丙卡巴肼;嘌呤霉素;盐酸嘌呤霉素;吡唑呋林;根霉素;根霉素d;利波腺苷;罗谷亚胺;沙芬戈;盐酸沙芬戈;司莫司汀;辛曲秦;司泊索非钠;司帕霉素;盐酸锗螺胺;螺莫司汀;螺铂;链黑霉素;链脲菌素;氯化锶sr 89;磺氯苯脲;太利苏霉素;紫杉烷;紫杉烷二萜;替可加兰钠;替加氟;盐酸替洛蒽醌;替莫泊芬;替尼泊苷;替罗昔隆;睾内酯;硫咪嘌呤;硫鸟嘌呤;噻替派;thymitaq;噻唑呋林;替拉扎明;雷替曲塞;top53;盐酸托泊替康、柠檬酸托瑞米芬;醋酸曲托龙;磷酸曲西立滨;三甲曲沙;葡萄糖醛酸三甲曲沙;曲普瑞林;盐酸妥布氯唑;乌拉莫司汀;乌瑞替派;伐普肽;维替泊芬;长春碱;硫酸长春碱;长春新碱;硫酸长春新碱;长春地辛;硫酸长春地辛;硫酸长春匹定;硫酸长春甘酯;硫酸长春罗辛;酒石酸长春瑞滨;硫酸长春罗定;硫酸长春利定;伏氯唑;折尼铂;净司他丁;盐酸佐柔比星;2-氯脱氧腺苷;2'脱氧间型霉素;9-氨基喜树碱;雷替曲塞;n-炔丙基-5,8-二脱氮叶酸;2-氯-2'-阿拉伯糖-氟-2'-脱氧腺苷;2-氯-2'-脱氧腺苷;茴香霉素;曲古抑菌素a;hprl-g129r;cep-751;利诺胺;硫芥子气;氮芥子气(二氯甲基二乙胺);环磷酰胺;美法仑;苯丁酸氮芥;异环磷酰胺;白消安;n-甲基-亚硝基脲(mnu);n,n'-双(2-氯乙基)-n-亚硝基脲(bcnu);n-(2-氯乙基)-n'环己基-n-亚硝基脲(ccnu);n-(2-氯乙基)-n'-反式-4-甲基环己基-n-亚硝基脲(meccnu);n-(2-氯乙基)-n'-(二乙基)乙基膦酸酯-n-亚硝基脲(福莫司汀);链脲佐菌素;达卡巴嗪(dtic);米托唑胺;替莫唑胺;噻替派;丝裂霉素c;azq;阿多来新;顺铂;卡铂;奥马铂;奥沙利铂;c1-973;dwa 2114r;jm216;jm335;双(铂);雷替曲塞;阿扎胞苷;阿糖胞苷;吉西他滨;6-巯基嘌呤;6-硫鸟嘌呤;次黄嘌呤;替尼泊苷9-氨基喜树碱;拓扑替康;cpt-11;多柔比星;道诺霉素;表柔比星;伊达比星;米托蒽醌;洛索蒽醌;更生霉素(放线菌素d);安吖啶;吡唑啉吖啶;全反式视黄醇;14-羟基-反-视黄醇;全反式视黄酸;n-(4-羟基苯基)维甲酰胺;13-顺式视黄酸;3-甲基ttneb;9-顺式视黄酸;氟达拉滨(2-f-ara-amp);或2-氯脱氧腺苷(2-cda)。
[0347]
可以与本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段缀合、混合或分开给予以治疗、预防或研究与异常细胞增殖相关的疾病的进展的其他治疗性化合物包括但不限于细胞毒性剂,如20-pi-1,25二羟基维生素d3;5-乙炔基尿嘧啶;阿比特龙;酰基夫文;腺环戊醇;阿多来新;阿地白介素;all-tk拮抗剂;六甲蜜胺;氨莫司汀;阿米多克斯(amidox);氨磷汀;氨基乙酰丙酸;氨柔比星;安吖啶;阿那格雷;阿那曲唑;穿心莲内酯;血管生成抑制剂;拮抗剂d;拮抗剂g;安雷利克斯;抗背部化形态发生蛋白-1;抗雄激素,前列腺癌;抗雌激素;抗瘤酮;反义寡核苷酸;阿非迪霉素甘氨酸;细胞凋亡基因调节物;细胞凋亡调控剂;脱嘌呤核酸;ara-cdp-dl-ptba;精氨酸脱氨酶;阿苏莱克林(asulacrine);阿他美坦;阿莫司汀;阿耐司汀(axinastatin)1;阿耐司汀(axinastatin)2;阿耐司汀(axinastatin)3;阿扎司琼;阿扎毒素;重氮酪氨酸;巴卡亭iii衍生物;巴拉诺(balanol);巴马司他;bcr/abl拮抗剂;苯并二氢卟酚;苯甲酰星状孢菌素(benzoylstaurosporine);β内酰胺衍生物;β-alethine;亚阿克拉霉素b;桦木酸;bfgf抑制剂;比卡鲁胺;比生群;双吖丙啶基精胺;双奈法德;bistratenea;比折来新;布瑞弗莱特(breflate);博来霉素a2;博来霉素b2;溴匹立明;布度钛;丁胱亚磺酰亚胺;卡泊三醇;卡弗他丁c;喜树碱衍生物(例如,10-羟基-喜树碱);金丝雀痘il-2;卡培他滨;甲酰胺-氨基-三唑;羧基酰氨基三唑;carest m3;carn 700;软骨衍生抑制剂;卡折来新;酪蛋白激酶抑制剂(icos);粟树精胺;天蚕素b;西曲瑞克;二氢卟酚;氯喹喔啉磺酰胺;西卡前列素;顺卟啉;克拉屈滨;氯米芬类似物;克霉唑;柯林斯霉菌
素a;柯林斯霉菌素b;康普瑞汀a4;康普瑞汀类似物;康那格林(conagenin);康伯西汀(crambescidin)816;克立那托;念珠藻环肽8;念珠藻环肽a衍生物;库拉素a;环戊蒽醌;赛克普拉特(cycloplatam);赛普米新(cypemycin);阿糖胞苷十八烷基磷酸酯;溶细胞因子;磷酸己烷雌酚;达昔单抗;地西他滨;脱氢膜海鞘素b;2'脱氧助间型霉素(dcf);地洛瑞林;右异环磷酰胺;右雷佐生;右维拉帕米;地吖醌;膜海鞘素b;迪多克斯(didox);二乙基去甲精胺;二氢-5-氮杂胞苷;二氢紫杉酚;9-二氧杂霉菌素;联苯螺莫司汀;圆皮海绵内酯;二十二醇;多拉司琼;脱氧氟尿苷;屈洛昔芬;屈大麻酚;多卡米新sa;依布硒;依考莫司汀;依地福新;依决洛单抗;依洛尼塞;榄香烯;乙嘧替氟;表柔比星;埃博霉素(a,r=h;b,r=me);表硫酮(epithilone);依立雄胺;雌莫司汀类似物;雌激素激动剂;雌激素拮抗剂;依他硝唑;依托泊苷;依托泊苷4'-磷酸酯(etopofos);依西美坦;法屈唑;法扎拉滨;芬维a胺;非格司亭;非那雄胺;黄酮吡多;氟卓斯汀;弗拉斯特伦(fluasterone);氟达拉滨;氟柔红霉素盐酸盐(fluorodaunorunicin hydrochloride);福酚美克;福美斯坦;福司曲星;福莫司汀;钆替沙林;硝酸镓;加洛他滨;加尼瑞克;明胶酶抑制剂;吉西他滨;谷胱甘肽抑制剂;海普撒凡(hepsulfam);调蛋白;六甲撑二乙酰胺;高三尖杉酯碱(hht);金丝桃素;伊班膦酸;伊达比星;艾多昔芬;伊决孟酮;伊莫福新;伊洛马司他;咪唑并吖啶酮;咪喹莫特;免疫刺激剂肽;胰岛素样生长因子-1受体抑制剂;干扰素激动剂;干扰素;白细胞介素;碘苄胍;碘阿霉素;依波米醇;伊立替康;伊罗普拉;伊索拉定;异本伽唑(isobengazole);异高软海绵b;伊他司琼;jasplakinolide;海蛞蝓提取物(kahalalide)f;三乙酸层状素n;兰瑞肽;来那米新(leinamycin);来格司亭;硫酸香菇多糖;莱普妥斯新(leptolstatin);来曲唑;白血病抑制因子;白细胞α干扰素;亮丙瑞林+雌激素+黄体酮;亮丙瑞林;左旋咪唑;利罗唑;线性多胺类似物;亲脂性二糖肽;亲脂性铂化合物;利沙克里那米得(lissoclinamide)7;洛铂;蚯蚓磷脂;洛美曲索;氯尼达明;洛索蒽醌;洛伐他汀;洛索立宾;勒托替康;替沙林镥;利索茶碱;裂解肽;美坦辛;制甘糖酶素a;马立马司他;马索罗酚;乳腺丝抑蛋白;基质溶解因子抑制剂;基质金属蛋白酶抑制剂;美诺立尔;美巴龙;美替瑞林;甲硫氨酸酶;甲氧氯普胺;mif抑制剂;米非司酮;米替福新;米立司亭;错配的双链rna;光辉霉素;米托胍腙;二溴卫矛醇;丝裂霉素类似物;米托萘胺;迈托毒素成纤维细胞生长因子-皂角素;米托蒽醌;莫法罗汀;莫拉司亭;单克隆抗体,人绒毛膜促性腺激素;单磷酰基脂质a+分枝杆菌细胞壁sk;莫哌达醇;多抗药性基因抑制剂;基于治疗的多肿瘤抑制剂1;芥末抗癌剂;印度洋海绵(mycaperoxide)b;分枝杆菌细胞壁提取物;米利亚普隆(myriaporone);n-乙酰地那林;n-取代的苯酰胺;那法瑞林;那瑞替喷;纳洛酮+喷他佐辛;纳帕因(napavin);纳福特平(naphterpin);那托司亭;奈达铂;奈莫柔比星;奈立膦酸;中性内肽酶;尼鲁米特;尼萨霉素(nisamycin);一氧化氮调节剂;氮氧化物抗氧化剂;尼图林(nitrullyn);06-苄基鸟嘌呤;奥曲肽;奥琪森酮(okicenone);寡核苷酸;奥那司酮;昂丹司琼;昂丹司琼;奥罗新(oracin);口服细胞因子诱导剂;奥马铂;奥沙特隆;奥沙利铂;奥克萨霉素(oxaunomycin);紫杉醇类似物;紫杉醇衍生物;帕劳霉素(palauamine);棕榈酰根瘤菌素(palmitoylrhizoxin);帕米膦酸;人参炔三醇;帕诺米芬;副球菌素;帕折普汀;培门冬酶;培得星;木聚硫钠;喷司他丁;pentrozole;全氟溴烷;培磷酰胺;紫苏醇;苯连氮霉素;苯乙酸酯;磷酸酯酶抑制剂;沙培林;盐酸毛果芸香碱;吡柔比星;吡曲克辛;普拉斯汀(placetin)a;普拉斯汀(placetin)b;纤溶酶原激活物抑制剂;铂复合物;铂化合物;铂-三胺复合物;鬼臼毒素;卟吩姆钠;甲基丝裂霉素;丙基双-吖
啶酮;前列腺素j2;蛋白酶体抑制剂;基于蛋白a的免疫调节剂;蛋白激酶c抑制剂;蛋白激酶c抑制剂、微藻;蛋白酪氨酸磷酸酶抑制剂;嘌呤核苷磷酸化酶抑制剂;羟基茜草素;吡唑啉吖啶;吡哆醛化血红蛋白聚氧乙烯结合物;raf拮抗剂;雷替曲塞;雷莫司琼;ras法呢基蛋白转移酶;ras抑制剂;ras-gap抑制剂;去甲基瑞替普汀;铼re 186羟乙膦酸;根霉素;核糖核酸酶;rii维甲酰胺(retinamide);罗谷亚胺;罗希吐碱;罗莫肽;罗喹美克;罗比吉能(rubiginone)b 1;如波希尔(ruboxyl);沙芬戈;辛妥平(saintopin);sarcnu;肌肉叶绿醇a;沙格司亭;sdi 1模拟物;司莫司汀;衰老衍生的抑制剂1;正义寡核苷酸;信号转导抑制剂;信号转导调节剂;单链抗原结合蛋白;西佐喃;索布佐生:硼卡钠;苯乙酸钠;索沃绕(solverol);生长调节素结合蛋白;索纳明;膦门冬酸;穗霉素d;螺莫司汀;斯耐潘定;海绵素1;角鲨胺;干细胞抑制剂;干细胞分裂抑制剂;斯蒂匹酰胺;间充质溶解素抑制剂;萨菲诺辛(sulfinosine);强效的血管活性肠肽拮抗剂;苏拉蒂斯塔(suradista);苏拉明;苦马豆素;合成的糖胺聚糖;他莫司汀;他莫昔芬甲碘化物;牛磺莫司汀;他扎罗汀;替可加兰钠;替加氟;替鲁里姆(tellurapyrylium);端粒酶抑制剂;替莫泊芬;替莫唑胺;替尼泊苷;四氯十氧化物;替唑唑胺(tetrazomine);白蓬达亭;沙利度胺;噻可拉林;血小板生成素;血小板生成素模拟物;胸腺法新;胸腺生成素受体激动剂;胸腺曲南;促甲状腺激素;乙基初卟啉锡(tin ethyl etiopurpurin);替拉扎明;二茂基二氯化钛;拓扑替康;妥普森汀(topsentin);托瑞米芬;全能干细胞因子;翻译抑制剂;维甲酸;三乙酰尿苷;曲西立滨;三甲曲沙;曲普瑞林;托烷司琼;妥罗雄脲;酪氨酸激酶抑制剂;酪氨酸磷酸化抑制剂;ubc抑制剂;乌苯美司;尿殖窦衍生的生长抑制因子;尿激酶受体拮抗剂;伐普肽;维瑞尔林(variolin)b;载体系统,红细胞基因疗法;维拉雷琐;藜芦胺;维尔丁斯(verdins);维替泊芬;长春瑞宾;维撒丁(vinxaltine);vitaxin;伏氯唑;扎诺特隆;折尼铂;亚苄维c;以及净司他丁斯酯。
[0348]
标记的抗tnfr2多肽
[0349]
在一些实施例中,出于纯化或检测的目的,可以将拮抗性tnfr2的单链多肽、抗体或其抗原结合片段与另一分子(例如,表位标签)缀合。可用于蛋白质纯化中的此类分子的实例包括呈现能够被第二分子识别的结构表位的那些分子。这是通过亲和层析用于蛋白质纯化的常用策略,其中将分子固定在固体支持物上并暴露于包含与能够结合固定的化合物的分子缀合的靶蛋白的异质混合物中。出于分子识别的目的可以与拮抗性tnfr2单链多肽、抗体或其片段缀合的表位标签分子的实例包括但不限于麦芽糖结合蛋白、谷胱甘肽-s-转移酶、聚组氨酸标签、flag标签、myc-标签、人流感血球凝集素(ha)标签、生物素、链霉亲和素。含有由这些分子呈现的表位的缀合物能够被这样的互补分子(分别如麦芽糖、谷胱甘肽、含镍复合物、抗flag抗体、抗myc抗体、抗ha抗体、链霉亲和素或生物素)识别。例如,可以纯化已经与来自其他蛋白质和生物分子(例如,dna、rna、碳水化合物、磷脂等)的复合混合物的表位标签缀合的本发明的拮抗性tnfr2单链多肽、抗体或其片段,通过用含有互补分子的固相树脂处理该混合物进行该纯化,该互补分子可以选择性识别并结合拮抗性抗tnfr2抗体或其片段的表位标记。固相树脂的实例包括琼脂糖珠,其与水性溶液中的纯化物相容。
[0350]
本发明的拮抗性tnfr2多肽还可以共价附加到荧光分子上,例如通过荧光测定法和/或通过使用荧光显微镜的直接可视化来检测抗体或其抗原结合片段。可以与本发明的多肽缀合的示例性荧光分子包括绿色荧光蛋白、青色荧光蛋白、黄色荧光蛋白、红色荧光蛋
白、藻红蛋白、别藻蓝蛋白、赫斯特、4',6-二脒基-2-苯基吲哚(dapi)、碘化丙啶、荧光素、香豆素、若丹明、四甲基若丹明以及花菁。适合与本发明的多肽缀合的荧光分子的另外的实例是本领域熟知的并且已经在例如美国专利号7,417,131和7,413,874中详细描述,将其各自通过引用结合在此。
[0351]
含有荧光分子的拮抗性tnfr2多肽对于监测本发明的多肽(如单链多肽、抗体及其片段)的细胞表面定位特性特别有用。例如,可以将培养的哺乳动物细胞(例如,t-reg细胞)暴露于与荧光分子共价结合的本发明的拮抗性tnfr2单链多肽、抗体或其片段,并随后使用本领域已知的常规荧光显微技术分析这些细胞。共焦荧光显微术是用于确定来自结合到细胞膜外表面的那些拮抗性抗tnfr2单链多肽、抗体或其片段的细胞表面定位的特别有力的方法,因为可以分析细胞的单个平面以区分已经例如通过受体介导的内吞作用内化到细胞内部的抗体或其片段。此外,可以用与发射特定波长的可见光的荧光分子(例如,在约535nm处发荧光的荧光素)缀合的拮抗性tnfr2抗体和已知定位于t-reg细胞表面上的特定位点并且在不同波长处发荧光的另外的荧光分子(例如,定位于cd25并在约599nm处发荧光的分子)处理细胞。可以通过共焦荧光显微术可视化所得的发射模式,并且可以合并来自这两个波长的图像以揭示关于拮抗性tnfr2单链多肽、抗体或其抗原结合片段在t-reg细胞表面上相对于其他受体的位置的信息。
[0352]
出于检测和可视化拮抗性抗tnfr2多肽的目的,还可以将生物发光蛋白掺入融合蛋白中。生物发光蛋白(如萤光素酶和水母发光蛋白)作为与底物(例如,萤光素和腔肠素)的化学反应的一部分而发光。适合用作诊断序列的示例性生物发光蛋白及其使用方法描述于例如美国专利号5,292,658;5,670,356;6,171,809和7,183,092中,将其各自通过引用结合在此。用生物发光蛋白标记的拮抗性tnfr2单链多肽、抗体或其片段是用于在体外测定后检测本发明的抗体的有用工具。例如,可以通过使用本领域已知的凝胶电泳方法(例如,天然凝胶分析)分离混合物的组分然后将分离的蛋白质转移到膜上以进行蛋白质印迹来检测另外蛋白质的复合混合物中的已经与生物发光蛋白缀合的拮抗性tnfr2抗体的存在。可以通过用适当的荧光素酶底物处理膜并随后使用已建立的方案可视化膜上的蛋白质的混合物来实现对其他蛋白质的混合物中的拮抗性tnfr2抗体的检测。
[0353]
本发明的多肽(例如,单链多肽、抗体及其片段)还可以与包含放射性核的分子缀合,使得可以通过分析核的放射性发射模式来检测本发明的抗体或其片段。可替代地,拮抗性tnfr2抗体或其片段可以通过在制备该蛋白质期间在该抗体内掺入放射性核来被直接修饰。可以通过例如在补充有含有这些同位素的营养素的培养基中培养细菌,将甲硫氨酸(
35
s)、氮(
15
n)或碳(
13
c)的放射性同位素掺入到本发明的抗体或其片段中。任选地,可以通过例如在补充有放射性标记的酪氨酸的培养基中培养细菌细胞,将含有放射性卤素的酪氨酸衍生物掺入到拮抗性tnfr2抗体或其片段中。已经表明,使用体内内源性翻译酶,将用苯酚系统的c2位置处的放射性卤素官能化的酪氨酸迅速掺入到延长的多肽链中(美国专利号4,925,651;通过引用结合在此)。所述卤素包括氟、氯、溴、碘和砹。此外,可以在从细胞培养物分离和纯化后通过用放射性同位素功能化本发明的抗体或其片段,将拮抗性tnfr2抗体或其片段进行修饰。卤素代表通过在酪氨酸或色氨酸处进行芳香取代,例如经由这些残基中的一个或多个与亲电子卤素物质进行反应而可以容易地掺入到纯化的蛋白质中的一类同位素。放射性卤素同位素的实例包括
18
f、
75
br、
77
br、
122
i、
123
i、
124
i、
125
i、
129
i、
131
i或
211
at。
[0354]
用于掺入放射性同位素的另一种替代性策略是将螯合基团与拮抗性抗tnfr2多肽(例如,单链多肽、抗体或其片段)进行共价连接。螯合基团可以通过连接到反应性官能团(如硫醇、氨基、醇或羧酸)上而共价附加到拮抗性tnfr2多肽上。然后可以修饰螯合基团以含有多种金属放射性同位素中的任何一种,包括但不限于如下的放射性核素,如
125
i、
67
ga、
111
in、
99
tc、
169
yb、
186
re、
123
i、
124
i、
125
i、
131
i、
99m
tc、
111
in、
64
cu、
67
cu、
186
re、
188
re、
177
lu、
90
y、
77
as、
72
as、
86
y、
89
zr、
211
at、
212
bi、
213
bi或
225
ac。
[0355]
在一些实施例中,希望将本发明的多肽(例如,单链多肽、抗体或其片段)与能够结合来自重元素或稀土离子的金属离子(如gd
3+
、fe
3+
、mn
3+
或cr
2+
)的螯合基团共价缀合。含有与这样的顺磁性金属配位的螯合基团的缀合物在mri成像应用中是有用的。顺磁性金属包括但不限于,铬(iii)、锰(ii)、铁(ii)、铁(iii)、钴(ii)、镍(ii)、铜(ii)、镨(iii)、钕(iii)、钐(iii)、钆(iii)、铽(iii)、镝(iii)、钬(iii)、铒(iii)以及镱(iii)。以这种方式,可以通过mri光谱来检测拮抗性tnfr2抗体。例如,可以将与顺磁性离子结合的螯合基团缀合的拮抗性tnfr2抗体或其片段给予哺乳动物受试者(例如,人类患者)以监测给予后抗体的分布。这可以通过将抗体以本文所述的任何给药途径(如静脉内)给予患者并且随后通过根据已建立的方案记录患者的mri分析给予的抗体的位置来实现。
[0356]
出于改善蛋白质在水性溶液中的溶解性和稳定性的目的,可以另外地将拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)与其他分子缀合。这样的分子的实例包括peg、psa、牛血清白蛋白(bsa)和人血清白蛋白(hsa)等等。例如,可以将拮抗性tnfr2抗体或其片段与碳水化合物部分缀合,以逃避由接受治疗的患者的免疫系统对抗体或其片段的检测。这种高糖基化过程通过空间抑制蛋白与循环中的b细胞受体的相互作用来降低治疗性蛋白的免疫原性。可替代地,拮抗性tnfr2抗体或其片段可以与阻止人血清的清除并改善本发明的抗体的药代动力学特征的分子缀合。可以缀合或插入到本发明的抗tnfr2抗体或其片段内以减弱清除并改善这些抗体和片段的药代动力学特征的示例性分子包括补救受体结合表位。这些表位在igg免疫球蛋白的fc区内被发现并已显示结合fc受体并延长人血清中的抗体半衰期。补救受体结合表位插入抗tnfr2抗体或其片段可以例如如美国专利号5,739,277中所述实现;通过引用结合在此。
[0357]
修饰的拮抗性tfnr2多肽
[0358]
除了与用于鉴定或可视化的其他治疗剂和标记缀合之外,本发明的抗tnfr2多肽(例如,单链多肽、抗体或其片段)还可以被修饰以改善其药代动力学曲线、生物物理稳定性或抑制能力。例如,任何不参与维持抗tnfr2抗体或其片段的适当构象的半胱氨酸残基可以被等比容或等电子氨基酸(例如,丝氨酸)取代以改善分子的氧化稳定性并防止异常交联。相反,可以将一个或多个半胱氨酸键添加至抗体或其片段以改进其稳定性(特别是在抗体是抗体片段(如fv片段)的情况下)。这可以例如通过改变编码抗体重链和轻链的多核苷酸或编码抗体片段的多核苷酸以编码可在氧化条件下形成二硫键的另外的一对或多对半胱氨酸残基来增强抗体三级结构来完成(参见,例如,美国专利号7,422,899;通过引用结合在此)。
[0359]
可以对本发明的抗tnfr2多肽(例如,单链多肽、抗体或其片段)进行的另一种有用的修饰包括改变这些抗体及其片段的糖基化特性。这可以例如通过取代、插入或删除拮抗性tnfr2抗体中的氨基酸以插入或去除糖基化位点来实现。抗体的糖基化通常以n-连接或
o-连接的方式发生。n-连接糖基化是碳水化合物部分与抗体的连接发生在天冬酰胺残基的侧链的过程。用于n-连接糖基化的共有氨基酸序列包括三肽序列天冬酰胺-x-丝氨酸(nxs)和天冬酰胺-x-苏氨酸(nxt),其中x是除脯氨酸以外的任何氨基酸。在多肽(例如,抗tnfr2抗体)中插入这些三肽序列中的任何一个产生了潜在的糖基化位点。o-连接糖基化是指将糖n-乙酰半乳糖胺、半乳糖或木糖之一连接到羟基氨基酸上,最通常为丝氨酸或苏氨酸,尽管5-羟基脯氨酸或5-羟基赖氨酸也是形成糖苷的感受态底物。因此,通过改变抗体的氨基酸序列(例如,使用如本文所述的重组表达技术)使得其含有促进n-连接糖基化的一个或多个上述三肽序列或者含有产生o-连接糖基化的原始抗体的序列的一个或多个丝氨酸或苏氨酸残基来实现向抗tnfr2抗体添加糖基化位点(参见,例如,美国专利号7,422,899;通过引用结合在此)。
[0360]
在替代的情况下,希望关于效应子功能来修饰本发明的抗体或其片段,例如以增强抗体的抗原依赖性细胞介导的细胞毒性(adcc)和/或补体依赖性细胞毒性(cdc)。这可以通过在抗体的fc区中引入一个或多个氨基酸置换来实现。例如,可以将半胱氨酸残基引入抗tnfr2抗体或其片段的fc区(例如,通过如本文所述的重组表达技术),以促进在该区域中形成另外的链间二硫键。由此产生的同型二聚体抗体可以具有增加的构象约束,其可以促进改善的内化能力和/或增加的补体介导的细胞杀伤和抗体依赖性细胞毒性(adcc)。具有增强的抗肿瘤活性的同型二聚体抗体还可以使用如例如wolff等人(canc.res.[癌症研究],53:2560-2565,1993)所述的异双功能交联剂来制备;通过引用结合在此。可替代地,可以工程化具有双重fc区并由此可以具有增强的补体溶解和adcc能力的抗体(参见,stevenson等人(anti-canc.drugdes.[抗癌药物设计],3:219-230,1989);通过引用结合在此)。
[0361]
可以在一些实施例中通过掺入一个或多个氨基酸修饰,如通过改变fab结构域的ch1或cl区以引入例如在igg的fc区的ch2结构域的两个环中发现的补救受体基序来改善本发明的抗tnfr2多肽(例如,单链多肽、抗体或其片段)的血清半衰期。这样的改变例如描述于美国专利号5,869,046和美国专利号6,121,022中;通过引用结合在此。还可以进行另外的框架修饰以降低抗体或其片段的免疫原性或者减少或去除存在于其中的t细胞表位,如例如在us 2003/0153043中所述;通过引用结合在此。
[0362]
治疗方法
[0363]
治疗细胞增殖性障碍的方法
[0364]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)是用于治疗广泛的癌症和细胞增殖性障碍的有用的治疗剂。可以将拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)施用于患有细胞增殖性障碍(如癌症)的哺乳动物受试者(如人),以增强针对靶癌细胞的适应性免疫应答的有效性。具体地,可以将本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)施用于哺乳动物受试者(如人)以减少或抑制t-reg细胞生长和活化(其允许肿瘤浸润性t淋巴细胞定位于呈递肿瘤相关抗原的细胞并促进细胞毒性)。此外,本发明的多肽可以与现有的过继性t细胞疗法平台协同作用,因为这种策略的有效性的限制之一是在输注到哺乳动物受试者(例如人)之后有延长肿瘤反应性t细胞的细胞毒性的困难。本发明的多肽还可以促进同种异体t淋巴细胞的活性,所述同种异体t淋巴细胞可以表达外来mhc蛋白,并且可以越来越容易受宿主免疫系统失活的影响。例如,本发明的抗体及其抗
原结合片段可以通过抑制通常伴随t细胞输注的t-reg细胞的生长和增殖来减轻t-reg介导的肿瘤反应性t细胞的消耗。例如,本发明的多肽(例如,单链多肽、抗体或其片段)能够将t-reg细胞群的生长相对于未处理的细胞减少约50%至约200%(例如50%、75%、100%、125%、150%、175%或200%)。甚至在存在tnfα下也会发生细胞生长的减少。在一些实施例中,本发明的多肽(例如,单链多肽、抗体或其片段)能够相对于未处理的细胞,将在tnfα存在下的t-reg细胞群的生长限制90%至150%(例如,90%、100%、110%、20%、130%、140%或150%,如例如实例4中所述)。本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)还能够将t-reg细胞群的增殖限制到未处理的t-reg细胞群的增殖的小于70%(例如60%、50%、40%、30%、20%、10%、5%、或1%)。本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)还能够将t-reg细胞群的存活相对于未处理的t-reg细胞群降低约10%(例如约20%、30%、40%或50%或更多)。
[0365]
可以将本发明的拮抗性tnfr2多肽施用于患有癌症的哺乳动物受试者(例如人),以通过促进针对癌细胞和致肿瘤材料的免疫应答来改善患者的状况。本发明的抗体可以例如经由本文所述的任何给药途径施用于受试者。本发明的多肽还可以用赋形剂、生物学上可接受的载体配制,并且可以任选地与另外的治疗剂(如抗癌剂)缀合、混合或分开地共给予(例如,顺序地)。可以通过施用本发明的多肽(例如,单链多肽、抗体或其片段)而治疗的癌症包括如以下这样的癌症:白血病、淋巴瘤、肝癌、骨癌、肺癌、脑癌、膀胱癌、胃肠癌、乳腺癌、贲门癌、宫颈癌、子宫癌、头颈癌、胆囊癌、喉癌、唇癌和口腔癌、眼癌、黑素瘤、胰腺癌、前列腺癌、结直肠癌、睾丸癌以及咽喉癌。可以通过施用本发明的抗体或其抗原结合片段而治疗的具体的癌症包括但不限于,急性淋巴母细胞性白血病(all)、急性髓性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性髓性白血病(cml)、肾上腺皮质癌、aids相关性淋巴瘤、原发性cns淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、非典型畸胎样/横纹肌样瘤、基底细胞癌、胆管癌、肝外癌、尤因肉瘤家族、骨肉瘤和恶性纤维组织细胞瘤、中枢神经系统胚胎性肿瘤、中枢神经系统生殖细胞肿瘤、颅咽管瘤、室管膜瘤、支气管肿瘤、伯基特淋巴瘤、类癌瘤、原发性淋巴瘤、脊索瘤、慢性骨髓组织增殖性赘生物、结肠癌、肝外胆管癌、原位导管癌(dcis)、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、颅外生殖细胞瘤、性腺外生殖细胞瘤、输卵管癌、骨纤维组织细胞瘤、胃肠类癌瘤、胃肠间质瘤(gist)、睾丸生殖细胞瘤、妊娠滋养细胞疾病、神经胶质瘤、儿童脑干神经胶质瘤、毛细胞白血病、肝细胞癌、朗格汉斯细胞组织细胞增多症、霍奇金淋巴瘤、下咽癌、胰岛细胞瘤、胰腺神经内分泌肿瘤、肾母细胞瘤及其他儿童肾脏肿瘤、朗格汉斯细胞组织细胞增多症、小细胞肺癌、皮肤t细胞淋巴瘤、眼内黑色素瘤、梅克尔细胞癌、间皮瘤、转移性鳞状颈癌、中线道癌、多发性内分泌肿瘤综合征、多发性骨髓瘤/浆细胞瘤、骨髓增生异常综合征、鼻腔和鼻窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤(nhl)、非小细胞肺癌(nsclc)、上皮性卵巢癌、生殖细胞卵巢癌、低恶性潜能卵巢癌、胰腺神经内分泌肿瘤、乳头瘤样增生、副神经节瘤、鼻窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、垂体瘤、胸膜肺母细胞瘤、原发性腹膜癌、直肠癌、成视网膜细胞瘤、横纹肌肉瘤、唾液腺癌、卡波西肉瘤、横纹肌肉瘤、塞扎莱综合征、小肠癌、软组织肉瘤、喉癌、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管的移行细胞癌、尿道癌、子宫内膜子宫癌、子宫肉瘤、阴道癌、外阴癌以及瓦尔登斯特伦巨球蛋白血症。
[0366]
例如,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)及其片段(例
如,fab片段),如具有非天然恒定区的tnfrab1和tnfrab2的变体,例如人源化的tnfrab1和tnfrab2抗体可以施用于患者(例如,哺乳动物患者,如人类患者)以治疗霍奇金氏淋巴瘤或皮肤非霍奇金氏淋巴瘤、t细胞淋巴瘤、卵巢癌、结肠癌、多发性骨髓瘤或肾细胞癌。
[0367]
本发明的抗tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)还可以与对癌细胞表现出反应性的治疗性抗体共同给予。以这种方式,本发明的拮抗性tnfr2多肽不仅可以例如通过延长t淋巴细胞肿瘤反应性与适应性免疫应答协同作用,还可以与肿瘤细胞生长的其他抑制剂协同作用。可以用于治疗癌症和其他细胞增殖性障碍的另外的治疗性抗体的实例包括与肿瘤抗原或在癌细胞表面上过度表达的细胞表面蛋白表现出反应性的那些。可以与本发明的拮抗性tnfr2多肽混合、共给予或顺序地给予的示例性抗体包括但不限于曲妥珠单抗贝伐单抗西妥昔单抗帕木单抗伊匹木单抗利妥昔单抗(和)、阿仑单抗奥法木单抗吉妥珠单抗奥佐米星布妥昔单抗
90
y-替伊莫单抗和
131
i-托西莫单抗它们详细描述于scott等人(cancer immun.[癌症免疫],12:14-21,2012);通过引用结合在此。
[0368]
具有本领域普通技术的医师能够容易地确定用于给予对其有需要的哺乳动物受试者(例如人)的拮抗性tnfr2多肽的有效量。例如,医师可以开始以低于实现所希望的治疗效果所需的水平开出本发明的多肽的剂量,并逐渐增加剂量直至达到所希望的效果。可替代地,医师可以通过以高剂量给予拮抗性tfnr2抗体或抗体片段开始治疗方案,并随后给予逐渐降低的剂量直至达到治疗效果(例如,减少一种或多种肿瘤的体积,减少t-reg细胞群,或缓解细胞增殖性障碍)。通常,本发明的抗体或其抗原结合片段的合适日剂量将是有效产生治疗效果的最低剂量的抗体量。可以通过注射,例如通过静脉内、肌肉内、腹膜内或皮下注射,任选地接近靶组织(例如肿瘤)的位点施用本发明的单链多肽、抗体或其抗原结合片段。本发明的抗体或其抗原结合片段的治疗组合物的日剂量,可以在全天、整周、整月或整年中作为单次剂量或作为以适当间隔分开给予的二、三、四、五、六次或更多次剂量,任选地以单位剂量形式施用。尽管单独施用本发明的抗体或其片段是可能的,但其也可以作为药物配制品与赋形剂、载体以及任选地另外的治疗剂组合给予。
[0369]
对于本发明的多肽(例如,单链多肽、抗体或其片段),可以通过本领域已知的多种方法中的任何一种来监测它们减弱细胞增殖疾病(如癌症)的进展的能力。例如,医师可以通过分析患者中一种或多种肿瘤的体积来监测哺乳动物受试者(例如人)对用本发明的抗体、抗体片段或单链多肽的治疗的响应。例如,本发明的多肽(例如,单链多肽、抗体或其片段)能够将肿瘤体积减小1%至100%之间(例如,1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、99%或100%)。可替代地,医师可以通过分析具体受试者的淋巴中的t-reg细胞群来监测受试者(例如人)对用本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段的治疗的反应性。例如,医师可以从哺乳动物受试者(例如人)中收回血液样品,并且使用已建立的程序(如荧光激活细胞分选)确定t-reg细胞(例如,cd4+cd25+foxp3+t-reg细胞或cd17+t-reg细胞)群的数量或密度。
[0370]
治疗传染性疾病的方法
[0371]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)还可以用于治疗传染性疾病,如由病毒、细菌、真菌或寄生虫中的任何一种或多种引起的那些传染性疾病。例如,可以将拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)施用于患有传染性疾病的哺乳动物受试者(例如人),以治疗该疾病以及减轻该疾病的一种或多种症状。
[0372]
例如,本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)可以用于治疗或减轻哺乳动物受试者(如人)中的病毒感染的一种或多种症状,所述病毒感染是由以下引起的:例如黄病毒科的成员(例如,黄病毒属、瘟病毒属和肝炎病毒属的成员),所述成员包括丙型肝炎病毒、黄热病病毒;蜱传病毒,如加德格兹谷病毒、凯丹姆病毒、科萨努尔森林疾病病毒、兰加特病毒、鄂木斯克出血热病毒、玻瓦桑病毒、皇家农场病毒、喀什病毒、蜱传脑炎病毒、纽多佛病毒、索夫吉病毒、羊跳跃病病毒和根岸病毒;海鸟蜱传病毒,如米班病毒、索马里兹礁病毒和秋列尼病毒;蚊传播病毒,如阿罗阿病毒、登革病毒、凯杜古病毒、卡西帕科利病毒、库坦戈病毒、日本脑炎病毒、墨累谷脑炎病毒,圣路易斯脑炎病毒、乌苏图病毒、西尼罗河病毒、雅温德病毒、科科贝拉病毒、巴加扎病毒、伊利乌斯病毒、以色列火鸡脑膜炎病毒、恩塔亚病毒、坦布苏病毒、齐卡病毒、班齐病毒、博博衣病毒、边山病毒、朱格拉病毒、萨沃亚病毒,赛皮克病毒、乌干达s病毒、韦塞尔斯布朗病毒、黄热病病毒;以及无已知的节肢动物载体的病毒,如恩德培蝙蝠病毒、横须贺病毒、阿波依病毒、牛骨山脊病毒、胡蒂亚帕病毒、摩多克病毒、萨尔别霍病毒、圣帕利塔病毒,布卡拉沙蝙蝠病毒、凯里岛病毒、达卡尔蝙蝠病毒、蒙太拿鼠耳蝠脑白质炎病毒、金边蝙蝠病毒、里约布拉沃病毒、塔马纳蝙蝠病毒和细胞融合因子病毒;沙粒病毒科的成员,所述成员包括伊皮病毒、拉沙病毒(例如,josiah、lp、或ga391株)、淋巴细胞性脉络丛脑膜炎病毒(lcmv)、莫巴拉病毒、莫佩亚病毒、阿马帕里病毒、弗莱克索病毒、瓜纳里托病毒、胡宁病毒、拉蒂诺病毒、马邱波病毒、奥利华斯病毒、巴拉那病毒、皮钦德病毒、皮里陶病毒、萨比亚病毒、塔卡里伯病毒、太米阿米病毒、怀特沃特阿罗约病毒、查帕雷病毒和卢约病毒;布尼亚病毒科的成员(例如,汉坦病毒属、内罗病毒属、正本雅病毒属和白蛉病毒属的成员),所述成员包括汉坦病毒、辛诺柏病毒、道格比病毒、布尼奥罗病毒、裂谷热病毒、拉克罗斯病毒、加利福尼亚脑炎病毒和刚果出血热(cchf)病毒;纤丝病毒科的成员,所述成员包括埃博拉病毒(例如,扎伊尔、苏丹、象牙海岸、雷斯顿和乌干达株)和马尔堡病毒(例如,安哥拉、ci67、莫索科(musoke)、popp、ravn和维多利亚湖(lake victoria)株);披膜病毒科的成员(例如,甲病毒属的成员),所述成员包括委内瑞拉马脑炎病毒(vee)、东方马脑炎病毒(eee)、西方马脑炎病毒(wee)、辛德毕斯病毒、风疹病毒、塞姆利基森林病毒、罗斯河病毒、巴马森林病毒、奥奈氏病毒和基孔肯亚病毒;痘病毒科的成员(例如,正痘病毒属的成员),所述成员包括天花病毒、猴痘病毒和牛痘病毒;疱疹病毒科的成员,所述成员包括单纯疱疹病毒(hsv;1型、2型和6型)、人疱疹病毒(例如,7型和8型)、巨细胞病毒(cmv)、eb病毒(ebv)、水痘带状疱疹病毒和卡波希氏瘤相关疱疹病毒(kshv);正粘病毒科的成员,所述成员包括流感病毒(a、b、和c),如h5n1禽流感病毒或h1n1猪流感;冠状病毒科的成员,所述成员包括严重急性呼吸综合征(sars)病毒;弹状病毒科的成员,所述成员包括狂犬病毒和水泡性口炎病毒(vsv);副粘病毒科的成员,所述成员包括人呼吸道合胞病毒(rsv)、新城疫病毒、亨德拉病毒、尼帕病毒、麻疹病毒、牛瘟病毒、犬瘟热病毒、仙台病毒、人副流感病毒(例如,1、2、3、和4)、鼻病毒和腮腺炎病毒;小核糖核酸病毒科的成员,所述成员包括脊髓灰质炎病毒、人肠道病毒(a、b、c和d)、甲型肝炎病毒和柯萨奇
病毒;嗜肝脱氧核糖核酸病毒科的成员,所述成员包括乙型肝炎病毒;乳头瘤病毒科的成员,所述成员包括人乳头瘤病毒;细小病毒科的成员,所述成员包括腺相关病毒;星状病毒科的成员,所述成员包括星状病毒;多瘤病毒科的成员,所述成员包括jc病毒、bk病毒和sv40病毒;杯状病毒科的成员,所述成员包括诺沃克病毒;呼肠孤病毒科的成员,所述成员包括轮状病毒;以及逆转录病毒科的成员,所述成员包括人免疫缺陷病毒(hiv;例如,1型和2型)和人t-嗜淋巴细胞病毒i型和ii型(分别是htlv-1和htlv-2);弗罗德白血病病毒;以及传染性海绵状脑病,如慢性消耗性疾病。具体而言,本发明的方法包括将拮抗性tnfr2抗体(例如,与含有tnfr2的kcrpg序列的一个或多个残基(seq id no:7的残基142-146)的表位特异性结合并且不表现出与含有tnfr2的kcspg序列(seq id no:7的残基56-60)的表位特异性结合并且具有非天然恒定区的tnfr2抗体,如含有tnfrab1和/或tnfrab2的一个或多个cdr或其变体的tnfr2抗体)施用于人以治疗hiv感染(如患有aids的人)。
[0373]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)还可以用于治疗或减轻哺乳动物受试者(例如人)中的细菌感染的一种或多种症状。可以通过施用本发明的拮抗性tnfr2抗体或抗体片段来治疗的细菌感染的实例包括但不限于由以下属中的细菌引起的那些:链球菌属、芽孢杆菌属、李斯特菌属、棒状杆菌属、诺卡氏菌属、奈瑟氏菌属、放线菌、莫拉氏菌属、enterobacteriacece(例如大肠杆菌、如o157:h7)、假单胞菌属(如铜绿假单胞菌)、埃希氏菌属、克雷伯菌属、沙雷氏菌属、肠杆菌属、变形杆菌属、沙门氏菌属、志贺氏菌属、耶尔森菌属、嗜血杆菌属、博德特菌属(如百日咳博德特菌)、军团菌属、巴氏杆菌属、弗朗西斯氏菌属、布鲁氏菌属、巴尔通氏体属、梭菌属、弧菌属、弯曲杆菌属、葡萄球菌属、分枝杆菌属(如结核分枝杆菌和鸟副结核分枝杆菌)以及螺杆菌属(如幽门螺杆菌和肝螺杆菌)。具体而言,本发明的方法包括将拮抗性tnfr2抗体(例如,与含有tnfr2的kcrpg序列的一个或多个残基(seq id no:7的残基142-146)的表位特异性结合并且不表现出与含有tnfr2的kcspg序列(seq id no:7的残基56-60)的表位特异性结合并且具有非天然恒定区的tnfr2抗体,如含有tnfrab1和/或tnfrab2的一个或多个cdr或其变体的tnfr2抗体)施用于人或非人哺乳动物以治疗结核分枝杆菌感染。本发明的具体方法包括将拮抗性tnfr2抗体(例如,与含有tnfr2的kcrpg序列的一个或多个残基(seq id no:7的残基142-146)的表位特异性结合并且不表现出与含有tnfr2的kcspg序列(seq id no:7的残基56-60)的表位特异性结合并且具有非天然恒定区的tnfr2抗体,如含有tnfrab1和/或tnfrab2的一个或多个cdr或其变体的tnfr2抗体)施用于牛科哺乳动物或野牛以治疗结核分枝杆菌感染。另外地,本发明的方法包括将拮抗性tnfr2抗体(例如,与含有tnfr2的kcrpg序列的一个或多个残基(seq id no:7的残基142-146)的表位特异性结合并且不表现出与含有tnfr2的kcspg序列(seq id no:7的残基56-60)的表位特异性结合并且具有非天然恒定区的tnfr2抗体,如含有tnfrab1和/或tnfrab2的一个或多个cdr或其变体的tnfr2抗体)施用于人或非人哺乳动物以治疗鸟副结核分枝杆菌感染。本发明的具体方法包括将拮抗性tnfr2抗体(例如,与含有tnfr2的kcrpg序列的一个或多个残基的表位(seq id no:7的残基142-146)特异性结合并且不表现出与含有tnfr2的kcspg序列的表位(seq id no:7的残基56-60)特异性结合并且具有非天然恒定区的tnfr2抗体,如含有tnfrab1和/或tnfrab2的一个或多个cdr或其变体的tnfr2抗体)施用于牛科哺乳动物或野牛以治疗鸟副结核分枝杆菌感染。
[0374]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)还可以施用于哺乳动
物受试者(例如人)用于治疗或减轻由原生动物寄生虫(例如,肠原生动物、组织原生动物或血原生动物)或蠕虫寄生虫(例如,线虫、蠕虫、有腺纲(adenophorea)、secementea、吸虫(trematode)、吸虫(fluke)(血吸虫、肝吸虫、肠吸虫和肺吸虫)或者绦虫)引起的寄生虫感染的一种或多种症状。可以根据本发明的方法治疗的示例性原生动物寄生虫包括但不限于,痢疾内变形虫、兰伯贾第虫、鼠隐孢子虫(cryptosporidium muris)、冈比亚锥虫、罗德西亚锥虫、克鲁兹锥虫、墨西哥利什曼原虫、巴西利什曼原虫、热带利什曼原虫、杜氏利什曼原虫、硕大利什曼原虫、弓形虫、间日疟原虫、卵形疟原虫、三日疟原虫、恶性疟原虫、plasmodium yoelli、阴道毛滴虫和组织滴虫(histomonas meleagridis)。示例性的蠕虫寄生虫包括毛首鞭形线虫、蛔虫、蛲虫、十二指肠钩虫、美洲板口线虫、粪类圆线虫、斑氏线虫和麦地那龙线虫、曼氏裂体吸虫、埃及裂体吸虫、日本裂体吸虫、肝片吸虫、大片吸虫、异形吸虫属、卫氏并殖吸虫、猪肉绦虫、牛肉绦虫、短膜壳绦虫以及细粒棘球绦虫。可以根据本发明的方法治疗的另外的寄生虫感染包括旋盘尾丝虫。
[0375]
拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)还可以施用于哺乳动物受试者(例如人)以治疗或缓解真菌感染的一种或多种症状。可以根据本发明的方法治疗的真菌感染的实例包括但不限于由例如曲霉属、假丝酵母属、马拉色氏霉菌属、毛孢子菌属、镰孢菌属、枝顶孢属、根霉属、毛霉属、肺囊虫属和犁头霉属引起的那些真菌感染。可以根据本发明的方法治疗的示例性真菌感染还包括卡氏肺囊虫、巴西副球孢子菌和荚膜组织胞浆菌。
[0376]
药物组合物
[0377]
可以使用本领域已知的方法制备含有本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其抗原结合片段)的治疗性组合物。例如,可以使用例如生理学上可接受的载体、赋形剂或稳定剂(remington's pharmaceutical sciences[雷明顿药物科学]第16版,osol,a.编辑(1980);通过引用结合在此),并且以所希望的形式,例如以冻干的配制品或水性溶液的形式来制备这样的组合物。还可以制备组合物以含有所希望浓度的活性剂(例如,拮抗性抗tnfr2抗体或其片段)。例如,本发明的药物组合物可以含有按重量计(w/w)至少10%(例如,10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、97%、98%、99%、99.5%、99.9%或100%)的活性剂。
[0378]
此外,可掺入药物配制品中的活性剂(例如,本发明的拮抗性tnfr2抗体或其片段)本身可以具有期望的纯度水平。例如,在从细胞培养基分离抗体之后或者在通过如本文所述的已建立的固相肽合成方法或天然化学连接对例如单链抗体片段(例如,scfv)进行化学合成后之后,能以一定程度的纯度表征本发明的抗体或其抗原结合片段。在将抗体掺入药物组合物之前,本发明的拮抗性tnfr2抗体可以是至少10%纯的(例如,10%、20%、30%、40%、50%、60%、70%、80%90%、95%、97%、98%、99%、99.5%、99.9%、99.99%或100%)。
[0379]
可以制备本发明的抗tnfr2多肽(例如,单链多肽、抗体或其片段)的药物组合物用于通过将具有所希望程度的纯度的抗体与任选的本领域通常使用的药学上可接受的载体、赋形剂或稳定剂(例如缓冲剂、稳定剂、防腐剂、等张剂、非离子洗涤剂、抗氧化剂以及其他各种添加剂)混合而储存为冻干配制品或水性溶液。参见,例如,remington's pharmaceutical sciences[雷明顿药物科学],第16版(osol编辑,1980;通过引用结合在此)。这样的添加剂在所用的剂量和浓度下必须对接受者无毒。
[0380]
缓冲剂
[0381]
缓冲剂有助于将ph保持在接近生理条件的范围内。它们能以约2mm至约50mm范围的浓度存在。用于与本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)一起使用的合适的缓冲剂包括有机酸和无机酸两者及其盐,如柠檬酸盐缓冲液(例如,柠檬酸一钠-柠檬酸二钠混合物、柠檬酸-柠檬酸三钠混合物、柠檬酸-柠檬酸一钠混合物等)、琥珀酸盐缓冲液(例如,琥珀酸-琥珀酸一钠混合物、琥珀酸-氢氧化钠混合物、琥珀酸-琥珀酸二钠混合物等)、酒石酸盐缓冲液(例如,酒石酸-酒石酸钠混合物、酒石酸-酒石酸钾混合物、酒石酸-氢氧化钠混合物等)、富马酸盐缓冲液(例如,富马酸-富马酸一钠混合物、富马酸-富马酸二钠混合物、富马酸一钠-富马酸二钠混合物等)、葡糖酸盐缓冲液(例如,葡糖酸-葡糖酸钠混合物、葡糖酸-氢氧化钠混合物、葡糖酸-葡糖酸钾混合物等)、草酸盐缓冲液(例如,草酸-草酸钠混合物、草酸-氢氧化钠混合物、草酸-草酸钾混合物等)、乳酸盐缓冲液(例如,乳酸-乳酸钠混合物、乳酸-氢氧化钾混合物、乳酸-乳酸钾混合物等)以及乙酸盐缓冲液(例如,乙酸-乙酸钠混合物、乙酸-氢氧化钠混合物等)。此外,可以使用磷酸盐缓冲液、组氨酸缓冲液和三甲胺盐(如tris)。
[0382]
防腐剂
[0383]
可以将防腐剂添加到本发明的组合物中以阻碍微生物生长,并且能以0.2%-1%(w/v)范围的量添加。适用于与本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)一起使用的防腐剂包括苯酚、苯甲醇、间甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、十八烷基二甲基苄基氯化铵、苄烷铵卤化物(例如,氯化物、溴化物和碘化物)、氯化六烃季铵以及对羟基苯甲酸烷基酯(如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯)、儿茶酚、间苯二酚、环己醇以及3-戊醇。可以添加有时被称为“稳定剂”的等张剂以确保本发明的液体组合物的等张性,并且所述等张剂包括多羟基糖醇,例如三羟基糖醇或更高级糖醇,如甘油、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇。稳定剂是指广泛类型的赋形剂,其就功能而言范围从膨胀剂到溶解治疗剂或者有助于防止变性或粘附到容器壁的添加剂。典型的稳定剂可以是多羟基糖醇(上面列举的);氨基酸,如精氨酸、赖氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、丙氨酸、鸟氨酸、l-亮氨酸、2-苯丙氨酸、谷氨酸、苏氨酸等;有机糖或糖醇,如乳糖、海藻糖、水苏糖、甘露醇、山梨糖醇、木糖醇、核糖醇、肌醇、半乳糖醇、甘油等,包括环多醇如肌醇;聚乙二醇;氨基酸聚合物;含硫还原剂,如尿素、谷胱甘肽、硫辛酸、巯基乙酸钠、硫代甘油、α-一硫代甘油和硫代硫酸钠;低分子量多肽(例如,具有10个残基或更少残基的肽);蛋白质,如人血清白蛋白、牛血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮单糖,如木糖、甘露糖、果糖、葡萄糖;二糖如乳糖、麦芽糖、蔗糖以及三糖如棉子糖;以及多糖如右旋糖酐。稳定剂能以每重量份活性蛋白质0.1至10,000重量的范围存在。
[0384]
洗涤剂
[0385]
可以添加非离子表面活性剂或洗涤剂(也称为“润湿剂”)以帮助溶解治疗剂以及保护治疗蛋白对抗搅拌引起的聚集,这也允许配制品暴露于剪切表面应力而不引起蛋白质的变性。合适的非离子表面活性剂包括聚山梨醇酯(20、80等)、泊洛沙姆(184、188等)、普朗尼克多元醇、聚氧乙烯脱水山梨糖醇单醚(等)。非离子表面活性剂能以约0.05mg/ml至约1.0mg/ml,例如约0.07mg/ml至约0.2mg/ml的范围存在。
[0386]
另外的各种赋形剂包括膨胀剂(例如淀粉)、螯合剂(例如edta)、抗氧化剂(例如抗
坏血酸、甲硫氨酸、维生素e)和助溶剂。
[0387]
其他药物载体
[0388]
可掺入本发明的组合物中的替代性药学上可接受的载体可以包括右旋糖、蔗糖、山梨糖醇、甘露醇、淀粉、可耕作橡胶、磷酸钾、精氨酸盐、明胶、硅酸钾、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、甲基羟基苯甲酸酯、丙基羟基苯甲酸酯、滑石、硬脂酸镁和矿物油,但不限于此。含有本发明的拮抗性tnfr2多肽的组合物可以进一步包含润滑剂、保湿剂、甜味剂、调味剂、乳化剂、助悬剂和防腐剂。合适的药学上可接受的载体和配制品的细节可以在remington's pharmaceutical sciences[雷明顿药物科学](第19版,1995)中找到,将其通过引用结合在此。
[0389]
用于组合疗法的组合物
[0390]
本发明的药物组合物可以任选地包含多于一种活性剂。例如,本发明的组合物可以包含与另一药物活性分子(例如,细胞毒性剂、抗生素)或t淋巴细胞(例如,用于car-t疗法的基因编辑的t淋巴细胞)缀合、混合或分开给予的拮抗性tnfr2多肽(如单链多肽、抗体或其片段)。例如,拮抗性tnfr2单链多肽、抗体、抗体片段或其治疗性缀合物(例如,本文所述的药物-抗体缀合物)可以与一种或多种可用于治疗癌症或另一种细胞增殖性障碍(例如肿瘤)的另外的活性剂进行混合。可替代地,可以配制本发明的药物组合物用于与一种或多种可用于治疗癌症或其他细胞增殖性障碍的另外的活性剂共给予或顺序给予。可用于治疗癌症和其他细胞增殖性障碍并且可以与本发明的拮抗性tnfr2单链多肽、抗体或抗体片段缀合、混合或分开给予的另外的活性剂的实例包括细胞毒性剂(例如,本文所述的那些),以及与肿瘤抗原或在癌细胞表面上过表达的细胞表面蛋白表现出反应性的抗体。可与本发明的拮抗性tnfr2抗体缀合、混合或分开给予的示例性抗体包括但不限于曲妥珠单抗贝伐单抗西妥昔单抗帕木单抗伊匹木单抗利妥昔单抗(和)、阿仑单抗奥法木单抗吉妥珠单抗奥佐米星布妥昔单抗
90
y-替伊莫单抗和
131
i-托西莫单抗它们详细描述于scott等人(cancer immun.[癌症免疫],12:14-21,2012);通过引用结合在此。
[0391]
可与本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)缀合、混合或分开给予的另外的药剂包括与特定病理相关的特异性抗原表现出反应性的t淋巴细胞。例如,可以配制本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段),用于与表达嵌合抗原受体(car-t)的t细胞一起给予以治疗细胞增殖性障碍,如本文所述的癌症。拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)可以通过阻止t-reg细胞使已经被遗传修饰的t淋巴细胞失活而与car-t疗法协同作用,以表达肿瘤反应性抗原受体。以这种方式,可以在给予拮抗性tnfr2单链多肽、抗体或其抗原结合片段之前、同时或之后向患者给予car-t细胞以治疗患有细胞增殖性障碍如癌症的哺乳动物受试者(例如人类)。
[0392]
考虑到基因工程化t淋巴细胞表达对肿瘤相关抗原具有特异性的抗原受体的能力,car-t疗法是用于靶向癌细胞的特别有力的平台。例如,在肿瘤和其他癌细胞表面上过表达的抗原的鉴定可以告知嵌合t细胞受体的设计和发现,所述嵌合t细胞受体通常由源自
天然存在的t细胞受体的胞质和跨膜结构域组成,所述天然存在的t细胞受体与特异性结合特定抗原肽的胞外scfv片段有效地连接。可以通过本文所述的或本领域已知的多种基因组编辑技术中的任一种对t细胞进遗传修饰,以表达特异性结合特定肿瘤抗原的抗原受体。用于修饰t细胞基因组以掺入编码嵌合抗原受体的基因的示例性技术包括本文所述的crisper/cas、锌指核酸酶、talen、arcus
tm
平台。用于基因工程化car-t淋巴细胞的方法例如已经描述于wo 2014/127261、wo 2014/039523、wo 2014/099671和wo 20120790000中;将其各自的披露内容通过引用结合在此。
[0393]
用于本发明的组合物和方法中的car-t细胞包括已被遗传修饰使得细胞不表达内源性t细胞受体的的那些细胞。例如,可以通过基因组编辑技术(如本文所述的那些)对car-t细胞进行修饰从而抑制内源性t细胞受体的表达,以防止接受car-t输注的患者中的接枝物抗宿主反应。另外地或可替代地,可以对car-t细胞进行遗传修饰以减少一种或多种内源性mhc蛋白的表达。这是用于输注同种异体t淋巴细胞的特别有用的技术,因为外来mhc蛋白的识别代表了促进同种异体接枝排斥的一种机制。本领域技术人员还可以修饰t淋巴细胞以抑制免疫抑制蛋白(如程序性细胞死亡蛋白1(pd-1)和细胞毒性t淋巴细胞相关蛋白4(ctla-4))的表达。这些蛋白质是当被激活时减弱t细胞活化的细胞表面受体。已经被遗传修饰以减少一种或多种免疫抑制剂蛋白的表达的car-t细胞的输注代表了可用于延长体内t淋巴细胞介导的细胞毒性的一种策略。
[0394]
除了缺失特定基因之外,还可以修饰car-t细胞以表达具有所希望抗原特异性的t细胞受体。例如,可以遗传修饰t淋巴细胞以表达与肿瘤相关抗原特异性结合的t细胞受体,以将输注的t细胞靶向癌细胞。可以由car-t细胞表达的示例性t细胞受体是结合pd-l1的受体,该pd-l1是通常在各种肿瘤细胞上过表达的细胞表面蛋白。由于pd-l1激活t-淋巴细胞表面上的pd-1,因此用car-t疗法靶向该肿瘤抗原可以与本发明的拮抗性tnfr2抗体或抗体片段协同作用,以增加由体内t淋巴细胞介导的免疫应答的持续时间。还可以修饰car-t细胞以表达特异性结合抗原的t细胞受体,该抗原与一种或多种传染性疾病相关,如来源于病毒蛋白质、细菌细胞、真菌或其他寄生虫生物的抗原。
[0395]
本发明的其他药物组合物包括含有可施用于患有传染性疾病的患者(例如人类患者)的拮抗性tnfr2抗体或抗体片段、干扰素α、和/或一种或多种抗生素的那些药物组合物。例如,拮抗性tnfr2抗体或抗体片段可以与用于治疗一种或多种传染性疾病的抗生素缀合、混合或分开给予,所述抗生素如阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、妥布霉素、巴龙霉素、链霉素、大观霉素、格尔德霉素、除莠霉素、利福昔明、氯碳头孢、厄他培南、多利培南、亚胺培南、美罗培南、头孢羟氨苄、头孢唑林、cefazlexin、头孢克洛、头孢西丁、头孢丙烯、头孢呋辛、头孢地尼、头孢托仑、头孢哌酮、克林霉素、林可霉素、达托霉素、红霉素、利奈唑胺、特地佐利(torezolid)、阿莫西林、氨比西林、枯草菌素、环丙沙星、多西环素以及四环素等。
[0396]
血脑屏障穿透
[0397]
在某些实施例中,可以配制本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)以确保体内适当的分布。例如,血脑屏障(bbb)排除许多高度亲水的化合物。为确保本发明的治疗性组合物穿过bbb(如果需要),可以将它们配制到例如脂质体中。例如,美国专利号4,522,811;5,374,548;和5,399,331已经描述了生产脂质体的方法。脂质体可以包括
被选择性运输至特定细胞或器官中,由此增强靶向药物递送的一个或多个部分(参见,例如,v.v.ranade(j.clin.pharmacol.[临床药理学杂志]29:685,1989))。示例性靶向部分包括例如叶酸酯或生物素(参见,例如,美国专利号5,416,016);甘露糖苷(umezawa等人(biochem.biophys.res.commun.[生物化学、生物物理研究通讯]153:1038,1988));抗体(p.g.bloeman等人(febs lett.[欧洲生物化学学会联盟通讯]357:140,1995);m.owais等人(antimicrob.agents chemother.[抗微生物剂化学疗法]39:180,1995));表面活性蛋白a受体(briscoe等人(am.j.physiol.[美国生理学杂志]1233:134,1995));将其各自的披露内容通过引用结合在此。
[0398]
给药途径和剂量给药
[0399]
本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)可以通过多种途径(如口服、透皮、皮下、鼻内、静脉内、肌肉内、眼内、瘤内、肠胃外、局部、鞘内和脑室内)施用于哺乳动物受试者(例如人)。在任何给定情况下,最合适的给药途径将取决于给予的特定抗体或抗原结合片段,患者,药物配制方法,给药方法(例如,给药时间和给药途径),患者的年龄、体重、性别,所治疗疾病的严重程度,患者的饮食和患者的排泄速率。
[0400]
本发明的抗tnfr2单链多肽、抗体或其抗原结合片段的有效剂量可以每单次(例如推注)给药、多次给药或连续给药在约0.0001至约100mg/kg体重的范围内,或达到每单次(例如推注)给药、多次给药或连续给药0.0001-5000μg/ml血清浓度的血清浓度,或取决于所治疗的病症、给药途径和受试者的年龄、体重和状况,所述范围内的任何有效范围或值。在例如用于治疗癌症的某些实施例中,每个剂量可以在约0.0001mg/kg至约500mg/kg体重的范围内。例如,能以0.001-100mg/kg(体重)的日剂量施用本发明的药物组合物。可以将剂量每天、每周、每月或每年一次或多次(例如2-10次)施用于对其有需要的哺乳动物受试者(例如人)。
[0401]
可以用本领域已知的医学装置来给予治疗性组合物。例如,在一个实施例中,可以用无针皮下注射装置,如美国专利号号5,399,163;5,383,851;5,312,335;5,064,413;4,941,880;4,790,824;或4,596,556中所披露的装置施用本发明的治疗性组合物。在本发明中有用的熟知植入物和模块的实例包括:美国专利号4,487,603,其披露了用于以受控速率分配药物的可植入式微量输注泵;美国专利号4,486,194,其披露了用于通过皮肤给予药物的治疗装置;美国专利号4,447,233,其披露了用于以精确输注速率递送药物的药物输注泵;美国专利号4,447,224,其披露了用于连续药物递送的可变流速可植入输注装置;美国专利号4,439,196,其披露了具有多腔区室的渗透性药物递送系统;以及美国专利号4,475,196,其披露了一种渗透性药物递送系统。这些专利通过引用结合在此。许多其他这类植入物、递送系统以及模块是本领域技术人员已知的。
[0402]
含有拮抗性抗tnfr2多肽的试剂盒
[0403]
本发明还包括含有拮抗性抗tnfr2多肽(例如,单链多肽、抗体或其片段)的试剂盒。本文提供的试剂盒可以含有任何上述拮抗性tnfr2多肽、以及编码这些多肽的任何多核苷酸、含有这些多肽的载体、或经改造以表达并分泌本发明的多肽的细胞(例如,原核或真核细胞)。本发明的试剂盒可以包括可用于生产本发明的组合物(例如,拮抗性抗tnfr2多肽,如单链多肽、抗体或其片段,含有拮抗性抗tnfr2多肽的缀合物,编码拮抗性抗tnfr2多肽的多核苷酸,含有这些多肽的载体)的试剂。任选地,本发明的试剂盒可以包括能够诱导
拮抗性tnfr2抗体在细胞(例如,哺乳动物细胞)内表达的试剂,如多西环素或四环素。在其他情况下,本发明的试剂盒可以含有能够结合并检测包含拮抗性tnfr2多肽和表位标签的融合蛋白的化合物。例如,在这样的情况下,本发明的试剂盒可以含有麦芽糖、谷胱甘肽、含镍复合物、抗flag抗体、抗myc抗体、抗ha抗体、生物素或链霉亲和素。
[0404]
本发明的试剂盒还可以包括能够直接检测拮抗性tnfr2单链多肽、抗体或其片段的试剂。此类试剂的实例包括选择性识别并结合本发明的抗tnfr2抗体的fc区内的特定结构特征的第二抗体。本发明的试剂盒可以包含识别拮抗性tnfr2抗体的fc区并与荧光分子缀合的第二抗体。这些抗体-荧光团缀合物提供了用于使用已建立的免疫荧光技术来分析拮抗性抗tnfr2抗体例如在特定组织或培养的哺乳动物细胞中的定位的工具。在一些实施例中,本发明的试剂盒可以包括展示已知的亚细胞定位模式的另外的荧光化合物。这些试剂可以与另一种抗体-荧光团缀合物(例如,特异性识别细胞表面上的不同受体的抗体-荧光团缀合物)组合使用以分析抗tnfr2抗体相对于其他细胞表面蛋白的定位。
[0405]
本发明的试剂盒还可以含有可用于分析患者对通过施用本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)的治疗的应答的试剂。例如,本发明的试剂盒可以包括拮抗性tnfr2多肽(如单链多肽、抗体或抗体片段)以及一种或多种可用于确定取自受试者(例如人)的血液样品中的t-reg细胞的量的试剂,所述受试者正用本发明的抗体进行治疗。这样的试剂盒可以含有例如选择性结合由t-reg细胞(如cd4和cd25)呈递的细胞表面抗原的抗体。任选地,这些抗体可以用荧光染料(如荧光素或四甲基若丹明)标记,以通过本领域已知的荧光激活细胞分选(facs)方法促进对t-reg细胞群的分析。本发明的试剂盒可以任选地含有一种或多种试剂,所述一种或多种试剂可以用于定量肿瘤反应性t淋巴细胞群以确定本发明的拮抗性tnfr2多肽在恢复肿瘤浸润性淋巴细胞增殖中的有效性。例如,本发明的试剂盒可以含有选择性结合细胞毒性t细胞(如cd8或cd3)表面上的细胞表面标记的抗体。任选地,这些抗体可以用荧光分子标记以能够通过facs分析进行定量。
[0406]
本发明的试剂盒还可以包含一种或多种试剂,所述一种或多种试剂用于确定本发明的拮抗性tnfr2单链多肽、抗体或其抗原结合片段对一种或多种衍生自tnfr2的肽(例如,含有seq id no:11、19、20和34-117中任一个的序列的肽,或在seq id no:7的位置80和130之间含有约10至约30个之间的连续或不连续氨基酸的肽)的亲和力和选择性。例如,试剂盒可以含有拮抗性tnfr2抗体和一种或多种试剂,所述一种或多种试剂可以用于elisa测定中以确定本发明的抗体对一种或多种肽的kd,所述一种或多种肽呈递处于与天然蛋白质中的表位的构象类似的构象的tnfr2表位。试剂盒可以包含例如含有预先与亲和素缀合的孔的微量滴定板,并且可以包含tnfr2衍生肽的文库,所述每一个tnfr2衍生肽与生物素部分进行缀合。这类试剂盒可以任选地含有与本发明的拮抗性tnfr2抗体的fc区特异性结合的第二抗体,并且第二抗体可以与催化化学反应的酶(例如,辣根过氧化物酶)缀合,所述化学反应导致发光的发射。
[0407]
本发明的试剂盒还可以包含本发明的拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)以及可以与这类多肽缀合的试剂,所述试剂包括之前描述的那些(例如,细胞毒性剂、荧光分子、生物发光分子、含有放射性同位素的分子、含有与顺磁性离子结合的螯合基团的分子等)。这些试剂盒可以另外地包含关于可以如何实现本发明的拮抗性tnfr2多肽与第二分子(如上述那些)的缀合的说明。
[0408]
本发明的试剂盒还可以包含含有编码拮抗性抗tnfr2单链多肽、抗体或其片段的多核苷酸的载体,如本文所述的任何载体。可替代地,试剂盒可以包括已被遗传改变以从细胞的核基因组表达并分泌拮抗性tnfr2多肽(例如,单链多肽、抗体或其片段)的哺乳动物细胞(例如cho细胞)。此类试剂盒还可以包含描述如何可以诱导从多核苷酸表达拮抗性tnfr2单链多肽、抗体或其片段的说明书,并且可以另外包括可用于促进这些多核苷酸的转录的的试剂(例如像多西环素或四环素)。这样的试剂盒可以用于生产本发明的拮抗性tnfr2抗体或其抗原结合片段。
[0409]
本发明的其他试剂盒可以包括用于工程化原核或真核细胞(例如,cho细胞或bl21(de3)大肠杆菌细胞)的工具,以从细胞的核基因组表达并分泌本发明的拮抗性tnfr2单链多肽、抗体或片段。例如,试剂盒可以包含储存在适当的培养基中并且根据本领域已知的方法任选地冷冻的cho细胞。该试剂盒还可以提供含有编码核酸酶(例如,如本文所述的crisper/cas、锌指核酸酶、talen、arcus
tm
核酸酶)的多核苷酸的载体以及用于在细胞中表达核酸酶的试剂。该试剂盒可以另外地提供用于修饰编码核酸酶的多核苷酸的工具,以能够改变核酸酶的dna序列,从而指导感兴趣的特定靶dna序列的切割。这样的工具的实例包括用于扩增并定点诱变编码感兴趣的核酸酶的多核苷酸的引物。该试剂盒还可以包括限制性酶,所述限制性酶可以用于从载体选择性地切除编码核酸酶的多核苷酸,并且随后一旦使用者已经修饰基因就将修饰的多核苷酸重新引入载体。此类试剂盒还可以包括可用于催化经修饰的编码核酸酶的多核苷酸和靶载体之间共价磷酸二酯键的形成的dna连接酶。本发明的试剂盒还可以提供编码拮抗性抗tnfr2单链多肽、抗体或其片段的多核苷酸,以及包装说明书,该说明书描述可用于选择性切割细胞基因组中的特定dna序列以将编码拮抗性tnfr2多肽的多核苷酸掺入该位点处的基因组的方法。任选地,该试剂盒可以提供编码融合蛋白的多核苷酸,所述融合蛋白包含拮抗性tnfr2单链多肽、抗体或其片段和另外的多肽,例如像本文所述的那些。
[0410]
实例
[0411]
提出以下实例以向本领域普通技术人员提供如何执行、制造和评价本文所要求保护的组合物和方法的描述,并且旨在纯粹是本发明的示例,而非旨在限制本发明人认为的本发明的范围。
[0412]
实例1.tnfr2内与tnfrab1和tnfrab2相互作用的离散表位作图
[0413]
针对蛋白质内对tnfr2抗体tnfrab2表现出高亲和力的不同序列来筛选衍生自人tnfr2的线性肽、环状肽和二环肽的文库。为了筛选tfnr2内的构象表位,将来自初级蛋白质序列的不同区域的肽彼此缀合以形成嵌合肽。这些肽在其一级序列内的战略位置处包含半胱氨酸残基(参见,例如图3,seq id no:34-117和134-252)。这促进了分子内交联策略,该策略被用于将各个肽约束到广泛的三维构象中的一个。将半胱氨酸残基的未受保护的硫醇与二价和三价亲电子试剂(如2,6-双(溴甲基)吡啶和1,3,5-三(溴甲基)苯)经由亲核取代反应进行交联,以分别形成构象受限的环状肽和二环肽。以这种方式,含有来自tnfr2一级序列的不同区域的氨基酸的独特组合的肽受到限制,从而在结构上预组织表位,所述表位可以类似于在天然tnfr2三级结构中呈现的那些。通过将肽固定到固体表面的不同区域并在过氧化氢存在下依次用tnfrab1或tnfrab2、与辣根过氧化物酶(hrp)缀合的第二抗体、以及hrp底物(2,2'-连氮基-二-3-乙基苯并噻唑啉磺酸盐)处理该表面来筛选包含这些肽的
文库。在用连续的试剂处理之间洗涤固体表面以去除过量或非特异性结合的物质。随后使用电荷耦合装置(ccd)-摄像机和图像处理系统分析每个表面的每个区域的发光。
[0414]“表面上的肽的受约束文库”(clips)平台开始于使用组合矩阵设计将靶蛋白(例如tnfr2)转化成多达10,000个重叠肽构建体的文库(timmerman等人,j.mol.recognit.[分子识别杂志],20:283-29,2007)。在固体载体上,合成线性肽的矩阵,所述线性肽随后被塑造成空间限定的clips构建体。代表正确构象的不连续表位的多个部分的构建体以高亲和力结合被检测和定量的抗体。呈递不完全表位的构建体以较低亲和力结合抗体,而不含表位的构建体根本不结合抗体。亲和力信息被用于迭代筛选以详细定义表位的序列和构象。从这些elisa实验获得的针对tnfrab1和tnfrab2的原始发光数据分别报告在图3a和3b中。这些结果告知了对存在于tnfr2的表面上的表位的分析,所述表位结合拮抗性tnfr2抗体。tnfr2的结构模型示于图4和15a-15c中,所述结构模型图解了结合这类抗体的表位。
[0415]
肽合成
[0416]
为了重建靶分子的表位,合成了肽文库。经由使用二环己基碳二亚胺(dcc)与n-羟基苯并三唑(hobt)而与叔丁氧基羰基-六亚甲基二胺(bochmda)进行反应并随后使用三氟乙酸(tfa)裂解boc-基团,通过接枝专有的亲水性聚合物配制品而获得氨基官能化的聚丙烯支持物。标准fmoc-肽合成被用于通过定制改进的液体处理站(珀金埃尔默公司(perkin-elmer))在氨基官能化的固体支持物上合成肽。clips技术允许将肽构造成单环、双环、三环、片状折叠、螺旋状折叠及其组合。clips模板与半胱氨酸残基偶联。肽中多个半胱氨酸的侧链与一个或两个clips模板偶联。例如,将clips模板(2,6-双(溴甲基)吡啶)的0.5mm溶液溶解于碳酸氢铵(20mm,ph 7.8)/乙腈(1:3(v/v))中。将该溶液添加到表面结合肽阵列中。clips模板将与存在于肽阵列(具有3μl孔的455孔板)的固相结合肽中的两个半胱氨酸的侧链进行反应。将肽阵列在溶液中轻轻摇动30至60分钟,同时完全覆盖在溶液中。最后,用过量的h2o充分洗涤肽阵列,并在含有pbs中的1%sds/0.1%β-巯基乙醇的破碎缓冲液(ph 7.2)中在70℃处超声处理30分钟,随后在h2o中再超声处理45分钟。
[0417]
通过表面等离子共振分析拮抗性tnfr2抗体的结合亲和力
[0418]
使用biacore
tm
分析服务(精密抗体公司(precision antibody))测量拮抗性tnfr2抗体对重组人tnfr2的亲和力。简言之,使用pbs中的生物素基-lc-lc-nose(赛默飞世尔公司(thermo-fisher))以5:1的化学计量比将抗体进行生物素酰化。通过离心层析去除过量的生物素酰化试剂,并将生物素酰化的抗体在3000ru的链霉亲和素表面上捕获至100ru的水平。具有抗体捕获水平的tnfr2的信号的理论最大值为26ru,并且在运行缓冲液中使用500nm tnfr2的初步实验达到该信号。以60μl/min的流速,伴随2分钟的注射进行抗原结合动力学的分析。以1mg/ml的浓度注射抗体至最终捕获为100ru。使用的仪器是具有biocap芯片的biacore
tm
3000(ge医疗集团(ge healthcare))。将双参考方法用于分析。参考通道含有相同水平的链霉亲和素。如使用该测定法测量的,拮抗性tnfr2抗体tnfrab1和tnfrab2与tnfr2结合的热力学和动力学参数示于图13a中。
[0419]
elisa筛选
[0420]
以elisa形式测试抗体与每种合成肽的结合。将表面固定的肽阵列与第一抗体溶液一起孵育(4℃过夜)。洗涤后,将肽阵列与适当的抗体过氧化物酶缀合物(sba)的1/1000稀释液在25℃孵育一小时。洗涤后,添加过氧化物酶底物2,2'-连氮基-二-3-乙基苯并噻唑
啉磺酸盐(abts)和2μl/ml的3%h2o2。一小时后,测量显色。用电荷耦合装置(ccd)-摄像机和图像处理系统对显色进行量化。从ccd摄像机获得的值在从0到3000mau的范围内,与标准的96孔板elisa读数器获得的值相似。结果被量化并存储到peplab数据库中。偶尔,孔含有导致假阳性值的气泡,手动检查卡片并将由气泡引起的任何值均记分为0。
[0421]
为了验证合成肽的质量,平行地合成单独的一组阳性和阴性对照肽。用阴性对照抗体57.9,一种不特异性结合tnfr2的抗体,筛选这些肽(posthumus等人(j.virology.[病毒学杂志]64:3304-3309,1990))。
[0422]
图3a和3b分别突出了以高亲和力结合tnfrab1和tnfrab2的肽。因此,这些肽含有tnfr2内的以下残基,所述残基在结构上被配置成优先被tnfrab1和tnfrab2结合的表位。
[0423]
表位作图
[0424]
elisa也用于确定存在于tnfr2的细胞外表面上的线性表位。对应于tnfr2一级序列内的各种区域的线性肽购自金斯瑞公司(genscript)(皮斯卡塔韦(piscataway),新泽西州),在包被缓冲液中稀释并以1μg/孔的浓度置于immulon 4hbx平底微量滴定板(赛默科技公司(thermo scientific))上。将第一tnfr2拮抗性抗体(0.1μg/孔)与底物一起孵育。使用针对啮齿动物igg的第二抗体来检测第一抗体。使用190吸光度读板仪测量吸光度,并用softmax pro 6.3(分子设备公司(molecular devices))分析。这些基于elisa的测定的结果示于图13b和13c中。
[0425]
实例2.拮抗性tnfr2抗体抑制t-reg细胞增殖
[0426]
材料与方法
[0427]
·
人t-reg flow
tm
试剂盒(博奇公司(biolegend),目录号320401)
[0428]
o混合物:抗-人cd4 pe-cy5/cd25 pe(博奇公司,部件号78930)
[0429]
o alexa488抗-人foxp3,克隆259d(博奇公司,部件号79467)
[0430]
o alexa488小鼠igg1,k同种型ctrl(icfc),克隆mopc-21(博奇公司,部件号79486)
[0431]
o foxp3 fix/perm缓冲液(4x)(博奇公司,目录号421401)
[0432]
o foxp3 perm缓冲液(10x)(博奇公司,目录号421402)
[0433]
·
pe抗-人cd25,克隆:bc96(博奇公司,目录号302606)
[0434]
·
alexa488抗-人foxp3,克隆259d(博奇公司,目录号320212)
[0435]
·
pbs ph 7.4(1x)(浠思生物测定技术有限公司(gibco),目录号10010-023)
[0436]
·
hbss(1x)(浠思生物测定技术有限公司,目录号14175-095)
[0437]
·
fbs(热灭活的)
[0438]
·
15ml试管
[0439]
·
针对15ml试管的具有吊桶式转子的台式离心机(设定速度1100rpm或200g)
[0440]
测试拮抗性tnfr2抗体(tnfrab1和tnfrab2)抑制t-reg细胞增殖的能力。在存在和不存在刺激性生长因子(例如,tnfα)下,将培养的t-reg细胞用不同浓度的拮抗性tnfr2抗体处理设定的时间段。在存在和不存在tnfα下,还在范围从0.0008-25μg/ml的不同浓度的tnfrab1存在下培养t-reg细胞。作为对照,还将t-reg细胞与浓度范围为0-40ng/ml的单独的tnfα一起孵育,以选择诱导t-reg细胞计数高分数增加的tnfα水平。此外,在il-2单独存在下和tnfrab2单独存在下培养t-reg细胞。
[0441]
在上述条件下孵育t-reg细胞之后,使用流式细胞术分析来确定细胞计数。将密度为0.2-1x106个细胞/100μl的t-reg细胞分配到15ml锥形管中并离心5分钟以沉淀细胞。丢弃上清液并将细胞重悬于100μl的洗涤缓冲液(含有2%fbs的1x hbss)中。向该混合物中添加5μl的pe抗人cd25荧光团-抗体缀合物,并且随后将细胞涡旋并在黑暗中孵育25分钟。然后通过添加1ml洗涤缓冲液洗涤细胞,并且随后离心5分钟。然后丢弃上清液,并且将1ml的foxp3固定/透化缓冲液(pbs中的4x foxp3 fix/perm缓冲液的1:4稀释液)添加到细胞中。然后将细胞涡旋并在黑暗中孵育20分钟。随后将细胞离心5分钟并丢弃上清液。然后将细胞重悬于1ml新鲜的洗涤缓冲液中,涡旋并离心5分钟。随后将细胞重悬于1ml的1x foxp3 perm缓冲液(pbs中的10x foxp3 perm缓冲液的1:10稀释液)中,涡旋,并在黑暗中孵育15分钟。孵育后,将细胞离心5分钟,并且随后丢弃上清液。然后将细胞沉淀物重悬于100μl的1x foxp3 perm缓冲液中。此时,将5μl的alexa488抗人foxp3或alexa488小鼠igg1、k同种型对照添加到细胞中。然后将细胞涡旋并在黑暗中孵育35分钟。孵育后,通过向细胞中添加1ml新鲜洗涤缓冲液来洗涤细胞,涡旋细胞并离心5分钟。然后丢弃上清液,并且将细胞沉淀物重悬于0.2-0.5ml的不含fbs的1x hbss中。然后通过流式细胞术分析来确定细胞计数。
[0442]
如图5所见,即使当细胞与20ng/ml tnfα共孵育时,拮抗性tnfr2抗体tnfrab1的孵育也以剂量依赖性方式抑制t-reg细胞增殖。引人注目的是,这种浓度的tnfα能够诱导在单独用tnfα处理的t-reg样品中分析的tnfα剂量中t-reg细胞计数的最大分数增加。即使在活化水平的tnfα存在下tnfrab1也能够减少t-reg细胞增殖,这表明拮抗性tnfr2抗体不仅能够与tnfα竞争受体结合,而且还表现出抑制导致t-reg细胞生长和增殖的下游信号级联的能力。例如,当t-reg细胞与20ng/ml的单独的tnfα一起孵育时,所得的t-reg群体增加至未处理的对照细胞的130%。然而,20ng/ml的t-reg细胞与tnfrab1共孵育时,在浓度范围为0.004-1.25μg/ml的tnfrab1下观察到细胞增殖的稳定的剂量依赖性抑制。
[0443]
实例3.通过噬菌体展示而产生拮抗性tnfr2抗体
[0444]
用于本发明的拮抗性tnfr2抗体的体外蛋白质进化的示例性方法是噬菌体展示,这是一种本领域熟知的技术。可以通过在抗体的cdr或抗体样支架的类似区域(例如,
10
fn3结构域的bc、cd和de环)的编码序列内进行一系列设计的突变或变异来创建噬菌体展示文库。其中引入了这些突变的模板抗体编码序列可以是例如本文所述的初试人类种系序列。可以使用本文所述的或本领域已知的标准诱变技术来进行这些突变。因此,每个突变序列编码整体结构与模板相对应的抗体,除了在模板序列中具有一个或多个氨基酸变异。可以使用如本文所述的或本领域已知的标准载体构建技术,将逆转录病毒和噬菌体展示载体工程化。如本领域所熟知的,p3噬菌体展示载体与相容的蛋白质表达载体一起可以用于产生如本文所述的用于抗体多样化的噬菌体展示载体。
[0445]
突变的dna提供了序列多样性,并且每个转化体噬菌体展示了由dna编码的初始模板氨基酸序列的一个变体,这导致展示了大量不同但结构上相关的氨基酸序列的噬菌体群(文库)。由于抗体高变区的明确结构,引入噬菌体展示筛选中的氨基酸变异预期会改变结合肽或结构域的结合特性,而不显著改变其结构。
[0446]
在典型筛选中,使噬菌体文库与tnfr2衍生肽(例如,具有seq id no:11、19、20和34-117中任一个的序列的肽,并且特别是含有如seq id no:42、50、52-54和61-63中的
kcrpg基序的那些)或其特定亚成分接触或允许与其结合。为了促进结合者和非结合者的分离,将靶标固定在固体支持物上是方便的。带有tnfr2结合部分的噬菌体可以与固体支持物上的靶标形成复合物,而非结合的噬菌体保留在溶液中并且可以用过量的缓冲液洗掉。然后通过改变缓冲液至极端ph(ph 2或ph 10)、改变缓冲液的离子强度、添加变性剂或其他已知的方式,从靶标释放结合的噬菌体。为了分离显示本发明多肽的结合噬菌体,进行蛋白质洗脱。
[0447]
然后可以通过感染细菌细胞扩增回收的噬菌体,并且可以用现在耗尽非结合抗体并富集结合靶肽的抗体的新池重复筛选过程。甚至几个结合噬菌体的回收足以扩增噬菌体用于随后的筛选迭代。经过几轮选择后,通过常规方法确定编码来源于结合池中选定噬菌体克隆的抗体或其抗原结合片段的基因序列,从而揭示赋予噬菌体对靶的结合亲和力的肽序列。在淘选过程中,群体的序列多样性随着每一轮选择而减小,直到留下所希望的肽结合抗体。序列可以聚集在少数相关的抗体或其抗原结合片段上,通常在来自每个文库的约10
9-10
10
个原始候选物中有10-50个。每轮选择中回收的噬菌体数量的增加很好地表明在筛选中发生文库的会聚。在鉴定了一组结合多肽之后,序列信息可以用于设计其他二级噬菌体文库,偏离具有另外所希望的性质的成员(参见wo 2014/152660;通过引用结合在此)。
[0448]
实例4.通过给予拮抗性抗tnfr2抗体治疗人类患者中的癌症
[0449]
本发明的拮抗性tnfr2抗体可以施用于人类患者以治疗细胞增殖性障碍,如癌症。这些抗体的给予抑制了t-reg细胞群的生长和增殖。本发明的抗体还可以施用于患者以抑制t-reg介导的免疫应答。例如,可以通过在数天、数周、数月或数年的过程中由适当途径(例如,静脉内)以特定剂量(例如,0.001至100mg/kg/天)施用本发明的拮抗性tnfr2抗体来治疗患有癌症(例如,本文所述的癌症)的人类患者。如果需要,可以例如通过高糖基化或通过与peg缀合来修饰抗tnfr2抗体,从而逃避免疫识别和/或改善抗体的药代动力学特征。
[0450]
用本发明的拮抗性tnfr2抗体治疗的癌症的进展可以通过几种已建立的方法中的任何一种或多种来监测。医师可以通过直接观察来监测患者,以评估患者所表现出的症状如何响应于治疗而改变。还可以对患者进行mri、ct扫描或pet分析以确定肿瘤是否已经转移或者肿瘤的大小是否已经改变,例如响应于用本发明的抗tnfr2抗体治疗而减小。任选地,可以从患者中提取细胞,并且可以进行定量生物化学分析以确定各种生长因子受体(如表皮生长因子受体)的相对细胞表面浓度。基于这些分析的结果,医师可以在随后几轮治疗中开出拮抗性tnfr2抗体的更高/更低剂量或更高/更低频率剂量给药。
[0451]
实例5.产生scfv tnfr2拮抗剂
[0452]
本发明的抗体片段包括scfv片段,该scfv片段由在单条肽链中合并的轻链和重链的抗体可变区组成。通过重组表达编码tnfr2抗体(例如,tnfrab1)的轻链可变区的多核苷酸,tnfr2抗体可以用作开发scfv抗体片段的框架,所述多核苷酸有效地与那个抗体的重链可变区连接。这可以使用如本文所述的或本领域已知的已建立的诱变方案来完成。然后可以在细胞(例如,cho细胞)中表达该多核苷酸,并且随后可以从细胞培养基中分离该scfv片段。
[0453]
可替代地,可以通过化学合成方法(例如,如本文所述的基于fmoc的固相肽合成)来产生衍生自tnfr2拮抗剂的scfv片段。本领域技术人员可以化学合成由tnfr2抗体(例如tnfrab1)的轻链可变区组成的肽链,该肽链有效地与该抗体的重链可变区连接。天然化学
连接可以被用作用以合成长肽(例如,大于50个氨基酸)的策略。天然化学连接方案是本领域中已知的并且已经被dawson等人(science[科学],266:776-779,1994)描述;通过引用结合在此。
[0454]
实例6.产生人源化tnfr2抗体
[0455]
产生本发明的人源化tnfr2抗体的一种方法是将tnfr2抗体的cdr导入人抗体共有序列。共有人抗体重链和轻链序列是本领域已知的(参见例如,“vbase”人类种系序列数据库;kabat等人(sequences of proteins of immunological interest,fifth edition[免疫学感兴趣的蛋白质的序列,第五版],u.s.department of health and human services[美国卫生和公共服务部],nih公开号91-3242,1991);tomlinson等人(j.mol.biol.[分子生物学杂志]227:776-798,1992);以及cox等人(eur.j.immunol.[欧洲免疫学杂志]24:827-836,1994);通过引用结合在此)。使用已建立的程序,可以鉴定共有抗体序列的可变结构域残基和cdr(例如,通过序列比对(参见kabat,同上))。可以用tnfrab1或本文所述的另一个tnfr2拮抗剂抗体的一个或多个相应的cdr取代共有人抗体的重链和/或轻链可变结构域的一个或多个cdr,以使用本文所述的或本领域已知的基因编辑技术产生人源化抗tnfrab1变体。共有人抗体的可变结构域的一个实例包括重链可变结构域evqlvesggglvqpggslrlscaasgftfsdyamswvrqapgkglewvavisengsdtyyadsvkgrftisrddskntlylqmnslraedtavyycardrggavsyfdvwgqgtlvtvss(seq id no:32)和轻链可变结构域diqmtqspsslsasvgdrvtitcrasqdvssylawyqqkpgkapklliyaasslesgvpsrfsgsgsgtdftltisslqpedfatyycqqynslpytfgqgtkveikrt(seq id no:33),在美国专利号6,054,297中被鉴定的;通过引用结合在此(cdr以粗体示出)。
[0456]
为了产生人源化tnfr2抗体,可以重组表达编码以上共有序列的多核苷酸,在所述以上共有序列中一个或多个可变区cdr已经被tnfr2特异性抗体的一个或多个可变区cdr序列替换。例如,共有人抗体的重链可变结构域的cdr 1-3可以分别被具有seq id no:23-25的序列的cdr 1-3替换,并且共有人抗体的轻链可变结构域的cdr 1-3可以分别被具有seq id no:26-28的序列的cdr 1-3替换。
[0457]
编码以上重链和轻链可变结构域的、有效地与另一多核苷酸连接的多核苷酸可以被整合到表达载体(例如,如本文所述或本领域已知的针对原核或真核细胞中的蛋白质表达进行优化的表达载体)中。因此,单链抗体片段(scfv)可以在宿主细胞中表达,并随后使用已建立的技术(如本文所述的尺寸排阻层析和/或亲和层析)从宿主细胞培养基中纯化。
[0458]
实例7.通过给予拮抗性抗tnfr2抗体治疗人类患者中的hiv
[0459]
本发明的拮抗性tnfr2抗体可以施用于人类患者以治疗病毒感染,如hiv。这些抗体的给予抑制了t-reg细胞群的生长和增殖,其通过允许能够增加对受感染细胞的攻击的细胞毒性t淋巴细胞的生长和增殖来增强患者的免疫应答。例如,可以通过在数天、数周、数月或数年的过程中由适当途径(例如,静脉内)以特定剂量(例如,0.001至100mg/kg/天)施用本发明的拮抗性tnfr2抗体(例如,与含有tnfr2的kcrpg序列的一个或多个残基的表位(seq id no:7的残基142-146)特异性结合并且不表现出与含有tnfr2的kcspg序列的表位(seq id no:7的残基56-60)特异性结合并且具有非天然恒定区的tnfr2抗体,如含有tnfrab1的一个或多个cdr或其变体的tnfr2抗体)来治疗患有hiv的人患者。如果需要,可以例如通过高糖基化或通过与peg缀合来修饰抗tnfr2抗体,从而逃避免疫识别和/或改善抗
体的药代动力学特征。
[0460]
用本发明的拮抗性tnfr2抗体治疗的hiv的进展可以通过几种已建立的方法中的任何一种或多种来监测。医师可以通过直接观察来监测患者,以评估患者所表现出的症状如何响应于治疗而改变。还可以从患者中取出血液样品以分析一种或多种白细胞的细胞计数,以确定感染细胞的量是否响应于用本发明的抗tnfr2抗体的治疗而改变(例如减少)。基于这些分析的结果,医师可以在随后几轮治疗中开出拮抗性tnfr2抗体的更高/更低剂量或更高/更低频率剂量给药。
[0461]
实例8.通过给予拮抗性抗tnfr2抗体治疗非人哺乳动物中的结核分枝杆菌
[0462]
可以将本发明的拮抗性tnfr2抗体施用于非人哺乳动物(例如,牛科哺乳动物、猪、野牛、马、绵羊、山羊、牛、猫、狗、兔、仓鼠、豚鼠或其他非人哺乳动物)以治疗细菌感染,如结核分枝杆菌。这些抗体的给予抑制了t-reg细胞群的生长和增殖,其通过允许能够增加对致病生物的攻击的细胞毒性t淋巴细胞的生长和增殖来增强患者的免疫应答。例如,可以通过在数天、数周、数月或数年的过程中由适当途径(例如,静脉内)以特定剂量(例如,0.001至100mg/kg/天)施用本发明的拮抗性tnfr2抗体(例如,与含有tnfr2的kcrpg序列的一个或多个残基的表位(seq id no:7的残基142-146)特异性结合并且不表现出与含有tnfr2的kcspg序列的表位(seq id no:7的残基56-60)特异性结合并且具有非天然恒定区的tnfr2抗体,如含有tnfrab1的一个或多个cdr或其变体的tnfr2抗体)来治疗患有结核分枝杆菌的非人哺乳动物。如果需要,可以例如通过高糖基化或通过与peg缀合来修饰抗tnfr2抗体,从而逃避免疫识别和/或改善抗体的药代动力学特征。
[0463]
用本发明的拮抗性tnfr2抗体治疗的结核分枝杆菌感染的进展可以通过几种已建立的方法中的任何一种或多种来监测。医师可以通过直接观察来监测患者,以评估患者所表现出的症状如何响应于治疗而改变。还可以从患者中取出血液样品以分析一种或多种白细胞的细胞计数,以确定免疫应答是否响应于用本发明的抗tnfr2抗体的治疗而改变(例如增加)。基于这些分析的结果,医师可以在随后几轮治疗中开出拮抗性tnfr2抗体的更高/更低剂量或更高/更低频率剂量给药。
[0464]
实例9.在il-2和tnf存在下,拮抗性tnfr2抗体抑制t-reg细胞增殖
[0465]
升高量的t-reg细胞的存在可以妨碍免疫系统对抗癌症和传染性疾病的能力。tnfr2代表t-reg增殖的重要检查点,并且因此构成免疫调节的理想靶标。为了表征两种拮抗性tnfr2单克隆抗体(mab)tnfrab1和tnfrab2的功能活性,使用了针对均质t-reg扩增而开发的基于细胞的测定法。首先证实,与增加浓度的tnfα一起孵育的正常人cd4+细胞导致t-reg细胞的剂量依赖性增加(图6a和7a)。我们还证实,t-reg增殖需要il-2的存在(图6b)。如图6b-6g中所示,相对于仅用il-2处理,在20ng/ml的tnf下对t-reg增殖的影响是显著的(》20%扩增),并且通过与tnfr2激动剂共孵育进一步增强(》60%扩增)。
[0466]
拮抗性tnfr2抗体引起treg增殖的相反作用,如使用该测定所测量的。这两种tnfr2拮抗性抗体均诱导对t-reg增殖的抑制作用,该抑制作用导致正常供血者中剩余t-reg细胞的百分比降低4%-15%。值得注意的是,该tnfr2拮抗作用占优势,并且甚至可以克服大量tnfα(20mg/ml)的存在(图6c-6g)。对t-reg的tnfr2拮抗作用是剂量依赖性的(图6d-6g)。更显著的是观察到当在tnfα存在下研究这两种tnfr2拮抗性抗体时,这两种tnfr2拮抗剂抗体都能够以剂量依赖性方式克服tnfα激动作用。这两种拮抗性抗体均能够减弱t-reg
扩增并反转tnfα激动曲线(图6a和6c-6g)。还通过将t-reg细胞与固定量的tnfr2拮抗性抗体和升高剂量的tnfα一起孵育来进行该测定(图6d-6g)。再次,剂量依赖性方式下的这两种tnfr2拮抗剂都能够逆转tnfα激动作用。应该指出的是,48小时t-reg扩增测定是用培养物中的il-2(激动剂)进行的,以防止非特异性人cd4+t细胞死亡。当对获得自这些实验的数据进行处理以确定拮抗性tnfr2抗体存在下相比于il-2单独存在下t-reg增殖的相对变化时,这两种抗体的拮抗特性持续存在(图7a-7e)。这些结果一起表明了这两种tnfr2拮抗剂抗体抑制人cd4+细胞中的t-reg增殖的功能性能力,并且该作用显著优于由中等剂量至高剂量tnfα驱动的激动作用。
[0467]
为了进行上述t-reg抑制测定,将外周血单核细胞(pbmc)用作响应者。使用ficoll-plaque plus(ge医疗集团,皮斯卡塔韦,新泽西州(ge healthcare,piscataway,nj))密度梯度在静脉穿刺当天分离pbmc并在-80℃下冷冻保存。将细胞在与t-reg细胞混合前一天解冻,并在rpmi 1640和il-2(10u/ml)中放置过夜。第二天,将应答细胞用1μm羧基荧光素乙酰乙酸琥珀酰亚胺酯(cfse)染色。然后将应答细胞(5x104个细胞)与扩增的t-reg细胞以不同比例(0:1、4:1、2:1、1:1)混合,并用抗cd3 mab(hit3a,bd生物科学公司(bd biosciences))和il-2(50u/ml)刺激。4天后收集细胞并通过流式细胞术分析。
[0468]
人类受试者
[0469]
根据马萨诸塞州综合医院人类研究委员会批准的人类研究方案(mgh-2001p001379)收集来自超过100位供者的人血样品。所有供者都提供了书面知情同意书。将血液收集到bd vacutainer edta管(bd诊断公司(bd diagnostics))中并在静脉放血2小时内处理。分离自卵巢癌患者的t-reg样品是从辐照前和化疗前新诊断出卵巢癌的妇女获得的。这些人体研究得到了马萨诸塞州综合医院人体研究委员会的批准(mgh-2015p002489;参见以下实例14)。
[0470]
血液和细胞培养物
[0471]
在静脉穿刺2小时内处理新鲜的人血。将血液用1x hbss(英杰公司(invitrogen))加上2%fbs(西格玛-奥德里奇公司(sigma-aldrich))洗涤两次,并使用cd4阳性分离试剂盒(英杰公司)分离cd4+细胞。将分离的cd4+细胞重悬浮于rpmi glutamax
tm
(生命技术公司(life technologies))加上10%fbs(西格玛-奥德里奇公司)和1%青霉素-链霉素(生命技术公司)中。将细胞以0.2-1x106个细胞/孔的浓度接种在96圆底孔的板中,用tnfr2拮抗剂抗体或tnfr2激动剂处理(如每个实例中所示),并且然后在37℃在5%co2下孵育长达48小时。由于分离的和培养的人t细胞在细胞培养基中不存在il-2时死亡,所以本文所述的所有基于细胞的实验都在培养基中使用低水平的il-2(100u/ml)以防止il-2撤回影响数据。首先通过将细胞浓缩在50-ml锥形管中并且然后悬浮细胞沉淀以获得cd4+细胞分离物,从而获得从无菌卵巢癌腹水分离的t-reg细胞(参见下面的实例14)。
[0472]
试剂和流式细胞术
[0473]
重组人tnf购自西格玛-奥德里奇公司,并且重组人il-2购自生命技术公司。使用piercef(ab’)2制备试剂盒(生命技术公司)制备tnfrab1和tnfrab2的f(ab’)2片段。针对啮齿动物igg的交联抗体(ab9165和ab99670)购自艾博抗公司(abcam)(坎布里奇(cambridge),马萨诸塞州)。根据制造商的说明书,使用人t-reg flow
tm
试剂盒(博奇公司)制备用于流式细胞术的细胞。用于流式细胞术的抗体包括用于foxp3的细胞内染色的alexa
488抗人foxp3,克隆259d,和用于cd25的细胞表面染色的pe抗人cd25克隆bc96(博奇公司)。将荧光染色的细胞重悬于1x hbss(英杰公司)中,并使用bd facs calibur流式细胞仪机器(bd公司(becton dickinson))进行分析。使用flowjo软件(版本10.0.8)处理facs数据。
[0474]
统计学分析
[0475]
通过使用excel(微软公司)或graphpad prism-5软件(graphpad软件公司(graphpad software),拉荷亚(la jolla),加利福尼亚州)的配对t检验(student t test)进行数据分析。显著性由小于0.05的双侧p值决定。
[0476]
实例10.tnfr2拮抗剂抗体对活化的t-reg细胞的短期培养效果
[0477]
为了研究拮抗性tnfr2抗体调节tnfr2分泌的能力,使用elisa(r&d系统公司(r&d systems))测量来自细胞培养上清液的可溶性人tnfr2。简言之,在将cd4+细胞与单独的il-2(200u/ml)或者与tnf(20ng/ml)或拮抗性tnfr2抗体(12.5μg/ml)一起孵育24-42小时后收集上清液,并立即使用或冷冻在-20℃。根据制造商的说明书进行elisa。使用190吸光度读板仪测量吸光度,并用softmax pro 6.3(分子设备公司)分析。
[0478]
t-reg细胞以两种状态存在,即活化的(at-reg)和静息的(rt-reg);这两种状态可以根据cd45ra的表达来区分。at-reg细胞的表型是cd25
高
cd45ra
低
,而rt-reg细胞的表型是cd25
中
cd45ra
高
。at-reg细胞是更有效的免疫功能抑制剂,并且因此是免疫治疗的理想靶标。为了研究抑制at-reg细胞的功效,首先证实的是,当用tnfr2拮抗剂处理cd4+细胞时t-reg细胞的总数减少,而不简单地是t-reg细胞的比例减少(图8a-8h)。接下来,为了确定哪一类t-reg被tnfr2拮抗剂抑制,将细胞通过cd45ra进行染色。我们发现虽然这两类t-reg细胞都被抑制,但是at-reg细胞比rt-reg细胞以更大程度被抑制。这些数据表明tnfr2拮抗剂抗体选择性地抑制at-reg细胞的增殖。高tnfr2表达是抑制性t-reg细胞的另一个特征。测量了tnfr2表达水平,并且发现tnfr2拮抗剂处理减少了tnfr2
高
表达细胞的数量。相反,tnfr2表达的平均荧光强度(mfi)在所有处理中保持相似(图9a)。总之,这些数据表明,拮抗性tnfr2抗体(如tnfrab1和tnfrab2)能够选择性地减弱cd25
高
+、cd45ra
低
+t-reg细胞的增殖。
[0479]
免疫应答通常被表征为由于高蛋白转换细胞导致的可溶性tnfr2的增加。因此,在用tnfr2调控剂处理后的培养上清液中测量可溶性tnfr2的水平,以确定这些分子对免疫活性的影响。观察到tnf和tnfr2激动剂增加可溶性tnfr2的量,而tnfr2拮抗剂降低可溶性tnfr2的水平(图9b)。此外,t-reg抑制剂测定证实了tnfr2拮抗作用对cd8+细胞的有效抑制(图9a和9c)。这些数据表明用tnfr2拮抗剂处理人cd4+细胞有效地减少了活化的和高度抑制的t-reg细胞的数量,并具有抑制可溶性诱饵tnfr2分泌的额外益处。
[0480]
为了进行如上所述的t-reg抑制测定,将外周血单核细胞(pbmc)用作响应者。使用ficoll-plaque plus(ge医疗集团,皮斯卡塔韦,新泽西州)密度梯度在静脉穿刺当天分离pbmc并在-80℃下冷冻保存。将pbmc在与t-reg细胞混合前一天解冻,并在rpmi 1640和il-2(10u/ml)中放置过夜。第二天,将应答细胞用1μm羧基荧光素乙酰乙酸琥珀酰亚胺酯(cfse)染色。然后将应答细胞(5x104个细胞)与扩增的t-reg细胞以不同比例(0:1、4:1、2:1、1:1)混合,并用抗cd3 mab(hit3a,bd生物科学公司(bd biosciences))和il-2(50u/ml)刺激。4
天后收集细胞并通过流式细胞术分析。
[0481]
为了测量如上所述的分泌的tnfr2的浓度,使用elisa测定试剂盒(r&d系统公司)。简言之,在将cd4+细胞与单独的il-2(200u/ml)或者与tnfα(20ng/ml)或tnfr2拮抗剂抗体(12.5μg/ml)一起孵育24-42小时后收集上清液,并立即使用或在-20℃冷冻。根据制造商的说明书进行elisa测定。使用190吸光度读板仪测量吸光度,并用softmax pro 6.3(分子设备公司(molecular devices))分析。
[0482]
实例11.tnfr2拮抗剂活性不依赖于非特异性fc区结合或交联
[0483]
抗体fc区的非特异性结合可以导致任意的功能性活性。用tnfr2 mab f(ab’)2片段(与tnf或不与tnf)处理cd4+细胞导致与用全单克隆抗体观察到的t-reg细胞量类似的剂量响应(图10a-10d)。这证实了拮抗性tnfr2抗体的f(ab’)2区域与tnfr2的特异性结合(而不是由fc区介导的非特异性结合)可能是抑制活性的原因。通过sds-page分析来评估f(ab’)2片段和完整抗体的纯度(图11a-11d)。
[0484]
交联也可导致抗体的异常功能活性。为了排除非特异性交联是观察到的功能活性的原因的可能性,进行剂量响应测定,其中将tnfr2拮抗剂抗体与具有和不具有抗igg抗体的t-reg细胞一起孵育。tnfr2拮抗剂抗体对t-reg细胞的剂量依赖性抑制不受抗igg的存在影响(图10c和10d)。总之,这些数据证实了tnfr2拮抗剂抗体的功能性活性不依赖于非特异性fc区活性或交联。
[0485]
为了进行上述的sds-page分析,将蛋白质样品与precision plus
tm
(伯乐公司(biorad))或perfect protein
tm
(emd密理博公司(emd millipore))标记物一起在具有mops sds运行缓冲液(生命技术公司)的nupage4%-12%bis-tris凝胶上在100v处运行1小时。用simply blue
tm
安全染色剂(英杰公司)将凝胶进行染色24小时。
[0486]
实例12.拮抗性tnfr2抗体抑制nfkb活化和基因表达
[0487]
nfkb信号传导是tnf介导的细胞应答所必需的,并且已经被提议作为癌症治疗的潜在靶标。在观察用tnfr2拮抗剂抗体处理之后t-reg细胞增殖减少时,假设潜在的信号传导机制将涉及nfkb活化的减少。为了研究对tnfr2拮抗作用的分子应答,通过实时pcr分析对八个nfkb激活启动子的表达进行了测量。这些蛋白质包括:chuk、nfkbie、knkbia、map3k11、traf2、traf3、relb、ciap2/birch。另外监测tnf和淋巴毒素、以及两种t-reg细胞的标志物foxp3和cd25的表达。在每种情况下,与用tnf处理相比,用tnfrab2处理导致基因表达的下调(图12a和12b)。接下来,使用磷酸化的rela/nfkb p65作为标记,证实了用tnfr2拮抗剂抗体处理cd4+细胞减少了nfkb活化,而用tnf处理增加了nfkb活化(图12c-12e)。这表明这两种tnfr2拮抗剂抗体对tnfr2信号转导的作用是高度相似的。此外,拮抗性tnfr2抗体与重组人tnfr2结合的动力学参数的分析揭示了tnfrab1和tnfrab2之间的缔合或解离速率没有显著差异(图13a)。
[0488]
为进行基因表达测定,将分离的cd4+细胞在il-2(50u/ml)和tnfα(20ng/ml)或tnfr2拮抗剂抗体(2.5μg/ml)存在下孵育3小时。收集细胞并使用rnaqueous-4pcr试剂盒(ambion公司)分离总rna。使用高容量cdna逆转录试剂盒(应用生物系统公司(applied-biosystems))将总rna进行逆转录。使用具有基因表达主混合物的阵列人nfkb途径96孔板和abi prism 7000序列检测系统(应用生物系统公司)进行实时pcr。
[0489]
使用基于细胞的人phospho-rela/nfkb p65免疫测定(r&d系统公司)来测量nfkb活化。简言之,将新鲜的cd4+细胞在单独的il-2(200u/ml)存在下或者在指定浓度的tnf或tnfr2拮抗剂存在下在96孔平底板(0.2x106个细胞/孔)中在37℃培养10分钟。通过离心和固定将细胞粘附在平板上,并且然后根据制造商的说明书进行染色。使用多标记读板仪(铂金埃尔默公司(perkinelmer))读取荧光,并计算归一化的相对荧光单位(rfu)。
[0490]
实例13.拮抗性tnfr2抗体与tnfr2的结合映射到重叠区域
[0491]
为了进一步研究tnfr2拮抗剂抗体tnfrab1和tnfrab2的特异性结合特性,进行了表位作图分析,并且将结合这些抗体的人tnfr2内的表位与受体表面上的不同位置相关联。这两种tnfr2拮抗剂的线性肽作图揭示,尽管这两种拮抗性抗体都表现出对全长靶蛋白的高亲和力,但这些抗体对线性肽表现出差别亲和力。特别地,tnfrab1对人tnfr2内含有seq id no:7的氨基酸112-139的表位表现出中等亲和力,并对含有seq id no:7的氨基酸128-155的表位表现出强亲和力。tnfrab2不与任何线性肽区域结合(图13b)。tnfrab1对tnfr2的亲和力不受tnfα的存在干扰,这表明tnfα不是tnfr2结合的该抗体的竞争物(图13c)。为了检查结合这两种拮抗剂抗体的构象表位,进行了三维结合分析。对于tnfrab1,3d数据与线性肽作图分析一致并且表明人tnfr2内的seq id no:7的氨基酸142-149的区域以高亲和力与tnfrab1结合。此外,3d分析揭示了人tnfr2内seq id no:7的氨基酸161-169处的新结合区域(图13a-13c和15a-15c)。对于tnfrab2,即使没有成功的线性肽结合,也通过3d分析绘制了四个结合区域(图15a-15c)。有趣的是,在人tnfr2内的seq id no:7的氨基酸142-144处的这两种tnfr2拮抗剂抗体的精确不连续表位中存在部分重叠。
[0492]
这个后来的数据是令人感兴趣的,因为以前试图产生针对tnfr2三聚体信号传导复合物的tnfr2结合位点的拮抗性tnfr2抗体和/或该三聚体结合位点的外部区域以防止tnfα进入并防止该tnf三聚体的稳定化不成功。tnfα和tnfr2复合物的溶液结构定义了由三个tnfr2受体包围的中心tnfα同源三聚体(mukai等人,science signaling[科学信号传导]3:ra83(2010))。许多先前的tnf超家族成员(包括具有淋巴毒素的tnfr1、具有trail配体的dr5以及与ox40l的ox40受体)也观察到这种安排(banner等人,cell[细胞]73:431-445(1993);cha等人,j.biol.chem.[生物化学杂志]275:31171-31177(2000);compaan等人,structure[结构]14:1321-1330(2006);hymowitz等人,mol.cell[分子细胞]4:563-571(1999);mongkolsapaya等人,nat.struct.biol.[自然结构生物学]6:1048-1053(1999))。
[0493]
先前对防止tnfα结合的这些区域产生拮抗性抗体以及tnfr2三聚体的尝试产生了在t-reg增殖测定中具有共同特征的具有轻度tnfr2抑制活性的隐性拮抗性抗体。如图14a-14d所示,在48小时t-reg测定中,这些隐性拮抗性抗体在tnfr2刺激剂不存在下表现为拮抗剂。实际上,两种隐性拮抗剂tnfr2抗体a和b本身都具有剂量响应t-reg拮抗作用的证明,剂量响应为0-25μg/ml(图14a和14c)。重要的是,当将tnfα(20mg/ml)添加到培养物中时,这些tnfr2定向性隐性拮抗性抗体a和b与tnfα很差地进行竞争。在每种情况下,tnfα驱动的激动剂优于这种形式的拮抗作用、与抗体的至少部分的和弱的拮抗作用以阻止tnfα或tnfr2三聚体形成(图15c)。这种行为与本文鉴定和描述的tnfr2内的特异性表位(如含有tnfr2的kcrpg基序的表位和如在本文提供的tnfrab1和tnfrab2的描述中所鉴定的其他表位)结合的显性拮抗性tnfr2抗体(如tnfrab1和tnfrab2)的能力相反。与隐性拮抗性tnfr2抗体a和b相反,tnfr2拮抗性抗体tnfrab1和tnfrab2即使在tnfr2激动剂(如tnfα和il-2)存在下也显
示出减弱tnfr2信号传导和t-reg增殖的能力。重要的是,本文鉴定的表位可以用于产生拮抗性tnfr2抗体,所述拮抗性tnfr2抗体显示在tnfr2刺激剂存在下仍然持续的拮抗效应。
[0494]
由于线性肽作图仅部分回答了为什么tnfrab1和tnfrab2是优秀拮抗剂的问题,所以接下来我们探索了鉴定这两种tnfr2拮抗剂的构象表位。我们使用pepscan技术(pepscan公司,荷兰)进行了三维(3d)结合分析。对于tnfrab1和tnfrab2两者,3d数据显示来自约aa138-aa150的重叠区域。显而易见的是,这些结合区域似乎不能与具有三聚体tnfα的典型tnfr2三聚体结合,因为该位点将位于该三聚体的内部(图15b)。由于其他研究小组已经报道了为平行或反平行模型的tnf超家族成员的tnf非依赖形式的替代形式,所以我们绘制了这些位点上的表位(naismith等人,j.biol.chem.[生物化学杂志]270:13303-13307(1995);naismith等人,structure[结构]4:1251-1262(1996))。令人惊讶的是,只有一种tnfr2拮抗结合的模型是最佳的:其中反平行二聚体(图15a)含有两个tnfr2拮抗性抗体结合区域的模型,这两个tnfr2拮抗性抗体结合区域对于必须铰接的tnfr2拮抗剂是间隔开的,并似乎稳定了这种tnfα-非依赖性复合物,这些抗体的另一功能性特点。通过进一步建模,显而易见是反平行复合物(而不是平行二聚体复合物)将具有彼此远离的细胞内区域,并且将抑制nfκb信号传导,如我们在我们的功能测定中所观察到的。由于tnf受体超家族的所有成员都可以显示这些很少研究的反平行构象,因此可以通过设计或筛选与反平行的tnfrs成员蛋白内的表面暴露表位结合的抗体或其抗原结合片段来制备对于tnfr超家族的任何受体的拮抗性抗体(参见,例如以下的实例15)。这些抗体或其抗原结合片段可以稳定这些蛋白质的反平行形式,并从而阻止信号传导以及阻止通常也结合可溶性同源配体的这些受体的活性三聚体形式的形成。已知表现出反平行二聚体结构的tnf受体超家族的已知成员包括:tnfr1、tnfr2、fas、dcr3、dr3、trail-r1(dr4)、trail-r2(dr5)、trail-r3、trail-r4、dr6、edar、cd271、opg、rank、ltβr、tweak-r、hvem、cd27、cd30、cd40、cd137、ox40、gitr、bcma、taci、baffr、edar2、troy以及relt等等。
[0495]
实例14.tnfr2对癌细胞的拮抗剂活性
[0496]
存在于患有癌症的患者中的t-reg细胞是有效的免疫抑制剂。与癌症患者或对照受试者的外周血的t-reg细胞相比,对于来自肿瘤部位的t-reg细胞尤其如此。为了开始了解tnfr2拮抗剂抗体对卵巢癌t-reg细胞的效力,分离新鲜的卵巢癌t-reg细胞并如实例2中所述对其增殖进行表征。首先使用tnf并且然后使用tnfr2激动剂,确实存在的情况是,存在卵巢癌的t-reg细胞扩增远远大于来自正常供体的t-reg细胞,这是超活化的标志(图16a-16b和17a-17h)。与从分离自健康供体的t-reg细胞的增殖的分析获得的紧密剂量响应数据相比,tnfr2拮抗性抗体以剂量依赖性方式并以更高的可变性抑制t-reg细胞增殖。此外,与健康供体相比,这两种拮抗性抗体更有效地抑制分离自卵巢癌患者的t-reg细胞的增殖。
[0497]
上述实验证明拮抗性tnfr2抗体能够抑制正常和癌症相关的t-reg细胞增殖两者。这样的抗体可以就培养物中t-reg细胞的数量而言以及就t-reg增殖而言消除或灭活有效的抑制性t-reg细胞。这些抗体的特点包括减弱nfkb活化之前的细胞内早期磷酸化事件的能力和改变剩余t-reg细胞的表型的能力,使得这些细胞表达减少量的活化标记物如cd45ro。此外,拮抗性tnfr2抗体可以减少可溶性tnfr2(一种促炎蛋白质)的分泌。值得注意的是,即使在添加到细胞培养基中的大量激动性tnfα或激动性tnfr2抗体的存在下,拮抗性tnfr2抗体仍然作为显性拮抗剂。
[0498]
将tnfα受体的抗体或配体激动作用与抗体拮抗作用进行对比是值得的。对tnf和其他tnf超家族与天然配体的激动作用的要求已被充分研究,并需要聚集和聚类有效的信号转导(das等人,j.mol.endocrinol.[分子内分泌学杂志]53:81-91(2014);siegel等人,j.cell.biol.[细胞生物学杂志]167:735-744(2004);takeda等人,oncogene[癌基因]26:3745-3757(2007))。肿瘤坏死因子受体超家族最常见的确认是与配体的三聚体配对的三聚体受体(gommerman等人,nat.rev.immunol.[免疫学自然评论]3:642-655(2003);loetscher等人,j.biol.chem.[生物化学杂志]266:18324-18329(1991);smith等人,cell[细胞]76:959-962(1994);tartaglia,j.biol.chem.[生物化学杂志]267:4304-4307(1992);ware,annu.rev.immunol.[免疫学年度评论]23:787-819(2005))。激动剂抗体似乎遵循相同的原理,并且还经常通过抗体依赖性细胞介导的细胞毒性(adcc)机制(将稳定细胞外晶格)需要其相关细胞的受体的fc部分。在tnfr2激动作用下观察到的这种外部受体寡聚和聚集允许相互的traf晶格网络的内部寡聚以获得活泼的nfkb信号传导(cabal-hierro等人,cell signal.[细胞信号]26:2658-2666(2014);yin等人,nat.struct.mol.biol.[自然结构分子生物学]16:658-666(2009);zheng等人,mol.cell.[分子细胞]38:101-113(2010))。激动剂的稳定作用也通过添加的配体与受体的协作而得到促进。这对于许多tnf受体超家族成员来说对于治疗有效性似乎是重要的(graves等人,cancer cell[癌细胞]26:177-189(2014))。
[0499]
本文研究的这两种tnfr2拮抗剂抗体的共有的受体结合区导致我们得到与tnfr2受体结合的非常不同的可能的抗体模型,以引起稳定的和显性的拮抗作用。通常研究的tnfr2的三聚体形式将不允许新鉴定的抗体拮抗剂与其氨基酸序列结合,并解释这些拮抗性抗体如何比tnfα或il-2占优势(mukai等人,science signal.[科学信号]3:ra83(2010))。事实上,多年来对在三聚体tnfr2结构中的tnfα结合区或对三聚体的tnfα结合区的外表面产生tnfr2抗体的研究不产生在tnfr2激动剂存在下维持受体信号传导的显性抑制的有效拮抗剂。设计用于与tnfα竞争的tnfr2三聚体定向抗体不是显性的,但是有时在用tnfα或il-2的炎性环境激发时表现出中和作用。
[0500]
tnfr2的三聚体形式是tnfα受体的最常被研究的形式,因为它涉及包括nfkb的细胞生长信号。先前的研究已经提出,tnfr2和类似的tnfα超家族成员如淋巴毒素受体也能以平行和反平行形式存在。这些形式缺少tnf结合位点(naismith等人,j.biol.chem.[生物化学杂志]270:13303-13307(1995);naismith等人,structure[结构]4:1251-1262(1996))。本文所述的数据显示没有添加交联剂以增加拮抗作用或将拮抗作用转化为激动作用的附加益处。很难想象,tnfα与三聚体tnfr2的高亲和性tnfα结合可被抗体竞争性抑制,即使具有极高的亲和力。tnfr2的反平行二聚体形式与拮抗性抗体的可评估结合位点和功能性测定最相符,但是还有另一个特征支持这一观察-外部界面相当广泛,并且因此这也将导致tnfr2的细胞内尾巴分开更远的距离,如由其他数据所支持的(naismith等人,structure[结构]4:1251-1262(1996))。在tnfr2三聚作用下,tnfr2的细胞内信号传导区一起被拉近,从而促进了traf直接或间接募集这些tnf超家族受体的细胞内结构域(napetschnig等人,annu.rev.biophys.[生物物理学年度评论]42:443-468(2013);yin等人,nat.struct.mol.biol.[自然结构分子生物学]16:658-666(2009))。该激动剂信号随后将结合其他信号传导蛋白以激活最终活化nfkb的kb(ikb)激酶(ikk)和map激酶的抑制剂。受
体后信号传导途径被tnfr2拮抗性抗体不同程度地阻断的事实表明,主要稳定化的外部tnfr2结构抑制了细胞内traf的募集。先前人们已经提出,tnfr1的反平行二聚体可能是一种抑制性复合物,并且不能结合tnf(naismith等人,structure[结构]4:1251-1262(1996))。该反平行模型更紧密证实了这种复合物的拮抗形成将如何解释对tnf共培养物的优势,因为新的活化三聚体不能形成。
[0501]
值得一提的是,正如其他人所报道的,癌症环境中的t-reg细胞与非癌性供体的t-reg细胞或甚至从癌性供体的外周血分离的t-reg细胞相比是及其有效的(govindaraj等人,clin.cancerres.[临床癌症研究]20:724-735(2013))。如本文所述,拮抗性tnfr2抗体能够抑制从卵巢癌患者分离的有效t-reg细胞的增殖。还观察到,用tnfr2拮抗剂抗体tnfrab1和tnfrab2实现了对从卵巢癌患者分离的t-reg细胞的加重抑制作用。鉴于最近报道鉴定了赋予癌症患者中tnfr2信号传导增强的效力的tnfr2基因序列的特征,该活性是有益的。在皮肤t细胞淋巴瘤的情况下,例如,tnfr2的基因是基因复制品并且/或可以在细胞内区域中突变以赋予基本激动作用。不断地维持tnfr2生长信号的这种遗传压力符合夸大的生长。
[0502]
本文所述的拮抗剂抗体结合tnfr2受体的限制性区域,该限制性区域在tnfα存在下调节t-reg抑制并且甚至调节显性抑制。这些拮抗剂与本文所述的隐性拮抗剂非常不同,本文所述的隐性拮抗剂可以温和地抑制t-reg细胞增殖,但是当用于tnf和il-2的炎性环境中时,激动作用占优势(图14a-14d)。总之,上述数据提供了一种新的平台,用于产生除本文所述的能够调节患有癌症(在该癌症中癌细胞表达升高的量的tnfr2,例如卵巢癌)的患者中的t-reg细胞生长并且即使在tnfr2激动剂存在下也可以表现出拮抗效应的那些以外的另外的拮抗性tnfr2抗体。值得注意的是,这种拮抗性tnfr2抗体对卵巢癌患者的t-reg细胞比对非癌性供体的t-reg细胞更有效。
[0503]
实例15.拮抗tnfrs成员抗体或其抗原结合片段的开发和活性
[0504]
结合tnfrs其他成员的拮抗性抗体及其抗原结合片段能以反平行二聚体构象结合这些受体,从而使得同源配体结合位点在空间上不可及,并从而阻止受体活化。可以用各种技术来开发这种抗体或其抗原结合片段。例如,可以产生结合其他tnfrs成员的拮抗性抗体或抗原结合片段,其结合tnfrs成员蛋白内的特定表位,所述特定表位在序列和/或结构上与如本文所述的tnfrab1和tnfrab2结合的tnfr2内的那些表位同源,或在tnfrs成员的相同区域内,正如本文关于tnfr2所述的那些表位一样。使用常规技术,本领域技术人员可以将一种或多种tnfrs成员蛋白的氨基酸序列与人tnfr2(seq id no:7)的氨基酸序列进行比对,以鉴定该一种或多种tnfrs成员蛋白内的表位,所述表位与例如人tnfr2内的kcrpgfgv(seq id no:20)、ckpcapgtf(seq id no:21)、caplrkcr(seq id no:11)、dstytql(seq id no:8)、peclscgs(seq id no:9)或rictcrpg(seq id no:10)基序共享序列同源性(例如,与人tnfr2内的一种或多种前述序列具有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的其他tnfrs成员蛋白内的氨基酸序列)。从其他tnfrs成员蛋白分离的同源表位可随后用于产生拮抗性抗体,例如使用本文所述的体外展示技术,如噬菌体展示(例如,如以上实例3中所述)、酵母展示、核糖体展示或rna展示等等。例如,tnfr2、dr3和tnfr1的氨基酸序列的比对揭示,dr3氨基酸序列(基因库
tm
登录号aaq88676.1)的残基138-150和tnfr1氨基酸序列(基因库
tm
登录号np_001056)的残基185-197匹配含有caplrkcr
(seq id no:11)和kcrpgfgv(seq id no:20)基序的tnfr2的区域。本发明的拮抗性dr3抗体或其抗原结合片段包括结合dr3氨基酸序列的残基138-150内的表位的那些。类似地,本发明的拮抗性tnfr1抗体或其抗原结合片段可以结合tnfr1氨基酸序列的残基185-197内的表位。
[0505]
与上述一种或多种tnfr2表位匹配的tnfrs成员蛋白内的肽(如与人tnfr2内的kcrpgfgv(seq id no:20)、ckpcapgtf(seq id no:21)、caplrkcr(seq id no:11)、dstytql(seq id no:8)、peclscgs(seq id no:9)或rictcrpg(seq id no:10)基序具有至少85%序列同一性(例如85%、90%、95%、97%、99%或100%序列同一性)的肽)可以如上所述进行鉴定,并且随后使用本领域已知的或本文所述的常规固相肽合成技术进行合成,或者使用本领域中已知的或本文所述的基于细胞的蛋白质表达技术进行重组表达。然后可以例如使用本领域已知的或本文所述的常规hplc技术来纯化该肽,并且随后可以将其固定在一种表面(如微量滴定板或水混溶性树脂)上。然后可以例如使用如本文所述的噬菌体展示、酵母展示、核糖体展示或rna展示技术等等来针对结合固定化肽的分子筛选抗体或抗原结合片段的文库。
[0506]
还可以例如使用标准免疫技术(例如,在非人哺乳动物中)来产生结合tnfrs的其他成员并将以反平行二聚体构象稳定它们的本发明的拮抗性抗体及其抗原结合片段。具体而言,具有与本文所述的tnfrab1和tnfrab2结合的tnfr2内的氨基酸序列相同或基本相似的氨基酸序列的免疫原性多肽,或者正如本文关于tnfr2描述的那些表位一样在tnfr2成员的相同区域内的免疫原性多肽可以用于产生根据本发明的抗体或其抗原片段。
[0507]
如上所述产生的拮抗性tnfrs成员抗体或其抗原结合片段能以反平行二聚体构象结合并稳定tnfrs成员蛋白,例如,如图18a(dr3)和18b(tnfr1)所示。这种抗体或其抗原结合片段可以随后用于抑制细胞(例如,哺乳动物细胞,如人细胞或牛细胞)中的tnfrs成员信号传导。例如,本领域技术人员可以使用拮抗性tnfrs成员抗体或其抗原结合片段来抑制靶细胞内的tnfr1、fas、dcr3、dr3、trail-r1(dr4)、trail-r2(dr5)、trail-r3、trail-r4、dr6、edar、cd271、opg、rank、ltβr、tweak-r、hvem、cd27、cd30、cd40、cd137、ox40、gitr、bcma、taci、baffr、edar2、troy或relt介导的信号传导。靶细胞群中tnfrs成员介导的信号传导的抑制可以使用本领域已知的常规技术如免疫印迹分析来测量,以确定与由上述tnfrs成员蛋白传播的信号转导级联相关的基因的表达程度。
[0508]
其他实施例
[0509]
本说明书中提到的所有出版物、专利和专利申请都通过引用结合在此,如同每一独立的出版物、或专利申请具体且单独地指明通过引用结合在此。
[0510]
虽然本发明已结合其特定实施例予以描述,但是应理解其能够进行进一步修改,并且本技术意在涵盖本发明的总体上遵循本发明原则并且包括本发明如下偏差的任何变化形式、应用或改造,这些偏差在本发明所属技术的己知或常规实践范围内,且可适用于如上阐明的基本特征,并且遵循权利要求的范围。
[0511]
在权利要求书内还有其他实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1