黄微杆菌及其在促进作物生长以及提高作物耐寒性能中的应用
1.本发明涉及黄微杆菌(microbacterium flavum),尤其涉及从水稻中分离的黄微杆菌,本发明进一步涉及该黄微杆菌在促进作物生长或提高作物耐寒性能中的应用,属于黄微杆菌的分离及其应用领域。
背景技术:
2.水稻是中国最重要的粮食作物之一,低温寒害作为主要非生物胁迫,严重影响了水稻的产量和品质,对水稻的各个生长时期都有不同程度的危害。中国南方广大双季稻区,早稻遇低温常常造成烂秧,晚稻在减数分裂期或开花期,往往由于受到17℃以下低温,其中,粳稻比籼稻低1-2℃,花粉发育受阻,受精发生障碍。而北方早粳稻区,在生育期中由于长期低温以致生育期延迟,成熟不良,最后导致减产。
3.目前,用于增强水稻耐寒性的措施包括水稻耐寒品种的选育,采用立枯素或油菜内酯处理,喷施脯氨酸,对幼苗进行耐寒性处理等措施,这些方法存在周期长,成本高,效果不显著等缺陷,有待改进。
4.文献中已报道了从土壤中分离的能够显著提高作物抗非生物胁迫能力的有益土壤微生物,这些有益微生物在增强宿主抗盐,抗干旱,抗低温胁迫等方面发挥重要作用。与土壤微生物相比,生活在植物体内的内生菌,因其特殊的生态位可能对植物具有更积极和直接的影响,迄今为止,能够高效提高作物耐冷能力的内生菌,尤其是高效提高水稻耐冷能力的内生菌,尚未见任何报道,因此,分离获得能够显著提高作物耐冷能力的内生菌,对于提高作物的耐冷胁迫具有重要的应用价值。
技术实现要素:
5.本发明的目的之一是提供一株黄微杆菌(microbacterium flavum);
6.本发明的目的之二是将所述的黄微杆菌应用于促进作物生长或提高作物耐寒性能等方面。
7.本发明的上述目的是通过以下技术方案来实现的:
8.本发明一方面是提供了一株黄微杆菌(microbacterium flavum)jg81-45,其微生物保藏编号是cgmcc no.23557;其分类命名是:黄微杆菌microbacterium flavum;保藏时间是:2021年10月9日;保藏单位是:中国微生物保藏管理委员会普通微生物中心;保藏地址是:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
9.本发明的第二方面是提供了该黄微杆菌在促进作物生长或提高作物抗寒能力等方面的应用。
10.作为本发明的一种优选的具体实施方案,所述的促进作物生长或提高作物产量,其中所述的促进生长包括促进作物地上部分生长或地下部分生长,譬如,包括但不限于增加根长、茎长、根鲜重、茎鲜重、根干重、茎干重等;所述的作物优选为水稻。
11.本发明的第三方面是提供了该黄微杆菌在提高作物耐寒能力中的应用。
12.作为本发明的一种优选的具体实施方案,所述的作物优选为水稻。
13.本领域技术人员可以按照生物菌剂的常规制备方法,将本发明提供的黄微杆菌jg81-45制备成适宜的生物菌剂,例如可以是种子包衣菌剂,采用该种子包衣菌剂对作物种子进行处理;还可以将发明提供的黄微杆菌jg81-45与其它的生物菌剂混合在一起加入适宜的辅料或载体制备成复合生物菌制剂,这些生物制剂能够应用于促进作物生长,增加作物产量和提高作物抗寒性能等。
14.本发明整体技术方案详述
15.本发明将所分离的黄微杆菌jg81-45进行全基因组分析,扩增得到pcr产物进行序列测序,其核苷酸序列见seq id no.1,将测序结果与ncbi数据库中的16s rrna序列进行同源性比对分析,结果分析表明其与菌株microbacterium flavum的16s rrna基因序列相似性最高(99.56%)。基于以上结果分析,初步鉴定本发明的耐寒短杆菌为microbacterium flavum。
16.经过测定,黄微杆菌jg81-45在37℃200rpm摇床培养7天后,测得其产吲哚乙酸的量为37.36mg/l,黄微杆菌jg81-45在pko培养基和nbrip培养基的解磷比分别为1.4和1.7,黄微杆菌jg81-45在解钾培养基的解钾比为1.8,黄微杆菌jg81-45能够在缺少氮源的ashby培养基中生长,并且有明显的菌落。
17.黄微杆菌jg81-45菌液浸种处理后的水稻种子在萌芽生长后,虽然经历了4℃冷害胁迫处理5天,但是没有影响其生长,水稻幼苗仍为深绿色,幼苗评分后的平均得分为2.77。只用lb浸种后的对照组水稻幼苗,经过4℃冷害胁迫处理5天后,叶片枯黄萎蔫死亡,幼苗评分后的平均得分为2.77分。实验结果说明,黄微杆菌jg81-45浸种后的水稻幼苗抗寒能力得到明显提升。
18.本发明提供的黄微杆菌jg81-45具有产吲哚乙酸的能力,还具有较高的解磷、解钾和固氮能力,能够显著促进作物的生长并提高作物的抗寒性能,因此,本发明提供的黄微杆菌jg81-45在促进作物的生长或提高作物的抗寒性能方具有重要的应用前景。
附图说明
19.图1黄微杆菌jg81-45的生长曲线。
20.图2黄微杆菌jg81-45产iaa能力评估的显色反应图。
21.图3溶磷能力评估试验结果,黄微杆菌jg81-45在pko和nbrip培养基上的溶磷降解圈。
22.图4为黄微杆菌jg81-45在解钾培养基上的降解圈。
23.图5为黄微杆菌jg81-45在ashby培养基上的生长情况。
24.图6为黄微杆菌jg81-45与水稻互作提高水稻幼苗抗寒能力效果图。
25.图7为黄微杆菌jg81-45处理水稻在4℃冷害胁迫后的幼苗评分统计结果图。
具体实施方式
26.以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人
员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
27.实施例1黄微杆菌jg81-45的筛选分离及纯化保存
28.筛选培养基成分和配制方法:
29.na培养基:牛肉膏3g、蛋白胨10g、葡萄糖2.5g、琼脂粉15g,ph值为7.0
±
1,蒸馏水定容至1l,培养基于108℃高温高压灭菌30min。
30.r2a培养基:酸水解酪蛋白0.5g、酵母提取物0.5g、蛋白胨0.5g、葡萄糖0.5g、淀粉0.3g、k2hpo
4 0.024g、mgso4·
7h2o 0.024g、丙酮酸钠0.3g、琼脂粉15g,蒸馏水定容至1l,培养基于108℃高温高压灭菌30min。
31.lb培养基:氯化钠10g、胰蛋白胨10g、酵母提取物5g,琼脂粉15g,ph值为7.0
±
1,蒸馏水定容至1l,培养基于121℃高温高压灭菌20min。
32.tsb培养基:酪蛋白17g、大豆蛋白胨3g、氯化钠5g、磷酸氢二钾2.5g、葡萄糖2.5g、琼脂粉15g,蒸馏水定容至1l,培养基于108℃高温高压灭菌30min。
33.称量:将水稻籽粒吉粳81(亲本来源:长白15(
♀
)长白16(
♂
)),放于称量纸上,称取5g籽粒,(籽粒个数约为70个)。
34.消毒:对水稻种子进行表面消毒,75%酒精浸洗10min,无菌水洗3次,用10%次氯酸钠浸洗10min,无菌水洗5次,确保种子充分消毒。
35.研磨:将消毒后的水稻种子放于研钵中,用研杵研磨至粉末状,加入25ml 0.9%生理盐水,混匀,静置15min。
36.稀释:混匀上述液体,用0.9%生理盐水培养基做梯度稀释:10-1
、10-2
、10-3
、10-4
、10-5
。
37.涂板:吸取300μl稀释液涂布在tsb、lb、na、r2a培养基平板(130cm
×
130cm)。
38.培养:将平板放于10℃培养,筛选具有耐寒性状的菌株。
39.筛选:将平板上生长的单菌落挑取至lb液体培养基中,于4℃低温摇床中培养。
40.存菌:将菌液进一步划线纯化,对纯化后的菌株,扩大培养并将菌种保存于甘油管,得到黄微杆菌jg81-45菌株。
41.实施例2黄微杆菌jg81-45的16s rrna鉴定
42.培养黄微杆菌jg81-45菌液,用细菌16s rrna基因扩增采用以下的通用引物进行pcr扩增:
43.27f/1492r:5
’‑
agagtttgatcctggctcag-3’44.5'-tacgacttaaccccaatcgc-3’;
45.扩增得到pcr产物进行序列测序,核苷酸序列为seq id no.1所示。将测序结果与ncbi数据库中的16s rrna序列进行同源性比对分析,结果分析表明其与菌株microbacterium flavum的16s rrna基因序列相似性最高(99.56%)。基于以上结果分析,初步鉴定本发明的耐寒短杆菌为microbacterium flavum,将其命名为:黄微杆菌(microbacterium flavum)jg81-45。该菌株于2021年10月9日保藏于中国微生物菌种保藏管理委员会普通微生物中心(23557)
46.黄微杆菌jg81-45菌株的核苷酸序列如下:
47.ggttgggccaccggcttcaggtgttaccgactttcatgacttgacgggcggtgtgtacaagacccggg
aacgtattcaccgcagcgttgctgatctgcgattactagcgactccgacttcatgaggtcgagttgcagacctcaatccgaactgggaccggctttttgggattcgctccaccttacggtattgcagccctttgtaccggccattgtagcatgcgtgaagcccaagacataaggggcatgatgatttgacgtcatccccaccttcctccgagttgaccccggcagtatcccatgagttcccaccattacgtgctggcaacatagaacgagggttgcgctcgttgcgggacttaacccaacatctcacgacacgagctgacgacaaccatgcaccacctgtttacgagtgtccaaagagttgaccatttctggcccgttctcgtatatgtcaagccttggtaaggttcttcgcgttgcatcgaattaatccgcatgctccgccgcttgtgcgggtccccgtcaattcctttgagttttagccttgcggccgtactccccaggcggggaacttaatgcgttagctgcgtcacggaatccgtggaatggaccccacaactagttcccaacgtttacggggtggactaccagggtatctaagcctgtttgctccccaccctttcgctcctcagcgtcagttacggcccagagatctgccttcgccatcggtgttcctcctgatatctgcgcattccaccgctacaccaggaattccaatctcccctaccgcactctagtctgcccgtacccactgcagacccgaggttgagcctcgggatttcacagcagacgcgacaaaccgcctacgagctctttacgcccaataattccggataacgcttgcgccctacgtattaccgcggctgctggcacgtagttagccggcgctttttctgcaggtaccgtcactttcgcttcttccctgctaaaagaggtttacaacccgaaggccgtcgtccctcacgcggcgttgctgcatcaggcttgcgcccattgtgcaatattccccactgctgcctcccgtaggagtctgggccgtgtctcagtcccagtgtggccggtcaccctctcaggccggctacccgtcgacgccttggtgagccattacctcaccaacaagctgataggccgcgagctcatccctgaccgaagttctttccagctgctgaagatgccttcgcagctcgtatccagtattagacgccgtttccagcgcttatcccagagtcaggggcagattgctcacgtgttactcacccgttcgccactgatccagcagagcaagctccgccttcaccgttcga。
48.试验例1黄微杆菌jg81-45的生长曲线测定试验
49.菌株培养使用培养基成分和配制方法:
50.lb培养基:氯化钠10g、胰蛋白胨10g、酵母提取物5g,琼脂粉15g,ph值为7.0
±
1,蒸馏水定容至1l,(固体培养基中加入15g琼脂粉),培养基于121℃高温高压灭菌20min。
51.菌株培养方法:
52.将黄微杆菌jg81-45菌株的甘油菌在lb固体培养基平板中划线,将划线平板倒置放置在30℃和37℃培养箱中培养,挑取单菌落至lb液体培养基中活化培养,分别在30℃和37℃摇床中200rpm培养。将活化的菌液以5%的接菌量转接至的生长曲线仪培养板,放入生长曲线仪中,分别设置30℃和37℃的培养条件,每小时测定菌液od
600
的值,最终绘制jg81-45菌株在30℃和37℃条件下的生长曲线。
53.jg81-45菌株在30℃和37℃条件下的生长曲线见图1。
54.试验例2黄微杆菌jg81-45的产生长素(iaa)能力评估
55.salkowski’s反应液fe-hclo4成分:1ml 0.5mol/l fecl3溶液加上50ml的35%的hclo4溶液,混合均匀。
56.2.5mg/ml色氨酸:将2.5g色氨酸溶于蒸馏水中,定容至100ml,0.22μm滤膜过滤除菌。
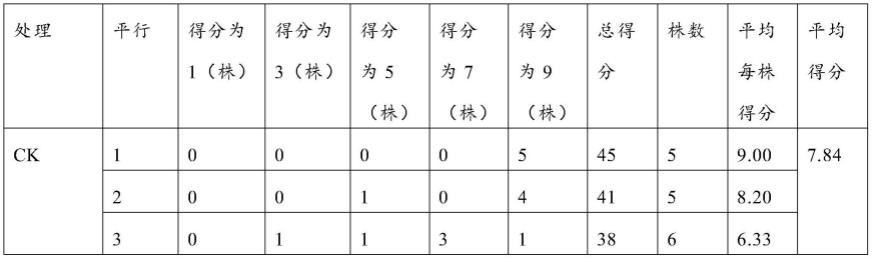
57.0.5mol/l fecl3溶液:6.758g fecl3溶于蒸馏水中,定容至50ml。
58.35%hclo4溶液:50ml蒸馏水+50ml 70%hclo4。
59.将筛选获得的黄微杆菌jg81-45挑菌至3mllb培养基中,37℃200rpm提前活化8-12小时。将活化菌液按照1%的菌种量转接于4ml lb与1ml色氨酸混合培养液中,于37℃200rpm摇床培养7天。菌体培养好以后,取1ml的菌液离心,去沉淀。再取100μl的上清夜加入
100μl的salkowski’s反应液。在暗处25℃混合反应30min。测定od
530
的值。称取吲哚乙酸(indole-3-acetic acid,iaa)的标准品,用双蒸水分别配制浓度为10、20、30、40、50、60mg/l的标准溶液,测定od
530
的值,得到标准曲线。将测得的数值代入标准曲线获得产吲哚乙酸的量。
60.经过测定将黄微杆菌jg81-45在30℃200rpm摇床培养7天后,测得其产吲哚乙酸的量为37.36mg/l(图2)。
61.试验例3黄微杆菌jg81-45的溶磷能力评估
62.使用两种溶磷培养基,即pko培养基和nbrip培养基,评估黄微杆菌jg81-45的溶磷能力。
63.pko培养基配方:葡萄糖10.0g,(nh4)2so4 0.5g,na cl 0.2g,kcl 0.2g,mgso4·
7h2o 0.03g,mnso
4 0.03g,fe so
4 0.003g,酵母提取物0.5g,琼脂粉15.0g,ca3(po4)
2 5.0g,ph6.8-7.0,加蒸馏水定容至1l。
64.nbrip培养基配方:葡萄糖10g/l,mgcl2·
6h2o 5.0g/l,mgso4·
7h2o 0.25g/l,kcl 0.2g/l,(nh4)2so
4 0.1g/l,ca3(po4)
2 5.0g/l,琼脂粉15.0g,ph 7.0,加蒸馏水定容至1l。
65.培养基于108℃高温高压灭菌30min后,在已灭菌培养皿中制备固体平板。
66.将活化的黄微杆菌jg81-45菌液3μl点板至pko培养基和nbrip培养基中,倒置于37℃培养箱中培养7天,测量透明圈直径(d)和菌落生长直径(d),并计算解磷比(透明圈直径和菌落生长直径的比值,即d/d)。
67.经过测定,黄微杆菌在pko培养基和nbrip培养基的解磷比(透明圈直径和菌落生长直径的比值,即d/d)分别为1.4和1.7(图3)。
68.试验例4黄微杆菌jg81-45的解钾能力评估
69.解钾培养基:甘露醇10g,酵母粉0.4g,mgso4·
7h2o 0.2g,kh2po
4 0.5g,caco
3 1g,mgcl
2 0.2g,琼脂粉15g,加蒸馏水定容至1l。培养基于121℃高温高压灭菌20min后,在已灭菌培养皿中制备固体平板。
70.将活化的黄微杆菌jg81-45菌液3μl点板至解钾培养基中,倒置于37℃培养箱中培养7天,测量透明圈直径(d)和菌落生长直径(d),并计算解钾比(透明圈直径和菌落生长直径的比值,即d/d)。
71.经过测定,黄微杆菌在解钾培养基的解钾比(透明圈直径和菌落生长直径的比值,即d/d)为1.8(图4)。
72.试验例5黄微杆菌jg81-45的固氮能力评估试验
73.ashby培养基:kh2po
4 0.2g,mgso4·
7h2o 0.2g,nacl 0.2g,caco
3 5.0g,葡萄糖10.0g,琼脂粉15.0g,ph6.8-7.0,加蒸馏水1l。培养基于108℃高温高压灭菌30min后,在已灭菌培养皿中制备固体平板。
74.将活化的黄微杆菌jg81-45菌液3μl点板至ashby培养基中,倒置于30℃培养箱中培养7天,观察菌落的生长情况。经过观察和测定,黄微杆菌在能够在缺少氮源的ashby培养基中生长,并且有明显的菌落(图5)。
75.试验例6黄微杆菌jg81-45提高水稻幼苗抗寒能力的应用效果试验
76.浸种液制备:将黄微杆菌jg81-45进行活化培养,以1%的接菌量转接至50ml lb培养基中,培养至od
600
=1.0,调整菌液浓度为108cfu/ml,制备成水稻种子的浸种培养基。
77.消毒:将水稻种子长白9和吉粳117浸水3小时、消毒(75%酒精浸洗10min,无菌水洗3次,用10%次氯酸钠浸洗10min,无菌水洗5次)后,选取50个完整饱满的水稻种子放入菌液中浸种1小时(ck-水组在水中浸种)。
78.培养:将浸种后的水稻放入铺有滤纸的培养皿中,加入5ml的灭菌蒸馏水。
79.催芽:将培养皿放入30℃中进行催芽。
80.在已灭菌的玻璃管倒入70ml含1/2ms营养液和0.4%琼脂的灭菌溶液,凝固后,制备成培养基质。
81.培养:将萌芽后的水稻种子移入含1/2ms营养液和0.4%琼脂的培养基质中,26℃,光照循环:20%光强度光照处理10小时,0%光强度黑暗处理14小时。
82.冷害处理:在4℃培养箱中进行冷害胁迫处理5天。光照循环:20%光强度光照处理10小时,0%光强度黑暗处理14小时。
83.恢复处理:将在5℃培养箱中进行冷害胁迫处理5天的幼苗移至常温培养箱中进行恢复生长7天,光照循环:20%光强度光照处理10小时,0%光强度黑暗处理14小时。
84.幼苗生长评估:根据国际水稻研究所开发的水稻标准评估系统中的水稻幼苗生长量表评估水稻在冷害后的生长情况,通过将幼苗评分为1=深绿色幼苗,3=浅绿色幼苗,5=黄色幼苗,7=褐色幼苗,9=死亡幼苗来换算水稻生长得分情况。
85.经过评估测定,黄微杆菌jg81-45菌液浸种处理后的水稻种子在萌芽生长后,虽然经历了4℃冷害胁迫处理5天,但是没有影响其生长,水稻幼苗仍为深绿色,幼苗评分为后的平均得分为2.77。只用lb浸种后的对照组水稻幼苗,经过4℃冷害胁迫处理5天后,叶片枯黄萎蔫死亡,幼苗评分后的平均得分为7.84分(表1、图6和图7)。实验结果说明,采用黄微杆菌jg81-45浸种后的水稻幼苗抗寒能力有明显提升。
86.表1为黄微杆菌jg81-45处理水稻在4℃冷害胁迫后的幼苗评分统计结果表
[0087][0088]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1