一种基于荧光检测的多酶恒温核酸快速扩增试剂及应用的制作方法
1.本发明涉及核酸检测试剂技术领域,具体为一种基于荧光检测的多酶恒温核酸快速扩增试剂及应用。
背景技术:
2.核酸可分为脱氧核糖核酸(dna)和核糖核酸(rna),是所有生命形式的基本要素。dna携带遗传信息并负责编码蛋白质的基本单元氨基酸。rna在基因的编码、解码、调节和表达中起到重要的作用。因此,核酸已作为重要的生物标志物应用于生物研究和医学诊断。核酸扩增技术为病原微生物的检测、生物材料的追溯与鉴真(如肉类),以及其他基因检测提供了重要的理论基础。
3.人疱疹病毒一般采用pcr-荧光探针法进行检测,在扩增过程中需要昂贵的仪器,同时仪器需要具备精细的温度控制程序和加热模板,从而实现在很高的温度下dna模板链的变性,在较低的温度下退火利用引物延伸模板;体系中需要耐受高温的聚合酶;在pcr循环中,每个循环的退火时间都很短,这就要求引物必须快速找到模板上的同源匹配区段,以实现延伸,这就要求pcr有过量的pcr引物,而过量的引物会与模板错配,引发错误扩增或产生引物二聚体。
4.而raa技术是重组酶介导等温核酸扩增技术的简称,是一种利用重组酶、单链结合蛋白、dna聚合酶在等温条件下(最佳温度37℃)进行核酸扩增的技术。具体原理为:重组酶、单链结合蛋白、引物形成复合体扫描双链dna,在与引物同源的序列处使双链dna解旋,单链结合蛋白(ssb)防止单链dna复性,在能量和dntp存在的情况下,由dna聚合酶完成链的延伸,5-20分钟就可实现仪器扩增,为此,提出一种基于荧光检测的多酶恒温核酸快速扩增试剂及应用。
技术实现要素:
5.针对现有技术的不足,本发明提供了一种基于荧光检测的多酶恒温核酸快速扩增试剂及应用,具备操作简单,在常温下可以实现核酸的快速扩增,不需要改变温度,便于使用等的优点,解决了上述背景技术中提出的问题。
6.本发明提供如下技术方案:一种基于荧光检测的多酶恒温核酸快速扩增试剂,包括核酸外切酶、缓冲液、氯化钾、氯化镁、恒温聚合酶、荧光染料、乙酸镁、探针、甘油、甜菜碱、甲酰胺、一对引物和逆转录酶,所述核酸外切酶的含量为16ng/μl-20ng/μl,缓冲液的体积含量为6%到8%,氯化钾0-200mm,氯化镁5mm-100mm,恒温聚合酶的含量为16ng/μl-20ng/μl,乙酸镁的含量为11mm-15mm,甲酰胺的体积百分含量为0.1%-0.5%,甜菜碱0-5ng/μl,甘油0.5ng/μl-5ng/μl。
7.优选的,所述核酸外切酶为taq酶,所述缓冲液为冰醋酸。
8.优选的,所述恒温聚合酶为hsv-2诱导的dna聚合酶。
9.优选的,所述试剂的ph值为弱碱性,该试剂的ph值为7.1-7.3。
10.优选的,所述荧光染料为sybr safa染料、sybr gold染料和sybr green中的至少一种。
11.优选的,所述探针为寡核苷酸,两端分别标记一个报告荧光基因和一个淬灭荧光基因。
12.优选的,该试剂可用于普通核酸扩增以及多重扩增。
13.优选的,将试剂中的荧光基因和淬灭基因进行分离,利用荧光监测系统采集分离过程中产生荧光信号;
14.将所述荧光信号输入到预设处理域中进行逐级放大,直到所述处理域中的荧光信号大于预设规格为止,获取标准荧光信号;
15.当所述标准荧光信号的数量不为1时,基于生成时间顺序,为每一所述标准荧光信号进行命名;
16.同时,基于每一所述荧光信号转换为标准荧光信号过程中的放大等级,获取每一级对应的放大增益,建立荧光信号增益对应列表;
17.其中,第一级对应的增益为预设增益,剩余级对应的增益为上一级增益的一半;
18.在预设空间中绘制每一所述标准荧光信号,获取每一标准荧光信号对应的空间形态;
19.提取空间形态与标准形态一致的第一荧光信号,并分别获取每一所述第一标准荧光信号对应的荧光度;
20.建立时间轴,将所述第一标准荧光信号输入到所述时间轴上分别记录每一第一标准荧光信号在每一单位时间的衰减量,建立衰减列表;
21.在所述荧光信号增益对应列表中获取所述第一标准荧光信号对应的第一增益;
22.根据所述第一增益和所述衰减列表,获取每一第一荧光信号在预设时间节点对应的实际荧光度;
23.基于所述实际荧光度判断待检dna样本的属性。
24.优选的,判断待检dna样本的属性之后,包括:
25.获取每一dna样本对应的属性,建立属性对应列表;
26.在所述属性对应列表中提取属性为阳性的第一dna样本;
27.当所述第一dna样本的数量为1时,确定所述第一dna样本的属性为纯阳性;
28.反之,利用预设基因引子分别在每一所述第一dna样本中获取目标基因点,记录每一所述第一dna样本中目标基因点对应的数量;
29.提取目标基因点数量为1的第二dna样本,确定所述第二dna样本的属性为纯阳性;
30.获取剩余dna样本利用对应的目标基因点的数量建立相应数量的基因存放列;
31.以所述目标基因点为起点,以预设螺旋顺序为路径分别获取所述剩余dna样本中的基因链,并放置在对应的基因存放列中;
32.将同一所述剩余dna样本对应的基因存放列视为基因存放组;
33.将所述基因存放组输入到预设对比域中,获取与剩余基因存放组相似度为0的第三dna样本,确定所述第三dna样本的属性为纯阳性;
34.获取不属于第三dna样本的未归类样本,视为第四dna样本,确定所述第四dna样本的受到污染属性为假阳性,传输到指定终端进行显示。
35.优选的,获取所述第四dna样本,生成重新检测指令;
36.基于所述重写检测指令获取所述第四dna样本对应的源样本进行重新检测;
37.根据检测结果,为所述第四dna样本匹配相应的属性。
38.与现有技术对比,本发明具备以下有益效果:
39.1、该基于多酶恒温核酸快速扩增试剂及应用,该试剂可以在常温下进行使用,且该试剂在使用时反应温度保持不变,不需要工作人员反复改变试剂的反应温度,简化了该试剂使用步骤,能够提高工作人员的工作效率,且该试剂降低了对扩增模板核酸纯度的要求,提高了该试剂的实用性。
40.2、该基于多酶恒温核酸快速扩增试剂及应用,通过探针和核酸外切酶的设置,核酸外切酶可以把探针酶切降解,使荧光基因和淬灭基因分离,从而荧光监测系统可以接受到荧光信号,即每当扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积和raa产物形成完全同步。
41.3、该基于多酶恒温核酸快速扩增试剂及应用,通过对阳性dna样本进行进一步的分析,获取阳性dna样本中存在的dna链,再根据多个阳性dna样本中dna链的重合情况来确定现阶段呈阳性的dna样本中是否存在假阳性的dna样本,即其本身应该属于非阳性但在检测过程中被污染的dna样本,提取假阳性dna样,避免对后续工作产生影响。
附图说明
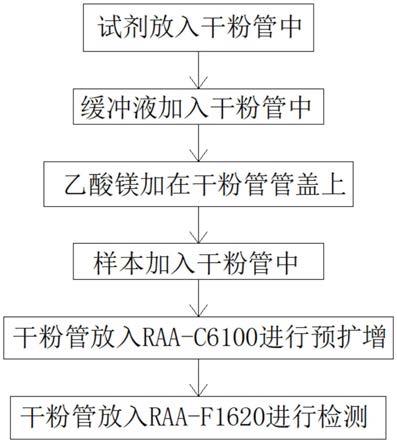
42.图1为本发明实施例1和实施例2流程示意图;
43.图2为本发明实施例1恒温扩增的核酸电泳结果示意图;
44.图3为本发明实施例1实时扩增曲线示意图;
45.图4为本发明实施例2恒温扩增的核酸电泳结果示意图;
46.图5为本发明实施例2实时扩增曲线示意图。
具体实施方式
47.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
48.请参阅图1至5,一种基于荧光检测的多酶恒温核酸快速扩增试剂,包括核酸外切酶、缓冲液、氯化钾、氯化镁、恒温聚合酶、荧光染料、乙酸镁、探针、甘油、甜菜碱、甲酰胺、一对引物和逆转录酶,核酸外切酶的含量为16ng/μl-20ng/μl,缓冲液的体积含量为6%到8%,氯化钾0-200mm,氯化镁5mm-100mm,恒温聚合酶的含量为16ng/μl-20ng/μl,乙酸镁的含量为11mm-15mm,甲酰胺的体积百分含量为0.1%-0.5%,甜菜碱0-5ng/μl,甘油0.5ng/μl-5ng/μl。
49.核酸外切酶为taq酶,通过核酸外切酶的设置,核酸外切酶可以把探针酶切降解,使荧光基因和淬灭基因分离,从而荧光监测系统可以接受到荧光信号,即每当扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积和raa产物形成完全同步,且核酸外切酶与探针的含量相同,通过核酸外切酶与探针含量相同的设置,该试剂可以快速的使需要
扩增的核酸快速的进行扩增,提高核酸扩增的效率,缓冲液为冰醋酸,冰醋酸的体积含量为1%-5%。
50.恒温聚合酶为hsv-2诱导的dna聚合酶,通过恒温聚合酶的设置,可以完成链的延伸。
51.试剂的ph值为弱碱性,该试剂的ph值为7.1-7.3。
52.荧光染料为sybr safa染料、sybr gold染料和sybr green中的至少一种,通过荧光染料的设置,可以吸收荧光基因发出的光波,便于荧光信号的检测。
53.探针为寡核苷酸,两端分别标记一个报告荧光基因和一个淬灭荧光基因,探针完整时,报告基因发射的荧光信号被淬灭基因吸收,荧光监测系统不能接受到荧光信号。
54.该试剂可用于普通核酸扩增;该试剂可用于多重扩增。
55.实施例1:该试剂用于普通核酸扩增时,使用者收集人疱疹病毒样本;把试剂干粉放在干粉管中,向干粉管中加入缓冲液和乙酸镁,把样本放在干粉管中,干粉管放入raa-c6100进行预扩增,需要检测时,把干粉管放入raa-f1620进行检测,干粉管在进行预扩增的过程中,taq酶的5-3外切酶活性降探针酶切降解,使荧光基因和淬灭基因分离,从而荧光监测系统可以接受到荧光信号,即每当扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积和raa产物形成完全同步,且核酸外切酶与探针的含量相同,且核酸外切酶与探针含量相同,该试剂可以快速的使需要扩增的核酸快速的进行扩增,提高核酸扩增的效率。
56.且试剂干粉中各部分的成分为:核酸外切酶的含量为16ng/μl,缓冲液的体积含量为6%,氯化钾50mm,氯化镁5mm,恒温聚合酶的含量为16ng/μl,乙酸镁的含量为11mm,甲酰胺的体积百分含量为0.2%,甜菜碱3ng/μl,甘油0.5ng/μl。
57.人疱疹病毒样本收集步骤:
58.步骤一:收集患有人疱疹病毒的患者的患处皮肤样本;
59.步骤二:把收集的样本用蒸馏水冲洗干净,并用无菌的吸水纸把样本表面残留的水渍擦干;
60.步骤三:把清洗干净的样本研磨粉碎,并在研磨的过程中向其内加入去离子水,得到混合溶液;
61.步骤四:把得到的混合溶液静止,取出上清液,把上清液离心,收集沉淀物,去除上清,对收集到的上清进行再次离心,收集沉淀物,重复步骤三次后,把收集的沉淀物放在一个新的收集管中,向收集管中加入100-200ul预热(70℃)elution buffer(10mm tris,ph 8.5),室温静置1~3分钟,≥13000g离心1分钟,获得dna样品。
62.实施例2:该试剂可用于多重扩增时,使用者根据需求收集不同种类的样本。(如人疱疹病毒样本和人乳头病毒样本),把试剂干粉放在干粉管中,向干粉管中加入缓冲液和乙酸镁,把样本放在干粉管中,干粉管放入raa-c6100进行预扩增,需要检测时,把干粉管放入raa-f1620进行检测,干粉管在进行预扩增的过程中,taq酶的5-3外切酶活性降探针酶切降解,使荧光基因和淬灭基因分离,从而荧光监测系统可以接受到荧光信号,即每当扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积和raa产物形成完全同步,且根据检测结果可知,多种样本混合后,针对每一个类型的dna模板都能成功扩增出相对应类型的产物,并且没有非特异性扩增,仅有特异性扩增,实现了多重扩增的效果,提高了工作人员的工作效率。
63.且试剂干粉中各部分的成分为:核酸外切酶的含量为16ng/μl,缓冲液的体积含量为6%,氯化钾50mm,氯化镁5mm,恒温聚合酶的含量为16ng/μl,乙酸镁的含量为11mm,甲酰胺的体积百分含量为0.2%,甜菜碱3ng/μl,甘油0.5ng/μl。
64.人乳头病毒样本的提取方法为:
65.从患者患处收集样本,并把样本保存在-80摄氏度的环境中,需要提取样本dna时,取出样本,把样本清洗干净,用剪刀把样本剪碎,并把剪碎后的样本磨碎,用人乳头病毒dna提取试剂盒提取样本中的人乳头病毒dna,保存提取的dna,并对提取的dna浓度进行检测。
66.实施例5:将试剂中的荧光基因和淬灭基因进行分离,利用荧光监测系统采集分离过程中产生荧光信号;
67.将所述荧光信号输入到预设处理域中进行逐级放大,直到所述处理域中的荧光信号大于预设规格为止,获取标准荧光信号;
68.当所述标准荧光信号的数量不为1时,基于生成时间顺序,为每一所述标准荧光信号进行命名;
69.同时,基于每一所述荧光信号转换为标准荧光信号过程中的放大等级,获取每一级对应的放大增益,建立荧光信号增益对应列表;
70.其中,第一级对应的增益为预设增益,剩余级对应的增益为上一级增益的一半;
71.在预设空间中绘制每一所述标准荧光信号,获取每一标准荧光信号对应的空间形态;
72.提取空间形态与标准形态一致的第一荧光信号,并分别获取每一所述第一标准荧光信号对应的荧光度;
73.建立时间轴,将所述第一标准荧光信号输入到所述时间轴上分别记录每一第一标准荧光信号在每一单位时间的衰减量,建立衰减列表;
74.在所述荧光信号增益对应列表中获取所述第一标准荧光信号对应的第一增益;
75.根据所述第一增益和所述衰减列表,获取每一第一荧光信号在预设时间节点对应的实际荧光度;
76.基于所述实际荧光度判断待检dna样本的属性。
77.该实例中,为标准荧光信号命名的依据为每一标准荧光信号的获取时间先后,例如,第一个获取的标准荧光信号命名为a荧光信号,第二个获取的标准荧光信号命名为b荧光信号,以此类推;
78.该实例中,信号增益列表表示每一级对应的放大增益统计列表;
79.该实例中,dna样本属性分为:阴性和阳性。
80.上述技术方案的工作原理以及有益效果:该基于多酶恒温核酸快速扩增试剂及应用,通过探针和核酸外切酶的设置,核酸外切酶可以把探针酶切降解,使荧光基因和淬灭基因分离,从而荧光监测系统可以接受到荧光信号,即每当扩增一条dna链,就有一个荧光分子形成,实现了荧光信号的累积和raa产物形成完全同步。
81.实施例6:判断待检dna样本的属性之后,包括:
82.获取每一dna样本对应的属性,建立属性对应列表;
83.在所述属性对应列表中提取属性为阳性的第一dna样本;
84.当所述第一dna样本的数量为1时,确定所述第一dna样本的属性为纯阳性;
85.反之,利用预设基因引子分别在每一所述第一dna样本中获取目标基因点,记录每一所述第一dna样本中目标基因点对应的数量;
86.提取目标基因点数量为1的第二dna样本,确定所述第二dna样本的属性为纯阳性;
87.获取剩余dna样本利用对应的目标基因点的数量建立相应数量的基因存放列;
88.以所述目标基因点为起点,以预设螺旋顺序为路径分别获取所述剩余dna样本中的基因链,并放置在对应的基因存放列中;
89.将同一所述剩余dna样本对应的基因存放列视为基因存放组;
90.将所述基因存放组输入到预设对比域中,获取与剩余基因存放组相似度为0的第三dna样本,确定所述第三dna样本的属性为纯阳性;
91.获取不属于第三dna样本的未归类样本,视为第四dna样本,确定所述第四dna样本的受到污染属性为假阳性,传输到指定终端进行显示。
92.上述技术方案的工作原理以及有益效果:该基于多酶恒温核酸快速扩增试剂及应用,通过对阳性dna样本进行进一步的分析,获取阳性dna样本中存在的dna链,再根据多个阳性dna样本中dna链的重合情况来确定现阶段呈阳性的dna样本中是否存在假阳性的dna样本,即其本身应该属于非阳性但在检测过程中被污染的dna样本,提取假阳性dna样,避免对后续工作产生影响。
93.实施例7:利用荧光监测系统采集分离过程中产生荧光信号的过程,包括:
94.获取含有荧光的光谱;
95.分别获取垂直方向和平行方向对应的垂直荧光强度和水平荧光强度;
96.同时,分别获取垂直方向和平行方向对应的垂直散光强度和水平散光强度;
97.根据公式(ⅰ)计算待生成荧光信号的强度特征值;
[0098][0099]
其中,t表示待生成荧光信号的强度特征值,q1表示所述水平荧光强度,q2表示所述垂直荧光强度,a表示水平强度系数,b表示垂直强度系数,且a+b=1(a≠0,b≠0),q表示荧光信号最大强度特征值,当q1>q2时,q=q1,当q2>q1时,q=q2,e表示无理常数,t表示获取所述光谱所需要的时长,s表示单位时间的强度衰减量;
[0100]
获取所述待生成荧光信号的强度特征值在预设范围内的初荧光信号,并根据公式(ⅱ)计算所述初荧光信号的亮度特征值;
[0101][0102]
其中,l表示所述初荧光信号的亮度特征值,h表示标准荧光信号在光谱下的最大亮度,y表示所述初荧光信号在所述光谱中的面积,y1表示所述光谱的总面积,d1表示所述光谱的吸收光率,m表示所述垂直散光强度,k表示所述水平散光强度;
[0103]
基于所述亮度特征值,建立对应亮度的荧光信号。
[0104]
上述技术方案的工作原理以及有益效果:当荧光监测系统采集分离过程中产生的荧光信号时,容易被外界亮度所干扰,采集到不必要的外界光线,为了避免折翼现象,先通过公式计算待生成荧光信号的强度特征值,获取在预设范围内的初荧光信号,再计算初荧光信号的亮度特征值,根据亮度特征值建立对应的荧光信号,为后续工作做基础。
[0105]
实施例8:获取所述第四dna样本,生成重新检测指令;
[0106]
基于所述重写检测指令获取所述第四dna样本对应的源样本进行重新检测;
[0107]
根据检测结果,为所述第四dna样本匹配相应的属性。
[0108]
上述技术方案的工作原理以及有益效果:为了进一步确定假阳性dna样本的属性,生成重新检测指令,再获取第四dna样本对应的源样本进行二次检测,获取第四dna样本的属性。
[0109]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1