一种基于双重微滴式数字PCR检测水貂阿留申病毒和水貂肠炎病毒的引物探针组及试剂盒的制作方法
一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的引物探针组及试剂盒
技术领域
1.本发明属于动物疫病检测技术领域,具体涉及一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的引物探针组及试剂盒。
背景技术:
2.微滴式数字pcr(droplet digital pcr,dd-pcr)是近些年来兴起的一项针对单分子目标dna的定量分析技术。dd-pcr把反应体系均匀分配到大量反应单中,每个反应单元中不包含或包含一个到多个目的核酸序列,目的核酸序列的数量符合泊松分布。然后在每个反应单元中独立地进行pcr扩增。扩增结束后,检测每个反应单元的荧光信号,最终根据泊松分布和荧光信号阳性的反应单元占所有反应单元的比例来计算目的核酸序列的拷贝数。在dd-pcr反应中荧光信号的产生过程基本与q-pcr相同,但与q-pcr不同是dd-pcr要求先稀释核酸模板,然后分配到大量独立的反应室中使之具有单个模板分子并且发生扩增反应,扩增结束采用泊松概率分布公式等统计学公式分析单个反应室的阳性信号,因此不需要采用内参基因和标准曲线,可以实现绝对定量分析。
3.水貂阿留申病毒和水貂肠炎病毒都是细小病毒科,细小病毒属成员,分别是危害水貂健康的“三大疫病”之一,水貂阿留申病(aleutianmink diseas,amd)是由水貂阿留申病毒(aleutian mink disease virus, amdv)引起的水貂的一种慢性进行性传染病。1946年,美国学者 ghartsough在“阿留申貂”中首次观察到该病。本病呈现免疫缺陷性、慢性退行性发病过程,故又被称为水貂的“艾滋病”,病程稍长的水貂会出现口渴、精神抑郁等现象。种貂主要表现为繁殖力下降、“空怀”或流产,成貂毛皮质量下降,幼貂成活率低,带来严重的经济损失。貂群中可以通过水平和垂直两种方式传播,也是水貂种质资源保护的“卡脖子”问题。建立灵敏而快速的诊断方法是水貂种质资源筛选的需求,也是贯彻疫病防控“早诊断、早发现”政策的技术保障。目前,已有的检测方法,比如:elisa实验、对流免疫电泳法(ciep)和荧光定量pcr等,尚未有能够实现“痕量化”检测和绝对定量的。
4.水貂病毒性肠炎是由水貂细小病毒引起,以剧烈的下痢为特征的急性、高度接触性传染病,其特征性病理变化是胃肠粘膜出现粘液出血性或坏死性炎症变化,主要临床症状是剧烈下痢。对水貂,尤其是在幼貂中的发病率和死亡率极高,该病广泛流行于世界各养貂国家,对养貂业危害很大,已引起各国的注意,并采取了严格的防疫措施。 mev常于8、9月份暴发流行,冬季散发,流行过的貂场常于下年夏、秋季再次发生。
5.我国是传统的农业大国,水貂养殖业是特色畜牧业,更是助力乡村振兴的优势产业之一。但是,水貂阿留申病和病毒性肠炎严重危害水貂生产性能,是影响水貂种质资源保护和优化的“卡脖子”问题,给养殖业造成重大的经济损失。预防的关键因素是控制传染源,做好种群净化。因此,建立一种快速、简便、灵敏的临床检测方法,及时发现病原,做出鉴别诊断,净化种群,是保障水貂养殖业发展亟需的技术支撑。
技术实现要素:
6.有鉴于此,本发明的目的在于提供一种基于双重微滴式数字pcr 检测水貂阿留申病毒和水貂肠炎病毒的引物探针组及试剂盒,在不需要内参基因和标准曲线的情况下,具有准确度高、重现性好的特点,可以实现绝对定量分析。
7.本发明提供了一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的引物探针组,包括检测水貂阿留申病毒的引物探针组和检测水貂肠炎病毒的引物探针组;
8.所述检测水貂阿留申病毒的引物探针组包括正向引物amdv-f、反向引物amdv-r和探针amdv-p;
9.所述正向引物amdv-f的核苷酸序列如seq id no:1所示;
10.所述反向引物amdv-f的核苷酸序列如seq id no:2所示;
11.所述探针amdv-p的核苷酸序列如seq id no:3所示;
12.所述检测水貂肠炎病毒的引物探针组包括正向引物mev-f、反向引物mev-r和探针mev-p;
13.正向引物mev-f的核苷酸序列如seq id no:4所示
14.反向引物mev-r的核苷酸序列如seq id no:5所示
15.探针mev-p的核苷酸序列如seq id no:6所示;
16.所述探针amdv-p和探针mev-p的5’端分别标记不同的荧光基团;
17.所述探针amdv-p和探针mev-p的3’端分别标记不同的猝灭基团。
18.本发明提供了所述引物探针组在制备同时检测水貂阿留申病毒和水貂肠炎病毒的试剂盒中的应用。
19.本发明提供了一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的试剂盒,包括所述引物探针组。
20.优选的,还包括2
×
supermix反应液。
21.本发明提供了一种非诊断目的的同时检测水貂阿留申病毒和水貂肠炎病毒的方法,包括以下步骤:
22.1)提取待测样品的dna;
23.2)配制双重数字pcr反应体系;
24.3)将步骤2)配制的双重数字pcr反应体系进行数字pcr扩增,读取微滴信号;
25.4)根据步骤3)中所述微滴信号的荧光种类,判断感染水貂阿留申病毒还是水貂肠炎病毒,再根据具体的微滴信号的强度与对应的病毒标准曲线进行比对,得到对应病毒的定量结果。
26.优选的,所述双重数字pcr反应体系共30μl如下:400nmamdv-f 1.2μl、400nm amdv-r 1.2μl、200nm amdv探针0.6μl、400nm mev-f 1.2μl、400nm mev-r 1.2μl、200nm mev-p 0.6μl、 2
×
supermix反应液15μl、去离子水4μl和dna5μl。
27.优选的,所述双重数字pcr的反应程序如下:95℃10min;94℃ 30sec,60℃60sec,40个循环;12℃5min。
28.优选的,当探针amdv-p标记fam-bhq1时,微滴信号产生蓝色荧光信号,判断样本中感染水貂阿留申病毒;
29.当探针mev-p标记vic-bhq2时,微滴信号产生绿色荧光信号,判断样本中感染水貂肠炎病毒。
30.优选的,所述水貂阿留申病毒的标准曲线是以amdv质粒标准品为样本,在1.43
×
108copies/μl浓度基础上,分别稀释经10-1
、10-2
、 10-3
,10-4
,10-5
,10-6
,10-7
,10-8
稀释,进行数字pcr检测,得到的荧光信号与不同稀释浓度绘制曲线得到。
31.优选的,所述水貂肠炎病毒的标准曲线是以mev质粒标准品为样本,在1.82
×
108copies/μl浓度基础上,分别稀释经10-1
、10-2
、10-3
, 10-4
,10-5
,10-6
,10-7
,10-8
稀释,进行数字pcr检测,得到的荧光信号与不同稀释浓度绘制曲线得到。
32.本发明提供了一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的引物探针组,包括检测水貂阿留申病毒的引物探针组和检测水貂肠炎病毒的引物探针组。所述引物探针组具有较高的检测灵敏度,检测水貂阿留申病毒的引物探针组的最低检测极限约为 1.43copies/μl,dd-pcr的检测极明显高于qpcr检测可达100倍。所述引物探针组具有较强的检测特异性性,且检测结果准确可靠。
33.本发明提供了一种非诊断目的的同时检测水貂阿留申病毒和水貂肠炎病毒的方法,本发明提取待测样品的dna,然后配制双重数字pcr反应体系进行数字pcr扩增,读取微滴信号;根据所述微滴信号的荧光种类,判断感染水貂阿留申病毒还是水貂肠炎病毒,再根据具体的微滴信号的强度与对应的病毒标准曲线进行比对,得到对应病毒的定量结果。该方法具有检测灵敏度高,特异性好,检测结果准确,稳定性好,可用于临床样本的检测,水貂种貂筛查、引种检测、养殖场环境污染检测和临床样品诊断,为水貂养殖业中种质资源的保护、引种筛查,以及貂群阿留申病的诊断和净化提供了绝对定量的检测方法。
附图说明
34.图1为数字pcr退火温度优化图谱;其中图1a为amdv,图 1b为mev;
35.图2为数字pcr引物浓度优化图谱;其中图2a为amdv,图 2b为mev;
36.图3为数字pcr探针浓度优化图谱;其中图3a为amdv,图 3b为mev;
37.图4为本发明提供的检测水貂阿留申病毒的引物探针组和检测水貂肠炎病毒的引物探针组建立的标准曲线图;其中图4a为amdv,图4b为mev;
38.图5为实施例1同荧光pcr灵敏性性试验对比图;其中图5a为 amdv,图5b为mev;
39.图6为实施例1同荧光pcr特异性试验对比图;其中图6a为 amdv,图6b为mev;
40.图7为实施例1同荧光pcr重复性试验对比图;其中图7a为 amdv,图7b为mev;
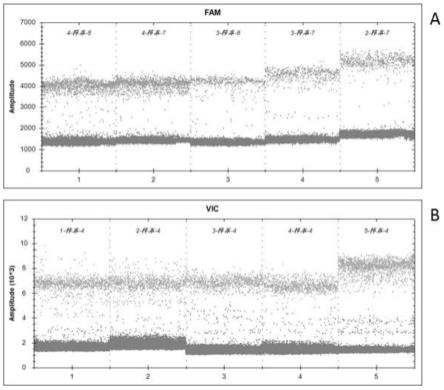
41.图8为实施例1同对比例探针对比试验对比图。
具体实施方式
42.本发明提供了一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的引物探针组,包括检测水貂阿留申病毒的引物探针组和检测水貂肠炎病毒的引物探针组;具体信息见表1。
43.表1检测水貂阿留申病毒和水貂肠炎病毒的引物探针组
[0044][0045][0046]
本发明提供了所述引物探针组在制备同时检测水貂阿留申病毒和水貂肠炎病毒的试剂盒中的应用。
[0047]
本发明提供了一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的试剂盒,包括所述引物探针组。所述试剂盒还优选包括2
×
supermix反应液。本发明对2
×
supermix反应液的来源没有特殊限制,采用本领域所熟知的2
×
supermix反应液即可。在本发明实施例中,所述2
×
supermix反应液购自北京新弈生物科技有限公司。
[0048]
本发明提供了一种非诊断目的的同时检测水貂阿留申病毒和水貂肠炎病毒的方法,包括以下步骤:
[0049]
1)提取待测样品的dna;
[0050]
2)配制双重数字pcr反应体系;
[0051]
3)将步骤2)配制的双重数字pcr反应体系进行数字pcr扩增,读取微滴信号;
[0052]
4)根据步骤3)中所述微滴信号的荧光种类,判断感染水貂阿留申病毒还是水貂肠炎病毒,再根据具体的微滴信号的强度与对应的病毒标准曲线进行比对,得到对应病毒的定量结果。
[0053]
本发明提取待测样品的dna。
[0054]
本发明对待测样品的dna的方法没有特殊限制,采用本领域所熟知提取动物来源的样品的dna的方法即可,例如采用爱思进公司生产的dna提取试剂盒即可。
[0055]
得到待测样品中dna,本发明配制双重数字pcr反应体系。
[0056]
在本发明中,所述双重数字pcr反应体系共30μl优选如下: 400nm amdv-f 1.2μl、400nm amdv-r 1.2μl、200nm amdv探针 0.6μl、400nm mev-f 1.2μl、400nm mev-r 1.2μl、200nm mev-p 0.6μl、2
×
supermix反应液15μl、去离子水4μl和dna5μl。本发明通过的引物、探针的浓度进行优化,筛选得到400nm为数字pcr的最佳引物终浓度。确定200nm为数字pcr的最佳探针浓度。
[0057]
在本发明中,所述双重数字pcr的反应程序优选如下:95℃ 10min;94℃30sec,60℃60sec,40个循环;12℃5min。本发明对退火温度进行优化,最终确定60℃为数字pcr的最佳退火温度。
[0058]
配制反应体系后,本发明将配制的双重数字pcr反应体系进行数字pcr扩增,读取
微滴信号。
[0059]
本发明对所述数字pcr扩增的方法没有特殊限制,采用本领域所熟知的数字pcr扩增方法即可。读取微滴信号的波长优选为fam: 473nm,vic:532nm。
[0060]
得到微滴信号后,本发明根据所述微滴信号的荧光种类,判断感染水貂阿留申病毒还是水貂肠炎病毒,再根据具体的微滴信号的强度与对应的病毒标准曲线进行比对,得到对应病毒的定量结果。
[0061]
在本发明中,当探针amdv-p标记fam-bhq1时,微滴信号产生蓝色荧光信号,判断样本中感染水貂阿留申病毒;
[0062]
当探针mev-p标记vic-bhq2时,微滴信号产生绿色荧光信号,判断样本中感染水貂肠炎病毒。
[0063]
所述水貂阿留申病毒的标准曲线优选是以amdv质粒标准品为样本,在1.43
×
108copies/μl浓度基础上,分别稀释经10-1
、10-2
、10-3
, 10-4
,10-5
,10-6
,10-7
,10-8
稀释,进行数字pcr检测,得到的荧光信号与不同稀释浓度绘制曲线得到。amdv标准曲线的斜率为 0.3036,相关系数为1,扩增效率为14.3%。
[0064]
所述水貂肠炎病毒的标准曲线优选是以mev质粒标准品为样本,在1.82
×
108copies/μl浓度基础上,分别稀释经10-1
、10-2
、10-3
,10-4
, 10-5
,10-6
,10-7
,10-8
稀释,进行数字pcr检测,得到的荧光信号与不同稀释浓度绘制曲线得到。mev标准曲线的斜率为0.784,相关系数为0.9998,扩增效率为20.4%。
[0065]
在本发明中,所述方法在样品稀释10-8
即1.43copies/μl还可以检测到。并且本发明提供的数学pcr方法具有良好的重复性以及良好的稳定性,交权pcr具有明显优势。
[0066]
下面结合实施例对本发明提供的一种基于双重微滴式数字pcr 检测水貂阿留申病毒和水貂肠炎病毒的引物探针组及试剂盒进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0067]
1.实验仪器
[0068][0069]
2.主要试剂
[0070]
数字pcr预混液(2
×
supermix)新弈生物有限公司
[0071]
ddh2o购自宝生物工程(大连)有限公司
[0072]
引物和探针均委托大连宝生物生物工程有限公司合成。
[0073]
实施例1
[0074]
数字pcr引物、探针设计
[0075]
根据genbank登录的已发表的水貂阿留申vp2基因序列 (genbank登录号ap014968.1),设计水貂阿留申病毒、水貂肠炎病毒通用引物、探针。水貂阿留申病毒通用探针序列的5’端标记报告荧光基团fam(6-carboxy-荧光素),3’端标记淬灭荧光基团bhq2。通过分析实验,得到以下引物、探针,如表1所示。
[0076]
表1检测水貂阿留申病毒和水貂肠炎病毒的引物探针组序列信息
[0077][0078][0079]
实施例2
[0080]
一种基于双重微滴式数字pcr检测水貂阿留申病毒和水貂肠炎病毒的试剂盒,包括以下组分:
[0081]
实施例1设计的引物探针组和数字pcr检测用缓冲液 (2
×
supermix反应液)。
[0082]
实施例3
[0083]
基于实施例2所述试剂盒同时检测水貂阿留申病毒和水貂肠炎病毒的方法
[0084]
1.病料的选择与处理
[0085]
送检至山东省动物疫病预防与控制中心的水貂,选择临床上有疑似阿留申病症状的发病水貂,剖检后取水貂的肝脏、肺脏、气管、肾脏、直肠等组织放在2ml离心管中,剪碎,加适量灭菌pbs,放入钢珠,在30hz下处理2min,取出钢珠,将病料于-80℃冰箱反复冻融3次,10000rpm离心5min,取上清通过0.22μm滤器加入到无菌的离心管中,放在-80℃冰箱保存备用。
[0086]
2.病毒dna的提取,参照爱思进操作说明进行操作。
[0087]
3.质粒标准品的制备,委托由上海生物工程有限公司合成。
[0088]
4.amdv-mev数字pcr操作流程
[0089]
(1)amdv数字pcr反应体系的配制
[0090]
数字pcr采用的引物及探针与荧光pcr相同,反应体系采用 probe dpcr supermix(no ung)试剂推荐的30μl。配制完的反应体系应充分震荡混均,并将气泡进行离心。反应体系如表2所示。
[0091]
表2 amdv-mev数字pcr扩增的反应体系
[0092]
[0093][0094]
(2)amdv-mev数字pcr微滴生成
[0095]
a将新的dg8 cartridge放入holder中,先将25μl样品反应液加入到gd8cartridge第一排(水)的8个孔内。再将5μl dna模板一次加入gd8cartridge第一排的8个孔,吹打均匀。
[0096]
b在gd8cartridge第二排(油)的8个孔内加入180μl微滴生成油(ddpcr droplet generation oil)。
[0097]
c盖上微滴生成板胶垫(droplet generator gd8 gasket),注意将微滴生成板胶垫盖好。否则影响微滴生成结果。
[0098]
d检查dg8 cartridge放入holder是否盖好,如盖好轻轻平稳放置微滴生成仪中,打开电脑程序开始运行,大约300秒即可生成微滴,形成油包水微滴。
[0099]
(3)pcr扩增
[0100]
取出8连扳,盖好胶盖,做好标记进行pcr扩增。
[0101]
扩增的反应条件按实验过程优化后的反应条件进行,如表3所示。
[0102]
表3反应程序
[0103][0104]
(4)微滴信号的读取:
[0105]
将扩增完的pcr8连扳,放入数字微滴分析仪,打开电脑程序,进行微滴数据读取。数字pcr微滴分析仪会自动吸取每个样品中的微滴进行fam通道检测和vic通道检测,fam通道能检测到的蓝色荧光信号为阳性微滴,无蓝色荧光信号的为阴性微滴;vic通道能检测到的绿色荧光信号为阳性微滴,软件会自动记录样品的阳性微滴的比例数,并根据泊松分布原理计算出检测浓度拷贝数。
[0106]
对比例1
[0107]
采用实施例1设计的检测水貂阿留申病毒和水貂肠炎病毒的引物探针组进行实时荧光定量pcr检测,具体方法如下:荧光pcr反应
‑‑‑
在检测区进行将加样后的pcr管放入荧光pcr检测仪内,记录 pcr管摆放顺序。反应参数设置:
[0108]
dna病毒:
[0109]
——第一阶段,预变性50℃/2min;95℃/3min;
[0110]
——第二阶段,95℃15sec,60℃60sec,共40个循环,最后40℃10sec。荧光收集在第二阶段每次循环的延伸时进行。
[0111]
rna病毒:
[0112]
——第一阶段,反转录45℃/15min;95℃/3min;
[0113]
——第二阶段,95℃15sec,60℃60sec,共40个循环,最后40℃10sec。荧光收集在第二阶段每次循环的延伸时进行。
[0114]
结果判定:
[0115]
1结果分析条件的设定
[0116]
阈值设定原则:根据仪器噪声情况进行调整,以阈值线刚好超过阴性对照品扩增曲线的最高点为准。
[0117]
选定fam检测通道读取检测结果;abi仪器,选择fam作为报告荧光基团,无淬灭荧光基团。
[0118]
2质控标准
[0119]
2.1阴性对照无ct/cp值并且无扩增曲线。
[0120]
2.2阳性对照的ct/cp值应小于等于28,并出现典型的扩增曲线。
[0121]
2.3如阴性和阳性对照不满足以上条件,此次实验视为无效。
[0122]
3结果判定
[0123]
阴性:无ct/cp值,且无特征性扩增曲线,表明样品为阴性。
[0124]
阳性:ct/cp值≤30.0,且出现典型的扩增曲线,表示样品为阳性。
[0125]
复验:ct/cp值大于30.0,且出现典型的扩增曲线的样品建议复验。复验仍出现上述结果的,判为阳性,否则判为阴性。
[0126]
实施例4
[0127]
反应条件中退火温度的优化
[0128]
退火温度摸索了56℃、57℃、58℃、59℃、60℃,垮度是1℃。按照实施例3记载的方法进行检测。
[0129]
最终确定60℃为数字pcr的最佳退火温度。此时最佳反应程序为95℃10min;94℃30s;60℃1min;12℃5min,具体结果见图1。
[0130]
实施例5
[0131]
引物浓度的优化
[0132]
反应体系中各条引物的浓度分别设置为400nm、500nm、600nm,每组2个重复,进行3组来进行引物终浓度的优化。
[0133]
最终确定400nm为数字pcr的最佳引物终浓度,具体结果见图 2。
[0134]
实施例6
[0135]
探针浓度的优化
[0136]
反应体系中探针分别设置了200nm、300nm、400nm、500nm每组2个重复,进行3组试验来进行探针终浓度的优化。
[0137]
最终确定200nm为数字pcr的最佳探针浓度,具体结果如图3所示。
[0138]
实施例7
[0139]
水貂阿留申病毒和水貂肠炎病毒的标准曲线的建立
[0140]
通过优化后的检测条件,以amdv质粒标准品为样本,统一稀释到1.43
×
108copies/μl。以mev质粒标准品为样本,统一稀释到 1.82
×
108copies/μl。对质粒进行倍比稀释,再分别按照10-1
、10-2
、1 0-3
,10-4
,10-5
,10-6
,10-7
,10-8
稀释,共8个样。利用graphpad pri sm5.0软件绘制出标准曲线。
[0141]
提取分离纯化amdv中的dna,根据以下公式计算出病毒拷贝数:
[0142][0143]
6.02
×
10
23
是阿佛加得罗常数。
[0144]
结果见图4所示。结果表明:amdv标准曲线的斜率为0.3036,相关系数为1,扩增效率为14.3%,mev标准曲线的斜率为0.784,相关系数为0.9998,扩增效率为20.4%。
[0145]
实施例7
[0146]
实施例2所述试剂盒的灵敏性实验
[0147]
以amdv质粒标准品为样本,统一稀释到1.43
×
108copies/μl。以mev质粒标准品为样本,统一稀释到1.82
×
108copies/μl。对质粒进行倍比稀释,再分别按照10-1
、10-2
、10-3
,10-4
,10-5
,10-6
,10-7
, 10-8
稀释,共8个样。采样优化好配制反应体系,按照优化好条件进行dd-pcr,分读取结果。
[0148]
结果见图5。dd-pcr可以检测到amdv质粒标准品的荧光信号的阳性液滴,其最低检测极限约为1.43copies/μl。dd-pcr可以检测到mev质粒标准品的荧光信号的阳性液滴,其最低检测极限约为 1.82copies/μl。
[0149]
实施例8
[0150]
实施例2所述试剂盒的特异性实验
[0151]
用amdv-mev质粒标准品为样本,分别以犬瘟热病毒(cdv)、水貂流感病毒(miv)为对照样本,去离子水为阴性对照及空白对照组,采样优化好配制反应体系,按照优化好条件进行dd-pcr,同时按照对比例1的方法进行qpcr检测,分别读取结果。
[0152]
结果见图6。由图6可知,该引物探针具有良好的特异性。
[0153]
实施例9
[0154]
重复性实验
[0155]
将amdv质粒标准品稀释成1.43
×
104copies/μl、1.43
×ꢀ
103copies/μl、1.43
×
102copies/μl,将mev质粒标准品稀释成1.82
ꢀ×
104copies/μl、1.82
×
103copies/μl、1.82
×
102copies/μl等3个不同浓度的amdv-mev质粒进行数字pcr,采样优化好配制反应体系,按照优化好方法进行数字pcr批内重复性实验,每组实验各设3 个重复,再进行3次重复实验,再利用统计学分析,计算其组内及组间变异系数,每次实验均设立阴性对照。同时采用对比例1记载的方法进行qpcr检测。
[0156]
结果表明,建立的数学pcr方法具有良好的重复性以及良好的稳定性,具体如图7
所示。
[0157]
实施例10
[0158]
amdv dd-pcr检测方法的初步应用
[0159]
用本发明提供的方法,检测507份来自疑似发病的水貂场的样品,其中包括261份环境样品,246份组织样品。采用实施例3记载的方法进行检测。
[0160]
用建立的dd-pcr检测组织样品和环境样品的核酸阳性检出率分别为:41.76%(109份)和39.43%(97份)。因此,本发明提供的 dd-pcr检测方法可以用于多种临床样本的检测。
[0161]
通过图8可以看出,针对vp2保守序列设计的引物探针,应用本发明优化的引物探针和反应体系,样本8空白试验,样本7为阴性试验,样本6为水,样本5为阳性试验。
[0162]
通过这个微滴生成的样本5读取阳性荧光信号与阴性信号不能较好分开,因此不能得出准确的拷贝数。该引物的反应体系还需要继续优化且检测效果不能作为试验的读取结果。
[0163]
鉴于水貂阿留申病毒的特点,截止目前没有生产出有效的疫苗,对于水貂阿留申病和水貂肠炎的防治主要措施是预防和净化。因此及时发现病原,是早期实现诊断和净化亟需的技术。本发明建立了一种检测水貂阿留申病毒、肠炎病毒的微滴式数字pcr(dd-pcr)方法,与山东地方标准里发行的amdv-mev的qpcr检测方法做比较。
[0164]
两种实验方法的线性关系表明:以amdv质粒标准品为样本,统一稀释到1.43
×
108copies/μl。以mev质粒标准品为样本,统一稀释到1.82
×
108copies/μl。对质粒进行倍比稀释,再分别按照10-1
、 10-2
、10-3
,10-4
,10-5
,10-6
,10+,10-8
稀释,共8个样。dd-pcr(r2=1)和qpcr(r2=0.994)均具有良好的线性关系,当质粒标准品倍稀释到10-6
以下,qpcr已无明显的”s”型扩增曲线,而dd-pcr仍然可以检测到荧光信号的阳性液滴,其最低检测极限约为1.43copies/μl 时,本发明中dd-pcr的检测极限明显高于qpcr可达100倍。因此表明dd-pcr检测方法具有良好的检测范围。利用建立的amdv-mev 双重dd-pcr的检测方法检测水貂阿留申病毒、水貂肠炎病毒、水貂流感病毒、水貂的犬瘟热病毒;结果表明水貂阿留申病毒为阳性其他病毒均为阴性。因此,表明该检测方法的特异性强,检测结果准确可靠。在重复性实验中,3个不同浓度的amdv-mev质粒进行dd-pcr 检测,每组实验设立3个平行重复,做3次实验;最终得到组内实验和组间实验的变异系数(cv%)均小于3%。因此表明该检测方法的稳定性好,可用于临床样本的检测,水貂种貂筛查、引种检测、养殖场环境污染检测和临床样品诊断,为水貂养殖业中种质资源的保护、引种筛查,以及貂群阿留申病的诊断和净化提供了绝对定量的检测方法。
[0165]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1