一种用于检测温度的近红外荧光探针及其制备方法与应用
一种用于检测温度的近红外荧光探针及其制备方法与应用
(一)技术领域
1.本发明属于荧光探针技术领域,具体涉及一种用于检测温度的近红外荧光探针及其制备方法和应用。
(二)
背景技术:
2.温度是维持细胞正常生命活动的重要条件(细胞内酶活、物质运输、细胞膜骨架、胞内代谢等),体现在诸多细胞进行正常生命活动中。具体在物质运输领域,温度通过影响膜内外酶以及膜上载体的活性影响物质的运输能力。且细胞质与囊泡之间的温度差异给予囊泡内递质的积累动力,从而控制囊泡中递质的运送量。此外温度也往往反映细胞内各细胞器的状态,细胞器的温度测定逐渐成为细胞生命活动的重要参数。因此细胞温度的检测有着重要的科研价值,并且可作为诸多疾病早期诊断的依据。
3.然而目前对于温度的检测大多停留在体外,细胞水平上的温度检测存在诸多限制,因此急需开发一种新型可应用于细胞层面的温度检测方法。
4.近些年来,凭借着较高的灵敏性、有效的专一性以及生物体的微创性,小分子荧光探针逐渐成为了细胞层面实时检测成像的重要工具。为此,设计一款新型的近红外温度敏感的探针具有很大的应用价值。本专利设计的一款高灵敏度的温度荧光探针可为研究细胞微环境等科学技术领域提供一个的有效工具,并在临床诊断领域提供早期预警,实实在在将科学技术融入生活。
(三)
技术实现要素:
5.本发明目的是提供一种可以用于检测温度的高灵敏度近红外荧光探针,及其制备方法与应用。
6.为了实现上述目的,本发明采用的技术方案是:
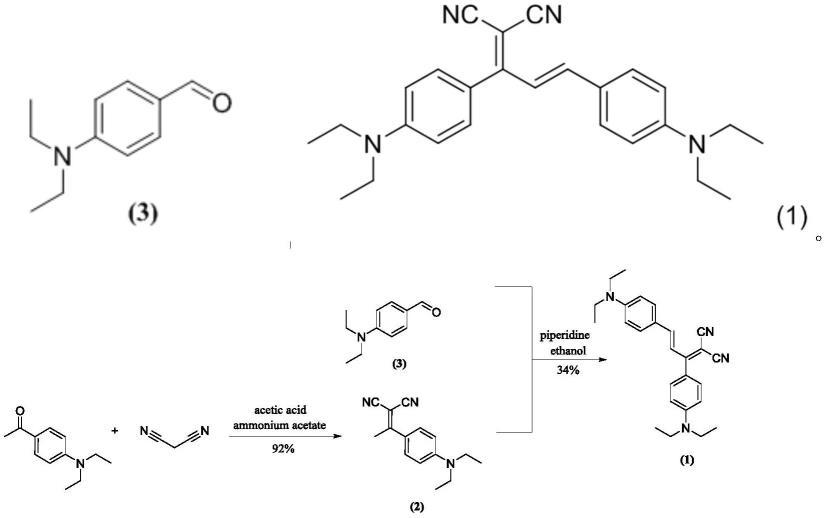
7.第一方面,本发明提供一种式(1)所示的近红外荧光探针,
[0008][0009]
本发明还提供一种所述式(1)所示的近红外荧光探针的制备方法,所述方法包括如下步骤:
[0010]
(1)将丙二腈、对二乙氨基苯乙酮、乙酸、乙酸铵加入甲苯中,110℃-112℃反应回流15h-20h(优选110℃反应回流18h),所得反应液a经后处理a,得到化合物(2);所述丙二腈、对二乙氨基苯乙酮、乙酸与乙酸铵的物质的量之比为14~15:3~5:4~5.5:1(优选15:5:5.5:1);
[0011][0012]
(2)将化合物(3)和步骤(1)所述的化合物(2)、哌啶加入乙醇中,78℃-80℃下搅拌进行回流反应2h-3h(80℃下搅拌进行回流反应2h),所得反应液b经后处理b,得到所述式(1)所示的近红外荧光探针;所述化合物(3)、化合物(2)与哌啶的物质的量之比为1:0.8~1.2:0.1~0.4(优选1:1:0.2);
[0013][0014]
进一步,步骤(1)中所述甲苯的体积以对二乙氨基苯乙酮的质量计为50-54ml/g(优选52.64ml/g)。
[0015]
进一步,步骤(1)中所述后处理a为:将所述反应液a冷却至室温,过滤,所得固体以体积比为5:1的石油醚与乙酸乙酯的混合溶液作为洗脱剂进行硅胶柱色谱纯化,收集含目标产物的洗脱液,减压浓缩得到所述化合物(2)。
[0016]
进一步,步骤(2)中所述乙醇的体积以化合物(3)的质量计为55-58ml/g(优选57.15ml/g)。
[0017]
进一步,步骤(2)中所述后处理b为:用二氯甲烷萃取所述反应液b,取有机相进行减压浓缩,以体积比为1:1的二氯甲烷和石油醚混合溶液作为洗脱剂进行硅胶柱层析,收集含目标产物的洗脱液,减压浓缩,得到所述式(1)所示的近红外荧光探针。
[0018]
本发明中字母a、b只是为了区分不同阶段中的相同步骤或物质,方便描述,无其它特殊含义。
[0019]
第三方面,本发明还提供上述式(1)所示的近红外荧光探针在温度检测中的应用。
[0020]
本发明尤其推荐所述式(1)所示的近红外荧光探针在细胞的温度检测中的应用。
[0021]
本发明化合物(3)为市场上已有化合物。
[0022]
本发明所述的化合物(1)可作为一种检测温度的荧光探针,在之前温度化合物筛选的基础上保留了对温度敏感的氮二乙基,并加入了丙二腈作为吸电子基团,经检测其荧光性能激发为ex=530nm,em=660nm。在pbs缓冲液中,溶液温度从25℃逐渐升温至60℃,荧光强度减弱约30倍,可应用于温度的荧光定量检测。所述的温度的荧光定量检测原理为:化合物(1)在检测环境温度升高过程中,会令本来被限制旋转的碳碳单键结构旋转,从而增加探针的非辐射能量,使荧光能量减弱。测定在激发为530nm时,检测660nm处探针的荧光强度变化,从而获得温度与荧光强度的关系。
[0023]
与现有技术相比,本发明的收益效果主要体现在:本发明化合物(1)可作为一种检测温度的荧光探针,其荧光性能激发为ex=530nm,em=660nm,具有较大的斯托克位移,具有较低的背景干扰、且对生物样品的光损伤小等。其温度的高敏感性,为研究细胞中温度的生理作用提供了一种有效的研究工具。
(四)附图说明
[0024]
图1为本发明中实施例2制备的化合物(1)的核磁氢谱。
[0025]
图2为本发明中实施例2制备的化合物(1)的碳谱。
[0026]
图3为本发明中实施例2制备的化合物(1),加入到pbs缓冲液中的荧光吸收光谱图。激发波长530nm,发射波长660nm。
[0027]
图4为本发明中实施例2制备的化合物(1),加入到pbs缓冲液中的荧光发射光谱图。激发波长530nm,发射波长660nm。
[0028]
图5为本发明中实施例2制备的化合物(1),加入到pbs缓冲液中,温度25℃到60℃不同阶段的荧光发射光谱图(ph=7.4)。激发波长530nm,发射波长660nm。
[0029]
图6为本发明中实施例2制备的化合物(1),加入到pbs缓冲液中,温度25℃到60℃不同阶段的线性关系图(ph=7.4)。激发波长530nm,发射波长660nm。
[0030]
图7为本发明中实施例2制备的化合物(1)在pbs缓冲液(ph=7.4)条件下,选择性结果的荧光图。1-15分别为cu
2+
、ca
2+
、co
32-、mn
+
、hso
3-、nh
4+
、zn
2+
、mg
+
、hco
3-、clo-、fe
3+
、na
+
、k
+
、po
43-、cl-。图11的激发波长为530nm,发射波长为660nm。
[0031]
图8为本发明中实施例2制备的化合物(1)在不同粘度环境中(ph=7.4)的荧光图。
[0032]
图9为本发明中实施例2制备的化合物(1)在不同ph缓冲液条件下的荧光图。
[0033]
图10为本发明中实施例2制备的化合物(1)在细胞层面的温度成像图。
[0034]
图11为本发明中实施例9制备的对比例(a)的核磁氢谱。
[0035]
图12为本发明中实施例9制备的对比例(a)的核磁碳谱。
[0036]
图13为本发明中实施例10制备的对比例(b)的核磁氢谱。
[0037]
图14为本发明中实施例10制备的对比例(b)的核磁碳谱。
[0038]
图15为本发明中实施例9制备的对比例(a),加入到pbs缓冲液中,温度25℃到60℃不同阶段的荧光发射光谱图(ph=7.4)。
[0039]
图16为本发明中实施例10制备的对比例(b),加入到pbs缓冲液中,温度25℃到60℃不同阶段的荧光发射光谱图(ph=7.4)。
[0040]
图17为本发明中实施例1制备的化合物(2)的核磁氢谱。
(五)具体实施方式
[0041]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
[0042]
实施例1:化合物(2)的制备
[0043]
将对二乙氨基苯乙酮(0.38g,2.0mmol)和丙二腈(0.40g,6.0mmol)完全溶解在含有20ml甲苯的圆底烧瓶中。然后,向反应体系中加入乙酸铵(0.70g,0.4mmol)和乙酸(0.14g,2.2mmol),110℃回流18小时。将反应体系冷却至室温后,过滤收集固体。通过用石油醚/乙酸乙酯(5:1v/v)洗脱的硅胶柱色谱纯化,收集含目标化合物的洗脱液,减压浓缩得到化合物(2)纯品454.67mg,为浅黄色固体,产品收率为95%。1h nmr(500mhz,chloroform-d)δ7.71(s,1h),7.69(s,1h),6.69(s,1h),6.67(s,1h),3.45(t,j=7.1hz,4h),2.58(s,3h),1.23(t,j=7.1hz,6h).核磁氢谱见图17。
[0044]
实施例2:化合物(1)的制备
[0045]
将化合物(3)(0.07g,0.42mmol)、化合物(2)(0.13g,0.42mmol)和哌啶(0.0072g,0.084mmol)加入4ml乙醇中,80℃搅拌进行回流反应2h,tlc检测进程,反应液用二氯甲烷萃取,将收集的有机相减压浓缩,硅胶柱层析,用二氯甲烷与石油醚体积比1:1的混合溶剂为洗脱液,收集含目标产物的洗脱液,减压浓缩得到化合物(1)纯品40.84mg,为橙红色固体,反应收率为25%。1h nmr(500mhz,chloroform-d)δ7.46
–
7.43(m,2h),7.37
–
7.33(m,2h),7.30(d,j=15.2hz,1h),7.01(d,j=15.2hz,1h),6.73
–
6.70(m,2h),6.65(d,j=9.0hz,2h),3.44(tt,j=7.1,3.6hz,8h),1.23(dt,j=11.5,7.1hz,12h).13c nmr(126mhz,chloroform-d)δ171.42,150.24,149.19,131.92,131.23,122.09,119.89,119.19,116.44,115.61,111.45,110.64,72.39,44.65,44.46,12.62,12.60.其核磁氢谱见图1,核磁碳谱见图2(500mhr,cdcl3)。
[0046]
实施例3:化合物(1)(5μm)在pbs检测体系里的荧光吸收光谱图(激发波长530nm,发射波长660nm。)
[0047]
称取一定量的实施例2的化合物(1),用二甲基亚砜配置成浓度为1mm的探针母液,抽取2μl母液加入398μlpbs缓冲液中。将其转移至96孔板中,测定化合物(1)的荧光吸收光谱与发射光谱。
[0048]
荧光谱图见图3与图4。
[0049]
实施例4:化合物(1)分别在不同温度下测定的荧光谱图(20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃)(激发波长530nm,发射波长660nm)。
[0050]
称取一定量的实施例2的化合物(1),以二甲基亚砜为溶剂将其配制成浓度为1mm的探针母液,抽取2μl母液加入398μlpbs缓冲液中,在96孔板中检测。通过持续升温,分别在20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃检测其荧光强度,并做好相关的线性曲线。
[0051]
荧光图谱见图5和图6。结果表明,随着温度的增加,化合物(1)的荧光强度逐渐减小,温度60℃的荧光强度是温度25℃时的荧光强度的30倍,且温度与荧光强度之间有较好的线性关系。说明化合物(1)有很强的温度敏感性。
[0052]
实施例5:测定化合物(1)在不同粘度下的荧光变化(激发波长530nm,发射波长660nm)。
[0053]
称取一定量的实施例2的化合物(1),以二甲基亚砜为溶剂将其配制成浓度为1mm的探针母液,抽取2μl母液加入398μl配置好的缓冲液中(甘油/水v/v 1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1、10:0),37℃下在96孔板中检测,测定化合物(1)的荧光谱图。
[0054]
荧光谱图见图8。结果表明,粘度的急剧变化对化合物(1)的荧光变化影响很小,荧光强度仅变化约3倍,比起温度带来的30倍的变化几乎可以忽略不计。实施例6:化合物(1)(5μm)在活性离子中的选择性检测(激发波长530nm,发射波长660nm)。
[0055]
称取一定量的实施例2的化合物(1),以二甲基亚砜为溶剂将其配制成浓度为1mm的探针母液,抽取2μl母液加入398μl配置好的水溶液中(用氯化铜、氯化钙、碳酸钾、氯化锰、亚硫酸氢钠、氯化铵、氯化锌、氯化镁、碳酸氢钠、次氯酸钠、氯化铁、磷酸钠配制成含有生物相关活性小分子1~20,分别为cu
2+
、ca
2+
、co
32-、mn
+
、hso
3-、nh
4+
、zn
2+
、mg
+
、hco
3-、clo-、fe
3+
、na
+
、k
+
、po
43-、cl-,其中各离子浓度为100μmol/l),在25℃下加入96孔板中,分别测定化合物(1)在25℃与60℃的荧光谱图。
[0056]
荧光谱图见图7。结果表明,生物相关活性小分子对化合物(1)的荧光强度没有影响,温度的变化对化合物(1)的荧光强度有直接的影响。
[0057]
实施例7:ph对化合物(1)(5μm)荧光强度影响的检测。(激发波长530nm,发射波长660nm)。
[0058]
称取一定量的实施例2的化合物(1),以二甲基亚砜为溶液将其配制成浓度为1mm的探针母液,抽取2μl母液加入398μl缓冲液中(ph3-10,缓冲液分别用0.2mol/l磷酸氢二钠与0.1mol/l柠檬酸配置而成;ph11-13,缓冲液分别用0.05mol/l磷酸氢二钠、0.1mol/l氢氧化钠以及0.2mol/l氯化钾配制而成)。加入96孔板中,测定其荧光谱图。
[0059]
荧光谱图见图9。结果表明,ph变化对化合物(1)的荧光强度没有影响。
[0060]
实施例8:化合物(1)(5μm)的温度敏感度在细胞中的应用。
[0061]
称取一定量的实施例2的化合物(1),以二甲基亚砜为溶剂将其配制成浓度为1mm的探针母液,抽取2μl加入到1.998mldmem培养基中,取1ml配置的培养液,加入进huh7细胞中,培育0.5h,用pbs洗涤了两次;同样的培养基加入另外一组细胞,用移液枪向其中加入2μl线粒体解偶联剂(将线粒体解偶联剂溶于二甲基亚砜,浓度为10mm),用于提高细胞温度,室温染色15min,用pbs洗涤两次,olympus fluoview fv 1200共聚焦显微镜进行荧光成像。
[0062]
荧光谱图见图10.结果表明,化合物(1)对温度的敏感性可用于细胞检测。
[0063]
实施例9:对比例(a)的制备。
[0064]
将2-(1-(4-氨基苯基)亚乙基)丙二腈(0.076g,0.42mmol)、化合物(2)(0.13g,0.42mmol)和哌啶(0.0072g,0.084mmol)加入4ml乙醇中,80℃回流2h,tlc检测进程,反应液用二氯甲烷萃取,有机相减压浓缩,硅胶柱层析,用二氯甲烷与石油醚体积比1:1的混合溶剂为洗脱液,收集含目标产物的洗脱液,减压浓缩得到对比例(a)纯品31.6mg,为橙红色固体,产品收率22%。400mhz,chloroform-d)δ7.43(d,j=8.7hz,2h),7.32(d,j=15.1hz,1h),7.25(d,j=8.1hz,2h),6.93(d,j=15.2hz,1h),6.76(d,j=8.1hz,2h),6.64(d,j=8.7hz,2h),4.11(s,2h),3.45(t,j=7.3hz,4h),1.23(t,j=7.0hz,6h).13c nmr(101mhz,chloroform-d)δ171.80,150.44,149.74,149.48,131.50,131.33,123.26,121.84,118.91,
114.47,111.45,44.70,12.63,12.51.其核磁氢谱见图11,核磁碳谱见图12。
[0065]
实施例10:对比例(b)的制备。
[0066]
将2-(1-(4-(哌啶-1-基)苯基)亚乙基)丙二腈(0.105g,0.42mmol)、化合物(2)(0.13g,0.42mmol)和哌啶(0.0072g,0.084mmol)加入4ml乙醇中,80℃回流2h,tlc检测进程,反应液用二氯甲烷萃取,有机相减压浓缩,硅胶柱层析,用二氯甲烷与石油醚体积比1:1的混合溶剂为洗脱液,收集含目标产物的洗脱液,减压浓缩得到对比例(b)纯品37.88mg,为橙红色固体,产品收率22%。400mhz,chloroform-d)δ7.45(s,1h),7.43(s,1h),7.36
–
7.30(m,3h),6.99
–
6.92(m,3h),6.65(d,j=8.7hz,2h),3.45(q,j=7.1hz,4h),3.36(t,j=5.4hz,4h),1.73(q,j=5.4hz,4h),1.23(t,j=7.0hz,6h),1.18(d,j=7.0hz,2h).13c nmr(101mhz,chloroform-d)δ171.49,153.42,150.36,149.54,131.41,131.29,130.20,122.55,121.94,119.02,116.03,115.24,114.23,111.43,73.62,48.89,44.69,25.59,24.32,12.63.其核磁氢谱见图13,核磁碳谱见图14。
[0067]
实施例11:对比例(a)分别在不同温度下测定的荧光谱图(20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃)(激发波长530nm,发射波长650nm)。
[0068]
称取一定量的实施例9的对比例(a),以二甲基亚砜为溶剂将其配制成浓度为1mm的探针母液,抽取2μl母液加入398μlpbs缓冲液中,在96孔板中检测。通过持续升温,分别在20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃检测其荧光强度。荧光图谱见图15.
[0069]
实施例12:对比例(b)分别在不同温度下测定的荧光谱图(20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃)(激发波长500nm,发射波长640nm)。
[0070]
称取一定量的实施例10的对比例(b),以二甲基亚砜为溶剂将其配制成浓度为1mm的探针母液,抽取2μl母液加入398μlpbs缓冲液中,在96孔板中检测。通过持续升温,分别在20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃检测其荧光强度。荧光图谱见图16.
[0071]
本发明在开发温度敏感的化合物时,尝试了以氮二乙基为温度敏感基团的一系列化合物的筛选,最终得到了对温度敏感性较好且荧光效果强的化合物(1),下述为所筛选化合物其中两款温度敏感化合物。
[0072]
化合物(a):
[0073][0074]
化合物(b):
[0075][0076]
化合物(a)ex=530nm,em=650nm,温度从25℃升至60℃荧光强度变化约7倍;化合物(b)ex=500nm,em=640nm,温度从25℃升至60℃荧光强度相差不到8倍;这两款化合物有一定的温度敏感性,但仍难以应用于复杂的细胞检测环境中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1