烯丙基羰基烯醇类化合物及其合成方法
1.本发明涉及化合物技术领域,具体是烯丙基羰基烯醇类化合物及其合成方法。
背景技术:
2.近年来,有机硅化合物的应用得到迅速发展,它不仅作为一类有效的保护试剂应用于有机合成,而且己成为一类应用广泛的合成中间体,其与1,3-二羰基化合物作用得到烯醇硅醚化合物,形成新的碳-碳键、碳-杂键等被用来合成各种天然产物、药物中间体及其他重要的功能分子。在合成许多药物分子时,不仅具有抗肿瘤活性,而且具有抗菌消炎、抗疟疾、抗病毒、消除自由基等作用。
3.现有文献记载[kim,h.l.res.commun.chem.pathol.pharmacol.1980,28,189.],烯醇硅醚作为羰基类化合物的等效体,因其具有反应活性高、易于制备以及操作简单等优点而被广泛应用于有机合成当中[aldrichimica acta,2009,42,3;jennifer kan,s.b.;ng,k.k.-h.;matsuo,j-i.;murakami,m.angew.chem.int.ed.,2013,52,9109.]。
[0004]
近年来,烯醇硅醚因在mukaiyama-aldol及mukaiyama-mannich反应中的广泛应用而被化学家们所关注。此外,其作为合成子用于不对称烯丙基化反应鲜有研究。[timm graening,t.;hartwig,j.f.j..2007,29,7720.chen,w-y.;hartwig,j.f.j.am.chem.soc.2012,134,15249.chen,m.;hartwig,j.f.angew.chem.int.ed.2014,53,8691.]
[0005]
现有文献[kresge,a.j.chem.,soc.rev.1996,25,275;chiang,y.;kresge,a.j.;santaballa,j.a.;wirz,j.j.am.chem.soc.1988,110,5506.]记载了,绝大多数羰基烯醇类化合物由于自身可以发生互变异构,在合成化学中具有重要的作用,它可以发生多种转变。现有文献[wright,t.b.;evans,p.a.chem.rev.2021,121,9196.]记载了,手性的羰基烯醇类化合物可以作为前手性化合物,相当于手性辅基,提供手性的来源,进一步诱导新的手性中心的产生,促进非对映选择性的碳-碳键或碳-杂键的形成,无论是在有机合成还是生物医药领域都具有潜在的应用价值。
[0006]
综上所述,现有技术还缺少一种高效、稳定地生成的烯丙基羰基烯醇类化合物及其合成方法。
技术实现要素:
[0007]
本发明提供一种高效、稳定地生成的烯丙基羰基烯醇类化合物及其合成方法。
[0008]
为达此目的,本发明提供如下的技术方案:
[0009]
本发明的第一个方面,提供了一种烯丙基羰基烯醇类化合物,所述化合物的分子式为:
[0010][0011]
优选的,所述化合物的分子式包括式3a-3p中的一种:
[0012][0013]
本发明的第二个方面,提供了烯丙基羰基烯醇类化合物在药物分子中的应用。
[0014]
优选的,烯丙基羰基烯醇类化合物的分子式为:
[0015][0016]
优选的,所述化合物的分子式包括式3a-3p中的一种:
[0017]
。
[0018]
本发明的第三个方面,提供了一种制备烯丙基羰基烯醇类化合物的方法,其特征在于,包括以下步骤
[0019]
s1、将烘干的反应管冷却至室温,在氩气保护的环境下加入催化剂和配体,然后加入无水四氢呋喃和正丙胺,50℃下搅拌0.5小时;
[0020]
s2、将反应管内溶剂抽干,50℃下继续搅拌2小时;
[0021]
s3、降至室温后加入并加入添加剂,最后加入溶剂;
[0022]
s4、-20-25℃下反应12小时;
[0023]
s5、层析法分离目标产物。
[0024]
优选的,步骤s5包括:加入饱和食盐水并用乙酸乙酯萃取,有机相减压蒸馏得到粗产物,通过使用石油醚/乙酸乙酯混合溶剂,经薄层层析住分离得到目标产物。
[0025]
优选的,体积比石油醚/乙酸乙酯=10/1。
[0026]
优选的,的摩尔比为2:1。
[0027]
优选的,所述添加剂是氟化铯,碳酸铯,氢氧化铯,碳酸钾,氯化铯,二氮杂二环。
[0028]
优选的,所述催化剂包括[ir(cod)cl]2,[ir(cp*)cl2]2或ir(cod)(acac)。
[0029]
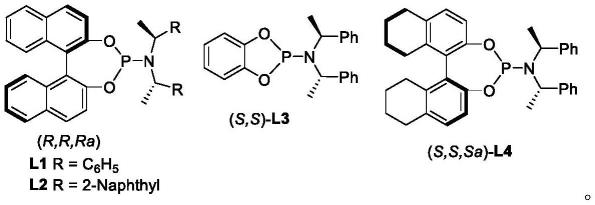
优选的,所述配体包括l1-l4中的一种:
[0030][0031]
优选的,所述溶剂包括乙腈、甲苯、二氯甲烷、四氢呋喃。
[0032]
本发明的第四个方面,提供了一种制备烯丙基羰基烯醇类化合物的方法,包括以下步骤:
[0033]
r1、将烘干的反应管冷却至室温,加入[ir(cod)cl]2和然后加入无水四氢呋喃和正丙胺,50℃下搅拌0.5小时;
[0034]
r2、将反应管内溶剂抽干,50℃下继续搅拌2小时;
[0035]
r3、降至室温后加入并加入cs2co3,最后加入甲苯;
[0036]
r4、-20-25℃下反应12小时;
[0037]
r5、层析法分离目标产物。
[0038]
与现有技术相比,本发明有益效果及显著进步在于:
[0039]
1、本发明建立的反应体系适用性广泛,底物的转化率及产物的产率都很高,拓展了在很多领域的应用。
[0040]
2、本发明提供的方法能够高效、稳定合成烯丙基羰基烯醇类化合物的方法,且合成的烯丙基羰基烯醇类化合物在有机合成和生物医药领域都具有潜在的应用价值。
具体实施方式
[0041]
为使本发明实施例的目的、技术方案、有益效果及显著进步更加清楚,下面,将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
[0042]
显然,所有描述的这些实施例仅是本发明的部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0043]
需要理解的是:
[0044]
对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
[0045]
还需要说明的是,以下的具体实施例可以相互结合,对于其中相同或相似的概念
或过程可能在某些实施例中不再赘述。
[0046]
下面,以具体的实施例对本发明的技术方案进行详细说明。
[0047]
实施例1烯丙基羰基烯醇类化合物实验条件筛选
[0048]
将烯丙基碳酸甲酯底物(反应式中的1)与6,6-二甲基-3-(三甲基硅氧基)环己基-2-烯-1-酮(反应式中的2)加入反应管中,反应12个小时,生成目标产物烯丙基羰基烯醇类化合物(反应式中的3a)。
[0049]
反应式为:
[0050][0051]
其中,ir catalyst为催化剂,l(ligand)为配体,solvent为溶剂,base为添加剂,temp为温度。
[0052]
烯丙基羰基烯醇类化合物制备的具体的步骤为:
[0053]
1.1、将烘干的反应管冷却至室温,加入0.004mmol催化剂和0.008mmol配体,然后用注射器加入0.5ml无水四氢呋喃和0.3ml正丙胺,50℃下搅拌0.5小时;
[0054]
1.2、将反应管内溶剂抽干,50℃下继续搅拌2小时;
[0055]
1.3、降至室温后加入0.2mmol的烯丙基碳酸甲酯和0.1mmol的6,6-二甲基-3-(三甲基硅氧基)环己基-2-烯-1-酮,并加入0.1mmol添加剂,最后加入1.0ml溶剂;
[0056]
1.4、-20-25℃下反应12小时;
[0057]
1.5、层析法分离目标产物:加入饱和食盐水并用乙酸乙酯萃取,有机相减压蒸馏得到粗产物,通过使用石油醚/乙酸乙酯混合溶剂(石油醚/乙酸乙酯=10/1,v/v),经薄层层析柱分离得到目标产物。
[0058]
本发明发现在不同反应条件下目标产物的合成效率具有较大差异。本发明通过大量实验筛选出能够高产目标产物的催化剂、配体、溶剂、添加剂和实验温度。由于筛选实验的数据量较大,本实施例只记录了部分实验数据。
[0059]
组1-19中的催化剂、配体、溶剂、添加剂和温度按照表1所示。
[0060]
表1组1-19的反应条件
[0061][0062][0063]
其中,dcm为二氯甲烷,thf为四氢呋喃,ch3cn为乙腈,toluene为甲苯,csf为氟化铯,cs2co3为碳酸铯,csoh为氢氧化铯,k2co3为碳酸钾,cscl为氯化铯,dbu为1,8-二氮杂二环十一碳-7-烯,l1、l2、l3、l4、l5的结构式为:
[0064][0065]
将组1-19反应得到的产物进行如下检测实验:
[0066]
1、分离产率:反应结束后加入硅藻土,过滤后经减压除去溶剂得到粗产物,最后经硅胶层析柱分离得到目标产物(石油醚/乙酸乙酯=10/1,v/v),经减压浓缩,油泵抽干,称重,计算产物的质量,得分离收率。。
[0067]
2、高效液相色谱法:对映选择性(ee值)值采用岛津lc-15c hplc测定,首先对每个
消旋体化合物选择合适的色谱柱、流速及溶剂极性,确定色谱条件,再对其对应的手性化合物采用相同的条件测定ee值。
[0068]
检测实验结果如下表2所示。
[0069]
表2
[0070][0071][0072]
其中,nr表示未反应。
[0073]
表2中,3a/3a”表示此反应的区域选择性。当3a/3a”大于20/1时说明区域选择性高;3a(%)表示3a的收率,当3a(%)越大说明3a收率越高;ee(%)表示此反应的对映选择性,当ee(%)越大说明对映选择性越高。综上,可见组10、11、12、13、16的产物合成效率较高,特别是组12,产物合成效率最高。
[0074]
底物拓展实验
[0075]
通过对不同的底物进行拓展研究,进一步表现出此反应适用范围广泛,具有良好的底物普适性以及官能团的兼容性,均以较好的收率及中等至优异的对映选择性得到相应的产物。
[0076]
实施例2
[0077]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为肉桂基碳酸甲酯,其反应式如下:
chiralcel oj-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=8.45(major),12.06(minor)min].[α]
d20
=+12.7(c 1.0,chcl3).1hnmr(600mhz,cd3cn)δ7.11(d,j=2.5hz,4h),6.49
–
6.42(m,1h),5.10
–
5.04(m,2h),4.85(d,j=8.2hz,1h),2.61(td,j=7.6,2.0hz,2h),2.55(td,j=6.4,3.2hz,2h),1.82(td,j=6.5,2.0hz,2h),1.23
–
1.19(m,3h),1.06(d,j=3.9hz,6h).
13
c nmr(150mhz,cd3cn)δ202.3,170.1,141.9,141.3,140.4,127.9,127.8,115.9,115.1,43.7,39.7,34.5,28.5,27.1,24.7,24.7,15.8.ir(kbr):ν
max
(cm-1
)=3443,3418,3012,1655,1621,1412,1234,1231,745.hrms(esi
+
)calcd for c
19h24
nao2[m+na]
+
:307.1669,found:307.1680.
[0090]
实施例4
[0091]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(4-异丙基苯基)碳酸烯丙基,其反应式如下:
[0092][0093]
得到的产物3c为:
[0094][0095]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3c/3c”(3c”表示除3c之外的反应副产物)大于20/1,3c(%)为78%,ee(%)为90%。
[0096]
产物3c的特征为:淡黄色固体,m.p.:99-101℃;78%yield(23.2mg);hplc ee:90%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=6.56(minor),7.41(major)min].[α]
d20
=-5.5(c 1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.45(s,1h),7.10
–
7.00(m,4h),6.41(ddd,j=17.1,10.1,8.6hz,1h),5.02
–
4.93(m,2h),4.76(d,j=8.6hz,1h),2.51(dt,j=3.9,2.0hz,3h),1.73(t,j=6.4hz,2h),1.17(d,j=7.0hz,6h),0.99(d,j=3.7hz,6h).
13
c nmr(150mhz,dmso-d6)δ201.1,170.6,145.4,141.5,140.5,127.3,126.0,115.0,114.9,43.5,34.2,33.4,26.9,25.3,25.2,24.5,24.4.ir(kbr):ν
max
(cm-1
)=3498,3431,3011,1676,1632,1413,1265,1243,743.hrms(esi
+
)calcd for c
20h26
nao2[m+na]
+
:321.1825,found:321.1823.
[0097]
实施例5
[0098]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(4-叔丁基苯基)碳酸烯丙基,其反应式如下:
[0099][0100]
得到的产物3d为:
[0101][0102]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3d/3d”(3d”表示除3d之外的反应副产物)大于20/1,3d(%)为90%,ee(%)为94%。
[0103]
产物3d的特征为:淡黄色固体,m.p.:91-94℃;90%yield(28.1mg);hplc ee:94%[daicel chiralcel oj-h(0.46cm
×
25cm);n-hexane/2-propanol=95/5;flow rate=0.5ml/min;detection wavelength=254nm;tr=16.86(minor),19.18(major)min].[α]
d20
=+15.8(c 1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.45(s,1h),7.22(d,j=8.4hz,2h),7.06
–
6.99(m,2h),6.41(ddd,j=17.1,10.0,8.6hz,1h),5.02
–
4.94(m,2h),4.75(d,j=8.7hz,1h),2.50(dd,j=3.9,2.1hz,2h),1.72(t,j=6.4hz,2h),1.24(s,9h),0.99(s,6h).
13
c nmr(150mhz,dmso-d6)δ201.1,170.6,147.6,141.1,140.5,127.1,124.9,114.9,114.8,43.4,34.4,31.7,26.9,25.3,25.2.ir(kbr):ν
max
(cm-1
)=3586,3523,3441,3129,1650,1400,1275,1269,764,752.hrms(esi
+
)calcd for c
21h27
nao2[m+na]
+
:2 353.1887,found:353.1908.
[0104]
实施例6
[0105]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(4-甲氧基苯基)碳酸烯丙基,其反应式如下:
[0106][0107]
得到的产物3e为:
[0108][0109]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3e/3e”(3e”表示除3e之外的反应副产物)大于20/1,3e(%)为70%,ee(%)为
83%。
[0110]
产物3e的特征为:黄色固体,m.p.:75-77℃;70%yield(20.1mg);hplc ee:83%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=10.52(minor),12.24(major)min].[α]
d20
=+6.8(c 1.0,chcl3).1h nmr(600mhz,cd3cn)δ7.07
–
7.00(m,2h),6.71(d,j=8.7hz,2h),6.33(ddd,j=17.1,10.1,8.0hz,1h),5.00
–
4.89(m,2h),4.71(d,j=8.1hz,1h),3.65(s,3h),2.44(td,j=6.4,2.8hz,2h),1.70(t,j=6.4hz,2h),0.95(d,j=3.6hz,6h).
13
c nmr(150mhz,cd3cn)δ202.2,176.0,158.2,140.6,135.9,128.8,116.0,115.0,113.7,55.3,43.3,39.7,34.5,27.6,24.7,24.7.ir(kbr):ν
max
(cm-1
)=3523,3129,3006,2990,1607,1509,1400,1275,1260,764,749.hrms(esi
+
)calcd for c
18h22
nao3[m+na]
+
:309.1461,found:309.1462.
[0111]
实施例7
[0112]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为甲基(3-(间甲基甲苯)烯丙基)碳酸酯,其反应式如下:
[0113][0114]
得到的产物3f为:
[0115][0116]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3f/3f”(3f”表示除3f之外的反应副产物)大于20/1,3f(%)为70%,ee(%)为82%。
[0117]
产物3f的特征为:黄色固体,m.p.:87-89℃;70%yield(21.1mg);hplc ee:82%[daicel chiralpak ic(0.46cm
×
25cm);n-hexane/2-propanol=95/5;flow rate=0.5ml/min;detection wavelength=254nm;tr=22.16(minor),23.36(major)min].[α]
d20
=+7.9(c 1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.46(s,1h),7.08(t,j=7.6hz,1h),6.95
–
6.87(m,3h),6.44
–
6.37(m,1h),5.03
–
4.96(m,2h),4.75(d,j=8.7hz,1h),2.51(dt,j=3.7,2.1hz,2h),2.23(s,3h),1.73(t,j=6.4hz,2h),0.99(d,j=3.2hz,6h).
13
c nmr(150mhz,dmso)δ201.0,170.7,144.2,140.4,136.9,128.1,128.0,126.2,124.5,115.1,114.9,43.7,34.2,26.9,25.2,25.1,21.6.ir(kbr):ν
max
(cm-1
)=3509,3440,3127,1628,1607,1440,1275,1234,765.hrms(esi
+
)calcd for c
18h22
nao2[m+na]
+
:293.1512,found:293.1513.
[0118]
实施例8
[0119]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(3-甲氧基苯基)丙烯基碳酸甲酯,其反应式如下:
[0120][0121]
得到的产物3g为:
[0122][0123]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3g/3g”(3g”表示除3g之外的反应副产物)大于20/1,3g(%)为60%,ee(%)为92%。
[0124]
产物3g的特征为:黄色固体,m.p.:83-85℃;60%yield(20.0mg);hplc ee:92%[daicel chiralcel oj-h(0.46cm
×
25cm);n-hexane/2-propanol=95/5;flow rate=1.0ml/min;detection wavelength=254nm;tr=23.39(major),26.21(minor)min].[α]
d20
=+16.9(c 1.0,chcl3).1h nmr(600mhz,cd3cn)δ7.87(s,1h),7.17(t,j=7.9hz,1h),6.80(dd,j=7.7,1.4hz,1h),6.77
–
6.70(m,2h),6.45(ddd,j=17.1,10.1,8.2hz,1h),5.13
–
5.04(m,2h),4.85(d,j=8.2hz,1h),3.75(s,3h),2.56(q,j=6.0hz,2h),1.82(t,j=6.4hz,2h),1.07(d,j=3.4hz,6h).
13
c nmr(150mhz,cd3cn)δ202.2,170.1,160.1,145.9,140.1,129.4,120.1,115.8,115.4,113.5,111.2,55.2,44.0,40.0,34.4,27.0,24.7.ir(kbr):ν
max
(cm-1
)=3651,3511,3112,1677,1609,1412,1212,1205,722.hrms(esi
+
)calcd for c
18h22
nao3[m+na]
+
:309.1461,found:309.1469.
[0125]
实施例9
[0126]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(3-乙氧苯基)丙烯基碳酸甲酯,其反应式如下:
[0127][0128]
得到的产物3h为:
[0129]
[0130]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3h/3h”(3h”表示除3h之外的反应副产物)大于20/1,3h(%)为76%,ee(%)为89%。
[0131]
产物3h的特征为:黄色固体,m.p.:83-85℃;76%yield(22.8mg);hplc ee:89%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=8.08(major),8.64(minor)min].[α]
d20
=-21.5(c1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.45(s,1h),7.13
–
7.07(m,1h),6.68(dd,j=7.6,1.3hz,1h),6.64(d,j=6.5hz,2h),6.39(ddd,j=16.7,10.7,8.6hz,1h),5.03
–
4.96(m,2h),4.75(d,j=8.7hz,1h),3.93(dd,j=7.0,3.0hz,2h),2.50(d,j=1.9hz,2h),1.72(t,j=6.4hz,2h),1.29(t,j=7.0hz,3h),0.99(d,j=3.5hz,6h).
13
c nmr(150mhz,dmso-d6)δ201.0,172.3,159.7,146.3,140.5,129.7,120.4,116.1,115.6,114.4,112.1,63.9,44.4,40.0,34.8,27.8,25.1,15.1.ir(kbr):ν
max
(cm-1
)=3498,3465,3009,1665,1620,1342,1298,1213,734.hrms(esi
+
)calcd for c
19h24
nao3[m+na]
+
:323.1618,found:323.1617.
[0132]
实施例10
[0133]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(3,4-二甲基苯基)烯丙基碳酸甲酯,其反应式如下:
[0134][0135]
得到的产物3i为:
[0136][0137]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3i/3i”(3i”表示除3i之外的反应副产物)于20/1,3i(%)为69%,ee(%)为91%。
[0138]
产物3i的特征为:黄色固体,m.p.:108-110℃;70%yield(19.9mg);hplc ee:91%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=6.07(minor),6.71(major)min].[α]
d20
=-30.2(c1.0,chcl3).1h nmr(600mhz,cd3cn)δ7.75(s,1h),7.01(d,j=7.7hz,1h),6.96(s,1h),6.92(dd,j=7.9,1.9hz,1h),6.44(ddd,j=17.6,10.0,8.1hz,1h),5.09
–
5.02(m,2h),4.82(d,j=8.1hz,1h),2.54(q,j=6.3hz,2h),2.21(s,6h),1.81(t,j=6.4hz,2h),1.10
–
1.03(m,6h).
13
c nmr(150mhz,cd3cn)δ200.6,172.4,141.5,140.5,136.4,129.6,129.0,125.2,116.0,115.0,43.6,39.7,34.5,27.5,24.8,24.7,19.5,18.9.ir(kbr):ν
max
(cm-1
)=3521,3422,3123,1710,1676,1423,1211,1201,725.hrms(esi
+
)calcd for c
19h24
nao2[m+na]
+
:307.1669,found:307.1661.
[0139]
实施例11
[0140]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(3-溴苯基)烯丙基碳酸甲酯,其反应式如下:
[0141][0142]
得到的产物3j为:
[0143][0144]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3j/3j”(3j”表示除3j之外的反应副产物)大于20/1,3j(%)为70%,ee(%)为81%。
[0145]
产物3j的特征为:白色固体,m.p.:90-92℃;70%yield(23.4mg);hplc ee:81%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=6.42(minor),7.12(major)min].[α]
d20
=+15.8(c 1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.73(s,1h),7.30(dd,j=7.8,2.0hz,1h),7.25(d,j=2.0hz,1h),7.18(t,j=7.8hz,1h),7.10(d,j=7.8hz,1h),6.35(ddd,j=16.7,10.3,8.5hz,1h),5.09
–
4.99(m,2h),4.78(d,j=8.5hz,1h),2.51(dd,j=3.9,2.0hz,2h),1.72(t,j=6.3hz,2h),0.98(d,j=5.1hz,6h).
13
c nmr(150mhz,dmso-d6)δ201.0,171.2,147.3,139.2,130.4,130.1,128.5,126.5,121.7,116.1,114.2,43.5,34.1,26.8,25.2,25.1.ir(kbr):ν
max
(cm-1
)=3508,3441,3116,1670,1628,1400,1273,1261,763,748.hrms(esi
+
)calcd for c
17h19
brnao2[m+na]
+
:357.0461,found:357.0457.
[0146]
实施例12
[0147]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(3-氯苯基)烯丙基碳酸甲酯,其反应式如下:
[0148][0149]
得到的产物3k为:
[0150][0151]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3k/3k”(3k”表示除3k之外的反应副产物)大于20/1,3k(%)为69%,ee(%)为87%。
[0152]
产物3k的特征为:淡黄色蜡状,69%yield(20.0mg);hplc ee:79%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=5.89(minor),6.56(major)min].[α]
d20
=+8.9(c 1.0,chcl3).1h nmr(600mhz,cd3cn)δ7.27
–
7.20(m,2h),7.16(ddd,j=13.2,7.7,1.8hz,2h),6.41(ddd,j=17.0,10.1,8.3hz,1h),5.13
–
5.07(m,2h),4.85(d,j=8.3hz,1h),2.59
–
2.55(m,2h),1.82(t,j=6.4hz,2h),1.05(d,j=8.5hz,6h).
13
c nmr(150mhz,cd3cn)δ201.9,178.5,147.1,139.3,133.7,130.0,127.7,126.3,125.9,115.9,115.4,43.8,39.7,34.4,27.3,24.6,24.5.ir(kbr):ν
max
(cm-1
)=3613,3524,34426,3009,1660,1392,1275,1260,765,746.hrms(esi
+
)calcd for c
17h19
clnao2[m+na]
+
:313.0966,found:313.0996.
[0153]
实施例13
[0154]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(4-溴苯基)烯丙基碳酸甲酯,其反应式如下:
[0155][0156]
得到的产物3l为:
[0157][0158]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3l/3l”(3l”表示除3l之外的反应副产物)大于20/1,3l(%)为62%,ee(%)为77%。
[0159]
产物3l的特征为:黄色固体,m.p.:93-95℃;62%yield(20.7mg);hplc ee:77%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=7.09(minor),8.95(major)min].[α]
d20
=+39.9(c 1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.61(s,1h),7.39(d,j=8.5hz,2h),7.06(d,j=8.4hz,2h),6.36(ddd,j=16.5,10.8,8.5hz,1h),5.05
–
4.97(m,2h),4.75(d,j=8.5hz,1h),2.51(t,j=1.9hz,2h),1.72(t,j=6.4hz,2h),0.97(d,j=7.8hz,6h).
13
c nmr
(150mhz,dmso-d6)δ201.0,171.0,143.9,139.5,131.0,129.7,118.6,115.8,114.5,43.2,34.2,26.8,25.2,25.1.ir(kbr):ν
max
(cm-1
)=3648,3526,3442,3207,1704,1628,1416,1386,1270,1010,655.hrms(esi
+
)calcd for c
17h19
brnao2[m+na]
+
:357.0461,found:357.0448.
[0160]
实施例14
[0161]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为甲基(3-(萘-2-基)烯丙基)碳酸酯,其反应式如下:
[0162][0163]
得到的产物3m为:
[0164][0165]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3m/3m”(3m”表示除3m之外的反应副产物)大于20/1,3m(%)为90%,ee(%)为90%。
[0166]
产物3m的特征为:白色固体,m.p.:139-141℃;90%yield(27.5mg);hplc ee:90%[daicel chiralpak ad-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=10.39(major),9.68(minor)min].[α]
d20
=-46.6(c1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.59(s,1h),7.80(t,j=7.9hz,2h),7.74(d,j=8.5hz,1h),7.59(s,1h),7.46
–
7.39(m,2h),7.29(dd,j=8.5,1.8hz,1h),6.55
–
6.48(m,1h),5.08(dq,j=13.6,2.5hz,2h),4.96(d,j=8.5hz,1h),2.51(t,j=1.9hz,2h),1.75(t,j=6.4hz,2h),0.99(d,j=7.6hz,6h).
13
c nmr(150mhz,dmso-d6)δ201.2,170.9,142.1,140.0,133.4,127.9,127.7,127.5,126.8,126.2,125.4,125.1,115.6,114.8,43.9,40.2,34.2,26.8,25.3,25.1.ir(kbr):ν
max
(cm-1
)=3523,3440,3127,3007,1641,1625,1605,1400,1276,1268,769,752.hrms(esi
+
)calcd for c
21h22
nao2[m+na]
+
:329.1512,found:329.1515.
[0167]
实施例15
[0168]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为3-(呋喃-2-基)烯丙基碳酸甲酯,其反应式如下:
[0169][0170]
得到的产物3n为:
[0171][0172]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3n/3n”(3n”表示除3n之外的反应副产物)大于20/1,3n(%)为61%,ee(%)为93%。
[0173]
产物3n的特征为:棕色固体,m.p.:100-102℃;61%yield(15.0mg);hplc ee:93%[daicel chiralpak ig(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=220nm;tr=7.28(minor),8.92(major)min].[α]
d20
=-4.6(c 1.0,chcl3).1h nmr(600mhz,cd3cn)δ7.23(s,1h),6.26
–
6.21(m,1h),6.20(dd,j=3.2,1.8hz,1h),5.88(d,j=3.2hz,1h),5.00
–
4.94(m,2h),4.82(d,j=7.4hz,1h),2.43(td,j=6.3,1.9hz,2h),1.70(t,j=6.4hz,2h),0.96(s,6h).
13
c nmr(150mhz,cd3cn)δ200.3,173.5,157.1,141.2,138.0,115.3,113.3,110.8,105.3,39.6,38.5,34.5,27.6,24.7.ir(kbr):ν
max
(cm-1
)=3524,3442,3129,1627,1590,1400,1277,1260,764,747.hrms(esi
+
)calcd for c
15h18
nao3[m+na]
+
:269.1148,found:269.1168.
[0174]
实施例16
[0175]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为甲基(3-(噻吩-2-基)烯丙基)碳酸酯,其反应式如下:
[0176][0177]
得到的产物3o为:
[0178][0179]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3o/3o”(3o”表示除3o之外的反应副产物)大于20/1,3o(%)为63%,ee(%)为93%。
[0180]
产物3o的特征为:黄色固体,m.p.:99-101℃;63%yield(16.5mg);hplc ee:93%[daicel chiralpak ig(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=220nm;tr=7.62(minor),10.17(major)min].[α]
d20
=+4.8(c1.0,chcl3).1h nmr(600mhz,cd3cn)δ7.16(dd,j=5.1,1.2hz,1h),6.90(dd,j=5.1,3.5hz,1h),6.75(dd,j=3.3,1.6hz,1h),6.48(ddd,j=17.2,9.9,8.1hz,1h),5.12(dt,j=17.2,1.5hz,1h),5.08
–
5.03(m,2h),2.56(td,j=6.3,1.7hz,2h),1.82(t,j=6.4hz,2h),1.08(d,j=3.2hz,6h).
13
c nmr(150mhz,cd3cn)δ148.7,140.0,127.0,123.7,
116.0,115.2,40.3,34.4,24.6,24.6.ir(kbr):ν
max
(cm-1
)=3510,3442,3128,3002,1647,1400,1275,1261,761,742.hrms(esi
+
)calcd for c
15h18
nao2s[m+na]
+
:285.0920,found:285.0913.
[0181]
实施例17
[0182]
参照实施例1的方法制备烯丙基羰基烯醇类化合物,其中,烯丙基碳酸甲酯换为2-丁烯甲基酯,其反应式如下:
[0183][0184]
得到的产物3p为:
[0185][0186]
参照实施例1的方法对产物进行检测,包括色谱仪器分析和高效液相色谱法。检测实验结果为:3p/3p”(3p”表示除3p之外的反应副产物)大于20/1,3p(%)为60%,ee(%)为91%。
[0187]
产物3p的特征为:白蜡状,60%yield(11.6mg);hplc ee:91%[daicel chiralcel oj-h(0.46cm
×
25cm);n-hexane/2-propanol=90/10;flow rate=1.0ml/min;detection wavelength=254nm;tr=6.56(major),7.71(minor)min].[α]
d20
=+24.6(c 1.0,chcl3).1h nmr(600mhz,dmso-d6)δ10.28(s,1h),6.04(ddd,j=17.2,10.1,7.1hz,1h),4.84(dt,j=17.3,1.8hz,1h),4.76(dt,j=10.1,1.7hz,1h),3.65
–
3.56(m,1h),2.44(t,j=6.4hz,2h),1.67(t,j=6.4hz,2h),1.11(d,j=7.1hz,3h),0.96(d,j=1.9hz,6h).
13
c nmr(150mhz,dmso-d6)δ201.4,169.7,143.5,115.8,112.1,34.3,32.9,25.3,25.3,18.8.ir(kbr):ν
max
(cm-1
)=3586,3523,3442,3209,1665,1608,1409,1311,1215,1112,756.hrms(esi
+
)calcd for c
12h18
nao2[m+na]
+
:217.1199,found:217.1195.
[0188]
在上述说明书的描述过程中:
[0189]
术语“本实施例”、“本发明实施例”、“如
……
所示”、“进一步的”、“进一步改进的技术分方案”等的描述,意指该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中;在本说明书中,对上述术语的示意性表述不是必须针对相同的实施例或示例,而且,描述的具体特征、结构、材料或者特点等可以在任意一个或者多个实施例或示例中以合适的方式结合或组合;此外,在不产生矛盾的前提下,本领域的普通技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合或组合。
[0190]
最后应说明的是:
[0191]
以上各实施例仅用以说明本发明的技术方案,而非是对其的限制;
[0192]
尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当
理解,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换,而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,本领域技术人员根据本说明书内容所做出的非本质改进和调整或者替换,均属本发明所要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1