一株绿木霉HLA-3及其应用
一株绿木霉hla-3及其应用
技术领域
1.本发明涉及微生物技术领域,具体涉及一株绿木霉hla-3及其应用。
背景技术:
2.火龙果是一株典型的热带、亚热带水果,具有很高的营养价值和经济价值。火龙果大多成熟于夏秋季节,因产地高温多雨,果实采后呼吸作用增强,极易发生病害,加速腐烂变质而失去商品价值,给种植户造成巨大的经济损失。火龙果的腐烂率随贮藏时间的增加而增加,火龙果果实在贮藏10d后开始腐烂,贮藏12d后腐烂率快速增加,13d时腐烂率可达50%,16d时则全部腐烂。目前使用咪鲜胺、多菌灵等化学杀菌保鲜剂是控制火龙果采后病害的主要手段,随着人们生活水平提高和生态安全观念的改变,寻求安全、有效、低毒、低残留的新型保鲜剂成为必然。植物内生菌寄生在植物组织内,在长期进化过程中与寄主形成了互利共生关系。植物内生菌通过产生大量具有生物活性的物质来保护寄主植物免受病害的侵染。目前尚无将内生菌应用火龙果采后保鲜的相关报道。
技术实现要素:
3.本发明克服了上述技术问题,提供一株绿木霉hla-3及其应用。
4.本发明的绿木霉(trichoderma virens)hla-3菌株,属于真菌门,丝孢纲,丝孢目,丛梗孢科,木霉属。所述绿木霉(trichoderma virens)hla-3菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.23818,保藏日期为2021年11月22日。
5.进一步的,所述绿木霉(trichoderma virens)hla-3菌株从广西南宁市西乡塘区采集到的健康火龙果的根部分离得到。
6.本发明的另一目的还在于保护上述绿木霉(trichoderma virens)hla-3菌株在火龙果采后病害防治中的应用。
7.具体的,本发明的目的还在于保护一种火龙果保鲜剂,所述火龙果保鲜剂的有效成分包含所述绿木霉(trichoderma virens)hla-3菌株和/或其发酵液。
8.更进一步的,所述火龙果保鲜剂中,绿木霉(trichoderma virens)hla-3菌株的活菌数不低于1.0
×
106cfu/ml。
9.更进一步的,所述发酵液由如下方法制备得到:
10.将绿木霉(trichoderma virens)hla-3菌株接种至种到pdb培养基中,于28℃、180r
·
min-1
培养14d后,10000r
·
min-1
离心5min取上清液,使用0.22μm的微孔滤膜进行抽滤去除菌体后收集无菌发酵液备用,将所得无菌发酵液用无水乙酸乙酯按照1:1的体积比进行萃取,收集萃取液通过旋转蒸发仪浓缩至干粉状后,再溶解于甲醇溶液中得到发酵液,干粉和甲醇溶液的固液比为1g:5ml。
11.更进一步的,所述火龙果保鲜剂的制备方法为:向所述发酵液中添加无菌水,配制成质量百分数为30%的混合液,再向混合液中添加海藻酸铵后混匀即制备得到火龙果保鲜
剂;所述海藻酸钠的添加量为混合液质量的2%。
12.本发明与现有技术相比较具有以下有益效果:本发明的绿木霉(trichoderma virens)hla-3菌株对多种常见的火龙果采后果实病原菌具有良好拮抗作用,在抑制火龙果果实腐烂方面具有明显效果,具有开发成生防菌剂和生物保鲜剂的潜力。研究发现,绿木霉(trichoderma virens)hla-3菌株相比于其他的绿木霉菌株具有更优的耐热性,本技术的绿木霉(trichoderma virens)hla-3菌株发酵液在高温的条件下也具有的抑制病原菌效果,且效果与市售的化学保鲜剂相当。
附图说明
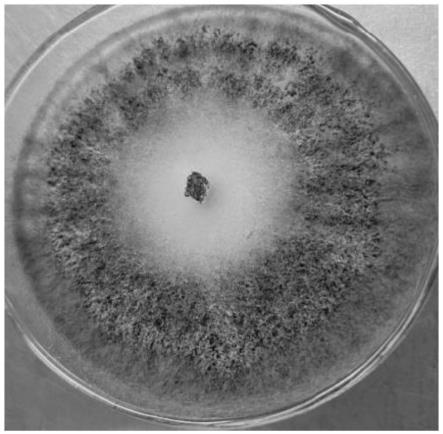
13.图1为本发明绿木霉(trichoderma virens)hla-3的菌落形态图;
14.图2为本发明绿木霉(trichoderma virens)hla-3是分生孢子和分生孢子梗形态图;
15.图3为本发明绿木霉(trichoderma virens)hla-3对火龙果采后病原菌胶孢炭疽菌(colletotrichum gloeosporiodes)的抑制效果图;
16.图4为本发明绿木霉(trichoderma virens)hla-3对火龙果采后病原菌平头炭疽菌(colletotrichum fructicola)的抑制效果图;
17.图5为本发明绿木霉(trichoderma virens)hla-3对火龙果采后病原菌尖孢镰刀菌(fusarium oxysporum)的抑制效果图;
18.图6为本发明绿木霉(trichoderma virens)hla-3对火龙果采后病原菌木贼镰刀菌(fusarium equiset)的抑制效果图;
19.图7为本发明绿木霉(trichoderma virens)hla-3对火龙果采后病原菌单隔镰刀菌(fusarium dimerum)的抑制效果图;
20.图8为本发明绿木霉(trichoderma virens)hla-3与胶孢炭疽菌(colletotrichum gloeosporiodes)菌丝的互作图。
21.图9为本发明绿木霉(trichoderma virens)hla-3与胶孢炭疽菌(colletotrichum gloeosporiodes)菌丝的另一互作图。
22.图10为本技术试验中有绿木霉(trichoderma virens)hla-3的保鲜剂在30℃下贮存10d后,对接种病原菌的火龙果的保鲜效果
23.图11为本发明试验空白对照处理中,接种病原菌的火龙果,于30℃条件下,贮存10d的效果图。
具体实施方式
24.下面结合实施例和试验对本发明作进一步说明。
25.实施例1
26.本发明的绿木霉(trichoderma virens)hla-3菌株,属于真菌门,丝孢纲,丝孢目,丛梗孢科,木霉属。所述绿木霉(trichoderma virens)hla-3菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,保藏编号为cgmcc no.23818,保藏日期为2021年11月22日。
27.本发明的绿木霉(trichoderma virens)hla-3菌株由如下方法筛选得到:
28.(1)内生真菌的获取
29.内生真菌菌株从广西南宁市西乡塘区采集到的健康火龙果根、茎、果实离得到。方法如下:用无菌水将采集的火龙果样品表面泥土冲洗干净,去除表皮,用灭菌滤纸吸干表面水分,室温晾干。使用无菌刀片将其切割成5mm*5mm的片段,置于75%酒精内浸泡1min,再用5%的次氯酸钠溶液浸泡5min,无菌水清洗3次,用灭菌滤纸将根样表面水分吸干,转移到pda培养基上,每皿放置3个片段。取表面消毒最后1次的无菌水洗涤液涂布于pda平板上检测有无杂菌污染。在25℃恒温培养箱培养7d后。用取尖端菌丝的方法进行分离纯化,经反复纯化,直至得到纯化菌落。将纯化的菌株分别转移至斜面培养基保存备用。
30.(2)拮抗菌株的筛选
31.初筛:以前期分离到火龙果采后病原真菌胶孢炭疽菌(colletotrichum gloeosporiodes)、平头炭疽菌(colletotrichum fructicola)、尖孢镰刀菌(fusarium oxysporum)、木贼镰刀菌(fusarium equiset)、单隔镰刀菌(fusarium dimerum)为指示菌,采用平板对峙的方法对15株内生真菌进行初筛。在pda平板中央两端相距3cm处分别放置一块内生真菌菌饼和指示菌,每处理4次重复,以4mm不接菌琼脂块为对照,28℃黑暗培养,5d后,十字交叉法测量病原菌的菌落直径,计算供试菌株对病原菌的生长抑制率。抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径]
×
100%。
[0032]
复筛:无菌条件下,将初筛有拮抗作用的内生真菌菌株分别接种到500mlpdb培养基中,于28℃、180r
·
min-1
培养14d后,10000r
·
min-1
离心5min取上清液,使用0.22μm的微孔滤膜进行抽滤去除菌体,收集无菌发酵液备用。拮抗活性测定采用生长速率法。取拮抗菌发酵液10ml与90ml灭菌pda培养基混匀后倒平板,对照组加等量的无菌水。用直径4mm的打孔器在培养4d的指示菌菌落边缘取菌饼,菌丝面朝下接种到含内生真菌发酵液的平板上。每个处理设4次重复,28℃恒温黑暗培养7d,采用十字交叉法测量病原菌的菌落直径,计算抑制率。抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径]
×
100%。
[0033]
通过初筛和复筛,挑选出对五种火龙果果实病原真菌都具有明显抑制效果的菌株hla-3(即也本技术的绿木霉(trichoderma virens)hla-3菌株),hla-3菌株对五种火龙果果实病原真菌的抑制效果参见下表1。
[0034]
表1 hla-3菌株对五种病原菌的抑制效果
[0035]
菌株初筛抑制率复筛抑制率胶孢炭疽菌(colletotrichum gloeosporiodes)98.65%74.35%平头炭疽菌(colletotrichum fructicola)100%85.86%尖孢镰刀菌(fusarium oxysporum)100%68.5%木贼镰刀菌(fusarium equiset)95.26%73.63%单隔镰刀菌(fusarium dimerum)100%82.54%
[0036]
筛选试验中发现,hla-3菌株生长速度快,能迅速占领生长空间,并侵染寄生到病原菌菌丝上,抑制其生长。具体的,hla-3菌株对火龙果采后病原真菌胶孢炭疽菌(colletotrichum gloeosporiodes)的抑制效果见图3,对火龙果采后病原真菌平头炭疽菌(colletotrichum fructicola)的抑制效果见图4,对火龙果采后病原真菌尖孢镰刀菌(fusarium oxysporum)的抑制效果参见图5、对火龙果采后病原真菌木贼镰刀菌(fusarium equiset)的抑制效果参见图6、对火龙果采后病原真菌单隔镰刀菌(fusarium dimerum)的
抑制效果参见图7。用光学显微镜观察菌株hla-3均与胶孢炭疽菌菌丝的互作情况,发现hla-3菌丝和病原菌菌丝接触后,与其平行生长或者螺旋缠绕生长,具体参见图8和图9。
[0037]
(3)hla-3菌株的鉴定
[0038]
在pda培养基上接种hla-3菌株,观察菌落形态;用插片培养法观察菌株的菌丝及产孢形态,进行初步形态鉴定。用ctab植物基因组dna提取试剂盒提取菌株基因组dna。采用真菌its区域通用引物its1(5'-tccgtaggtgaacctgcgg-3')和its4(5'-tcctccgcttattgatatgc-3')进行pcr扩增,pcr反应条件为:94℃预变性3min;94℃变性0.5min,55℃退火0.5min,72℃延伸1min,共30个循环;72℃延伸5min。pcr产物经凝胶电泳检测后,送上海生工生物工程技术服务有限公司测序。所得its序列在ncbi数据库中进行blast比对及同源性比较分析。
[0039]
hla-3菌株的菌落如图1所示,菌落形成同心环,产生大量的分生孢子,呈现暗绿色,孢子形态呈圆形或卵形,分生孢子梗呈现树枝状。hla-3菌株的its序列共616bp,具体参见序列表中序列2所示,同源性比较分析显示该菌株与trichoderma virens isolate s402的相似性为100%,结合形态分析将菌株hla-3鉴定为trichoderma virens。
[0040]
实施例2
[0041]
绿木霉(trichoderma virens)hla-3菌株在火龙果采后病害防治中的应用。
[0042]
实施例3
[0043]
一种火龙果保鲜剂,有效成分包含所述绿木霉(trichoderma virens)hla-3菌株的发酵液。
[0044]
所述发酵液由如下方法制备得到:
[0045]
将绿木霉(trichoderma virens)hla-3菌株接种至种到pdb培养基中,于28℃、180r
·
min-1
培养14d后,10000r
·
min-1
离心5min取上清液,使用0.22μm的微孔滤膜进行抽滤去除菌体后收集无菌发酵液备用,将所得无菌发酵液用无水乙酸乙酯按照1:1的体积比进行萃取,收集萃取液通过旋转蒸发仪浓缩至干粉状后,再溶解于甲醇溶液中得到发酵液,干粉和甲醇溶液的固液比为1g:5ml。
[0046]
所述火龙果保鲜剂的制备方法为:向所述发酵液中添加无菌水,配制成质量百分数为30%的混合液,再向混合液中添加海藻酸铵后混匀即制备得到火龙果保鲜剂;所述海藻酸钠的添加量为混合液质量的2%。
[0047]
实验:不同菌株保鲜液的制备以及对火龙果采后病害的防治效果
[0048]
为了比较菌株hla-3与其他木霉菌株的保鲜效果,将菌株bjm-11、ltr-2作为对照菌株进行保鲜试验,与此同时还进行了空白对照实验以及市售化学保鲜剂的对比实验,各实验组如下:
[0049]
组1:实施例1中的绿木霉(trichoderma virens)hla-3菌株。
[0050]
组2:菌株bjm-11(cgmcc no.17196)为实验室前期从生姜根部分离到的深绿木霉菌株;
[0051]
组3:菌株ltr-2为昆明农药有限公司登记生产的哈茨木霉菌(登记证号:pd20212932);
[0052]
组4:25%咪鲜胺乳油
[0053]
组5:无菌水(空白对照)
[0054]
试验方法:
[0055]
分别将组1-组3中的hla-3菌、bjm-11菌、ltr-2菌的菌饼接种到1l pdb培养基中,于28℃、180r
·
min-1
培养14d后,10000r
·
min-1
离心5min取上清液,使用0.22μm的微孔滤膜进行抽滤去除菌体,收集无菌发酵液备用,将所得发酵液用无水乙酸乙酯按照1:1的体积比进行萃取,收集萃取液通过旋转蒸发仪浓缩至干粉状后,再溶解于甲醇溶液中得到发酵液,干粉和甲醇溶液的固液比为1g:5ml。向发酵液中添加无菌水配制成质量百分数为30%的混合液,再添加混合液质量的2%的海藻酸钠,混匀后制成保鲜液备用。
[0056]
在超市选取购买无机械损伤、无腐烂、无病虫侵害、成熟度一致的火龙果,用蒸馏水冲洗一遍后自然晾干,随机分组进行试验,分别将无菌水(空白对照)、25%咪鲜胺乳油500倍稀释液、菌株hla-3保鲜液、菌株blj-11保鲜液、菌株ltr-2保鲜液喷施于火龙果果实表面,自然晾干,装袋,放入低温(10℃)、常温(22℃)和高温(30℃)条件下进行贮存。1d后取出果实,用灭菌牙签刺伤果皮,伤口处接种直径3mm的胶孢炭疽菌菌饼,接续培养2d后取下接种体,贮存至第10d时测量果实腐烂指数、抑制率和质量损失率:
[0057]
腐烂级别:0级为无腐烂;1级为0<腐烂面积≤1/4;2级为1/4<腐烂面积≤2/4;3级为2/4<腐烂面积≤3/4;4级为腐烂腐烂>3/4;5级为完全腐烂。
[0058]
腐烂指数=σ(腐烂级别
×
该级别果数)
×
100%/(腐烂最高级
×
总果数)
[0059]
抑制率(%)=(空白对照腐烂指数-处理组腐烂指数)*100/空白对照腐烂指数
[0060]
质量损失率(%)=(果实原始重量-处理结束后果实重量)
×
100%/果实原始重量
[0061]
结果参见下表2:
[0062]
表2不同木霉菌株在不同温度条件下对火龙果的保鲜效果
[0063]
[0064]
其中,组1菌株hla-3保鲜液在30℃条件下贮存10d后对接种病原菌的火龙果的保鲜效果参见图10,组5即对照处理在30℃条件下接种病原菌的火龙果贮存10d的效果图参见图11。
[0065]
结果分析:
[0066]
由图10、图11以及表2可知,在10℃时,菌株hla-3处理对火龙果腐烂的抑制率最高,达到81.43%,且显著高于25%咪鲜胺乳油、菌株blj-11和菌株ltr-2,菌株blj-11抑制率与25%咪鲜胺乳油差异不显著,菌株ltr-2抑制率最低且显著低于25%咪鲜胺乳油;在22℃时,菌株hla-3处理抑制率最高,达到78.26%,且显著高于25%咪鲜胺乳油、菌株blj-11和菌株ltr-2,菌株blj-11、菌株ltr-2抑制率显著低于25%咪鲜胺乳油,其中菌株blj-11抑制率最低,仅为27.74%;在30℃时,25%咪鲜胺乳油抑制率最高,达到62.72%,其次为菌株hla-3,两者差异不显著,菌株blj-11、菌株ltr-2抑制率均显著低于25%咪鲜胺乳油和菌株hla-3,菌株blj-11抑制率最低,仅为4.56%。
[0067]
水果在贮藏过程中由于呼吸作用,导致水分散失,引起重量减少,果皮皱缩,因此质量损失率的变化是果蔬保鲜的重要指标。由表2可知,在10℃、22℃时菌株hla-3质量损失率均为最低,分别为3.88%和9.62%,均显著低于25%咪鲜胺乳油、菌株blj-11和菌株ltr-2;在30℃时,25%咪鲜胺乳油500倍稀释液质量损失率最低,其次为菌株hla-3,二者差异不显著,且显著高于其他处理。
[0068]
从以上结果可知,在10℃、22℃和30℃时菌株hla-3处理对火龙果腐烂的抑制率和质量损失率与25%咪鲜胺乳油相当,保鲜效果相当且不易受到温度的影响。对照木霉菌株blj-11和ltr-2抑制率和质量损失率均显著低于化学药剂,不同温度下保鲜效果差异大,说明其保鲜效果容易受到温度的影响。说明本技术的绿木霉(trichoderma virens)hla-3菌株相比于其他菌株对火龙果保鲜效果更好,能达到化学药剂的保鲜水平,且本技术绿木霉(trichoderma virens)hla-3菌株制成的火龙果保鲜剂耐热性好,本技术具有突出的技术效果。
[0069]
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1