一种非洲猪瘟抗原介导细胞免疫的多聚体及应用的制作方法
1.本发明涉及生物技术领域,特别是一种非洲猪瘟抗原介导细胞免疫的多聚体及应用。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)引发的以家猪为感染对象进而引起的一种急性、出血性、高度接触性的蜱传病毒病,可致家猪网状内皮系统出血且致死率100%,是危害世界养猪业健康发展的最严重的烈性传染病之一。科学家们曾尝试过研发asfv灭活疫苗、基因工程疫苗、活载体疫苗和减毒活疫苗,但由于其安全性和保护效力不理想,市场上仍未出现asfv疫苗。asfv作为非洲猪瘟病毒家族中唯一成员,是一种大型的双链dna病毒,结构复杂,基因组庞大,其基因组编码大量蛋白,包括结构蛋白和宿主免疫调节蛋白等150多种蛋白,asfv主要经呼吸道和消化道进入家猪体内,主要靶向感染单核-巨噬细胞,但具体受体仍不明确。未来的研究需要深化对asfv免疫机制的认识,揭示与保护力相关的病毒抗原。
3.asfv的基因组约170-193kb,含有150-167个开放阅读框(open reading frames,orfs),编码150-200种蛋白质,其中约50多种是病毒的结构蛋白。同时asfv基因组还编码参与dna复制、基因转录和rna修饰的酶类,以及调节宿主细胞功能和参与病毒免疫逃逸的相关蛋白。然而,目前仍有约一半以上的asfv基因编码的蛋白功能尚不明确。asfv病毒粒子为二十面体结构,直径约200nm,是由核壳蛋白包裹的病毒基因组dna、病毒内囊膜、病毒衣壳和外囊膜组成的,大小为其他病毒结构的数倍。囊膜蛋白是构成病毒颗粒的主要结构蛋白,也是重要的表面抗原,与宿主细胞嗜性、致病性与免疫原性密切相关。已知功能的asfv囊膜蛋白主要有cd2v、p54、p12、p30、p17和p22等,衣壳蛋白目前功能已知的有p72、p49(pb438l)和p14.5(pe120r),核壳蛋白有多聚蛋白前体pp220和pp62,类组蛋白pa104r以及五邻体蛋白h240r。
4.乙肝病毒核心蛋白病毒样颗粒(hepatitis b virus core protein virus-like nanoparticles,hbc vlps)是由病毒骨架蛋白自组装形成的一类不含病毒基因组的病毒衣壳蛋白,其形态呈中空笼状,有球形、棒状、二十四面体结构。由于其不含病毒基因组,具有良好的生物相容性;颗粒中空部分可以包封药物,延缓药物在血液中的释放速率;同时可以通过基因工程和化学偶联对颗粒进行功能化修饰。hbc蛋白全长由183aa组成,整体结构分为三个部分:n末端自组装结构域(sa,aa1-140),与颗粒的组装形成相关;c末端聚精氨酸结构域(ctd,aa150-183),主要负责与病毒复制相关的hbc功能,包括前基因组rna的衣壳化,部分双链基因组dna的包装、磷酸化等;10个氨基酸作为ctd和sa之间连接链(aa141-149)。与其他vlp相比,hbc可以同样可以通过基因工程和化学偶联进行功能化修饰,并具有良好的颗粒分散性,其可作为理想的蛋白纳米载体被运用。
5.ruiz gonzalvo等、zsak等、borca等和g
ó
mez-puertas等描述了直接针对三种病毒蛋白p30蛋白、p54蛋白和p72蛋白的asfv中和抗体。另外,g
ó
mez-puertas等和barderas等证
明,宿主反应(包括对p30蛋白和p54蛋白的中和抗体反应)合起来可以对用asfv欧洲毒株e75株攻毒的动物提供一定程度的保护(约50%的存活率,幸存者有临床症状,并可检测到高滴度的病毒血症)。同样,用含有与泛激素结合的cd2v蛋白、p30蛋白和p54蛋白细胞外域的融合蛋白对猪进行免疫,可以保持十二分之三的免疫动物免受asfv欧洲分离株e75株的攻毒。用表达p30蛋白、p54蛋白、p72蛋白和p22蛋白的杆状病毒免疫猪并不能保护动物免受非洲猪瘟病毒的攻击。
6.就整体而言,抗体介导的体液免疫对asfv几乎不起作用,细胞免疫在抗asfv方面起关键作用。使用乙肝病毒核心抗原作为载体展示非洲猪瘟病毒抗原,有利于诱发特异性的体液和细胞免疫反应,增加对机体的保护性免疫响应。因此,提供一种提升非洲猪瘟病毒基因工程抗原细胞免疫的方法势在必行。
技术实现要素:
7.针对上述情况,为解决现有技术之缺陷,本发明之目的就是提供一种非洲猪瘟抗原介导细胞免疫的多聚体及应用,可有效解决抗原在机体中激活细胞免疫水平较低的问题。
8.本发明解决的技术方案是,一种非洲猪瘟抗原介导细胞免疫的多聚体,所述的多聚体包括乙肝病毒核心抗原和非洲猪瘟病毒抗原核心区域,还包括用于将纳米载体和非洲猪瘟病毒抗原连接起来的捕手和标签等非还原性片段(必要时还可包括接头肽、化学修饰部分、n端信号肽和c端多聚腺苷酸等)。
9.优选的,所述的非洲猪瘟病毒抗原核心区域包括p72蛋白富含多种b、t细胞表位区域,氨基酸序列如seq id no.4所示。
10.优选的,所述的非洲猪瘟病毒抗原核心区域包括p54蛋白含中和表位区域,氨基酸序列如seq id no.5所示,p30蛋白含中和表位区域,氨基酸序列如seq id no.6所示,h240r蛋白抗原指数高的区域,氨基酸序列如seq id no.7所示。
11.优选的,所述的乙肝病毒核心抗原c端和spy-catcher捕手序列之间通过柔性连接子连接,所述spy-catcher捕手序列如seq id no.2所示,柔性连接子的氨基酸序列选自ggsggsggsggs、gggsgggsggg中的任意一种,形成的纳米载体序列如seq id no.3所示。
12.优选的,所述的非洲猪瘟病毒抗原加上能和纳米载体结合的标签,在p72、p54、p30和h240r抗原核心区域的c端或n端与spy-tag序列(ahivmvdaykptk)分别通过柔性连接子gsggsggsg连接。
13.优选的,所述纳米载体和非洲猪瘟病毒通过spy-catcher和spy-tag进行连接,所述spy-catcher和spy-tag是一对能够重组的蛋白质,它们之间自发形成异肽键偶联,紧密的共价结合可使其抗原稳定在纳米载体的外侧附着。
14.本发明多聚体的制备方法可采用化学合成法或采用基因工程的方法通过原核或真核表达系统制备、纯化得到。
15.所述的基于纳米载体展示非洲猪瘟病毒抗原的多聚体在制备非洲猪瘟单克隆抗体、非洲猪瘟亚单位疫苗和非洲猪瘟检测试纸条或检测卡或试剂盒中的应用。
16.本发明多聚体可结合一种或多种合适的佐剂制成,例如:201、206佐剂(法国赛比克公司)、化学类免疫佐剂如氢氧化铝、弗氏佐剂、矿物油、司盘等;天然来源佐剂植多为从
植物中提取的活性物质,如quila、皂苷、蜂胶等,新型免疫佐剂多为微生物来源佐剂,如革兰氏阴性菌脂多糖、细菌蛋白毒素(霍乱毒素、破伤风毒素、白喉类毒素)、cpg等。
17.本发明多聚体可快速引起机体免疫,效果良好,在体内不逸散,能直接被抗原呈递细胞(apc)识别,有效刺激机体非特异性和特异性细胞免疫,使机体一免后即产生高于对照组的抗体水平效果,产生足够高的中和抗体滴度,对机体有效保护,可以提供一种提升非洲猪瘟病毒基因工程抗原细胞免疫的策略,为疫苗的研发和抗体的制备提供一种可能。
具体实施方式
18.以下结合具体实施例对本发明的具体实施方式作进一步详细说明,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
19.在没有其他明确说明的情况下,本发明中所用的氨基酸序列均按照n端-c端的顺序排列。
20.一、乙肝病毒核心抗原连接spycatcher蛋白序列构建纳米载体
21.1.1利用生物信息学手段,结合基因工程技术,连接后的形成纳米载体序列
22.乙肝病毒核心抗原序列:
23.mdidpykefg atvellsflp sdffpsvrdl ldtasalyre alespehcsp hhtalrqail cwgelmtlat wvgvnledpa srdlvvsyvn tnmglkfrql lwfhiscltf gretvieylv sfgvwirtpp ayrppnapil stlpettvvr rrgrsprrrt psprrrrsqs prrrrsksre sqc(seq id no.1)
24.spycatcher蛋白序列:
25.mgssvttlsg lsgeqgpsgd mtteedsath ikfskrdedg relagatme lrdssgktis twisdghvkd fylypgkytf vetaapdgye vatpieftvne dgqvtvdgea tegdahtggs(seq id no.2)
26.连接后纳米载体序列:
27.mgssvttlsg lsgeqgpsgd mtteedsath ikfskrdedg relagatme lrdssgktis twisdghvkd fylypgkytf vetaapdgye vatpieftvne dgqvtvdgea tegdahtggs ggsggsggs mdidpykefg atvellsflp sdffpsvrdl ldtasalyre alespehcsp hhtalrqail cwgelmtlat wvgvnledpa srdlvvsyvn tnmglkfrql lwfhiscltf gretvieylv sfgvwirtpp ayrppnapil stlpettvvr rrgrsprrrt psprrrrsqs prrrrsksre sqc(seq id no.3)
28.1.2根据纳米载体的基因设计,经密码子优化后,由苏州金唯智生物科技有限公司合成,并连接在pet43.1a质粒中,测序正确后,该重组质粒命名为:pet43.1a-hbc vlp。取﹣80℃下保存的大肠杆菌bl21(de3)菌株,活化培养后,采用cacl2法制备感受态细胞。将含目的基因的重组质粒转化至bl21(de3)感受态细胞中,获得重组工程菌株。对工程菌株表达条件(诱导温度、诱导时间、iptg浓度)进行优化,目的蛋白以可溶性形式存在,经硫酸铵沉淀,凝胶过滤层析纯化,疏水层析及离子交换层析纯化,利用sds-page、western blot、tem、dls对纯化蛋白进行鉴定,得到了粒度均匀,球形的纳米载体,下述简称为vlp颗粒。
29.具体步骤如下:
30.1.2.1感受态细胞制备
31.(1)从bl21(de3)平板中挑取单克隆,置于50ml lb液体培养基中,37℃摇床培养3小时,至od=0.5时方可进行下一步;
32.(2)在无菌条件下,将活化后的bl21(de3)菌液转移至离心管中,冰浴10min;
33.(3)4000r/min离心5min,弃上清,将离心管倒置尽可能减少上清残留;
34.(4)加入10ml提前预冷的0.1mol/l的cacl2溶液,重悬沉淀;
35.(5)4000r/min离心5min,弃上清,将离心管倒置尽可能减少上清残留;
36.(6)加入2ml提前预冷的0.1mol/l的cacl2溶液,重悬沉淀;
37.(7)在无菌条件将感受态细胞分装至无菌ep管中,若制备后无需立刻使用时可加入20%甘油,置于-70℃保存。
38.1.2.2重组质粒转化
39.采用制备的感受态细胞将确认序列正确的重组质粒进行转化。
40.(1)采用无菌枪头吸取200μlbl21(de3)感受态细胞,随后加入2μl确定序列正确的重组质粒,混匀后,冰浴30min;
41.(2)将离心管立刻转入提前预热至42℃的水浴锅中,静置90s;
42.(3)随后将离心管立即转入冰中,冷却5min;
43.(4)取1.3ml lb液体培养基加入至转化后菌液中,200rpm,37℃摇床过夜培养;
44.(5)无菌条件下,蘸取少量菌液在氨苄卡那霉素平板划线,37℃恒温培养12-16h。
45.1.2.3原核表达
46.转化后菌种在一定的培养条件下,通过加入诱导剂能够促使蛋白表达。蛋白表达主要包括:目的蛋白初步诱导表达;目的蛋白表达与否;诱导条件的探究;大量诱导表达。
47.(1)无菌条件下,取1支无菌试管,加入5ml含氨苄lb培养基,从平板中挑取3-5个单克隆至培养基中;
48.(2)37℃过夜培养,作为诱导表达时初始菌液;
49.(3)取少量初始菌液接种至250ml液体培养基中继续培养2-3h;
50.(4)按1:1比例进行扩瓶培养;
51.待菌液培养至od=2.0,加入iptg使其终浓度为0.5mmol/l,37℃诱导6h。
52.1.2.3硫酸铵沉淀
53.(1)20%硫酸铵沉淀:冰浴条件下,缓慢将饱和硫酸铵溶液加入到搅拌状态下的蛋白上清中,配制成含20%硫酸铵的蛋白溶液,800rpm搅拌10min。然后高速冷冻离心,收集上清(记为20%上清)与沉淀(记为20%沉淀)。
54.(2)40%硫酸铵沉淀:冰浴条件下,缓慢将饱和硫酸铵溶液加入到搅拌状态下的上一步蛋白上清中,配制成含40%硫酸铵的蛋白溶液,800rpm搅拌10min。然后高速冷冻离心(转子规格50ml
×
6,12000rpm,4℃,10min),收集上清(记为40%上清)与沉淀(记为40%沉淀)。蛋白上清为粗提蛋白液。
55.1.2.4超离及分子筛纯化
56.(1)从4℃冰箱中取出蛋白质40%硫酸铵沉淀重悬液(来源于工程菌表达产物的40%硫酸铵沉淀)。
57.(2)重悬液进行超声波破碎(200w,2s,2s,3min,冰上)。
58.(3)破碎后蛋白进行高速冷冻离心(13000rpm,4℃,10min),保留上清液。
59.(4)上清液用0.45μm水系滤膜进行过滤。
60.(5)取专用超离管,每支超离管按照样品、40%蔗糖溶液、50%蔗糖溶液、60%蔗糖溶液的顺序,用20ml注射器和专用加样针头由管底添加,形成分层。
61.(6)将存在于40%和50%蔗糖溶液中的蛋白取出,用含20mmol/l tris-hcl
–
300mmol/l nacl的缓冲液进行透析。
62.(7)分子筛层析柱的清洗与再生:打开蠕动泵,调整转速为4rpm,将300ml 0.5mol/l naoh溶液由蠕动泵泵入层析柱内,然后更换20mmol/l tris-hcl
–
300mmol/l nacl(ph=8.0)分子筛平衡液,继续泵入层析柱内,直至洗脱液体ph=8.0,完成层析柱的清洗与再生。
63.(8)样品的预处理:从4℃冰箱中取出粗提蛋白重悬液,置于50ml烧杯中,超声波破碎(参数设置:6mm探头,150w,工作10s,暂停20s,3次,冰浴),然后高速冷冻离心(转子规格50ml
×
6,12000rpm,5min,4℃)。取上清,最后用0.45μm水系滤膜过滤,获得滤液。
64.(9)上样:取过滤后的样品,调节蠕动泵转速为4rpm,进行上样操作,用1000μl微量移液器吸取1ml 20mmol/l tris-hcl
–
300mmol/l nacl(ph=8.0)对样品稀释,边稀释边上样,共计5次。上样结束后,将上样管移至20mmol/l tris-hcl
–
300mmol/l nacl(ph=8.0)中。
65.(10)样品收集:待第一洗脱峰快形成时,对紫外检测器进行第二次校零(光通量100%,灵敏度0.2a,od280=0)。待第一洗脱峰出现后,用50ml ep管接样(冰浴条件),接至第二洗脱峰结束,边接样边记录od280变化值。
66.二、筛选非洲猪瘟抗原含优势表位区域的氨基酸序列
67.2.1利用生物信息学手段,结合以往经验,筛选出来非洲猪瘟病毒p72、p54、p30和h240r蛋白优势表位的氨基酸序列。
68.p72蛋白含b、t细胞表位区域序列
69.mqpthhaeisfqdrdtalpdacssisdispvtypitlpiiknisvtahginlidkfpskfcssyipfhyggnaiktpddpgammitfalkpreeyqpsghinvsrarefyiswdtdyvgsittadlvvsasainflllqngsavlryst(seq id no.4)
70.p54蛋白含中和表位区域序列
71.mdseffqpvyprhygeclspvttpsffsthmytiliaivvlviiiivliylfssrkkkaaaieeediqfinpyqdqqwvevtpqpgtskpagattasvgkpvtgrpatnrpatnkpvtdnpvtdrlvmatggpaaapaaasapahpaepyttvttqntasqtmsaienlrqrntythkdlensl(seq id no.5)
72.p30蛋白含中和表位区域序列
73.vifktdlrsssqvvfhagslynwfsveiinsgrivttaiktllstvkydivksariyagqgytehqaqeewnmilhvlfeeetessassenihekndnetnectssfetlfeqepssevpkdsklymlaqktvqhieqygkapdfnkvirahnfiqtiygtplkeeekevvrl(seq id no.6)
74.h240r蛋白全长序列
75.maaniiatravpkmaskkehqyclldsqekrhghypfsfelkpygqtganiigvqgslthvikmtvfpfmipfplqkthiddfiggriylffkeldmqavsdvngmqyhfefkvvpvspnqvellpvnnkykftyaipvvqyltpifydlsgpldfpldtlsvhvdilsnhiqlpiqnhnlttgdrvfisgykhlqtielcknnkifiknipplssekiklyilknririplyfkslktsk(seq id no.7)
76.spytag序列
77.ahivmvdaykptk(seq id no.8)
78.2.2非洲猪瘟病毒抗原与spytag序列连接
79.柔性连接子选用gsggsggsg,将spytag序列分别连接上述抗原序列(对下述列出的spytag序列连接在非洲猪瘟蛋白片段的c端或n端不做具体限定,可任意变换),形成融合蛋白,纯化标签hhhhhh始终加在融合蛋白的c端。
80.连接后序列
81.p72+spytag
82.捕手序列连接p72蛋白序列
83.mqpthhaeisfqdrdtalpdacssisdispvtypitlpiiknisvtahginlidkfpskfcssyipfhyggnaiktpddpgammitfalkpreeyqpsghinvsrarefyiswdtdyvgsittadlvvsasainflllqngsavlrystgsggsggsgahivmvdaykptkgsggsggsghhhhhh(seq id no.9)
84.p54+spytag
85.捕手序列连接p54蛋白序列
86.mdseffqpvyprhygeclspvttpsffsthmytiliaivvlviiiivliylfssrkkkaaaieeediqfinpyqdqqwvevtpqpgtskpagattasvgkpvtgrpatnrpatnkpvtdnpvtdrlvmatggpaaapaaasapahpaepyttvttqntasqtmsaienlrqrntythkdlenslgsggsggsgahivmvdaykptkgsggsggsghhhhhh(seq id no.10)
87.p30+spytag
88.捕手序列连接p30蛋白序列
89.vifktdlrsssqvvfhagslynwfsveiinsgrivttaiktllstvkydivksariyagqgytehqaqeewnmilhvlfeeetessassenihekndnetnectssfetlfeqepssevpkdsklymlaqktvqhieqygkapdfnkvirahnfiqtiygtplkeeekevvrlgsggsggsgahivmvdaykptkgsggsggsghhhhhh(seq id no.11)
90.h240r+spytag
91.捕手序列连接h240r蛋白序列
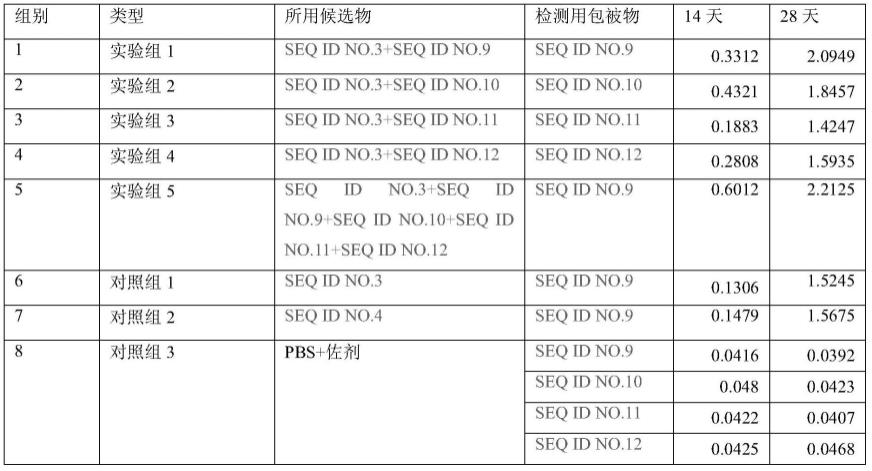
92.maaniiatravpkmaskkehqyclldsqekrhghypfsfelkpygqtganiigvqgslthvikmtvfpfmipfplqkthiddfiggriylffkeldmqavsdvngmqyhfefkvvpvspnqvellpvnnkykftyaipvvqyltpifydlsgpldfpldtlsvhvdilsnhiqlpiqnhnlttgdrvfisgykhlqtielcknnkifiknipplssekiklyilknririplyfkslktskgsggsggsgahivmvdaykptkgsggsggsghhhhhh(seq id no.12)
93.2.3按照上述1.2的方法,密码子优化后,选择在pet-28a载体上ndei和xhoi之间插入合成的核酸分子,并使用kana作为抗生素,分别表达这些抗原,按顺序命名为p7、p5、p3和h2。
94.2.4蛋白纯化
95.融合蛋白的分离纯化:将工程菌于最适条件下进行表达,收集菌体进行超声破碎,破碎液于4℃,10600
×
g离心30min,上清液经0.45μm的滤膜过滤后,负载上ni-nta柱,用10倍柱体积的结合缓冲液(20mmol/l tris-hcl,0.3mol/lnacl,5mmol/l咪唑,ph 8.0)冲洗柱子,收集流出液;用6倍柱体积的洗涤缓冲液(20mmol/l tris-hcl,0.3mol/l nacl,20mmol/l咪唑,ph8.0)冲洗柱子,收集流出液;最后用10倍柱体积的洗脱缓冲液(20mmol/l tris-hcl,0.3mol/l nacl,300mmol/l咪唑,ph8.0)对目的蛋白进行洗脱,收集洗脱液,洗脱至无
nacl 0.1%tween-20)洗板一次,按115ul/孔加入含5%小牛血清的ph7.0 0.01mol/lpb封板,4℃封闭过夜,第二天吸净封板液,37℃干燥1小时,加干燥剂封装于铝箔袋中,包被完毕。样品用0.05mol/l cb(ph9.5)稀释,将稀释好的样品按每孔100μl,加入到酶反应板中,贴上封板膜放至37℃烘箱中温育0.5h。取出,倒掉样品,pbst洗板5次,拍干。将稀释6000倍的的鼠抗兔-hrp酶标结合物按每孔100μl,加入到包被板中,贴上封板膜放至37℃烘箱中温育0.5h。取出,倒掉样品及酶标结合物,pbst洗板5次,拍干。每孔依次加入50μl的显色剂a(含h2o2),显色剂b(含tmb),贴上封板膜,放至37℃烘箱中温育20min每孔依次加入50μl的终止液(2mol/l h2so4),立即用酶标仪双波长检测(450,630)。取出检测包被板,关闭酶标仪和打印机。读取结果od450nm》2.1
×
阴性对照od平均值者为阳性,od450nm《2.1
×
阴性对照平均值为阴性。
113.检测结果如下:
114.表2 各组血清抗体检测检测结果
[0115][0116]
5.2免疫效果评价(细胞免疫检测)
[0117]
5.2.1淋巴细胞分离,小鼠脾脏浸入75%的乙醇中浸泡1-2min。
[0118]
5.2.2脾脏研磨的方法
[0119]
无菌条件下摘取脾脏,撕去脾脏被膜,用眼科剪将脾脏剪成小块。将尼龙烯网成者是细胞过滤筛放置于平皿上,加入少量全血及组织稀释液(保证脾脏及获得的细胞处于液体环境中)。将脾脏放置于筛网上,使用注射器活塞或者是无菌镊子来研磨脾脏(尽量控制研磨力度、保证筛网悬空,避免在皿底上直接研磨而造成大批细胞死亡)研磨完全后使用全血及组织稀释液冲洗筛网,收集细胞悬液,再经滤网过滤。
[0120]
5.2.3淋巴细胞分离
[0121]
取一支适当的离心管,加入与脾脏单细胞悬液等量的分离液。(分离液最少不得少于3ml,总体积不能超过离心管的三分之二,否则会影响分离效果)。小心吸取单组胞悬液加于分离液液面上,注意保持两液面界面清晰。室温,500-900g,离心20-30min。(根据脾脏单细胞悬液的量确定离心条件,单细胞悬液量越大,离心力越大,离心时间越长,具体离心条件可以自行摸索,以达到最佳分离效果)离心后,此时离心管中由上至下细胞分四层。第一
层为稀释液层;第二层为环状乳自色淋巴细胞层;第三层为透明分离液层;第四块为红细胞层。用吸管小心吸取第二层环状乳白色淋巴细胞至另一洁净的15ml离心管中,向离心管中加入10ml细胞洗涤液洗涤白膜层细胞,250g,离心10min。弃上清,5ml的pbs或细胞清洗液重悬细胞,250g,离心10min。重复步骤。弃上清,细胞重悬备用。
[0122]
5.2.4加入3-5ml 5%fcs1640培养基重悬,细胞计数,取2x105细胞悬液铺于96孔板每孔100μl。在二氧化碳培养箱中培养。
[0123]
5.2.5cck8法检测细胞增殖及细胞毒性,酶标仪检测od450吸光度。刺激指数=(特异性抗原刺激孔平均od值-本底od值)/(无抗原刺激孔平均od值-本底od值)。
[0124]
检测结果如下:
[0125]
表3 各组淋巴细胞分离检测结果
[0126][0127]
六、候选物可作为抗原应用于单克隆抗体制备
[0128]
候选物作为抗原可与弗式佐剂乳化后免疫小鼠,共免疫3次,脾细胞和骨髓瘤细胞融合筛选杂交瘤细胞,单克隆化直至单克隆孔内抗体效价检测结果100%阳性且孔内为单个细胞株为止,扩大培养阳性细胞株,部分冻存。可进行单克隆细胞株亚型测定和单克隆抗体特异性鉴定。
[0129]
本发明主要成分为纳米载体展示非洲猪瘟病毒抗原的多聚体,该病毒样颗粒展示非洲猪瘟不同蛋白应用于疫苗或抗体制备时,可快速引起机体免疫,效果良好,在体内不逸散,能直接被抗原呈递细胞(apc)识别,有效刺激机体非特异性和特异性细胞免疫,使机体一免后即产生高于对照组的抗体水平效果,产生足够高的中和抗体滴度,对机体有效保护,可以提供一种提升非洲猪瘟病毒基因工程抗原细胞免疫的策略,为疫苗的研发和抗体的制备提供一种可能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1