一种可以分泌溶解性多糖单加氧酶的工程菌株及其构建方法与应用与流程
fusca yx)。
11.本发明另一方面提供了一种可以分泌溶解性多糖单加氧酶的工程菌株的构建方法,将溶解性多糖单加氧酶基因tfu_1665导入热纤梭菌基因组上,构建重组表达该基因的热纤梭菌工程菌,得到可以分泌溶解性多糖单加氧酶的工程菌株。
12.优选的,将热纤梭菌基因组上cel9k基因中seq id no:1所示的核苷酸序列替换为溶解性多糖单加氧酶基因tfu_1665,重组表达溶解性多糖单加氧酶基因tfu_1665,其中溶解性多糖单加氧酶基因tfu_1665的基因序列如seq id no:2所示。
13.优选的,本发明以热纤梭菌野生菌株为出发菌株构建工程菌株。
14.进一步优选的,所述出发菌株为热纤梭菌(clostridium thermocellum)pn2102,保藏日期为 2021年07月09日,保藏单位为中国普通微生物菌种保藏管理中心,保藏编号为cgmcc no.22869。
15.本发明工程菌的构建方法,包括步骤:(1)构建及设计插入tfu_1665基因的重组质粒puc-tfu;(2)利用电转化将重组质粒puc-tfu转入热纤梭菌,经过同源重组和抗性筛选将目的基因序列插入热纤梭菌基因组;(3)重组工程菌株的阳性单克隆挑选及验证。
16.本发明还提供了上述可以分泌溶解性多糖单加氧酶的工程菌株在木质纤维素水解中的应用,将热纤梭菌工程菌的厌氧发酵发酵液复配纤维素酶对秸秆纤维进行水解。具体包括如下步骤:(1)木质纤维素的预处理:以常见农业秸秆为原料进行预处理,脱除木质素并提取秸秆纤维;(2)热纤梭菌的厌氧发酵:将热纤梭菌工程菌进行种子培养、厌氧发酵,得到发酵液;(3)纤维水解:将步骤(2)所得发酵液复配其它纤维素酶对步骤(1)处理得到的秸秆纤维进行水解。
17.优选的,步骤(1)中,木质纤维素的预处理具体步骤为:将秸秆原料洗净切碎,在碱性条件下进行水热反应,充分脱除木质素后,提取秸秆纤维,脱水并充分洗去残留碱液;所述碱为氢氧化钠与亚硫酸钠;所述氢氧化钠的重量:秸秆原料绝干重为1:(4-6),亚硫酸钠与氢氧化钠的重量比为1:(3-5);处理条件为:反应温度为150-160℃,时间为1-3 h。
18.优选的,步骤(2)中培养基采用mtc培养基,该培养基包括体积比为40:2:1:1:1(v/v)的abcde液,其中,a液为5 g/l碳源(微晶纤维素或秸秆纤维)与10.00 g/l mops;b液为50.00 g/l柠檬酸三钾、31.25 g/l一水合柠檬酸、25.00 g/l na2so4、25.00 g/l kh2po4、62.50 g/l nahco3;c液为250.00 g/l尿素、d液为50.00 g/l mgcl2·
6h2o、10.00 g/l cacl2·
2h2o、5.00 g/l fecl2·
4h2o、50.00 g/l半胱氨酸盐;e液为1.00 g/l吡哆胺二盐酸盐、0.20 g/l对氨基苯甲酸、0.10 g/l生物素、0.10 g/l vb
12
。
19.进一步优选的,a液配制结束后,121℃、20 min灭菌处理;b、c、d、e液按上述浓度配制完成,装于厌氧瓶中,加胶塞铝盖密封后反复抽真空充入高纯氮气3次,最后保持厌氧瓶内为正压。5种培养液按照40:2:1:1:1(v/v)在超净台内使用一次性无菌注射器和0.22 μm无菌滤膜注入已灭菌装有a液的厌氧瓶中,总体积不超过厌氧瓶体积的40%。
20.优选的,步骤(2)中,热纤梭菌的种子培养与厌氧发酵步骤为:将从-80℃保藏的热纤梭菌工程菌菌种置于4℃冰箱解冻,无菌条件下吸取1 ml菌种注入种子培养基中,55℃、
200 rpm条件下培养16-24 h;随后以5%-10%(v/v)的接种量接入发酵培养基中,55℃、200 rpm下培养16-24 h。
21.优选的,步骤(2)种子培养基a液中的碳源为5.00 g/l微晶纤维素,进一步优选为微晶纤维素avicel ph 105;发酵培养基中碳源为5.00 g/l的秸秆纤维,进一步优选为步骤(1)制得的秸秆纤维。
22.优选的,步骤(3)中,纤维水解的具体步骤为:ph 4.5-5.5,固(秸秆纤维绝干重)液比1:(10-30),反应温度45-55℃,单位质量秸秆纤维投加上述热纤梭菌发酵液10-20 ml、纤维素酶0-10 fpu、木聚糖酶4 mg,水解时间12-48 h,搅拌速率为200 rpm。
23.本发明的有益效果为:本发提供了的热纤梭菌工程菌,可以高效应用在木质纤维素的水解中。经过基因工程改造,将热纤梭菌基因组上cel9k基因的部分序列替换为来自褐色高温双岐菌thermobifida fusca yx的溶解性多糖单加氧酶(lpmo)基因tfu_1665,从而构建了具有溶解性多糖单加氧酶生物活性的融合蛋白,通过溶解性多糖单加氧酶的协同作用增强了热纤梭菌的酶水解效率,在相同酶解条件下,相比传统的纤维素酶水解,不仅水解时间短,水解率也更高。
附图说明
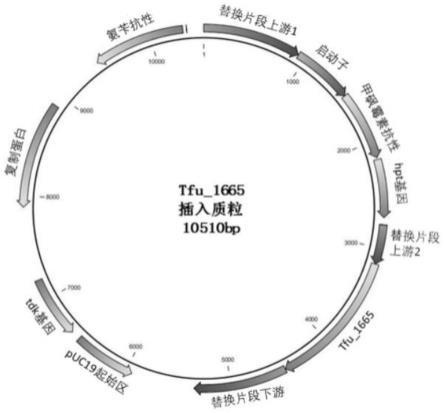
24.图1为本发明实施例1插入tfu_1665基因的重组质粒puc-tfu图谱。
具体实施方式
25.为了使本发明的目的、技术方案和优点更加清楚,下面将结合实施例对本发明作进一步地详细描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
26.本发明用到了遗传工程和分子生物学领域使用的常规技术和方法,例如molecular cloning: a laboratory manual, 3nd ed. (sambrook, 2001)和currentprotocols in molecular biology (ausubel, 2003) 中所记载的方法。这些一般性参考文献提供了本领域技术人员已知的定义和方法。但是,这并不意味着将本发明限定于所述的任何具体方法、实验方案和试剂,因为它们可以改变。
27.溶解性多糖单加氧酶基因tfu_1665来源于褐色高温双岐菌(thermobifida fusca yx),由文献(integration of bacterial lytic polysaccharide monooxygenases into designer cellulosomes promotes enhanced cellulose degradation)获得高温褐色双岐菌(thermobifida fusca yx)溶解性多糖单加氧酶基因序列,通过南京金斯瑞生物科技有限公司合成了该溶解性多糖单加氧酶基因,命名为tfu_1665,并进行密码子优化。tfu_1665的基因序列为seq id no:2。
28.构建重组质粒的表达载体为ppn01模板质粒,可市售购买或由基因设计公司合成。包含gapdh启动子、甲砜霉素抗性基因、hpt基因、puc19起始区、tdk基因、复制蛋白和氨苄抗性基因。
29.热纤梭菌(clostridium thermocellum)pn2102,保藏日期为 2021年07月09日,保藏单位为中国普通微生物菌种保藏管理中心,保藏编号为cgmcc no.22869。
30.实施例中使用的培养基为:ctfud培养基(g/l):3.00 二水柠檬酸钠、1.30 (nh4)2so4、1.50 kh2po4、0.13 cacl2•
2h2o、0.5 l-半胱氨酸盐酸盐、11.56 mops-na、2.60 mgcl2•
6h2o、0.001 feso4•
7h2o、5.00 avicel ph 105、4.50 ye,若配制固体培养基则加入10 g/l琼脂。实施例所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。实施例中的实验方法,如无特殊说明,均为常规方法。
31.实施例1 热纤梭菌工程菌的构建方法通过替换热纤梭菌基因组上cel9k基因的部分序列构建融合蛋白来表达tfu_1665。cel9k基因替换前的核苷酸序列如seq id no:1所示:agaaccggaggttatttatggtgactgcaatggcgacggaaaagttaattcaactgacgctgtggcattgaagagatatatcttgagatcaggtataagcatcaacactgataatgctgatgtaaatgctgatggcagagtta替换后tfu_1665基因的核苷酸序列如seq id no:2所示:gttcgaatgcgaagcagacttgcggcgttcggagcgcttgcgggactcacggcgacacttgcagcagttacgccggcagaggacgcgtacgcacatggagcaatgacatacccgccgacccgtagctacatttgctacgttaacggaattgagggtggacagggaggaaacattgcaccgacaaacccggcgtgccagaaccttctcgcagagaacggaaactacccgttttacaactggtttggaaaccttattagcgatgcggggggaagacatagagagattattccggatggacagctttgcggaccgcatccgcagtttagcggacttaaccttgttagcgagcattggccgacaacaacccttgttgcaggcagcacaattacatttcagtacaacgcatgggcgccgcatccgggaacatggtacctttacgttacaaaggacggatgggacccgaacagcccgcttgggtgggatgatcttgagccagtcccgtttcataccgttacagatccgccgattcgtccagggggaccggagggcccggagtactactgggatgcaacccttccaaacaagagtggaagacatattatttacagtatttggcagagaagcgatagcccggaggcattttacgattgcacagatgttgtttttgttggaggaggagatgatggagggagtggagggccacagccggatacggaggcaccgacggcgccgggaacaccggttgcggggagccttaacggaacaagcgcacagattagctggccagcggcgacagataacgttggggttgcagagtacagagtttacaacgcagcaaacgatgagcttcttgcaaccacgagaacaacaagcgttacacttacaggtcttaccccgaacacagattacagtatttacgttgttgcaagagatgcagcaggaaacacaagtagcccgagtgcaacccttacatttaacagtggggatgcgccggcacttgcatgcgagattgagtacagcacgccgaacacatggtacggaggctttacagcacaggttagaatttacaacggaagccatgagagcattgatggatgggagcttacctgggattttacaaacggggagacaattaaccaggcatggaacgcaacggcacagcagagcggcacaacagttaccgttacaaacgttagttggaacagcacaatcccgcatcatggaagtgttgagtttggatttaacgcaaacagcaccagagagccgggcgttccggagaactttaagcttaacggaagcctttgcagcgttgcatag具体实施方法步骤为:(1)重组质粒puc-tfu的设计及构建通过gibson assembly连接tfu_1665与线性化模板质粒ppn01构建重组质粒puc-tfu,然后转入bl21并在含氨苄的胶板上涂布筛选确认。具体步骤如下:1)pcr基因扩增以ppn01为模板质粒,在启动子gapdh前端插入被替换dna的上游重组片段1 up,在hpt基因后端插入被替换dna(seq id no:1)的上游重组片段2、tfu_1665基因和被替换dna的下游重组片段,得到重组质粒puc-tfu。
32.用于基因插入质粒构建的被替换dna的三段重组片段由下面三对引物加上20-25 bp模板质粒首尾连接片段经pcr获得。
33.上游片段1引物1:gcggctcaatgtttggaa;上游片段1引物2:tctgggtctactcctcct;上游片段2引物1:atcttgacggaatgcagg;上游片段2引物2:tctgggtctactcctcct;下游片段引物1:actctacagacttggcaat;下游片段引物2:tccatctgttttgcccttt。
34.pcr反应体系为:各引物1用量 0.4
ꢀµ
l,各引物2用量 0.4
ꢀµ
l,菌液或质粒用量1
ꢀµ
l,prime star用量 5
ꢀµ
l (效率10 s/kb),无菌水用量3.2
ꢀµ
l,各引物浓度为10 μm。
35.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
36.2)模板质粒ppn01的线性化及载体片段回收:将模板质粒ppn01线性化,使用的引物及pcr条件如下:引物1:cttactctagcagacttggcaatg,引物2:tccatctgtttcgtttgccctttcc。
37.pcr反应体系为:引物1用量 0.4
ꢀµ
l,引物2用量 0.4
ꢀµ
l,菌液或质粒用量1
ꢀµ
l,prime star 5
ꢀµ
l (效率10 s/kb),无菌水用量3.2
ꢀµ
l。其中各引物浓度均为10 μm。
38.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
39.将三段重组片段和tfu_1665与线性化后的模板质粒ppn01用gibson assembly(三段重组片段和tfu_1665各30 ng,线性化后的模板质粒ppn01 30 ng,gibson assembly 5
ꢀµ
l,无菌水补足至10
ꢀµ
l,50℃保温1 h)连接,然后转入bl21并在含氨苄的胶板上涂布,长出菌落后用下面一对引物做pcr筛选确认。
40.引物1:agcggtaaaagtgaagaac;引物2:tgggcccctactaaaatga。
41.pcr反应体系为:引物1用量0.4
ꢀµ
l,引物2用量0.4
ꢀµ
l,菌液或质粒用量1
ꢀµ
l,prime star 用量5
ꢀµ
l (效率10 s/kb),无菌水用量3.2
ꢀµ
l,其中各引物浓度均为10 μm。
42.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
43.将pcr扩增之后的反应液进行琼脂糖凝胶电泳实验(2%琼脂糖,110 v,30 min),dna回收片段tfu_1665基因,阳性验证胶图条带大小为473 bp。
44.图1为插入tfu_1665基因的重组质粒puc-tfu图谱,其中上游片段1为923 bp,上游片段2为370 bp,下游片段为877 bp,证明重组片段已整合到模板质粒上。
45.(2)重组质粒puc-tfu的转入利用电转化将重组质粒puc-tfu转入热纤梭菌pn2102,经过同源重组和抗性筛选将目的基因序列插入基因组。其操作步骤如下:1)细胞生长将50 ml的菌液培养至od600=0.6-1后,将其置于冰上放置20分钟。
46.2)细胞收集与洗涤在6500 g、4℃条件下离心10分钟收集热纤梭菌pn2102细胞,离心完成后小心倒掉
上清液,再向离心管或离心瓶中小心加入洗涤缓冲液(经蒸汽灭菌过的反渗透纯化水),加的过程中不要搅动沉淀,然后再次在6500 g、4℃条件下离心10分钟,小心倒掉上清液,重复上述步骤两次。
47.3)电转化将收集到的细胞放进厌氧室中,用100 μl 厌氧的洗涤缓冲液将其轻轻重悬。随后在标准的 1 mm 电转杯中,加入 20 μl 细胞悬液和1 μg dna,充分混匀。设置电转条件为电压1500v、持续时间1.5 ms 进行电转化。
48.4)孵育电转化细胞用1 ml ctfud培养基将电转后细胞重新混合,在51℃下孵育16小时。
49.(3)阳性单克隆挑选及验证1)筛选转化细胞ctfud 固体培养基融化并冷却至55℃,将6 mg/ml 的甲砜霉素1 ml与50 μl 孵育后的电转化细胞加入到20 ml ctfud 固体培养基中倒入平板,室温下让平板中的培养基凝固30分钟,随后将平板放置在55℃下培养3-5天。
50.2)挑选单克隆菌落,用下面一对引物做pcr验证重组质粒puc-tfu是否已经转入热纤梭菌pn2102感受态细胞。
51.引物1:agcggtaaaagtgaagaac;引物2:tgggcccctactaaaatga。
52.pcr反应体系为:引物1用量0.4
ꢀµ
l,引物2用量0.4
ꢀµ
l,菌液或质粒用量1
ꢀµ
l,prime star 用量5
ꢀµ
l (效率10 s/kb),无菌水用量3.2
ꢀµ
l,其中各引物浓度均为10 μm。
53.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
54.将pcr扩增产物进行2%琼脂糖凝胶电泳实验(110 v,30 min),阳性验证胶图条带大小为473 bp,说明重组质粒puc-tfu成功转入热纤梭菌感受态细胞中。
55.把经过验证的单克隆细胞菌落接入含有甲砜霉素(6 mg/ml)的ctfud 液体培养基在55℃培养1-2天。
56.3)取10 μl到1 ml培养液加入到20 ml 含有甲砜霉素(6 mg/l)和fudr(10 mg/l)的ctfud固体培养基中倒入平板,室温下让平板中的培养基凝固30分钟,随后将平板放置在55℃下培养2-5天。
57.4)挑选单克隆菌落,用下面一对引物做pcr验证重组质粒puc-tfu中的上游片段1和下游片段是否已重组到基因组上。
58.引物1:gcggctcaatgtttggaa;引物2:tccatctgttttgcccttt。
59.pcr反应体系为:引物1用量0.4
ꢀµ
l,引物2用量0.4
ꢀµ
l,菌液或质粒用量1
ꢀµ
l,prime star 用量5
ꢀµ
l (效率10 s/kb),无菌水用量3.2
ꢀµ
l,其中各引物浓度均为10 μm。
60.pcr反应程序为:98℃预变性2 min;98℃变性10 s,55℃退火10 s,72℃延伸30 s到2 min 30 s,循环数30;72℃再延伸2 min,12℃保温20 min。
61.将pcr扩增产物进行2%琼脂糖凝胶电泳实验(110 v,30 min),阳性验证胶图条带大小为5347 bp,片段大小符合设计预期,证明重组质粒puc-tfu中的上游片段1和下游片段已重组到热纤梭菌感受态细胞基因组上。
62.把经过验证的单克隆细胞菌落加入到20 ml 含有8azh(500 mg/l)的ctfud固体培
养基中倒入平板,室温下让平板中的培养基凝固30分钟,随后将平板放置在55℃下培养2-5天。
63.5)挑选单克隆菌落,用下面一对引物做pcr验证基因组上两个上游片段2是否已重组。
64.引物1:gcggctcaatgtttggaa;引物2:tccatctgttttgcccttt。
65.pcr反应体系为:引物1用量0.4
µ
l,引物2用量0.4
µ
l,菌液或质粒用量1
µ
l,primestar用量5
µ
l(效率10s/kb),无菌水用量3.2
µ
l,其中各引物浓度均为10μm。
66.pcr反应程序为:98℃预变性2min;98℃变性10s,55℃退火10s,72℃延伸30s到2min30s,循环数30;72℃再延伸2min,12℃保温20min。
67.将pcr扩增产物进行琼脂糖凝胶电泳实验(2%琼脂糖,110v,30min),阳性验证胶图条带大小为3117bp。说明基因组上两个上游片段2已重组。
68.把经过验证的单克隆细胞菌落加入5ml培养基培养1-2天后保存,得到重组工程菌株。
69.实施例2热纤梭菌工程菌的发酵培养(1)培养基的配制培养基采用mtc培养基,按照下表(表1)配制。a液配制结束后,121℃、20min灭菌处理;b、c、d、e液按表配制完成,装于厌氧瓶中,加胶塞铝盖密封后反复抽真空充入高纯氮气3次,最后保持厌氧瓶内为正压。5种培养液按照40:2:1:1:1(v/v)在超净台内使用一次性无菌注射器和0.22μm无菌滤膜注入已灭菌装有a液的厌氧瓶中,总体积不超过厌氧瓶体积的40%。其中,a液中的碳源(微晶纤维素或者秸秆纤维),种子培养基中使用微晶纤维素avicelph105,浓度为5g/l;发酵产酶时使用秸秆纤维,浓度为5g/l。
70.表1培养基配方
ꢀ
(2)种子液的制备:将从-80℃保藏的热纤梭菌工程菌菌种置于4℃冰箱解冻,无菌条件下吸取1 ml注入种子培养基中,55℃、200 rpm条件下培养24 h;其中种子培养基的配方如表1所示,a液中的碳源为5.00 g/l的微晶纤维素avicel ph 105。
71.(3)发酵:将上述种子液以10%(v/v)的接种量接入发酵培养基中,55℃、200 rpm下培养16 h。发酵培养基的配方如表1所示,碳源为5.00 g/l的秸秆纤维,秸秆纤维可通过对农业秸秆为预处理提取得到,参见实施例3步骤(1)。
72.实施例3 热纤梭菌工程菌在木质纤维素水解中的应用(1)小麦秸秆纤维的制备:将小麦秸秆原料洗净切碎,采用氢氧化钠和亚硫酸钠进行处理,氢氧化钠重量:小麦秸秆原料绝干重为1:6,亚硫酸钠:氢氧化钠重量比为1:3,处理条件为:反应温度为150℃,时间为2 h。充分脱除木质素后,提取小麦秸秆纤维,脱水并充分洗去残留碱液;(2)小麦秸秆纤维的水解:将秸秆纤维浸泡在乙酸-乙酸钠(或同类具备缓冲效应的缓冲对)缓冲液中,投加热纤梭菌发酵液,进行秸秆纤维的水解。水解条件如下:ph 5,固液比1:10,单位质量纤维的热纤梭菌发酵液投加量为20 ml、纤维素酶10 fpu、木聚糖酶为4 mg,反应温度为50℃、反应时间24 h,震荡速率为200转/分钟。
73.水解结束时,水解液中的木糖浓度约为8.05 g/l,葡萄糖浓度为65.00 g/l。相同条件下,使用热纤梭菌野生菌株pn2102(即本发明菌株改造的出发菌株)发酵液进行水解时,水解24 h,木糖浓度约为7.95 g/l,葡萄糖浓度为54.30 g/l。
74.以上对本发明的实例进行了详细说明,但内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍
归属于本发明的专利涵盖范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1