1,2-苯二甲醇化合物的制造方法与流程
1,2-苯二甲醇化合物的制造方法
1.本技术是中国专利申请号201680081183.1(pct/jp2016/053650),申请日2016年02月08日,发明名称为“1,2-苯二甲醇化合物的制造方法”的分案申请。
【技术领域】
2.本发明乃是关于1,2-苯二甲醇化合物的制造方法。
【现有技术】
3.至今为止,作为1,2-苯二甲醇化合物的制造方法,有报告指出使苯二甲酸或苯二甲酸酐、或邻苯二甲内酯与氢化铝锂或硼烷、氢化硼钠等的强力还原剂反应的方法,或者是将1,2-双卤甲基苯以碱性水溶液处理的方法(非专利文献1~3)。但是,要使用前者的方法工业上制造该化合物时,必须有副生的铝化合物的处理或以禁水条件实施制造,而要使用后者的方法工业上制造该化合物时,经常会意外地产生官能基的分解或是不作为目的的氧杂环戊烷副生而成为问题,从作业性或经济性、安全性、官能基的容许性的观点来看,也寻求一种更具效率的改良法。
4.[现有技术文献]
[0005]
[非专利文献]
[0006]
[非专利文献1]j.am.chem.soc.1947,69,1197.
[0007]
[非专利文献2]j.am.chem.soc.1949,71,122.
[0008]
[非专利文献3]j.org.chem.1990,55,2325.
技术实现要素:
[0009]
[发明要解决的课题]
[0010]
本发明是以提供一种有效率地制备可用作为杀菌性作物保护剂的哌啶衍生物的合成中间体1,2-苯二甲醇化合物的方法作为本发明的目的。
[0011]
[用以解决课题的手段]
[0012]
本发明人们专致于解决前述课题的结果,发现一种有效地制备式[1]所示的1,2-苯二甲醇化合物的方法,并基于该见解完成本发明。
[0013]
本发明包含以下化合物的制造方法。
[0014]
(1)一种式[1]所示的化合物的制造方法,其包含将式[2]所示的化合物于酸性或碱性条件下水解的步骤,
[0015]
[化1]
[0016]
[0017]
{式中,x1、x2、x3及x4各自独立地为氢原子、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷氧基、硝基、卤素原子或-os(o)2r1,
[0018]
x1、x2、x3及x4之中任一者为-os(o)2r1,
[0019]
r1为c1~c8烷基、c1~c8卤代烷基或c3~c6环烷基}
[0020]
[化2]
[0021][0022]
{在此,x1、x2、x3及x4如式[1]中所定义}。
[0023]
(2)如(1)中记载的制造方法,其中,前述碱性条件由金属碳酸盐类所提供。
[0024]
(3)如(1)或(2)中记载的制造方法,其中,进一步包含使式[3]所示的化合物与金属乙酸盐类反应而制造式[2]所示的化合物的步骤,
[0025]
[化3]
[0026][0027]
{在此,x1、x2、x3及x4如(1)中所记载,l1及l2各自独立地为卤素原子}。
[0028]
(4)一种式[2]所示的化合物的制造方法,其包含使式[3]所示的化合物与金属乙酸盐类反应的步骤,
[0029]
[化4]
[0030][0031]
{在此,x1、x2、x3及x4如(1)中所记载}
[0032]
[化5]
[0033][0034]
{在此,x1、x2、x3及x4如(1)中所记载,l1及l2各自独立地为卤素原子}。
[0035]
(5)如(1)~(4)中任一项记载的制造方法,其中,进一步包含使式[4]所示的化合物卤素化而制造式[3]所示的化合物的步骤,
[0036]
[化6]
[0037][0038]
{在此,x1、x2、x3及x4如(1)中所记载}。
[0039]
(6)一种式[3]所示的化合物的制造方法,其进一步包含使式[4]所示的化合物卤素化的步骤,
[0040]
[化7]
[0041][0042]
{在此,x1、x2、x3及x4如(1)中所记载,l1及l2各自独立地为卤素原子}
[0043]
[化8]
[0044][0045]
{在此,x1、x2、x3及x4如(1)中所记载}。
[0046]
(7)如(5)或(6)中记载的制造方法,其中,前述卤素化反应的卤素化试剂为氯、硫酰氯、n-氯丁二酰亚胺等的氯化试剂,或溴、n-溴丁二酰亚胺等的溴化试剂。
[0047]
(8)如(1)~(3)中任一项记载的制造方法,其为式[1]所示的化合物的制造方法,其中,包含通过使式[3]所示的化合物与金属乙酸盐类反应而得式[2]所示的化合物,并在不分离此式[2]所示的化合物的情况,于碱性条件下通过水解而得式[1]所示的化合物的步骤。
[0048]
(9)一种式[1]所示的化合物的制造方法,前述制造方法包含使式[3]所示的化合物在碱、离子液体及金属硫酸盐类的存在下或不存在下,在水中或水与有机溶剂的混合溶剂中反应的步骤,
[0049]
[化9]
[0050][0051]
{在此,x1、x2、x3及x4如(1)中所记载}
[0052]
[化10]
[0053][0054]
{在此,x1、x2、x3及x4如(1)中所记载,l1及l2如(3)中所记载}。
[0055]
(10)如(9)中记载的制造方法,其中,前述反应条件为通过于碱或金属硫酸盐类存在下,在水中或水与有机溶剂的混合溶剂中使其反应的步骤所提供。
[0056]
(11)如(9)中记载的制造方法,其中,前述反应条件为通过在水中或水与有机溶剂的混合溶剂中使其反应的步骤所提供。
[0057]
(12)如(1)~(11)中任一项记载的制造方法,其中,x1为-os(o)2r1,
[0058]
x2、x3及x4各自独立地为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me。
[0059]
(13)如(12)中记载的制造方法,其中,
[0060]
x1为-os(o)2me、-os(o)2et、-os(o)2n-pr、
[0061]-os(o)2i-pr、-os(o)2c-pr、-os(o)2n-bu、-os(o)2n-c8h
17
、-os(o)2ch2ch2cf3,
[0062]
x2及x3为氢原子,
[0063]
x4为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me。
[0064]
(14)如(13)中记载的制造方法,其中,
[0065]
x1为-os(o)2me,
[0066]
x4为氢原子或氟原子。
[0067]
(15)如(3)~(11)中任一项记载的制造方法,其中,
[0068]
x1为-os(o)2r1,
[0069]
x2、x3及x4各自独立地为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me,
[0070]
l1及l2各自独立地为氯原子或溴原子。
[0071]
(16)如(15)中记载的制造方法,其中,
[0072]
x1为-os(o)2me、-os(o)2et、-os(o)2n-pr、
[0073]-os(o)2i-pr、-os(o)2c-pr、-os(o)2n-bu、-os(o)2n-c8h
17
、-os(o)2ch2ch2cf3,
[0074]
x2及x3为氢原子,
[0075]
x4为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me,
[0076]
l1及l2为溴原子。
[0077]
(17)如(16)中记载的制造方法,其中,
[0078]
x1为-os(o)2me,
[0079]
x4为氢原子或氟原子。
[0080]
(18)如(1)~(11)中任一项记载的制造方法,其中,
[0081]
x1、x3及x4为氢原子,
[0082]
x2为-os(o)2r1,
[0083]
r1为c1~c4烷基。
[0084]
(19)如(18)中记载的制造方法,其中,x2为-os(o)2me。
[0085]
(20)如(3)~(11)中任一项记载的制造方法,其中,
[0086]
x1、x3及x4为氢原子,
[0087]
x2为-os(o)2r1,
[0088]
r1为c1~c4烷基,
[0089]
l1及l2各自独立地为氯原子或溴原子。
[0090]
(21)如(20)中记载的制造方法,其中,
[0091]
x2为-os(o)2me,
[0092]
l1及l2为溴原子。
[0093]
(22)一种式[2]所示的化合物或其盐,
[0094]
[化11]
[0095][0096]
{式中,x1、x2、x3及x4各自独立地为氢原子、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷氧基、硝基、卤素原子或-os(o)2r1,
[0097]
x1、x2、x3及x4之中任一者为-os(o)2r1,
[0098]
r1为c1~c8烷基、c1~c8卤代烷基或c3~c6环烷基}。
[0099]
(23)如(22)中记载的化合物或其盐,其中,x1为-os(o)2me、-os(o)2et、-os(o)2n-pr、-os(o)2i-pr、-os(o)2c-pr、-os(o)2n-bu、-os(o)2n-c8h
17
、-os(o)2ch2ch2cf3,
[0100]
x2及x3为氢原子,
[0101]
x4为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me。
[0102]
(24)一种式[3]所示的化合物或其盐,
[0103]
[化12]
[0104][0105]
{式中,x1、x2、x3及x4各自独立地为氢原子、c1~c4烷基、c1~c4烷氧基、c1~c4卤代
烷氧基、硝基、卤素原子或-os(o)2r1,
[0106]
x1、x2、x3及x4之中任一者为-os(o)2r1,
[0107]
r1为c1~c8烷基、c1~c8卤代烷基或c3~c6环烷基,
[0108]
l1及l2各自独立地为卤素原子}。
[0109]
(25)如(24)中记载的化合物或其盐,其中,
[0110]
x1为-os(o)2me、-os(o)2et、-os(o)2n-pr、
[0111]-os(o)2i-pr、-os(o)2c-pr、-os(o)2n-bu、-os(o)2n-c8h
17
、-os(o)2ch2ch2cf3,
[0112]
x2及x3为氢原子,
[0113]
x4为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me,
[0114]
l1及l2为溴原子。
[0115]
(26)一种式[5]所示的化合物的制造方法,其包含使式[6]所示的化合物与式[1]所示的化合物反应的步骤,且式[1]的化合物为通过前述(1)、(3)、(5)、(8)及(9)的任一项中记载的步骤所制造,
[0116]
[化13]
[0117][0118]
{式中,a为由a-1、a-2所选出的基团,
[0119]
[化14]
[0120][0121]
r2及r3各自独立地为c1~c4烷基、c1~c4卤代烷基或卤素原子,
[0122]
r4、r5、r6、r7及r8各自独立地为氢原子、卤素原子、氰基、羟基、氨基、硝基、c1~c6烷基、c2~c6烯基、c2~c6炔基、c1~c6卤代烷基、c2~c6卤烯基、c2~c6卤炔基、c1~c6烷氧基、c1~c6卤代烷氧基、c3~c6环烷基、c3~c6卤环烷基、c4~c
10
环烷基烷基、c4~c
10
烷基环烷基、c5~c
10
烷基环烷基烷基、c2~c6烷氧基烷基、c1~c6羟基烷基、c1~c6烷基硫代基、c1~c6卤代烷基硫代基、c1~c6烷基亚磺酰基、c1~c6卤代烷基亚磺酰基、c1~c6烷基磺酰基、c1~c6卤代烷基磺酰基、c1~c6烷基氨基、c2~c8二烷基氨基、c3~c6环烷基氨基、c2~c6烷基羰基、c2~c6卤代烷基羰基、c2~c6烷氧基羰基、c2~c6卤代烷氧基羰基、c2~c6烷基羰基氧基、c2~c6烷基羰基硫代基、c2~c6烷基氨基羰基、c2~c8(二烷基氨基)羰基、或c3~c6三烷基硅烷基,
[0123]
x1、x2、x3及x4如(1)所定义}
[0124]
[化15]
[0125][0126]
{式中,a如式[5]所定义}
[0127]
[化16]
[0128][0129]
{式中,x1、x2、x3及x4如(1)所定义}。
[0130]
(27)如(26)中记载的制造方法,其中,
[0131]
r4、r6及r7为氢原子,
[0132]
r5及r8各自独立地为氢原子、卤素原子、c1~c6烷基或c1~c6卤代烷基。
[0133]
(28)如(26)或(27)中记载的制造方法,其中,
[0134]
r2为三氟甲基、二氟甲基或氯原子,
[0135]
r3为甲基、三氟甲基、二氟甲基或氯原子,
[0136]
r5及r8各自独立地为氢原子、氯原子、三氟甲基或甲基。
[0137]
(29)如(26)~(28)中任一项记载的制造方法,其中,a为a-1。
[0138]
(30)如(26)~(29)中任一项记载的制造方法,其中,a为[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基或[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基。
[0139]
(31)如(26)中记载的制造方法,式中,
[0140]
x1、x2、x3及x4各自独立地为氢原子、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷氧基、硝基、卤素原子或-os(o)2r1,
[0141]
x1、x2、x3及x4之中任一者为-os(o)2r1,
[0142]
r1为c1~c8烷基、c1~c8卤代烷基或c3~c6环烷基。
[0143]
(32)如(26)或(31)中记载的制造方法,其中,x1为-os(o)2r1,
[0144]
x2、x3及x4各自独立地为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me。
[0145]
(33)如(26)、(31)及(32)中任一项记载的制造方法,其中,x1为-os(o)2me、-os(o)2et、-os(o)2n-pr、-os(o)2i-pr、-os(o)2c-pr、-os(o)2n-bu、-os(o)2n-c8h
17
、-os(o)2ch2ch2cf3,
[0146]
x2及x3为氢原子,
[0147]
x4为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me。
[0148]
(34)如(26)、及(31)~(33)中任一项记载的制造方法,其中,x1为-os(o)2me,
[0149]
x4为氢原子或氟原子。
[0150]
(35)如(26)中记载的制造方法,其中,x1、x3及x4为氢原子,
[0151]
x2为-os(o)2r1,
[0152]
r1为c1~c4烷基。
[0153]
(36)如(26)或(35)中记载的制造方法,其中,x2为-os(o)2me。
[0154]
(37)如(31)~(36)中任一项记载的制造方法,其中,a为a-1。
[0155]
(38)如(26)~(36)中任一项记载的制造方法,其中,式[5]所示的化合物为由下述所选出:
[0156]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0157]
4-[4-(6-乙基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0158]
4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0159]
4-[4-(7-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0160]
4-[4-(6-环丙基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0161]
4-[4-(6-甲基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0162]
4-[4-(6-丁基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0163]
4-[4-(6-丙基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0164]
4-[4-(6-辛基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0165]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0166]
4-[4-(6-异丙基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0167]
4-[4-(7-乙基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0168]
4-[4-[6-(1,1,1-三氟丙烷-3-基)磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基]-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
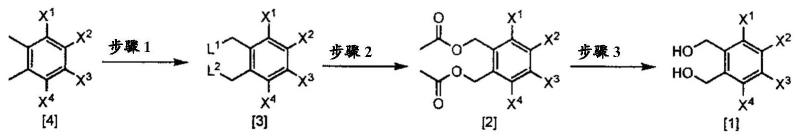
[0169]
4-[4-(6-甲基磺酰基氧基-9-硝基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0170]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0171]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0172]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑
基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0173]
4-[4-(6-甲基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0174]
4-[4-(7-氟-6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0175]
4-[4-(6-异丙基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0176]
4-[4-(6-丁基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0177]
4-[4-(6-辛基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0178]
4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0179]
4-[4-(6,7-二甲基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0180]
4-[4-(6-氯-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0181]
4-[4-(6-溴-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0182]
4-[4-(6-异丙基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0183]
4-[4-(6-丁基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0184]
4-[4-(6-碘-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0185]
4-[4-[6,9-双(甲基磺酰基氧基)-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基]-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0186]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(3,5-二甲基-1h-吡唑-1-基)乙酰基]哌啶、
[0187]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-氯-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0188]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(3,5-二氯-1h-吡唑-1-基)乙酰基]哌啶、
[0189]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(3,5-二甲基-1h-吡唑-1-基)乙酰基]哌啶、
[0190]
4-[4-(6-氯-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0191]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0192]
4-[4-(6-氯-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0193]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氯甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0194]
4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(3,5-二甲基-1h-吡唑-1-基)乙酰基]哌啶、
[0195]
4-[4-(6,7-二甲基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0196]
4-[4-(6,7-二甲基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0197]
4-[4-(6-溴-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0198]
4-[4-(6-甲基磺酰基氧基-9-硝基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0199]
4-[4-(6-溴-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0200]
4-[4-(6-甲基磺酰基氧基-9-硝基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0201]
4-[4-(6-碘-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0202]
4-[4-(6-碘-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0203]
4-[4-(7-氟-6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0204]
4-[4-(7-氟-6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0205]
4-[4-(7-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0206]
4-[4-(7-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0207]
4-[4-[6-(二氟甲氧基)-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基]-2-噻唑基]-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0208]
4-[4-[6,9-双(甲基磺酰基氧基)-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基]-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0209]
4-[4-[6,9-双(甲基磺酰基氧基)-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基]-2-噻唑基]-1-[2-[3,5-双(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0210]
4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[5-甲基-3-(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶、
[0211]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑
基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0212]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0213]
4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0214]
4-[4-(6-丁基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0215]
4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0216]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0217]
4-[4-(6-甲氧基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0218]
4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[2,5-双(三氟甲基)苯基]乙酰基]哌啶、
[0219]
4-[4-(6,7-二甲基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0220]
4-[4-(6,7-二甲基-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0221]
4-[4-(6-溴-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0222]
4-[4-(6-甲基磺酰基氧基-9-硝基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0223]
4-[4-(6-溴-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0224]
4-[4-(6-甲基磺酰基氧基-9-硝基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0225]
4-[4-(6-氯-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0226]
4-[4-(6-碘-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0227]
4-[4-(6-氯-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0228]
4-[4-(7-氟-6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶、
[0229]
4-[4-(7-氟-6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0230]
4-[4-(6-碘-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、
[0231]
4-[4-(7-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶、及
[0232]
4-[4-[6,9-双(甲基磺酰基氧基)-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基]-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶。
[具体实施方式]
[0233]
以下,就本发明详细说明。
[0234]
式[1]赋予可通过本发明制备的1,2-苯二甲醇化合物的一般定义。有关上述及下述中所示的式的基团的优选定义,如以下记载。如此的定义可适用于式[1]所示的最终生成物,以及同样地,也适用于所有中间体。
[0235]
x1、x2、x3及x4各自独立地,优选为氢原子、c1~c4烷基、c1~c4烷氧基、c1~c4卤代烷氧基、硝基、卤素原子或-os(o)2r1,更优选为x1、x2、x3及x4之中任一者为-os(o)2r1,进一步优选为x1为-os(o)2r1,进一步优选为x2、x3及x4各自独立地为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me,特优选为x1为-os(o)2me、-os(o)2et、-os(o)2n-pr、-os(o)2i-pr、-os(o)2c-pr、-os(o)2n-bu、-os(o)2n-c8h
17
、-os(o)2ch2ch2cf3,特优选为x2及x3为氢原子,特优选为x4为氢原子、硝基、卤素原子、二氟甲氧基或-os(o)2me,最优选x1为-os(o)2me,最优选为x4为氢原子、或氟原子。
[0236]
r1优选为c1~c8烷基、c1~c8卤代烷基或c3~c6环烷基,更优选为甲基。
[0237]
l1及l2各自独立地,优选为卤素原子,进一步优选为氯原子或溴原子,特优选为溴原子。
[0238]
a优选为a-1。
[0239]
r2及r3各自独立地,优选为c1~c6烷基、c1~c6卤代烷基或卤素原子,更优选为甲基、三氟甲基、二氟甲基或氯原子。
[0240]
r4、r6及r7优选为氢原子。
[0241]
r5及r8各自独立地,优选为氢原子、卤素原子、c1~c6烷基或c1~c6卤代烷基,更优选为氢原子、氯原子、三氟甲基或甲基。
[0242]
一般的范围或优选的范围中,上述所示的基团的定义及说明,也可视需要而互相组合。即,也可于各自的范围与优选的范围之间组合。这些可适用于最终生成物与其对应前体及中间体双方。
[0243]
优选的一个方式是式[1]{式中,x1、x2、x3及x4之中至少一个表示-os(o)2me}所示的化合物。
[0244]
优选的别的方式是式[1]{式中,x1为-os(o)2me,x2、x3及x4表示氢原子}所示的化合物。
[0245]
优选的别的方式是式[1]{式中,x1为-os(o)2et,x2、x3及x4表示氢原子}所示的化合物。
[0246]
优选的别的方式是式[1]{式中,x1为-os(o)2n-pr,x2、x3及x4表示氢原子}所示的化合物。
[0247]
优选的别的方式是式[1]{式中,x1为-os(o)2i-pr,x2、x3及x4表示氢原子}所示的化合物。
[0248]
优选的别的方式是式[1]{式中,x1为-os(o)2c-pr,x2、x3及x4表示氢原子}所示的化合物。
[0249]
优选的别的方式是式[1]{式中,x1为-os(o)2n-bu,x2、x3及x4表示氢原子}所示的化合物。
[0250]
优选的别的方式是式[1]{式中,x1为-os(o)2n-c8h
17
,x2、x3及x4表示氢原子}所示的化合物。
[0251]
优选的别的方式是式[1]{式中,x1为-os(o)2ch2ch2cf3,x2、x3及x4表示氢原子}所示的化合物。
[0252]
优选的别的方式是式[1]{式中,x1为-os(o)2me,x2及x3为氢原子,x4表示硝基}所示的化合物。
[0253]
优选的别的方式是式[1]{式中,x1为-os(o)2me,x2及x3为氢原子,x4表示氟原子}所示的化合物。
[0254]
优选的别的方式是式[1]{式中,x1为-os(o)2me,x2及x3为氢原子,x4表示氯原子}所示的化合物。
[0255]
优选的别的方式是式[1]{式中,x1为-os(o)2me,x2及x3为氢原子,x4表示溴原子}所示的化合物。
[0256]
优选的别的方式是式[1]{式中,x1为-os(o)2me,x2及x3为氢原子,x4表示碘原子}所示的化合物。
[0257]
优选的别的方式是式[1]{式中,x1为-os(o)2me,x2及x3表示氢原子,x4表示二氟甲氧基}所示的化合物。
[0258]
优选的别的方式是式[1]{式中,x1及x4为-os(o)2me,x2及x3表示氢原子}所示的化合物。
[0259]
优选的别的方式是式[1]{式中,x1及x3、x4表示氢原子,x2表示-os(o)2me}所示的化合物。
[0260]
优选的一个方式是式[5]{式中,a表示2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基}所示的化合物。
[0261]
优选的别的方式是式[5]{式中,a表示2-[3、5-双(三氟甲基)-1h-吡唑-1-基]乙酰基}所示的化合物。
[0262]
优选的别的方式是式[5]{式中,a表示2-[3、5-双(二氟甲基)-1h-吡唑-1-基]乙酰基}所示的化合物。
[0263]
优选的别的方式是式[5]{式中,a表示2-(3、5-二甲基-1h-吡唑-1-基)乙酰基}所示的化合物。
[0264]
优选的别的方式是式[5]{式中,a表示2-(2、5-二甲基苯基)乙酰基}所示的化合物。
[0265]
优选的别的方式是式[5]{式中,a表示2-(2、5-二氟苯基)乙酰基}所示的化合物。
[0266]
优选的别的方式是式[5]{式中,a表示2-(2、5-二氯苯基)乙酰基}所示的化合物。
[0267]
优选的别的方式是式[5]{式中,a表示2-(2、5-二溴苯基)乙酰基}所示的化合物。
[0268]
优选的别的方式是式[5]{式中,a表示2-[2、5-双(三氟甲基)苯基]乙酰基}所示的化合物。
[0269]
优选的别的方式是式[5]{式中,a表示2-(5-溴-2-甲基苯基)乙酰基}所示的化合物。
[0270]
优选的别的方式是式[5]{式中,a表示2-[2-甲基-5-(三氟甲基)苯基]乙酰基}所示的化合物。
[0271]
优选的别的方式是式[5]{式中,a表示2-[2-氟-5-(三氟甲基)苯基]乙酰基}所示的化合物。
[0272]
优选的别的方式是式[5]{式中,a表示2-[2-氯-5-(三氟甲基)苯基]乙酰基}所示的化合物。
[0273]
优选的别的方式是式[5]{式中,a表示2-[2-溴-5-(三氟甲基)苯基]乙酰基}所示的化合物。
[0274]
优选的别的方式是式[5]{式中,x1、x2、x3及x4之中至少一个表示-os(o)2me}所示的化合物。
[0275]
优选的别的方式是式[5]{式中,x1表示-os(o)2me,x2、x3及x4表示氢原子}所示的化合物。
[0276]
优选的别的方式是式[5]{式中,x1表示-os(o)2et,x2、x3及x4表示氢原子}所示的化合物。
[0277]
优选的别的方式是式[5]{式中,x1表示-os(o)2n-pr,x2、x3及x4表示氢原子}所示的化合物。
[0278]
优选的别的方式是式[5]{式中,x1表示-os(o)2i-pr,x2、x3及x4表示氢原子}所示的化合物。
[0279]
优选的别的方式是式[5]{式中,x1表示-os(o)2c-pr,x2、x3及x4表示氢原子}所示的化合物。
[0280]
优选的别的方式是式[5]{式中,x1表示-os(o)2n-bu,x2、x3及x4表示氢原子}所示的化合物。
[0281]
优选的别的方式是式[5]{式中,x1表示-os(o)2n-c8h
17
,x2、x3及x4表示氢原子}所示的化合物。
[0282]
优选的别的方式是式[5]{式中,x1表示-os(o)2ch2ch2cf3,x2、x3及x4表示氢原子}所示的化合物。
[0283]
优选的别的方式是式[5]{式中,x1表示-os(o)2me,x2及x3表示氢原子,x4表示硝基}所示的化合物。
[0284]
优选的别的方式是式[5]{式中,x1表示-os(o)2me,x2及x3表示为氢原子,x4表示氟原子}所示的化合物。
[0285]
优选的别的方式是式[5]{式中,x1表示-os(o)2me,x2及x3表示氢原子,x4表示氯原子}所示的化合物。
[0286]
优选的别的方式是式[5]{式中,x1表示-os(o)2me,x2及x3表示氢原子,x4表示溴原子}所示的化合物。
[0287]
优选的别的方式是式[5]{式中,x1表示-os(o)2me,x2及x3表示氢原子,x4表示碘原子}所示的化合物。
[0288]
优选的别的方式是式[5]{式中,x1表示-os(o)2me,x2及x3表示氢原子,x4表示二氟
甲氧基}所示的化合物。
[0289]
优选的别的方式是式[5]{式中,x1及x4表示-os(o)2me,x2及x3表示氢原子}所示的化合物。
[0290]
优选的别的方式是式[5]{式中,x1及x3、x4表示氢原子,x2表示-os(o)2me}所示的化合物。
[0291]
以下,就本说明书中所记载的用语进行说明。
[0292]
所谓卤素原子,包含氟原子、氯原子、溴原子或碘原子。
[0293]
如c1~c6般的元素记号与下标数字所成的标记,表示接续于此所标记的基团的元素数为下标数字所示的范围。例如,此情况表示碳数为1~6,c2~c6的标记表示碳数为2~6。
[0294]
接续于c1~c6般的元素记号与下标数字所成的标记后有复合取代基被标记时,表示复合取代基全体的元素数为下标数字所示的范围。例如,c2~c6烷基羰基中,表示烷基羰基全体的碳数为2~6,且包含丙基羰基等。
[0295]
所谓烷基,在未特别限定下,意指碳数为1~8,优选碳数为1~6的直链或分支链状的烷基,可举例如甲基、乙基、n-丙基、异丁基、n-丁基、sec-丁基、异丁基、tert-丁基、n-戊基、1-甲基丁基、2-甲基丁基、3-甲基丁基、1-乙基丙基、1,1-二甲基丙基、1,2-二甲基丙基、新戊基、n-己基、1-甲基戊基、2-甲基戊基、3-甲基戊基、4-甲基戊基、1-乙基丁基、2-乙基丁基、1,1-二甲基丁基、1,2-二甲基丁基、1,3-二甲基丁基、2,2-二甲基丁基、2,3-二甲基丁基、3,3-二甲基丁基、1,1,2-三甲基丙基、1,2,2-三甲基丙基、1-乙基-1-甲基丙基、1-乙基-2-甲基丙基等的基团。此定义在没有其他定义的情况下,也可适用为例如卤代烷基、烷基硫代基、烷基羰基等的复合取代基的一部分的烷基。例如像烷基环烷基,在末端包含烷基的复合取代基的情况下,环烷基的该部分,也可通过相同或不同的烷基来独立地被单取代或多取代。末端具有其他基例如烯基、烷氧基、羟基、卤素等的复合取代基也是同样地解释。
[0296]
所谓环烷基,在未特别限定下,意指具有碳数为3~8优选碳数为3~6的分支链的环烷基,可举例如环丙基、1-甲基环丙基、2-甲基环丙基、环丁基、环戊基、环己基、4,4-二甲基环己基等的基团。此定义在没有其他定义的情况下,也可适用为例如卤环烷基等的复合取代基的一部分的环烷基。
[0297]“卤
…”
(例如,“卤代烷基”)中“卤”的用语包含氟、氯、溴及碘。与“卤”的接头语所示的卤取代包含单取代或多取代,优选单取代、二取代及三取代。
[0298]
所谓的卤代烷基,在未特别限定下,意指碳数为1~6的直链或分支链状的烷基,这些基团中的氢原子的一部或全部被卤素原子所取代的基团,可举例如氟甲基、氯甲基、溴甲基、碘甲基、二氟甲基、二氯甲基、二溴甲基、二碘甲基、三氟甲基、三氯甲基、三溴甲基、三碘甲基、1-氯乙基、1-溴乙基、2-三氟乙基、3-氯丙基、3-溴丙基、4-氯丁基、4-溴丁基、4-三氟丁基、5-氯戊基、6-氯己基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤代烷基羰基等的复合取代基的一部分的卤代烷基。
[0299]
所谓烯基,在未特别限定下,意指碳数为2~6的直链或分支链状的烯基,可举例如乙烯基、1-丙烯基、2-丙烯基、异丙烯基、3-丁烯基、1,3-丁二烯基、4-戊烯基、5-己烯基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤烯基等的复合取代基的一部分的烯基。
[0300]
所谓炔基,在未特别限定下,意指意指碳数为2~6的直链或分支链状的炔基,可举
例如乙炔基、1-丙炔基、2-丙炔基、3-丁炔基、1-甲基-3-丙炔基、4-戊炔基、5-己炔基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤炔基等的复合取代基的一部分的炔基。
[0301]
所谓烷氧基,在未特别限定下,意指碳数为1~6的直链或分支链状的烷氧基,可举例如甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、sec-丁氧基、tert-丁氧基、戊基氧基、己基氧基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤代烷氧基、烷氧基羰基等的复合取代基的一部分的烷氧基。
[0302]
所谓卤代烷氧基,在未特别限定下,意指被1个以上优选1~10个的卤素原子所取代的碳数为1~6的直链或分支链状的烷氧基,可举例如氟甲氧基、氯甲氧基、溴甲氧基、碘甲氧基、二氟甲氧基、二氯甲氧基、二溴甲氧基、二碘甲氧基、三氟甲氧基、三氯甲氧基、三溴甲氧基、三碘甲氧基、1-氯乙氧基、1-溴乙氧基、2-三氟乙氧基、3-氯丙氧基、3-溴丙氧基、4-氯丁氧基、4-溴丁氧基、4-三氟丁氧基、5-氯戊氧基、6-氯己基氧基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤代烷氧基羰基等的复合取代基的一部分的卤代烷氧基。
[0303]
所谓烷基硫代基,在未特别限定下,意指烷基部分为上述意义的碳数为1~6的(烷基)-s-基,可举例如甲基硫代基、乙基硫代基、n-丙基硫代基、异丙基硫代基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤代烷基硫代基等的复合取代基的一部分的烷基硫代基。
[0304]
所谓烷基亚磺酰基,在未特别限定下,意指烷基部分为上述意义的碳数为1~6的(烷基)-so-基,可举例如甲基亚磺酰基、乙基亚磺酰基、n-丙基亚磺酰基、异丙基亚磺酰基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤代烷基亚磺酰基等的复合取代基的一部分的烷基亚磺酰基。
[0305]
所谓烷基磺酰基,在未特别限定下,意指烷基部分为上述意义的碳数为1~6的(烷基)-so
2-基,可举例如甲基磺酰基、乙基磺酰基、n-丙基磺酰基、异丙基磺酰基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤烷基磺酰基等的复合取代基的一部分的烷基磺酰基。
[0306]
所谓羟基烷基,意指被1~5个的羟基所取代的碳原子数1~6的直链状或分枝状的烷基,可举例如羟基甲基、羟基乙基、羟基丙基或羟基异丙基等。
[0307]
所谓烷基羰基,在未特别限定下,意指烷基部分为上述意义的(烷基)-c(=o)-基,可举例如甲酰基、乙酰基、丙酰基、丁酰基、三甲基乙酰基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤烷基羰基等的复合取代基的一部分的烷基羰基。
[0308]
所谓烷基羰基氧基,在未特别限定下,意指烷基部分为上述意义的(烷基)-c(=o)o-基,可举例如甲基羰基氧基、乙基羰基氧基、丙基羰基氧基等的基团。此定义在没有其他定义的情况下,也可适用于例如作为卤烷基羰基氧基等的复合取代基的一部分的烷基羰基氧基。
[0309]
本发明所谓在反应中使用的酸,在未特别说明的下,意指反应系中放出质子的布忍斯特酸,可例示出盐酸、氢溴酸、硫酸等的无机酸、乙酸、三氟乙酸、p-甲苯磺酸、三氟甲烷磺酸等的有机酸。本发明的反应中使用的路易斯酸,意指在氢离子以外于反应系中作为电子对受体发挥作用的化合物,可例示如氯化锌、氯化铝、氯化锡、三氯化硼、三氟化硼、三氟
甲烷磺酸三甲基硅烷基酯等。
[0310]
本发明的反应中使用的碱,在未特别说明的下,意指反应系中接受质子的化合物,或于反应系中作为电子对供体发挥作用的化合物,可例示出三乙基胺、吡啶、4-二甲基氨基吡啶、n,n-二甲基苯胺、1,8-二氮杂双环[5,4,0]-7-十一烯等的有机胺类;碳酸钠、碳酸钾、碳酸镁、碳酸钙等的金属碳酸盐类;碳酸氢钠、碳酸氢钾等的金属碳酸氢盐类;乙酸钠、乙酸钾、乙酸钙、乙酸镁等的金属乙酸盐类所代表的羧酸金属盐类;钠甲氧化物、钠乙氧化物、钠第三丁氧化物、钾甲氧化物、钾第三丁氧化物等的金属烷氧化物;氢氧化钠、氢氧化钾、氢氧化钙、氢氧化镁等的金属氢氧化物;氢化锂、氢化钠、氢化钙等的金属氢化物等。
[0311]
本发明的反应中使用的离子液体,可例示出1-丁基-3-甲基咪唑鎓四氟硼酸盐、1-丁基-2,3-二甲基咪唑鎓四氟硼酸盐、1-乙基-3-甲基咪唑鎓四氟硼酸盐、1-己基-3-甲基咪唑鎓四氟硼酸盐、1-乙基-3-甲基咪唑鎓甲烷磺酸盐、1-丁基-3-甲基咪唑鎓三氟甲烷磺酸盐、1-丁基-2,3-二甲基咪唑鎓三氟甲烷磺酸盐、1-乙基-3-甲基咪唑鎓三氟甲烷磺酸盐、1-己基-3-甲基咪唑鎓三氟甲烷磺酸盐等的咪唑鎓盐类;四丁基铵氟化物、四丁基铵氯化物、四丁基铵溴化物、四丁基铵碘化物等的铵盐类等。
[0312]
本说明书中,表中的以下标记各自相当于下述的基团。
[0313]
例如,
[0314]
me表示甲基,
[0315]
et表示乙基,
[0316]
n-pr表示n-丙基,
[0317]
i-pr表示异丙基,
[0318]
c-pr表示环丙基,
[0319]
n-bu表示n-丁基。
[0320]
将式[1]所示的化合物的代表性制造方法例示于下,但并不受限于这些方法。
[0321]
《制造方法1》
[0322]
式[1]所示的化合物,可通过下述例示的反应式而成的方法来制造。
[0323]
[化17]
[0324][0325]
(式中,x1、x2、x3、x4、l1及l2各自如(1)及(3)中所定义。)
[0326]
(步骤1)
[0327]
式[3]的化合物,使式[4]的化合物于卤素化试剂的存在下在溶剂中反应而制造。
[0328]
作为本步骤中可使用的卤素化试剂,可举例如氯或硫酰氯、n-氯丁二酰亚胺等的氯化试剂;溴或n-溴丁二酰亚胺等的溴化试剂。
[0329]
本步骤中,为了使自由基反应开始,也可进行光照射,或添加偶氮异丁腈、过氧化苯甲酰基等的自由基引发剂。
[0330]
本步骤中使用的卤素化试剂的使用量,相对于式[4]的化合物1摩尔,可由2.0~10摩尔的范围适当地选择,优选2.0~3.0摩尔。
[0331]
作为本步骤中可使用的溶剂,若为不阻碍本反应的进行即可,可使用例如乙腈等的腈类;二乙基醚、二异丙基醚、四氢呋喃、二氧陆圜、乙二醇二甲醚、二乙二醇二甲醚等的醚类;二氯甲烷、二氯乙烷、氯仿、四氯化碳、四氯乙烷等的卤素化烃类;苯、氯苯、硝基苯、甲苯等的芳香族烃类;n,n-二甲基甲酰胺、n,n-二甲基乙酰胺等的酰胺类;1,3-二甲基-2-咪唑啉酮等的咪唑啉酮类;二甲基亚砜等的硫化合物类等,再者,也可使用这些的混合溶剂。
[0332]
溶剂的使用量,相对于式[4]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0333]
反应温度若由-20℃至使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~100℃的范围进行。
[0334]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0335]
作为反应目的物的式[3]的化合物,于反应终了后,可通过既定的方法从反应系中取得,视需要可通过柱色谱、重结晶等的操作予以纯化。
[0336]
另外,通过本步骤所得的式[3]的化合物,于反应终了后,也可不进行分离及纯化操作而使用步骤2的反应。
[0337]
(步骤2)
[0338]
式[2]的化合物可使式[3]所示的化合物在金属乙酸盐类存在下于溶剂中反应所制造。
[0339]
作为本步骤中可使用的金属乙酸盐类,可举例如乙酸锂或乙酸钠、乙酸钾等。
[0340]
本步骤中使用的金属乙酸盐类的使用量,相对于式[3]的化合物1摩尔,可由2.0~10摩尔的范围适当地选择,优选2.0~3.0摩尔。
[0341]
作为本步骤中可使用的溶剂,可举出于制造方法1、步骤1中所说明同样者。
[0342]
溶剂的使用量,相对于式[3]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0343]
反应温度若由-20℃至使用的惰性溶剂的沸点域的范围选择即可,优选可以0℃~100℃的范围进行。
[0344]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0345]
通过本步骤所得的式[2]的化合物于反应终了后,可通过既定的方法从反应系中取得,且视需要可通过柱色谱、重结晶等的操作予以纯化。
[0346]
另外,通过本步骤所得的式[2]的化合物于反应终了后,可不进行分离及纯化操作而使用于步骤3的反应。
[0347]
(步骤3)
[0348]
式[1]的化合物可使式[2]所示的化合物于酸、酰氯化物或碱存在下在水及溶剂中反应而制造。
[0349]
作为本步骤中可使用的酸方面,可举例如盐酸、氢溴酸、硫酸等的无机酸;乙酸、三氟乙酸、p-甲苯磺酸、三氟甲烷磺酸等的有机酸等。
[0350]
酸的使用量相对于式[2]的化合物1摩尔,由0.1~10摩尔的范围适当地选择,优选0.1~5.0摩尔。
[0351]
作为本步骤中可使用的酰氯化物,可举例如乙酰氯化物、苯甲酰基氯化物等。
[0352]
酰氯化物的使用量相对于式[2]的化合物1摩尔,由0.1~10摩尔的范围适当地选
择,优选0.1~5.0摩尔。
[0353]
本步骤中可使用的碱方面,可举例如三乙基胺、吡啶、4-二甲基氨基吡啶、n,n-二甲基苯胺、1,8-二氮杂双环[5,4,0]-7-十一烯等的有机胺类;碳酸钠、碳酸钾、碳酸镁、碳酸钙等的金属碳酸盐类;碳酸氢钠、碳酸氢钾等的金属碳酸氢盐类;乙酸钠、乙酸钾、乙酸钙、乙酸镁等的金属乙酸盐类所代表的羧酸金属盐类;钠甲氧化物、钠乙氧化物、钠第三丁氧化物、钾甲氧化物、钾第三丁氧化物等的金属烷氧化物;氢氧化钠、氢氧化钾、氢氧化钙、氢氧化镁等的金属氢氧化物;氢化锂、氢化钠、氢化钙等的金属氢化物等,优选碳酸钠、碳酸钾、碳酸镁、碳酸钙等的金属碳酸盐类。
[0354]
碱的使用量相对于式[2]的化合物1摩尔,由0.2~10摩尔的范围适当地选择,优选0.2~5.0摩尔。
[0355]
作为本步骤中可使用的溶剂,可举出水及于制造方法1、步骤1中所说明同样者。
[0356]
溶剂的使用量相对于式[2]的化合物1摩尔,由0.01~100l的范围适当地选择,优选0.1~10l。
[0357]
水的使用量相对于式[2]的化合物1摩尔,由0.01~100l的范围适当地选择,优选0.1~10l。
[0358]
反应温度若由-20℃起从使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~100℃的范围进行。
[0359]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0360]
作为反应目的物的式[1]的化合物,于反应终了后,可通过既定的方法从反应系中取得,且视需要可通过柱色谱、重结晶等的操作予以纯化。
[0361]
《制造方法2》
[0362]
式[1]所示的化合物可通过下述例示的反应式所成的方法来制造。
[0363]
[化18]
[0364][0365]
(式中,x1、x2、x3、x4、l1及l2各自如(1)及(3)中所定义。)
[0366]
式[1]的化合物是使式[3]所示的化合物于金属乙酸盐类存在下在溶剂中反应(步骤1),之后,于步骤1的反应液中加入醇、水及碱使其反应(步骤2)而得以制造。
[0367]
(步骤1)
[0368]
作为本步骤中可使用的金属乙酸盐类,可举出于制造方法1、步骤2中所说明同样者。
[0369]
本步骤中使用的金属乙酸盐类的使用量,相对于式[3]的化合物1摩尔,可由2.0~10摩尔的范围适当地选择,优选2.0~3.0摩尔。
[0370]
作为本步骤中可使用的溶剂,可举出于制造方法1、步骤1中所说明同样者。
[0371]
溶剂的使用量,相对于式[3]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0372]
反应温度若由-20℃起从使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~100℃的范围进行。
[0373]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0374]
(步骤2)
[0375]
式[1]的化合物,可于通过制造方法2、步骤1所得的反应液中加入醇、水及碱使其反应而制造。
[0376]
作为本步骤中可使用的醇,可举例如,甲醇或乙醇等。
[0377]
醇的使用量,相对于式[3]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0378]
水的使用量,相对于式[3]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0379]
作为本步骤中可使用的碱,可举出与制造方法1、步骤3中所说明的同样者。
[0380]
碱的使用量,相对于式[3]的化合物1摩尔,可由0.2~10摩尔的范围适当地选择,优选0.2~5.0摩尔。
[0381]
反应温度若由-20℃起从使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~100℃的范围进行。
[0382]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0383]
作为反应目的物的式[1]的化合物,于反应终了后,可通过既定的方法从反应系中取得,且视需要可通过柱色谱、重结晶等的操作予以纯化。
[0384]
《制造方法3》
[0385]
式[1]所示的化合物可通过下述例示的反应式所成的方法来制造。
[0386]
[化19]
[0387][0388]
(式中,x1、x2、x3、x4、l1及l2各自如(1)及(3)中所定义。)
[0389]
式[1]的化合物是使式[3]的化合物于碱、离子液体及金属硫酸盐类的存在下或不存在下在水中或水与有机溶剂的混合溶剂中反应,优选于碱或金属硫酸盐类存在下在水中或水与有机溶剂的混合溶剂中使其反应,更优选为在水中或水与有机溶剂的混合溶剂中使其反应而得以制造。
[0390]
作为本步骤中可使用的碱,可举例如三乙基胺、吡啶、4-二甲基氨基吡啶、n,n-二甲基苯胺、1,8-二氮杂双环[5,4,0]-7-十一烯等的有机胺类;碳酸钠、碳酸钾、碳酸镁、碳酸钙等的金属碳酸盐类;碳酸氢钠、碳酸氢钾等的金属碳酸氢盐类;乙酸钠、乙酸钾、乙酸钙、乙酸镁等的金属乙酸盐类所代表的羧酸金属盐类;钠甲氧化物、钠乙氧化物、钠第三丁氧化物、钾甲氧化物、钾第三丁氧化物等的金属烷氧化物;氢氧化钠、氢氧化钾、氢氧化钙、氢氧化镁等的金属氢氧化物;氢化锂、氢化钠、氢化钙等的金属氢化物等,优选碳酸钠、碳酸钾、碳酸镁、碳酸钙等的金属碳酸盐类;碳酸氢钠、碳酸氢钾等的金属碳酸氢盐类。
[0391]
本反应中使用的碱的使用量,相对于式[3]的化合物1摩尔,可由0~100摩尔的范围适当地选择,优选0~10摩尔。
[0392]
本步骤中可使用的离子液体方面,可举例如1-丁基-3-甲基咪唑鎓四氟硼酸盐、1-丁基-2,3-二甲基咪唑鎓四氟硼酸盐、1-乙基-3-甲基咪唑鎓四氟硼酸盐、1-己基-3-甲基咪唑鎓四氟硼酸盐、1-乙基-3-甲基咪唑鎓甲烷磺酸盐、1-丁基-3-甲基咪唑鎓三氟甲烷磺酸盐、1-丁基-2,3-二甲基咪唑鎓三氟甲烷磺酸盐、1-乙基-3-甲基咪唑鎓三氟甲烷磺酸盐、1-己基-3-甲基咪唑鎓三氟甲烷磺酸盐等的咪唑鎓盐类;四丁基铵氟化物、四丁基铵氯化物、四丁基铵溴化物、四丁基铵碘化物等的铵盐类。
[0393]
本反应中使用的离子液体的使用量,相对于式[3]的化合物1摩尔,可由0~100摩尔的范围适当地选择,优选0~10摩尔。
[0394]
本步骤中可使用的金属硫酸盐类方面,可举例如硫酸铜(ⅱ)、硫酸铁(ⅲ)等。
[0395]
本反应中使用的金属硫酸盐类的使用量,相对于式[3]的化合物1摩尔,可由0~100摩尔的范围适当地选择,优选0~1.0摩尔。
[0396]
作为本步骤中可使用的溶剂,可举出水及于制造方法1、步骤1中所说明同样者。
[0397]
溶剂的使用量,相对于式[3]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0398]
反应温度若由-20℃起从使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~100℃的范围进行。
[0399]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0400]
作为反应目的物的式[1]的化合物于反应终了后,可通过既定的方法从反应系中取得,且视需要可通过柱色谱、重结晶等的操作予以纯化。
[0401]
《制造方法4》
[0402]
式[5]所示的本发明化合物可通过下述例示的反应式所成的方法来制造。
[0403]
[化20]
[0404][0405]
(式中,a如(26)中所定义,x1、x2、x3及x4如(1)所定义。)
[0406]
可通过使式[1]所示的化合物与式[6]所示的化合物于溶剂中、酸或路易斯酸的存在下,优选于酸的存在下反应,来制造式[5]所示的本发明化合物。
[0407]
本步骤中使用的式[1]的化合物的使用量,相对于式[6]的化合物1摩尔,可由1.0~10摩尔的范围适当地选择,优选1.0~3.0摩尔。
[0408]
作为本步骤中可使用的酸,可举例如盐酸、氢溴酸、硫酸等的无机酸、乙酸、三氟乙酸、p-甲苯磺酸、三氟甲烷磺酸等的有机酸等。
[0409]
作为本步骤中可使用的路易斯酸,可举例如氯化锌、氯化铝、氯化锡、三氯化硼、三氟化硼、三氟甲烷磺酸三甲基硅烷基等。
[0410]
酸或路易斯酸的使用量,相对于式[6]的化合物1摩尔,可由0.01~5摩尔的范围适当地选择,优选0.1~1.0摩尔。
[0411]
作为本步骤中可使用的溶剂,可举出于制造方法1、步骤1中所说明同样者。
[0412]
溶剂的使用量,相对于式[6]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0413]
反应温度若由-20℃起从使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~150℃的范围来进行。
[0414]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0415]
作为反应目的物的式[5]的化合物,于反应终了后,可通过既定的方法从反应系中取得,且视需要可通过柱色谱、重结晶等的操作予以纯化。
[0416]
《中间体制造方法1》
[0417]
[化21]
[0418][0419]
(式中,a如(26)中所定义,l3表示氯原子、溴原子等的卤素原子。)
[0420]
(步骤1)
[0421]
式[6]的化合物可通过使式[7]的化合物与式[8]的化合物于碱的存在下或不存在下、脱水缩合剂存在下在溶剂中反应而制造。
[0422]
本步骤中使用的式[8]的化合物的使用量,相对于式[7]的化合物1摩尔,可由0.5~10摩尔的范围适当地选择,优选1.0~1.2摩尔。
[0423]
作为本步骤中可使用的脱水缩合剂,可举出二环己基碳二酰亚胺(dcc)、n-(3-二甲基氨基丙基)-n’―乙基碳二酰亚胺(edc或wsc)、n,n-羰基二咪唑、2-氯-1,3-二甲基咪唑鎓氯化物、碘化-2-氯-1-吡啶鎓等。
[0424]
本反应中使用的脱水缩合剂的使用量,相对于式[7]的化合物1摩尔,可由1.0~10摩尔的范围适当地选择,优选1.0~3.0摩尔。
[0425]
作为本步骤中可使用的碱,可举例如三乙基胺、吡啶、4-二甲基氨基吡啶、n,n-二甲基苯胺、1,8-二氮杂双环[5,4,0]-7-十一烯等的有机胺类;碳酸钠、碳酸钾、碳酸镁、碳酸钙等的金属碳酸盐类;碳酸氢钠、碳酸氢钾等的金属碳酸氢盐类;乙酸钠、乙酸钾、乙酸钙、乙酸镁等的金属乙酸盐类所代表的羧酸金属盐类;钠甲氧化物、钠乙氧化物、钠第三丁氧化物、钾甲氧化物、钾第三丁氧化物等的金属烷氧化物;氢氧化钠、氢氧化钾、氢氧化钙、氢氧
化镁等的金属氢氧化物;氢化锂、氢化钠、氢化钙等的金属氢化物等。
[0426]
本反应中使用的碱的使用量,相对于式[7]的化合物1摩尔,可由0~100摩尔的范围适当地选择,优选0~10摩尔。
[0427]
作为本步骤中可使用的溶剂,可举出于制造方法1、步骤1中所说明同样者。
[0428]
本反应中使用的溶剂的使用量,相对于式[7]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0429]
反应温度若由-20℃起从使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~100℃的范围进行。
[0430]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0431]
作为反应目的物的式[6]的化合物,于反应终了后,可通过既定的方法从反应系中取得,且视需要可通过柱色谱、重结晶等的操作予以纯化。
[0432]
(步骤2)
[0433]
式[6]的化合物也可通过使式[7]的化合物与式[9]的化合物于碱的存在下在溶剂中反应而制造。
[0434]
本步骤中使用的式[9]的化合物的使用量,相对于式[7]的化合物1摩尔,可由0.5~10摩尔的范围适当地选择,优选1.0~1.2摩尔。
[0435]
本步骤中可使用的碱方面,中间体可举出于制造方法1、步骤1中所说明同样者。
[0436]
本反应中使用的碱的使用量,相对于式[7]的化合物1摩尔,可由0~100摩尔的范围适当地选择,优选0~10摩尔。
[0437]
作为本步骤中可使用的溶剂,可举出于制造方法1、步骤1中所说明同样者。
[0438]
本步骤中使用的溶剂的使用量,相对于式[7]的化合物1摩尔,可由0.01~100l的范围适当地选择,优选0.1~10l。
[0439]
反应温度若由-20℃起从使用的惰性溶剂的沸点域的范围选择即可,优选可于0℃~100℃的范围进行。
[0440]
反应时间虽视反应温度、反应基质、反应量等而异,但通常为10分~48小时。
[0441]
作为反应目的物的式[6]的化合物,于反应终了后,可通过既定的方法从反应系中取得,且视需要可通过柱色谱、重结晶等的操作予以纯化。
[0442]
制备式[1]、式[2]、式[3]、式[4]或式[5]的化合物用的上述几个试剂及反应条件,会被设定为不适合存在于中间体的特定官能基的情况。这些的例中,通过于合成中导入保护/去保护的手法或官能基的相互转换,可获得所期望的生成物。有关保护基的使用与选项,若为化学合成领域的技术人员自可明白(例如,参考t.w.greene及p.g.wuts着、protective groups in organic synthesis、第4版;wiley:new york、2007)。视情况,如各个流程图中所说明的,将特定的试剂导入后,为了完成式[1]、式[2]、式[3]、式[4]或式[5]的化合物的合成,可能有必要追加实行未说明的既定方法的合成步骤,此乃本领域技术人员所认知的。以为了制备式[1]、式[2]、式[3]、式[4]或式[5]的化合物所提案显示出特定顺序之外,本领域技术人员也认识到,也可能必须依序施行上述流程图例示的步骤的组合。
[0443]
【实施方式】
[0444]
[实施例]
[0445]
以下列举实施例以进一步说明本发明,但即使未详细地说明,若为本领域技术人
员被认为可最大限度地利用本发明。因此,以下的实施例可单解释成例示者,并不受限于本文公开。以下的例中的步骤是说明全体的合成展开中各步骤的程序,各步骤的起始原料,若依据其它例或步骤中所载程序的特定的制备的实施,未必需要经过制备。
[0446]
此外,以下的说明中,“%”表示重量百分率,“份”表示重量份。
[0447]
[实施例1]3-甲基磺酰基氧基-1,2-苯二甲醇(化合物1-1)的制备
[0448]
步骤1:1-甲基磺酰基氧基-2,3-二甲基苯的制备
[0449]
使2,3-二甲基苯酚(10g)溶解于四氢呋喃(125ml),并加入三乙基胺(9.1g)。之后,于冰冷下,加入甲烷磺酰基氯化物(10.26g)并于室温搅拌一晚。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(16.39g、产率100%)。
[0450]1h-nmr(cdcl3/tmsδ(ppm)值):2.26(s,3h)、2.31(s,3h)、3.17(s,3h)、7.11~7.15(m,3h)。
[0451]
步骤2:1-甲基磺酰基氧基-2,3-双(溴甲基)苯的制备
[0452]
上述实施例1的步骤1中,使所得的生成物(16.39g)溶解于四氯化碳(300ml),加入n-溴丁二酰亚胺(32.05g)与2,2
′‑
偶氮二异丁腈(671mg),加热回流4小时。将反应液冷却至室温为止之后,使用硅藻土过滤,减压下馏去溶剂,由此获得标题化合物(29.3g、产率100%)。
[0453]1h-nmr(cdcl3/tmsδ(ppm)值):3.20(s,3h)、4.87(s,2h)、5.00(s,2h)、7.04(d,1h)、7.16~7.23(m,2h)。
[0454]
步骤3:1-甲基磺酰基氧基-2,3-双(乙酰基氧基甲基)苯的制备
[0455]
上述实施例1的步骤2中,使所得的生成物(506mg)溶解于n,n-二甲基甲酰胺(2.8ml),并加入乙酸钠(241mg),在室温搅拌一晚。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(380mg、产率85%)。
[0456]1h-nmr(cdcl3/tmsδ(ppm)值):2.07(s,3h)、2.11(s,3h)、3.28(s,3h)、5.25(s,2h)、5.30(s,2h)、7.40~7.43(m,3h)。
[0457]
另外,标题化合物也可通过以下的步骤3a及步骤3b来制备。
[0458]
步骤3a:1-甲基磺酰基氧基-2,3-双(氯甲基)苯的制备
[0459]
上述实施例1的步骤1中,使所得的生成物(1g)溶解于氯苯(25ml),并加入2,2
′‑
偶氮二异丁腈(0.05g)。将反应液升温至90℃,于反应液中通入氯气(相对于起始物质为3.15当量)。将反应液冷却至室温为止之后,减压下馏去溶剂,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0460]1h-nmr(cdcl3/tmsδ(ppm)值):3.29(s,3h)、4.75(s,2h)、4.84(s,2h)、7.38-7.51(m,3h)。
[0461]
步骤3b:1-甲基磺酰基氧基-2,3-双(乙酰基氧基甲基)苯的代替性制备
[0462]
上述实施例1的步骤3a中,使所得的粗生成物(630mg)溶解于甲苯(23ml),并加入乙酸钠(480mg)与四丁基铵溴化物(75mg),于80℃搅拌7小时。将反应液冷却至室温为止之后,加入水,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/
isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:40%来溶出)进行纯化,由此得到标题化合物(310mg)。
[0463]
步骤4:3-甲基磺酰基氧基-1,2-苯二甲醇的制备
[0464]
上述实施例1的步骤3中,使所得的生成物(17g)溶解于甲醇(160ml)、四氢呋喃(160ml),并于冰冷下,加入水(40ml)、碳酸钾(15.23g),搅拌3小时。减压下馏去溶剂,加入水,使用乙酸乙基酯进行萃取。将有机层以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(12.18g、产率98%)。
[0465]1h-nmr(dmso-d6/tmsδ(ppm)值):3.42(s,3h)、4.57(d,2h)、4.70(d,2h)、4.98(t,1h)、5.27(t,1h)、7.25(d,1h)、7.36(t,1h)、7.46(d,1h)。
[0466]
另外,标题化合物也可通过以下的步骤4a来制备。
[0467]
步骤4a:3-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0468]
上述实施例1的步骤2中,于所得的生成物(502mg)中加入水(5.6ml),加热回流6小时。将反应液冷却至室温为止之后,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(325mg、产率100%)。
[0469]
[实施例2]3-甲基磺酰基氧基-6-硝基-1,2-苯二甲醇(化合物1-14)的制备
[0470]
步骤1:1-甲基磺酰基氧基-2,3-二甲基-4-硝基苯的制备
[0471]
使2,3-二甲基-4-硝基苯酚(25g)溶解于四氢呋喃(500ml),并加入三乙基胺(16.7g)。之后,于冰冷下加入甲烷磺酰基氯化物(18.93g),使其与实施例1的步骤1的制备同样地反应,通过后处理而得标题化合物(34.98g、产率95%)。
[0472]1h-nmr(cdcl3/tmsδ(ppm)值):2.36(s,3h)、2.44(s,3h)、3.26(s,3h)、7.30(d,1h)、7.67(d,1h)。
[0473]
步骤2:1-甲基磺酰基氧基-2,3-双(溴甲基)-4-硝基苯的制备
[0474]
上述实施例2的步骤1中,使所得的生成物(2.92g)溶解于1,2-二氯乙烷(140ml),加入n-溴丁二酰亚胺(8.43g)与2,2
′‑
偶氮二异丁腈(195mg),加热回流8小时。将反应液冷却至室温为止之后,静置一晚,将析出的固体过滤之后,减压下馏去溶剂,由此获得标题化合物(4.8g、产率100%)。
[0475]1h-nmr(cdcl3/tmsδ(ppm)值):3.42(s,3h)、4.73(s,2h)、4.84(s,2h)、7.62(d,1h)、7.98(d,1h)。
[0476]
步骤3:1-甲基磺酰基氧基-2,3-双(乙酰基氧基甲基)-4-硝基苯的制备
[0477]
上述实施例2的步骤2中,使所得的生成物(4.8g)溶解于n,n-二甲基甲酰胺(50ml),加入乙酸钠(1.75g),在室温搅拌一晚。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:40%来溶出)进行纯化,由此得到标题化合物(2.8g、产率65%)。
[0478]1h-nmr(cdcl3/tmsδ(ppm)值):2.04(s,3h)、2.08(s,3h)、3.36(s,3h)、5.37(s,2h)、5.47(s,2h)、7.60(d,1h)、7.89(d,1h)。
[0479]
步骤4:3-甲基磺酰基氧基-6-硝基-1,2-苯二甲醇的制备
[0480]
上述实施例2的步骤3中,使所得的生成物(2.8g)溶解于甲醇(80ml)、四氢呋喃(80ml),冰冷下,加入水(20ml)、碳酸钾(1.9g),搅拌2小时。于反应液中加入1当量的盐酸,减压下馏去溶剂,加入水,使用乙酸乙基酯进行萃取。将有机层以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:50%来溶出)来进行纯化,由此获得标题化合物(1.59g、产率74%)。
[0481]1h-nmr(cdcl3/tmsδ(ppm)值):3.05-3.12(m,2h)、3.36(s,3h)、4.91(dd,4h)、7.48(d,1h)、7.89(d,1h)。
[0482]
[实施例3]3-氟-6-甲基磺酰基氧基-1,2-苯二甲醇(化合物1-3)的制备
[0483]
步骤1:1-氨基-2,3-二甲基-4-甲基磺酰基氧基苯的制备
[0484]
上述实施例2的步骤1中,使将所得的生成物(10g)溶解于甲醇(200ml),并加入钯/碳(2g、钯含有量10%、约55%水湿润品),于氢氛围下,在室温搅拌24小时。将反应液使用硅藻土过滤,减压下馏去溶剂,由此获得标题化合物(8.43g、产率96%)。
[0485]1h-nmr(cdcl3/tmsδ(ppm)值):2.09(s,3h)、2.26(s,3h)、3.12(s,3h)、3.64(brs,2h)、6.54(d,1h)、6.98(d,1h)。
[0486]
另外,标题化合物也可通过以下的步骤1a来制备。
[0487]
步骤1a:1-氨基-2,3-二甲基-4-甲基磺酰基氧基苯的代替性制备
[0488]
使2,3-二甲基-4-硝基苯酚(25.3g)溶解于乙酸乙基酯(300ml),并加入三乙基胺(16.8g)。之后,于冰冷下加入甲烷磺酰基氯化物(18.2g),在室温搅拌30分钟。于反应液中加入钯/碳(8g、钯含有量10%、约55%水湿润品),于氢氛围下,在室温搅拌24小时。将反应液使用硅藻土过滤,减压下馏去溶剂,由此获得标题化合物(33g、产率100%)。
[0489]
步骤2:2,3-二甲基-4-甲基磺酰基氧基苯重氮四氟硼酸盐的制备
[0490]
上述实施例3的步骤1中,使所得的生成物(15.6g)溶解于48%四氟硼酸水溶液(84ml)、水(120ml)中,并于冰冷下花费10分钟加入将亚硝酸钠(5.1g)溶解于水(12ml)中所成的水溶液,在冰冷下搅拌1小时半。过滤反应液,将所得的个体以二乙基醚洗净之后,予以干燥,由此获得标题化合物(19.5g、产率86%)。
[0491]
步骤3:1-氟-2,3-二甲基-4-甲基磺酰基氧基苯的制备
[0492]
上述实施例3的步骤2中,于所得的生成物(0.5g)中加入1-丁基-3-甲基咪唑鎓四氟硼酸盐(1.8g),在80℃搅拌2小时。将反应液冷却至室温为止之后,使用甲苯进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(0.29g、产率83%)。
[0493]1h-nmr(cdcl3/tmsδ(ppm)值):2.21(d,3h)、2.28(s,3h)、3.18(s,3h)、6.90(t,1h)、7.11(dd,1h)。
[0494]
另外,标题化合物也可通过以下的步骤3a或步骤3b来制备。
[0495]
步骤3a:1-氟-2,3-二甲基-4-甲基磺酰基氧基苯的代替性制备
[0496]
上述实施例3的步骤1中,于所得的生成物(1g)中在冰冷下加入氟化氢吡啶(8ml),之后,少量逐次地添加亚硝酸钠(355mg),搅拌30分钟。然后,在55℃搅拌1小时半。将反应液冷却至室温为止之后,使用二乙基醚进行萃取。将有机层以饱和碳酸氢钠水溶液及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物
(0.75g、产率74%)。
[0497]
步骤3b:1-氟-2,3-二甲基-4-甲基磺酰基氧基苯的代替性制备
[0498]
使2,3-二甲基-4-氟苯酚(200mg)溶解于乙酸乙基酯(5ml),并添加三乙基胺(174mg)。然后,于室温添加甲烷磺酰基氯化物(180mg)并搅拌30分钟。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(290mg、产率93%)。
[0499]
步骤4:1-氟-2,3-双(溴甲基)-4-甲基磺酰基氧基苯的制备
[0500]
上述实施例3的步骤3中,使所得的生成物(1.48g)溶解于氯苯(15ml),并加入水(8ml)、2,2
′‑
偶氮二异丁腈(0.11g)。将反应液升温至80℃,花费30分钟添加将溴(1ml)溶解于氯苯(15ml)所得的溶液,再进一步于80℃搅拌1小时半。将反应液冷却至室温为止之后,使用乙酸乙基酯进行萃取。将有机层以水及硫代硫酸钠水溶液、饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(2.45g、产率96%)。
[0501]1h-nmr(cdcl3/tmsδ(ppm)值):3.33(s,3h)、4.65(d,2h)、4.68(s,2h)、7.12(t,1h)、7.42(dd,1h)。
[0502]
步骤5:1-氟-2,3-双(乙酰基氧基甲基)-4-甲基磺酰基氧基苯的制备
[0503]
上述实施例3的步骤4中,使所得的生成物(16.71g)溶解于n,n-二甲基甲酰胺(50ml),加入乙酸钠(7.65g),使其与实施例2的步骤3的制备同样地反应,并予以纯化,由此获得标题化合物(11.81g、产率80%)。
[0504]1h-nmr(cdcl3/tmsδ(ppm)值):2.06(s,3h)、2.07(s,3h)、3.29(s,3h)、5.29(d,2h)、5.31(s,2h)、7.17(t,1h)、7.44(dd,1h)。
[0505]
另外,标题化合物也可通过以下的步骤5a及步骤5b来制备。
[0506]
步骤5a:1-氟-2,3-双(氯甲基)-4-甲基磺酰基氧基苯的制备
[0507]
上述实施例3的步骤3中,使所得的生成物(1g)溶解于氯苯(25ml),并加入2,2
′‑
偶氮二异丁腈(0.08g)。将反应液升温至88℃,于反应液中通入氯气(相对于起始物质为4.1当量)。将反应液冷却至室温为止之后,减压下馏去溶剂,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0508]1h-nmr(cdcl3/tmsδ(ppm)值):3.33(s,3h)、4.79(s,2h)、4.82(s,2h)、7.14-7.19(m,1h)、7.44-7.47(m,1h)。
[0509]
步骤5b:1-氟-2,3-双(乙酰基氧基甲基)-4-甲基磺酰基氧基苯的代替性制备
[0510]
上述实施例3的步骤5a中,使所得的粗生成物(2g)溶解于甲苯(20ml),并加入乙酸钠(1.32g)与四丁基铵溴化物(225mg),在80℃搅拌5小时。将反应液冷却至室温为止之后,加入饱和食盐水,使用甲苯进行萃取。将有机层以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:35%来溶出)来进行纯化,由此获得标题化合物(1.47g)。
[0511]
步骤6:3-氟-6-甲基磺酰基氧基-1,2-苯二甲醇的制备
[0512]
上述实施例3的步骤5中,使所得的生成物(7.19g)溶解于甲醇(20ml),并于冰冷下,加入水(4ml)、碳酸钾(6.53g),搅拌15分钟。减压下馏去溶剂,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由
此获得标题化合物(5.38g、产率100%)。
[0513]1h-nmr(cdcl3/tmsδ(ppm)值):3.27(s,3h)、3.53(brs,1h)、3.65(brs,1h)、4.80(s,2h)、4.84(s,2h)、7.11(dd,1h)、7.26-7.29(m,1h)。
[0514]
另外,标题化合物也可通过以下的步骤6a、6b、6c、6d或6e来制备。
[0515]
步骤6a:3-氟-6-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0516]
上述实施例3的步骤4中,使所得的生成物(10g)溶解于n,n-二甲基甲酰胺(27ml),加入乙酸钠(4.58g),在50℃搅拌4小时。将反应液冷却至室温为止之后加入甲醇(20ml)、水(5ml)、碳酸钾(7.73g),搅拌2小时。于反应液中加入水之后,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(6.43g、产率97%)。
[0517]
步骤6b:3-氟-6-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0518]
上述实施例3的步骤4中,于所得的生成物(0.38g)中加入水(10ml),加热回流6小时。将反应液冷却至室温为止之后,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(0.23g、产率92%)。
[0519]
步骤6c:3-氟-6-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0520]
上述实施例3的步骤4中,使所得的生成物(10g)溶解于n,n-二甲基甲酰胺(27ml),加入水(240ml),在100℃搅拌3小时。将反应液冷却至室温为止之后,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(6.66g、产率100%)。
[0521]
步骤6d:3-氟-6-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0522]
上述实施例3的步骤4中,使所得的生成物(5g)溶解于n,n-二甲基甲酰胺(11ml),加入硫酸铜(ⅱ)五水合物(234mg)与水(30ml),在110℃加热回流7小时。将反应液冷却至室温为止之后,加入水,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(3.1g、产率93%)。
[0523]
步骤6e:3-氟-6-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0524]
上述实施例3的步骤5中,使所得的生成物(4.46g)溶解于甲醇(20ml),并加入乙酰基氯化物(208mg),在室温搅拌一晚。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(2.8g、产率84%)。
[0525]
[实施例4]3-氯-6-甲基磺酰基氧基-1,2-苯二甲醇(化合物1-17)的制备
[0526]
步骤1:1-氯-2,3-二甲基-4-甲基磺酰基氧基苯的制备
[0527]
使2,3-二甲基-4-氯苯酚(1.81g)溶解于四氢呋喃(20ml),并加入三乙基胺(1.41g)。之后,于冰冷下加入甲烷磺酰基氯化物(1.45g),使其与实施例1的步骤1的制备同样地反应,通过后处理而得标题化合物(1.86g、产率68%)。
[0528]1h-nmr(cdcl3/tmsδ(ppm)值):2.31(s,3h)、2.37(s,3h)、3.19(s,3h)、7.10(dd,1h)、7.25(dd,1h)。
[0529]
步骤2:1-氯-2,3-双(溴甲基)-4-甲基磺酰基氧基苯的制备
[0530]
上述实施例4的步骤1中,使所得的生成物(1.86g)溶解于1,2-二氯乙烷(50ml),并
加入n-溴丁二酰亚胺(4.23g)与2,2
′‑
偶氮二异丁腈(130mg),加热回流3小时。将反应液冷却至室温为止之后,加入水,使用氯仿进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(3.11g、产率100%)。
[0531]1h-nmr(cdcl3/tmsδ(ppm)值):3.34(s,3h)、4.69(s,2h)、4.76(s,2h)、7.39-7.45(m,2h)。
[0532]
步骤3:1-氯-2,3-双(乙酰基氧基甲基)-4-甲基磺酰基氧基苯的制备
[0533]
上述实施例4的步骤2中,使所得的生成物(3.11g)溶解于n,n-二甲基甲酰胺(40ml),并加入乙酸钠(1.56g),在室温搅拌一晚。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0534]1h-nmr(cdcl3/tmsδ(ppm)值):2.06(s,3h)、2.09(s,3h)、3.30(s,3h)、5.31(s,2h)、5.36(s,2h)、7.42(d,1h)、7.49(d,1h)。
[0535]
步骤4:3-氯-6-甲基磺酰基氧基-1,2-苯二甲醇的制备
[0536]
上述实施例4的步骤3中,使所得的粗生成物溶解于甲醇(20ml)、四氢呋喃(20ml),于冰冷下,加入水(5ml)、碳酸钾(2.2g),搅拌3小时。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:80%来溶出)来进行纯化,由此获得标题化合物(1.41g)。
[0537]1h-nmr(cdcl3/tmsδ(ppm)值):2.57(brs,2h)、2.85(s,3h)、4.88(s,2h)、4.94(s,2h)、6.84(d,1h)、7.35(d,1h)。
[0538]
另外,标题化合物也可通过以下的步骤4a来制备。
[0539]
步骤4a:3-氯-6-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0540]
上述实施例4的步骤2中,于所得的生成物(1.64g)中加入水(42ml),加热回流7小时。将反应液冷却至室温为止之后,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(1.11g、产率100%)。
[0541]
[实施例5]3-溴-6-甲基磺酰基氧基-1,2-苯二甲醇(化合物1-18)的制备
[0542]
步骤1:1-溴-2,3-二甲基-4-甲基磺酰基氧基苯的制备
[0543]
使2,3-二甲基-4-溴苯酚(6.57g)溶解于四氢呋喃(100ml),并加入三乙基胺(3.64g)。之后,于冰冷下加入甲烷磺酰基氯化物(4.12g),使其与实施例1的步骤1的制备同样地反应,并进行后处理,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0544]1h-nmr(cdcl3/tmsδ(ppm)值):2.33(s,3h)、2.41(s,3h)、3.19(s,3h)、7.04(d,1h)、7.44(d,1h)。
[0545]
步骤2:1-溴-2,3-双(溴甲基)-4-甲基磺酰基氧基苯的制备
[0546]
上述实施例5的步骤1中,使所得的粗生成物(1.87g)溶解于1,2-二氯乙烷(13ml),并加入n-溴丁二酰亚胺(2.5g)与2,2
′‑
偶氮二异丁腈(110mg),加热回流3小时。将反应液冷却至室温为止之后,以水及饱和食盐水洗净,并以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化
硅胶体快速层析(乙酸乙基酯-己烷:30%溶出)来进行纯化,由此获得标题化合物(2.66g)。
[0547]1h-nmr(cdcl3/tmsδ(ppm)值):3.34(s,3h)、4.71(s,2h)、4.79(s,2h)、7.33(d,1h)、7.62(d,1h)。
[0548]
步骤3:1-溴-2,3-双(乙酰基氧基甲基)-4-甲基磺酰基氧基苯的制备
[0549]
上述实施例5的步骤2中,使所得的生成物(15.28g)溶解于n,n-二甲基甲酰胺(100ml),加入乙酸钠(6.31g),在90℃搅拌3小时。将反应液冷却至室温为止之后,加入水,使用乙酸乙基酯进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0550]1h-nmr(cdcl3/tmsδ(ppm)值):2.06(s,3h)、2.09(s,3h)、3.30(s,3h)、5.32(s,2h)、5.37(s,2h)、7.35(d,1h)、7.68(d,1h)。
[0551]
步骤4:3-溴-6-甲基磺酰基氧基-1,2-苯二甲醇的制备
[0552]
上述实施例5的步骤3中,使所得的粗生成物溶解于甲醇(75ml)、四氢呋喃(25ml)中,并于冰冷下,加入水(25ml)、碳酸钾(9.04g),搅拌3小时。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:50%来溶出)来进行纯化,由此获得标题化合物(7.53g)。
[0553]1h-nmr(cdcl3/tmsδ(ppm)值):2.10(s,2h)、3.29(s,3h)、4.86(s,2h)、5.01(s,2h)、7.17(d,1h)、7.64(d,1h)。
[0554]
另外,标题化合物也可通过以下的步骤4a来制备。
[0555]
步骤4a:3-溴-6-甲基磺酰基氧基-1,2-苯二甲醇的代替性制备
[0556]
上述实施例5的步骤2中,于所得的生成物(1.95g)中加入水(45ml),加热回流8小时。将反应液冷却至室温为止之后,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(1.35g、产率97%)。
[0557]
[实施例6]3-碘-6-甲基磺酰基氧基-1,2-苯二甲醇(化合物1-19)的制备
[0558]
步骤1:1-碘-2,3-二甲基-4-甲基磺酰基氧基苯的制备
[0559]
上述实施例3的步骤1中,使所得的生成物(3.44g)溶解于二甲基亚砜(100ml),并加入碘化钾(13.3g)、亚硝酸钠(4.41g),于冰冷下少量逐次加入48%氢溴酸(20ml),搅拌3小时。于反应液中加入硫代硫酸钠水溶液,使用乙酸乙基酯进行萃取。将有机层以水、饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:50%来溶出)来进行纯化,由此获得标题化合物(2.97g、产率57%)。
[0560]1h-nmr(cdcl3/tmsδ(ppm)值):2.35(s,3h)、2.47(s,3h)、3.18(s,3h)、6.89(d,1h)、7.72(d,1h)。
[0561]
步骤2:1-碘-2,3-双(溴甲基)-4-甲基磺酰基氧基苯的制备
[0562]
上述实施例6的步骤1中,使所得的生成物(2.97g)溶解于1,2-二氯乙烷(50ml),并加入n-溴丁二酰亚胺(3.89g)与2,2
′‑
偶氮二异丁腈(150mg),加热回流3小时。将反应液冷
却至室温为止之后,加入水,使用氯仿进行萃取。将有机层以水、饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0563]1h-nmr(cdcl3/tmsδ(ppm)值):3.34(s,3h)、4.74(s,2h)、4.80(s,2h)、7.18(d,1h)、7.89(d,1h)。
[0564]
步骤3:1-碘-2,3-双(乙酰基氧基甲基)-4-甲基磺酰基氧基苯的制备
[0565]
上述实施例6的步骤2中,使所得的粗生成物溶解于n,n-二甲基甲酰胺(50ml),并加入乙酸钠(1.79g),在室温搅拌一晚。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以水、饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0566]1h-nmr(cdcl3/tmsδ(ppm)值):2.06(s,3h)、2.09(s,3h)、3.30(s,3h)、5.31(s,2h)、5.37(s,2h)、7.42(d,1h)、7.49(d,1h)。
[0567]
步骤4:3-碘-6-甲基磺酰基氧基-1,2-苯二甲醇的制备
[0568]
上述实施例6的步骤3中,使所得的粗生成物溶解于甲醇(20ml)、四氢呋喃(20ml),于冰冷下,加入水(5ml)、碳酸钾(2.52g),使其与实施例5的步骤4的制备同样地反应,并进行纯化,由此获得标题化合物(652mg)。
[0569]1h-nmr(cdcl3/tmsδ(ppm)值):3.11-3.16(m,2h)、3.29(s,3h)、4.86(d,2h)、5.00(d,2h)、7.01(d,1h)、7.92(d,1h)。
[0570]
[实施例7]3-二氟甲氧基-6-甲基磺酰基氧基-1,2-苯二甲醇(化合物1-21)的制备
[0571]
步骤1:2,3-二甲基-4-二氟甲氧基-苯酚的制备
[0572]
使2,3-二甲基-4-[[(1,1-二甲基乙基)二甲基硅烷基]氧基]苯酚(820mg)(european journal of organic chemistry,(11),2218-2225;2010记载的化合物)溶解于乙腈(13ml)中,并加入水(13ml)、氢氧化钾(3.65g),使反应液冷却至-20℃后,加入(溴二氟甲基)膦酸二乙基(1.74g),再进一步于-20℃搅拌1小时。然后,在室温搅拌2小时半之后,于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:50%来溶出)来进行纯化,由此获得标题化合物(200mg、产率33%)。
[0573]1h-nmr(cdcl3/tmsδ(ppm)值):2.18(s,3h)、2.21(s,3h)、5.01(s,1h)、6.37(t,1h)、6.60(d,1h)、6.84(d,1h)。
[0574]
步骤2:1-二氟甲氧基-2,3-二甲基-4-甲基磺酰基氧基苯的制备
[0575]
上述实施例7的步骤1中,使所得的生成物(200mg)溶解于四氢呋喃(20ml),并加入三乙基胺(178mg)。之后,于冰冷下加入甲烷磺酰基氯化物(134mg),在室温搅拌3小时。过滤反应液,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:50%来溶出)来进行纯化,由此获得标题化合物(220mg、产率78%)。
[0576]1h-nmr(cdcl3/tmsδ(ppm)值):2.24(s,3h)、2.29(s,3h)、3.19(s,3h)、6.47(t,1h)、6.99(d,1h)、7.15(d,1h)。
[0577]
步骤3:1-二氟甲氧基-2,3-双(溴甲基)-4-甲基磺酰基氧基苯的制备
[0578]
上述实施例7的步骤2中,使所得的生成物(220mg)溶解于四氯化碳(10ml),加入n-溴丁二酰亚胺(353mg)与2,2
′‑
偶氮二异丁腈(13.6mg),加热回流4小时。将反应液冷却至室温为止之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:50%来溶出)来进行纯化,由此获得标题化合物(340mg、产率97%)。
[0579]1h-nmr(cdcl3/tmsδ(ppm)值):3.34(s,3h)、4.68(s,2h)、4.69(s,2h)、6.58(t,1h)、7.20(d,1h)、7.45(d,1h)。
[0580]
步骤4:1-二氟甲氧基-2,3-双(乙酰基氧基甲基)-4-甲基磺酰基氧基苯的制备
[0581]
上述实施例7的步骤3中,使所得的生成物(340mg)溶解于n,n-二甲基甲酰胺(10ml),并加入乙酸钠(158mg),在室温搅拌一晚。于反应液中加入水,使用乙酸乙基酯酯进行萃取。将有机层以水、饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(306mg、产率100%)。
[0582]1h-nmr(cdcl3/tmsδ(ppm)值):2.06(s,6h)、3.30(s,3h)、5.30(s,2h)、5.31(s,2h)、6.53(t,1h)、7.27(d,1h)、7.48(d,1h)。
[0583]
步骤5:3-二氟甲氧基-6-甲基磺酰基氧基-1,2-苯二甲醇的制备
[0584]
上述实施例7的步骤4中,使所得的生成物(306mg)溶解于甲醇(8ml)、四氢呋喃(8ml),于冰冷下,加入水(2ml)、碳酸钾(222mg),搅拌1小时。于反应液中加入水,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-甲醇:甲醇15%来溶出)来进行纯化,由此获得标题化合物(130mg、产率55%)。
[0585]1h-nmr(cdcl3/tmsδ(ppm)值):3.27-3.30(m,5h)、4.82(s,2h)、4.86(s,2h)、6.57(t,1h)、7.22(d,1h)、7.31(d,1h)。
[0586]
[实施例8]3,6-双(甲基磺酰基氧基)-1,2-苯二甲醇(化合物1-20)的制备
[0587]
步骤1:1,4-双(甲基磺酰基氧基)-2,3-二甲基苯的制备
[0588]
使2,3-二甲基氢醌(1g)溶解于四氢呋喃(12ml),并加入三乙基胺(1.75g)。之后,于冰冷下加入甲烷磺酰基氯化物(1.83g),使其与实施例1的步骤1的制备同样地反应,通过后处理而得标题化合物(2.13g、产率100%)。
[0589]1h-nmr(cdcl3/tmsδ(ppm)值):2.30(s,6h)、3.21(s,6h)、7.20(s,2h)。
[0590]
步骤2:1,4-双(甲基磺酰基氧基)-2,3-双(溴甲基)苯的制备
[0591]
上述实施例8的步骤1中,使所得的生成物(2g)溶解于1,2-二氯乙烷(13ml),并加入n-溴丁二酰亚胺(2.53g)与2,2
′‑
偶氮二异丁腈(112mg),加热回流3小时。将反应液冷却至室温为止之后,以水及饱和食盐水洗净,并以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(2.81g、产率92%)。
[0592]1h-nmr(cdcl3/tmsδ(ppm)值):3.36(s,6h)、4.69(s,4h)、7.50(s,2h)。
[0593]
步骤3:1,4-双(甲基磺酰基氧基)-2,3-双(乙酰基氧基甲基)苯的制备
[0594]
上述实施例8的步骤2中,使所得的生成物(2.68g)溶解于n,n-二甲基甲酰胺(40ml),并加入乙酸钠(1.07g),使其与实施例2的步骤3的制备同样地反应,并予以纯化,由此获得标题化合物(1.78g、产率60%)。
[0595]1h-nmr(cdcl3/tmsδ(ppm)值):2.07(s,6h)、3.31(s,6h)、5.34(s,4h)、7.51(s,2h)。
[0596]
步骤4:3,6-双(甲基磺酰基氧基)-1,2-苯二甲醇的制备
[0597]
上述实施例8的步骤3中,使所得的生成物(1.78g)溶解于甲醇(40ml)、四氢呋喃(40ml),于冰冷下,加入水(10ml)、碳酸钾(1.1g),使其与实施例2的步骤4的制备同样地反应,并进行纯化,由此获得标题化合物(916mg、产率64%)。
[0598]1h-nmr(cdcl3/tmsδ(ppm)值):3.30-3.38(m,8h)、4.86(d,4h)、7.39(s,2h)。
[0599]
另外,标题化合物也可通过以下的步骤4a来制备。
[0600]
步骤4a:3,6-双(甲基磺酰基氧基)-1,2-苯二甲醇的代替性制备
[0601]
上述实施例8的步骤2中,于所得的生成物(1g)中加入水(22ml),加热回流7小时。将反应液冷却至室温为止之后,使用乙酸乙基酯进行萃取。将有机层以饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(790mg、产率100%)。
[0602]
[实施例9]4-甲基磺酰基氧基-1,2-苯二甲醇(化合物1-4)的制备
[0603]
步骤1:1-甲基磺酰基氧基-3,4-二甲基苯的制备
[0604]
使3,4-二甲基苯酚(2g)溶解于四氢呋喃(25ml),并加入三乙基胺(1.99g)。之后,于冰冷下加入甲烷磺酰基氯化物(2.06g),使其与实施例1的步骤1的制备同样地反应,并进行后处理,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0605]1h-nmr(cdcl3/tmsδ(ppm)值):2.26(s,3h)、2.28(s,3h)、3.11(s,3h)、7.01(dd,1h)、7.06(d,1h)、7.15(d,1h)。
[0606]
步骤2:1-甲基磺酰基氧基-3,4-双(溴甲基)苯的制备
[0607]
上述实施例9的步骤1中,使所得的粗生成物溶解于四氯化碳(60ml),加入n-溴丁二酰亚胺(6.4g)与2,2
′‑
偶氮二异丁腈(134mg)、实施例1的步骤2的制备同样地反应,并进行后处理,由此获得含标题化合物的粗生成物。不将此粗生成物纯化而是使用下述步骤。
[0608]1h-nmr(cdcl3/tmsδ(ppm)值):3.18(s,3h)、4.61(s,2h)、4.63(s,2h)、7.22-7.25(m,1h)、7.32(d,1h)、7.42(d,1h)。
[0609]
步骤3:1-甲基磺酰基氧基-3,4-双(乙酰基氧基甲基)苯的制备
[0610]
上述实施例9的步骤2中,使所得的粗生成物溶解于n,n-二甲基甲酰胺(50ml),并加入乙酸钠(3.36g),使其与实施例2的步骤3的制备同样地反应,并予以纯化,由此获得标题化合物(3.26g)。
[0611]1h-nmr(cdcl3/tmsδ(ppm)值):2.10(s,3h)、2.12(s,3h)、3.17(s,3h)、5.18(s,2h)、5.19(s,2h)、7.28(d,1h)、7.35(d,1h)、7.46(d,1h)。
[0612]
步骤4:4-甲基磺酰基氧基-1,2-苯二甲醇的制备
[0613]
上述实施例9的步骤3中,使所得的生成物(3.26g)溶解于甲醇(40ml)、四氢呋喃(40ml),于冰冷下,加入水(20ml)、碳酸钾(2.6g),使其与实施例2的步骤4的制备同样地反应,并进行纯化,由此获得标题化合物(1.64g、产率69%)。
[0614]1h-nmr(cdcl3/tmsδ(ppm)值):2.63(brs,2h)、3.16(s,3h)、4.76(s,4h)、7.21-7.53(m,2h)、7.32(s,1h)、7.42(d,1h)。
[0615]
[实施例10]4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(化合物2-1)的制
备
[0616]
将4-(4-甲酰基-2-噻唑基)-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(200mg)(wo2008/013622号公报记载的化合物)、实施例1中所得的生成物(121mg)与p-甲苯磺酸一水合物(20mg)溶解于甲苯(20ml),使用dean-stark装置,加热回流1小时。将反应液冷却至室温为止之后,以乙酸乙基酯稀释,并以水及饱和食盐水洗净。将有机层以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:40%-100%来溶出)来进行纯化,由此获得标题化合物(298mg、产率96%)。
[0617]
[实施例11]4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(化合物2-3)的制备
[0618]
将4-(4-甲酰基-2-噻唑基)-1-[2-[5-甲基-3-(三氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(220mg)(wo2008/013622号公报记载的化合物)、实施例3所得的生成物(150mg)与p-甲苯磺酸一水合物(20mg)溶解于甲苯(15ml),并使其与化合物2-1的制备中的反应同样地反应,并进行纯化,由此获得标题化合物(297mg、产率84%)。
[0619]
[实施例12]4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(化合物2-15)的制备
[0620]
使4-(4-甲酰基-2-噻唑基)-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(202mg)(wo2010/066353号公报记载的化合物)、实施例1中所得的生成物(232mg)与p-甲苯磺酸一水合物(5mg)溶解于甲苯(15ml),使其与化合物2-1的制备中的反应同样地反应,并进行纯化,由此获得标题化合物(164mg、产率53%)。
[0621]
[实施例13]4-[4-(6-氟-9-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(化合物2-23)的制备
[0622]
使4-(4-甲酰基-2-噻唑基)-1-[2-[3,5-双(二氟甲基)-1h-吡唑-1-基]乙酰基]哌啶(202mg)(wo2010/066353号公报记载的化合物)、实施例3中所得的生成物(250mg)与p-甲苯磺酸一水合物(5mg)溶解于甲苯(15ml)中,使其与化合物2-1的制备中的反应同样地反应,并进行纯化,由此获得标题化合物(105mg、产率33%)。
[0623]
[实施例14]4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二甲基苯基)乙酰基]哌啶(化合物3-1)的制备
[0624]
使4-(4-甲酰基-2-噻唑基)-1-[2-(2,5-二甲基苯基)乙酰基]哌啶(200mg)、实施例1中所得的生成物(142mg)与p-甲苯磺酸一水合物(20mg)溶解于甲苯(15ml)中,使其与化合物2-1的制备中的反应同样地反应,并进行纯化,由此获得标题化合物(206mg、产率64%)。
[0625]
[实施例15]4-[4-(6-甲基磺酰基氧基-1,5-二氢-3h-2,4-苯并二氧杂环庚-3-基)-2-噻唑基]-1-[2-(2,5-二氯苯基)乙酰基]哌啶(化合物3-2)的制备
[0626]
使4-(4-甲酰基-2-噻唑基)-1-[2-(2,5-二氯苯基)乙酰基]哌啶(191mg)、实施例1中所得的生成物(232mg)与p-甲苯磺酸一水合物(5mg)溶解于甲苯(15ml),使其与化合物2-1的制备中的反应同样地反应,并进行纯化,由此获得标题化合物(267mg、产率72%)。
[0627]
以下的实施例16~18中,表示于上述实施例1~15所用的制造起始物质的制造例。
[0628]
[实施例16]2,3-二甲基-4-硝基苯酚的制备
[0629]
使2,3-二甲基-4-亚硝基苯酚(500mg)混悬于甲醇(10ml),并加入钨酸钠二水合物(54mg),将反应液升温至60℃。于其中,缓慢地加入30%过氧化氢水溶液(563mg),在60℃搅拌8小时。将反应液冷却至室温为止,并加入亚硫酸钠、水,使用乙酸乙基酯进行萃取。将有机层以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂,由此获得标题化合物(500mg、产率90%)。
[0630]
[实施例17]4-(4-甲酰基-2-噻唑基)-1-[2-(2,5-二甲基苯基)乙酰基]哌啶的制备
[0631]
步骤1:4-(4-甲酰基-2-噻唑基)哌啶三氟乙酸盐的制备
[0632]
使4-(4-甲酰基-2-噻唑基)哌啶羧酸1,1-二甲基乙基酯(3.9g)(wo2008/013622号公报记载的化合物)溶解于二氯甲烷(65ml),并加入三氟乙酸(15.2ml),在室温搅拌一晚。将二氯甲烷与三氟乙酸于减压下馏去,由此获得标题化合物。
[0633]
步骤2:4-(4-甲酰基-2-噻唑基)-1-[2-(2,5-二甲基苯基)乙酰基]哌啶的制备
[0634]
上述实施例17的步骤1中,使所得的生成物(1g)溶解于二氯甲烷(50ml),并加入2,5-二甲基苯基乙酸(919mg)与1-(3-二甲基氨基丙基)-3-乙基碳二酰亚胺盐酸盐(1.07g),在室温搅拌一晚。于反应液中加入水,使用氯仿进行萃取。将有机层以水及饱和食盐水洗净,以无水硫酸钠干燥,过滤无机物之后,减压下馏去溶剂。将残渣使用通过急速自动纯化装置(biotage ab社制/isolera
tm
)所为的氧化硅胶体快速层析(以乙酸乙基酯-己烷:0%-100%来溶出)来进行纯化,由此获得标题化合物(1.45g、产率83%)。
[0635]1h-nmr(cdcl3/tmsδ(ppm)值):1.61-1.84(m,2h)、2.08-2.22(m,2h)、2.24(s,3h)、2.29(s,3h)、2.82-2.89(m,1h)、3.13-3.33(m,2h)、3.68(s,2h)、3.87-3.90(m,1h)、4.74-4.78(m,1h)、6.96-6.98(m,2h)、7.07(d,1h)、8.09(s,1h)、9.99(s,1h)。
[0636]
[实施例18]4-(4-甲酰基-2-噻唑基)-1-[2-(2,5-二氯苯基)乙酰基]哌啶的制备
[0637]
上述实施例17的步骤1中,使所得的生成物(1.1g)溶解于二氯甲烷(30ml),并加入2,5-二氯苯基乙酸(1.7g)与1-(3-二甲基氨基丙基)-3-乙基碳二酰亚胺盐酸盐(1.18g),使其与实施例17的步骤2的制备同样地反应,并进行纯化,由此获得标题化合物(1.7g、产率79%)。
[0638]1h-nmr(cdcl3/tmsδ(ppm)值):1.74-1.85(m,2h)、2.20-2.23(m,2h)、2.85-2.92(m,1h)、3.22-3.37(m,2h)、3.81(s,2h)、3.94-4.02(m,1h)、4.69-4.73(m,1h)、7.20(dd,1h)、7.31-7.33(m,2h)、8.10(s,1h)、10.00(s,1h)。
[0639]
通过同样的制造法,合成[表1]~[表4]中所示的化合物1-2、1-5~1-13、1-15、1-16、2-2、2-4~2-14、2-16~2-22、2-24~2-55、及3-3~3-22。
[0640]
[表1]
[0641]
[0642]
no.x1x2x3x41-1oso2mehhh1-2oso2ethhh1-3oso2mehhf1-4hoso2mehh1-5oso2c-prhhh1-6oso2mehhme1-7oso2n-buhhh1-8oso2n-prhhh1-9oso2n-c8h
17
hhh1-10oso2mehhome1-11oso2i-prhhh1-12hoso2ethh1-13oso2ch2ch2cf3hhh1-14oso2mehhno21-15oso2mefhh1-16oso2mehmeme1-17oso2mehhcl1-18oso2mehhbr1-19oso2mehhi1-20oso2mehhoso2me1-21oso2mehhochf2[0643]
[表2]
[0644][0645]
no.r2r3x1x2x3x42-1cf3meoso2mehhh2-2cf3meoso2ethhh2-3cf3meoso2mehhf2-4cf3mehoso2mehh2-5cf3meoso2c-prhhh2-6cf3meoso2mehhme2-7cf3meoso2n-buhhh2-8cf3meoso2n-prhhh2-9cf3meoso2n-c8h
17
hhh
2-10cf3meoso2mehhome2-11cf3meoso2i-prhhh2-12cf3mehoso2ethh2-13cf3meoso2ch2ch2cf3hhh2-14cf3meoso2mehhno22-15chf2chf2oso2mehhh2-16chf2chf2oso2mehhome2-17cf3cf3oso2mehhh2-18chf2chf2oso2mehhme2-19cf3meoso2mefhh2-20chf2chf2oso2i-prhhh2-21chf2chf2oso2n-buhhh2-22chf2chf2oso2n-c8h
17
hhh2-23chf2chf2oso2mehhf2-24cf3meoso2mehmeme2-25cf3meoso2mehhcl2-26cf3meoso2mehhbr2-27cf3cf3oso2i-prhhh2-28cf3cf3oso2n-buhhh2-29cf3meoso2mehhi2-30cf3meoso2mehhoso2me2-31memeoso2mehhh2-32cf3closo2mehhome2-33clcloso2mehhome2-34memeoso2mehhome2-35chf2chf2oso2mehhcl2-36cf3cf3oso2mehhome2-37cf3cf3oso2mehhcl2-38chcl2chcl2oso2mehhh
[0646]
[表3]
[0647]
no.r2r3x1x2x3x42-39memeoso2mehhf2-40chf2chf2oso2mehmeme2-41cf3cf3oso2mehmeme2-42cf3cf3oso2mehhbr2-43chf2chf2oso2mehhno22-44chf2chf2oso2mehhbr2-45cf3cf3oso2mehhno22-46cf3cf3oso2mehhi
2-47chf2chf2oso2mehhi2-48cf3cf3oso2mefhh2-49chf2chf2oso2mefhh2-50chf2chf2hoso2mehh2-51cf3cf3hoso2mehh2-52cf3meoso2mehhochf22-53chf2chf2oso2mehhoso2me2-54cf3cf3oso2mehhoso2me2-55chf2meoso2mehhf
[0648]
[表4]
[0649][0650]
no.r5r8x1x2x3x43-1memeoso2mehhh3-2clcloso2mehhh3-3memeoso2mehhf3-4memeoso2n-buhhh3-5clcloso2mehhf3-6clcloso2mehhome3-7memeoso2mehhome3-8cf3cf3oso2mehhh3-9memeoso2mehmeme3-10clcloso2mehmeme3-11memeoso2mehhbr3-12clcloso2mehhno23-13clcloso2mehhbr3-14memeoso2mehhno23-15memeoso2mehhcl3-16memeoso2mehhi3-17clcloso2mehhcl3-18memeoso2mefhh3-19clcloso2mefhh3-20clcloso2mehhi3-21clclhoso2mehh
3-22memeoso2mehhoso2me
[0651]
将上述实施例所得的化合物及由以同样方法制造的[表1]~[表4]中所示的化合物的1h-nmr数据(cdcl3/tmsδ(ppm)值)显示于[表5]~[表11]。
[0652]
[表5]
[0653][0654]
[表6]
[0655][0656]
[表7]
[0657][0658]
[表8]
[0659][0660]
[表9]
[0661][0662]
[表10]
[0663][0664]
[表11]
[0665][0666]
接着,记载本发明化合物的使用实施例。
[0667]
(1)制剂化的实施程序
[0668]
《制剂例1》水合剂
[0669]
将本发明化合物10份与月桂基硫酸钠2份、木质素磺酸钠4份、白碳(非晶质二氧化硅)20份及粘土64份混合,予以粉碎而得10%水合剂。
[0670]
《制剂例2》混悬剂(floable agent)
[0671]
加入本发明化合物10份、聚氧乙烯烯丙基苯基醚硫酸酯4份、聚氧乙烯烷基醚5份、丙二醇5份、硅系消泡剂0.2份、钠蒙脱土0.8份、水50份予以混合,使用dyno-mill进行湿式粉碎,得到粉碎混悬液。
[0672]
于粉碎混悬液75份中,添加包含黄原胶、2-苯基异噻唑啉-3-酮各0.2份、0.1份的黄原胶溶液10份与水15份之后,予以混合而得10%水性混悬状农药组成物。
[0673]
《制剂例3》乳剂
[0674]
使本发明化合物10份、十二烷基苯磺酸钙2份、蓖麻油乙氧基化15份与芳香族烃混合物73份混合溶解而得均质的10%可乳化油状液体。
[0675]
《制剂例4》颗粒水合剂
[0676]
添加本发明化合物10份、木质素磺酸钠20份、萘磺酸缩合物的钠盐10份、烷基苯磺酸钠3份、硅系泡消剂0.5份、硅藻土5份、硫酸铵10份、滑石10份、粘土份31.5份后充分地搅拌混合并粉碎而得粉碎物。粉碎物中可视需要添加适量的水而于造粒机予以造粒,干燥后过筛而得10%水合性细粒。
[0677]
《制剂例5》乳化剂
[0678]
添加本发明化合物10份、芳香族烃混合物15份、十二烷基苯磺酸钙2份、聚氧乙烯蓖麻油20份、丙二醇4份予以溶解并获得混合液。于水49份中添加混合液,使用均质机而混合,得到均质的10%乳浊液体。
[0679]
《制剂例6》粒剂
[0680]
添加本发明化合物10份、聚羧酸型阴离子表面活性剂3份、磺基琥珀酸钠二辛酯0.2份、糊精2份、钠膨土15份、碳酸钙69.8份予以均一混合后,加入适当量的水予以混练,以笼型造粒机押出予以造粒后经干燥后筛分,得到10%细粒。
[0681]
《制剂例7》微乳化剂
[0682]
将本发明化合物10份与脂肪酰二甲基铵(fatty acid dimethylamide)12份、环己酮10份芳基苯酚乙氧基化物(aryl phenol ethoxylate)15份予以混合,并添加醇乙氧基化物10份及水43份,于加温下搅拌数分钟,得到安定的10%水溶性液体。
[0683]
(2)试验混悬液的制备的实施程序
[0684]
将根据制剂例1所作成的10%水合剂以制备成1/5000的浓度的teen20水溶液进行稀释,并将式[1]所示的化合物制备成4ppm的浓度。另外,对于试验4将式[1]所示的化合物制备成1000ppm的浓度。
[0685]
(3)对植物病害的防治效果的评价试验程序
[0686]
《试验1对蕃茄疫病的防治效果试验》
[0687]
对5叶期的西红柿(品种:redina)每1苗散布20ml的试验混悬液。于散布的1日后,将制备成1.0
×
105个/ml浓度的马铃薯晚疫霉(phytophthora infestans)的游走孢子混悬液进行喷雾接种,于调节至22℃的湿室中培养16小时。然后,于室内促进发病,自接种日起4日后调查叶面上所产生的病斑面积率,使用以下算式算出防治价。
[0688]
防治价的算出式:防治价值={1-散布试验药剂的叶的发病面积率/无处理的发病面积率}
×
100
[0689]
《试验2对黄瓜霜霉病(downy mildew of cucumber)的防治效果试验》
[0690]
对2叶期的黄瓜(品种:sagami hanjiro)每1苗散布20ml的试验混悬液。于散布的1日后,将制备成1.0
×
104个/ml浓度的古巴假单轴霉(pseudoperonospora cubensis)的游走子囊混悬液进行喷雾接种,于调节至22℃的湿室中培养16小时。于室内促进发病,自接种日起5日后调查叶面上所产生的病斑面积率,使用以下算式算出防治价。
[0691]
防治价的算出式:防治价值={1-散布试验药剂的叶的发病面积率/无处理的发病面积率}
×
100
[0692]
《试验3对葡萄霜霉病的防治效果试验》
[0693]
对实生的葡萄(品种:neo muscat)每1苗散布20ml的试验混悬液。于散布的1日后,将制备成1.0
×
104个/ml浓度的葡萄生单轴霉(plasmopara viticola)的游走子囊混悬液进行喷雾接种,于调节至22℃的湿室中培养16小时。于室内促进发病,自接种日起5日后调查叶面上所产生的病斑面积率,使用以下算式算出防治价。
[0694]
防治价的算出式:防治价值={1-散布试验药剂的叶的发病面积率/无处理的发病面积率}
×
100
[0695]
《试验4对腐霉属(pythium)菌所致水稻苗立枯病的防治效果试验(土壤灌注)》
[0696]
在以剪股颖属种子培养基培养的禾生腐霉(pythium graminicola)的菌丛中加入蒸馏水,以搅拌机搅拌,对土壤1kg而言混合菌5g,制备污染土。
[0697]
1穴是对31
×
31mm2的穴盘填充污染土各20ml,将已催芽的糙米(品种:越光)以每穴3粒进行播种,加入5ml的覆土,灌注处理试验混悬液2.5ml,于调节至28℃的湿室培养72小时,进行出芽处理。然后,于5℃的低温室内2日促进发病,之后,在25℃的温室内育病14
日。
[0698]
洗掉土壤,计测枯死株、生育抑制株、健全株,根据下述算式算出发病度。
[0699]
发病度=[σ(程度不同的发病株数
×
发病指数)/(已调查株
×
3)]
×
100
[0700]
[发病指数]
[0701]
0:健全株
[0702]
1:生育抑制株
[0703]
3:枯死株
[0704]
另外,使用以下算式,从已算出的发病度算出防治价。
[0705]
防治价的算出式:防治价值={1-已散布试验药剂的区的发病度/无处理区的发病度}
×
100
[0706]
(4)对植物病害《试验1》~《试验4》的防治效果的评价试验结果
[0707]
实施试验1的结果,以下所示的化合物显示出防治价80以上:
[0708]
no.2-1~2-55、3-1~3-7、3-10、3-12~3-15、3-17~3-22。
[0709]
实施试验2的结果,以下所示的化合物显示出防治价80以上:
[0710]
no.2-1~2-55、3-1~3-20、3-22。
[0711]
实施试验3的结果,以下所示的化合物显示出防治价80以上:
[0712]
no.2-1~2-53、2-55、3-1~3-22。
[0713]
就几个化合物实施试验4的结果,任何化合物均显示出防治价90以上。以下显示出这些化合物no.:
[0714]
no.2-1、2-7、2-8、2-14、2-18、2-19、2-23、2-33、2-34、2-38、2-42、2-46、2-48、2-49、2-54、3-1、3-2、3-4、3-8、3-9、3-19、3-20。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1