外泌体介导RNACASC15干预阿尔茨海默症突触损失的应用
外泌体介导rna casc15干预阿尔茨海默症突触损失的应用
技术领域
1.本发明属于生物医药技术领域,涉及外泌体介导rna casc15干预阿尔茨海默症突触损失的应用。
背景技术:
2.阿尔茨海默症(ad)病程缓慢,临床早期表现为单纯的记忆功能损伤,随病程深入,ad认知障碍进行性加重,并出现明显的神经退行性病变。突触损失是ad最早的标志性事件之一。突触损失与认知功能下降呈现最显著的相关性。
3.由于ad复杂的病理成因和不为明确的致病因素,针对ad患者开发的成功的药物非常少,而且药物疗效不佳,不能阻断ad的发病进程。目前,美国食品药品监督管理局(fda)批准的治疗ad的药品有tacrine、donepezil、rivastigmine、 galanthamine、memantine以及最新公布的治疗轻中度ad的药物aducanumab。即使是2021年最新批准的治疗轻中度ad的药物aducanumab,科学界仍对aducanumab 充满巨大的争议。目前基础研究正在开发针对ad关键致病蛋白分子的靶向疫苗,但是最终效果未知。
4.ad患者的早发现早治疗对于阻断ad的病情进行极其关键,这也是针对ad患者药物开发的核心思路。因此,针对阿尔茨海默症最早的标志性临床病理改变——突触损失,开发治疗药物,可能是最有可能治疗ad的一种策略。
技术实现要素:
5.本发明解决的技术问题在于提供外泌体介导rna casc15干预阿尔茨海默症突触损失的应用,外泌体介导的casc15传递可有效富集于大脑皮层与海马组织,使 ca1区神经元的突触结构得到显著改善。
6.本发明是通过以下技术方案来实现:
7.长链非编码rna casc15作为靶点在筛选、制备预防/治疗阿尔茨海默症的药物中的应用。
8.所述的药物是基于过表达长链非编码rna casc15的药物。
9.所述的药物是预防/治疗早期阿尔茨海默症患者突触损失的药物。
10.外泌体介导的长链非编码rna casc15在制备预防/治疗阿尔茨海默症的药物中的应用。
11.所述的外泌体为100-200nm的外泌囊泡,其由过表达rna casc15或 2610307p16rik基因的神经元细胞系经高速离心分离得到。
12.所述的药物为可富集于大脑皮层与海马组织、并改善神经元的突触结构的药物。
13.所述的药物为学习记忆与识别记忆能力得到提高的药物。
14.富含2610307p16rik转录本的外泌体在制备构建阿尔茨海默症小鼠模型的药物中的应用。
15.与现有技术相比,本发明具有以下有益的技术效果:
16.本发明通过生物信息学方法对200多例临床ad样本进行hcluster层次聚类,分析发现casc15低表达与ad的发生显著相关;而构建casc15超表达的细胞其不仅在神经元细胞中有表达,而且在其分泌的外泌体中也特异性富集;进一步的外泌体作为天然的胞间信息载体,以其较小的分子结构穿过血脑屏障,到达海马ca1区,具有天然分子的转运特性及良好的生物相容性;所以外泌体介导的casc15传递可能具有治疗ad的良好潜力。
17.本发明通过实验揭示富含2610307p16rik转录本的外泌体导入app/ps1 ad小鼠体内,外泌体介导的casc15传递可有效富集于小鼠大脑皮层与海马组织,app/ps1 ad小鼠海马ca1区神经元的突触结构得到显著改善;而将富含2610307p16rik转录本的外泌体导入小鼠体内后app/ps1 ad小鼠学习记忆能力变化;充分表明了外泌体介导的casc15治愈早期阿尔茨海默症的可行性。
附图说明
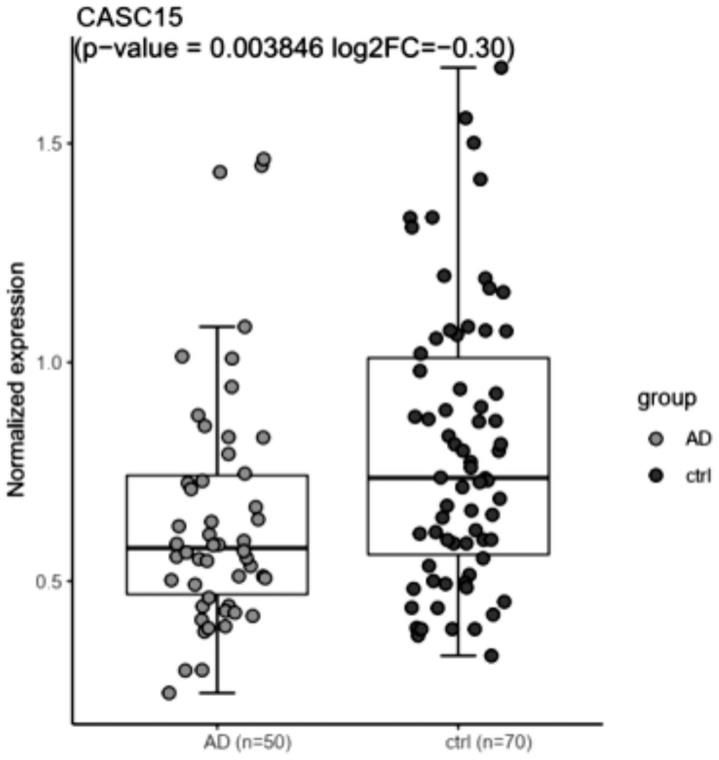
18.图1为阿尔茨海默症患者(ad)和正常健康人(ctrl)的基因表达情况分析图;
19.图2a-图2e为富含2610307p16rik转录本的外泌体导入app/ps1 ad小鼠体内, app/ps1 ad小鼠海马ca1区神经元的突触结构变化情况;
20.图3a-图3c为将富含2610307p16rik转录本的外泌体导入小鼠体内后app/ps1 ad小鼠学习记忆能力变化。
具体实施方式
21.下面结合实施例对本发明做进一步详细描述,所述是对本发明的解释而不是限定。
22.1、casc15低表达与ad的发生显著相关
23.长链非编码rna casc15的基因序列如下:
24.casc15(人源):chromosome6-nc_000006.12
25.2610307p16rik(鼠源)的基因序列如下:chromosome13-nc_000079.7
26.我们通过生物信息学方法对200多例临床ad样本进行hcluster层次聚类。
27.本发明经过gwas分析发现,casc15基因中多个snp位点与ad患病风险密切相关。进一步,通过生物信息学方法对200多例临床ad样本进行hcluster层次聚类,其中ad病人死后脑组织进行rna-seq检测,芯片数据来自美国国家生物技术信息中心(ncbi)的基因表达集(geo),数据登录号为:gse95587,数据包括219 个阿尔茨海默症患者和70个正常健康人对照;分析发现casc15低表达与ad的发生显著相关。
28.结果显示casc15水平在阿尔茨海默症患者脑部显著低于正常人(参见图1, p=0.003846,t-test);图中每个点代表1个人大脑组织样本;横坐标表示两组早期阿尔茨海默症患者(ad=50人)和正常健康人(ctrl=70人);纵坐标表示casc15基因在阿尔茨海默症患者(ad)和正常健康人(ctrl)的相对表达水平;来自两样本t 检验(two-sample t-test);p-value为ad vs ctrl t.test单端检验显著性;log2fc表示 casc15基因在阿尔茨海默症患者(ad)和正常健康人(ctrl)的相对表达差异倍数取log2为底的对数值。
29.对图1显示阿尔茨海默症患者(ad)和正常健康人(ctrl)的基因表达情况分析表明:长链非编码rna casc15水平在阿尔茨海默症患者脑部显著低于正常人。
30.以上提示casc15低表达与ad的发生显著相关,casc15可能是预防和治疗阿尔茨海默症的靶点。
31.2、外泌体介导casc15
32.外泌体作为一种自然生物形成的纳米级膜泡在过去的几年里受到了人们相当大的关注。外泌体被广泛用作药物载体;在生物治疗领域有着极大的潜力。
33.通过构建过表达2610307p16rik基因的慢病毒(比如基于慢病毒载体构建载体 pslenti-ef1-egfp-f2a-puro-wpre2-cmv-2610307p16rik并转染形成慢病毒)感染 ht22细胞,构建稳转的过表达2610307p16rik基因的ht22小鼠海马神经元细胞系。
34.然后通过超高速离心技术分离纯化过载casc15的外泌体:收集过表达 2610307p16rik基因的ht22小鼠海马神经元细胞系上清液,300
×
g离心10min;转移上清液,2000
×
g离心10min;转移上清液,10000
×
g离心30min;转移上清液, 100000
×
g离心90min;收集沉淀,并用适量0.01m pbs稀释,-20℃保存待用。
35.3、外泌体介导的casc15在阿尔茨海默症小鼠中的治疗过程和效果评估
36.app/ps1 ad小鼠来自南京大学模式动物研究所。
37.正常对照组小鼠打入脂质体组(wt+lipo)、app/ps1 ad小鼠打入脂质体组 (app/ps1+lipo)、app/ps1 ad小鼠打入空载体过表达转录本的外泌体组 (app/ps1+lv-ctrl exo)、app/ps1 ad小鼠打入过表达2610307p16rik转录本的外泌体组(app/ps1+lv-2610307p16rik exo)各6只,每48小时尾静脉注射给药,连续给药治疗30天。小鼠体重30.5
±
2.3克(g)。年龄:6个月。
38.给药:给药剂量:200ug(灭菌生理盐水配制,大概200ul);用法:每48小时一次;给药方式:尾静脉注射。
39.高尔基检测:神经元和胶质细胞形态学研究的完整golgi-cox染色体系;试剂盒:fd rapid golgistaintm kit(fd neurotechnologies,inc,美国)。
40.从四组实验组每组取3只小鼠进行海马区连续冠状震荡切片,厚度100um,进行高尔基染色。100倍油镜下拍照观察海马ca1区神经元树突棘情况。连续给药30天治疗后,神经元树突棘变化情况以及各组小鼠学习记忆情况结果见图2和图3。
41.图2为通过尾静脉注射的方法将富含2610307p16rik转录本的外泌体导入 app/ps1 ad小鼠体内,app/ps1 ad小鼠海马ca1区神经元的突触结构变化情况。其中,a图为将富含2610307p16rik转录本的外泌体导入app/ps1 ad小鼠体内,使用高尔基实验检测app/ps1 ad小鼠海马ca1区神经元的突触可塑性变化情况,不同颜色标注不同的分组情况,灰色表示正常对照组小鼠打入脂质体(wt+lipo)、紫色表示app/ps1 ad小鼠打入脂质体(app/ps1+lipo)、红色表示app/ps1 ad小鼠打入空载体过表达转录本的外泌体(app/ps1+lv-ctrl exo)、紫色表示app/ps1 ad 小鼠打入过表达2610307p16rik转录本的外泌体(app/ps1+lv-2610307p16rik exo);
42.b图为四组实验组小鼠海马ca1区神经元树突棘密度(个/10um(微米)),不同颜色标注不同的分组情况(同上),图中每个点代表1张大脑组织样本;
43.c图为四组实验组小鼠海马ca1区神经元树突棘长度(um(微米)),不同颜色标注不同的分组情况(同上),图中每个点代表1个树突棘;
44.d图为四组实验组小鼠海马ca1区神经元成熟树突棘mushroom的密度(个 /10um
(微米)),不同颜色标注不同的分组情况(同上),图中每个点代表1张大脑组织样本;e图为四组实验组小鼠海马ca1区神经元非成熟树突棘studdy的密度(个 /10um(微米)),不同颜色标注不同的分组情况(同上),图中每个点代表1张大脑组织样本。
45.结果表明:给与富含2610307p16rik转录本外泌体治疗的app/ps1 ad小鼠组其海马组织ca1区神经元树突棘密度显著增多、长度显著变长、成熟mushroom树突棘数目显著增多、非成熟stubby树突棘数目显著减少。
46.图3为将富含2610307p16rik转录本的外泌体导入小鼠体内后app/ps1 ad小鼠学习记忆能力变化。新物体识别实验结果显示,给与富含2610307p16rik转录本外泌体治疗的app/ps1 ad小鼠组,其新物体识别指数及新物体识别次数显著增多。其中,a图为新物体识别实验检测不同分组小鼠新物体识别次数变化,不同颜色标注不同的分组情况(同上),图中每个点代表1只老鼠;b图为新物体识别实验检测不同分组小鼠新物体识别指数变化,不同颜色标注不同的分组情况(同上),图中每个点代表1只老鼠;c图为水迷宫实验检测不同分组小鼠逃避平台潜伏期变化,不同颜色标注不同的分组情况(同上),图中每个点代表1只老鼠。(每组6只老鼠)
47.结果表明:水迷宫实验结果显示给与富含2610307p16rik转录本外泌体治疗的 app/ps1 ad小鼠组逃避平台潜伏期显著降低。以上结果提示富含2610307p16rik转录本的外泌体能有效的改善ad小鼠的学习记忆能力。
48.以上结果表明通过尾静脉注射的方法将富含2610307p16rik转录本的外泌体导入app/ps1 ad小鼠体内,app/ps1 ad小鼠海马ca1区神经元的突触结构得到显著改善,空间学习记忆与新物体识别记忆能力也得到显著提高。
49.突触损失是阿尔茨海默症最早的标志性事件之一,而外泌体介导的casc15传递可有效富集于小鼠大脑皮层与海马组织,小鼠海马ca1区神经元的突触结构得到显著改善,治愈早期阿尔茨海默症。
50.本发明通过尾静脉注射的方法将富含2610307p16rik转录本的外泌体导入 app/ps1 ad小鼠体内首次得出app/ps1 ad小鼠海马ca1区神经元的突触结构得到显著改善(图2)。
51.结果显示,富含2610307p16rik转录本的外泌体进入海马组织后能显著改善ad 小鼠海马神经元突触可塑性损伤,治疗ad小鼠的学习记忆能力。
52.因此,casc15是早期预防和治疗阿尔茨海默症的良好靶点,外泌体介导的 casc15治疗早期阿尔茨海默症的,在早期阿尔茨海默症的模型小鼠中验证了其治疗效果。连续给药30天后,app/ps1 ad小鼠空间学习记忆与新物体识别记忆能力也得到显著提高(图3)。整体显示了外泌体介导的casc15对早期阿尔茨海默症的良好治愈效果。
53.综上,本发明提出了:
54.外泌体介导的长链非编码rna casc15可作用预防和治疗早期阿尔茨海默症。
55.其中,其长链非编码rna casc15是预防和治疗阿尔茨海默症的靶点;外泌体介导的长链非编码rna casc15为预防和治疗阿尔茨海默症的药物剂型。
56.突触损失是阿尔茨海默症最早的标志性事件之一,预防和治疗早期阿尔茨海默症患者突触损失是关键干预策略。而外泌体介导的casc15传递可有效富集于小鼠大脑皮层与海马组织,小鼠海马ca1区神经元的突触结构得到显著改善,治愈早期阿尔茨海默症。
57.进一步,本发明还揭示了富含2610307p16rik(鼠源)转录本的外泌体在构建的阿尔茨海默症小鼠模型中的应用。通过尾静脉注射的方法将富含2610307p16rik转录本的外泌体导入app/ps1 ad小鼠体内,app/ps1 ad小鼠海马ca1区神经元的突触结构得到显著改善,空间学习记忆与新物体识别记忆能力也得到显著提高。
58.作为优选,本发明中富含2610307p16rik(鼠源)转录本的外泌体每48小时尾静脉注射剂量为6.6mg(毫克)/kg(千克)。
59.由本发明中所述阿尔茨海默症小鼠的有效剂量推算成成人(60kg),外泌体介导的长链非编码rna casc15每48小时注射剂量为396mg。
60.以上给出的实施例是实现本发明较优的例子,本发明不限于上述实施例。本领域的技术人员根据本发明技术方案的技术特征所做出的任何非本质的添加、替换,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1