一种改造的琼胶酶及其制备方法与应用与流程
1.本发明涉及生物技术领域,具体涉及一种改造的琼胶酶及其制备方法与应用。
背景技术:
2.琼胶是一种从红藻中提取得到的亲水胶体,被广泛应用于食品等相关领域。琼胶经降解后会生成琼胶寡糖,该产物具有免疫调节、抗肿瘤活性、抗辐射功能、抗菌和抗病毒活性、抗氧化活性及抗凝血作用,在药品、食品、化妆品等领域具有很强的应用潜力。因此,琼胶的降解及降解效率的提升就显得十分重要。
3.目前,酸水解法和酶水解法是琼胶降解的主要方法。在酸降解的过程中存在环境污染、设备损耗较大等问题,而酶降解法与酸降解相比反应条件较为温和,对环境的污染程度也较小。
4.根据琼胶酶降解琼脂糖作用方式不同,可以把琼脂酶分为两大类:α-琼胶酶和β-琼胶酶。α-琼胶酶裂解琼脂糖的α-1,3糖苷键,生成以β-d-半乳糖作为非还原性末端和以3,6-内醚-α-l-半乳糖作为还原性末端的琼寡糖系列;而β-琼胶酶裂解琼脂糖的β-1,4糖苷键,生成以β-d-半乳糖作为还原性末端和以3,6-内醚-α-l-半乳糖为非还原性末端的新琼寡糖系列。
5.使用酶解法是较为理想的琼胶降解手段。但是,目前大多数报道的琼胶酶稳定性欠佳。许多琼胶酶在0-30℃之间可以维持较高活性,但当温度超过40℃时会损失较多酶活性;再如,当作用ph大于6.0时,多数琼胶酶同样会丧失大部分活性。因此,筛选高稳定性的琼胶酶对相关寡糖的生产十分重要。
6.此外,目前所报道的大多数琼胶酶从酶液分离出来的步骤繁琐,周期长,成本高,限制了其在琼胶寡糖生产领域的应用。因此,开展琼胶酶的快速分离富集方法对未来琼胶寡糖的大规模生产十分重要。
7.因此,本领域技术人员希望开发新的具有高稳定性的琼胶酶,及相应的琼胶酶的快速分离富集方法。
技术实现要素:
8.本发明的目的在于提供一种改造的琼胶酶及其制备方法与应用,该改造得到的琼胶酶命名为aga433f,具有与改造前琼胶酶相似的酶学性质;该酶能够形成自集聚为24聚体,便于进行分离纯化;此外,该酶相对于改造之前的酶还具有更好的热稳定性。
9.为此,本发明的第一方面提供一种β-琼胶酶,其氨基酸序列如seq id no:1所示。
10.本发明的第二方面,提供一种基因,其编码所述β-琼胶酶。
11.进一步,所述基因的核苷酸序列如seq id no:2所示。
12.本发明的第三方面,提供一种核酸构建体,其包含本发明所述的基因。
13.第四方面,本发明提供一种细胞,其表达本发明所述的β-琼胶酶,和/或包含本发明所述的基因或核酸构建体。
14.进一步,所述细胞可为原核细胞或真核细胞。
15.进一步,所述细胞包括但不限于:大肠杆菌细胞、枯草芽孢杆菌细胞、乳酸杆菌细胞、放线菌细胞、酵母菌细胞或藻类细胞等。
16.第五方面,本发明提供所述β-琼胶酶的制备方法,其包括以下步骤:在允许表达所述β-琼胶酶的条件下培养本发明所述的细胞;和从所得培养物中纯化β-琼胶酶。
17.进一步,所述纯化包括以下步骤:收集所述培养物中的菌体沉淀,超声破碎所述菌体,得到菌体破碎液;将所述菌体破碎液进行离心,收集沉淀部分,即为所述β-琼胶酶。
18.进一步,所述离心的条件为2000-4000
×
g,例如2000
×
g、3000
×
g、4000
×
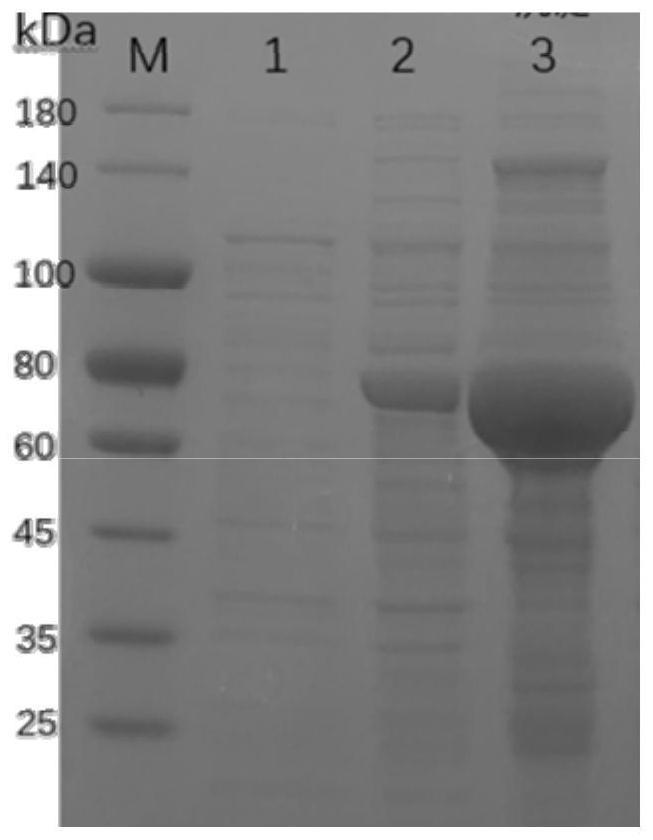
g等;离心的时间为10-15min。
19.第六方面,本发明提供所述β-琼胶酶在以下(i)、(ii)方面之一的应用:
20.(i)水解琼胶;
21.(ii)制备琼胶寡糖。
22.本发明的有益效果为:
23.(1)本发明提供了一种改造后的琼胶酶(命名为aga433f),其为β-琼胶酶,可催化琼胶降解为琼寡糖。本发明为琼胶水解及琼胶寡糖的工业生产提供了优异的基因资源和酶资源,具有广泛的应用前景。
24.(2)本发明提供的β-琼胶酶的最适作用温度为60℃,且在30℃-70℃的温度范围内能均能保持50%以上的活力,具有较宽的作用温度范围、优良的热稳定性,可用于高效水解高温状态下的琼胶。
25.(3)本发明提供的β-琼胶酶的最适作用ph为8.0,在5.0-9.0的ph范围内仍能保持50%以上的活力。
26.(4)本发明还提供了该β-琼胶酶的制备方法。改造前的β-琼胶酶aga433为胞内表达酶,且比宿主细胞的碎片轻;因此在细胞破碎后,通过10000
×
g离心10min,目标表达酶仍会在上清液中,下一步还需要采用亲和层析等进行上清液中的酶的分离,过程复杂,耗时长。而本发明提供的改造后的β-琼胶酶aga433f,通过将一段特定的氨基酸序列加在目标酶的c端,该改造后的酶可以自集聚为24聚体,形成2微米左右的微球。该微球比大部分的宿主的碎片大,通过2000
×
g离心10min,即可离心下来;可以实现目标酶的快速富集,其纯度大于90%。
附图说明
27.通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。在附图中:
28.图1:分析β-琼胶酶aga433f诱导表达结果的sds-page电泳图;
29.其中,m为蛋白质marker,泳道1为空载bl21对照,泳道2为粗酶液,泳道3为粗酶液经1000
×
g、5min离心沉淀处蛋白;
30.图2:检测不同离心力对β-琼胶酶aga433f纯化效率的影响的sds-page电泳图;
31.其中,m为蛋白质marker,泳道1为粗酶液,泳道2为2000
×
g、1min离心沉淀处蛋白,泳道3为3000
×
g、10min离心沉淀处蛋白,泳道4为4000
×
g、10min离心沉淀处蛋白;
32.图3:温度对β-琼胶酶aga433f的相对酶活力的影响;
33.图4:β-琼胶酶aga433f在60℃条件下的热稳定性检测结果;
34.图5:ph对β-琼胶酶aga433f的相对酶活力的影响。
具体实施方式
35.下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
36.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件(例如参考j.萨姆布鲁克等著,黄培堂等译的《分子克隆实验指南》,第三版,科学出版社)或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
37.实施例1β-琼胶酶aga433f的获取
38.在β-琼胶酶aga433(氨基酸序列如seq id no:3所示)的c端加一段特定的氨基酸序列,得到改造后的β-琼胶酶aga433f,其氨基酸序列如seq id no:1所示。委托金唯智生物科技有限公司对aga433f的编码基因进行全序列合成,得到β-琼胶酶aga433f基因,其核苷酸序列如seq id no:2所示。
39.实施例2β-琼胶酶aga433f的克隆表达
40.将实施例1合成的aga433f基因连接至pet-22b(+)载体,连接方法按照载体的说明书进行,获得pet-aga433f重组载体;将获得的重组载体转化至大肠杆菌e.coli bl21(de3)感受态细胞中,并涂布于含有100μg/ml氨苄青霉素的lb固体培养平板上,37℃培养过夜;鉴定得到阳性克隆。
41.将阳性克隆接种至5ml lb液体培养基(含amp)中,37℃、200rpm摇床培养约10h,得到活化的菌液;取500μl活化的菌液转接于50ml lb液体培养基(含amp)中,37℃、200rpm摇床培养至od
600
约为0.8时,加入终浓度为0.1mm的异丙基硫代-β-d-半乳糖苷(iptg),在16℃、180rpm条件下摇床培养20h诱导目的蛋白aga433f的表达。
42.实施例3β-琼胶酶aga433f的分离纯化
43.7000
×
g、20min离心收集实施例2诱导表达得到的菌体,按照菌体沉淀与ddh2o为2:1(v/v)的比例加入ddh2o,吹打均匀后在冰浴下超声破碎菌体重悬液。超声功率:300w、工作时间2s、间隙时间4s、超声时间20min,得到菌体破碎液,即为粗酶液。在4℃下,将粗酶液分别按照以下条件进行离心,然后收集沉淀部分进行sds-page电泳分析:(a)1000
×
g,5min;(b)2000
×
g,10min;(c)3000
×
g,10min;(d)4000
×
g,10min。
44.电泳分析结果见图1和图2所示,图1中,m为蛋白质marker,泳道1为空载bl21对照,泳道2为粗酶液,泳道3为粗酶液经1000
×
g、5min离心沉淀处蛋白。图2中,m为蛋白质marker,泳道1为粗酶液,泳道2为2000
×
g、1min离心沉淀处蛋白,泳道3为3000
×
g、10min离心沉淀处蛋白,泳道4为4000
×
g、10min离心沉淀处蛋白。
45.根据上述结果,与粗酶液相比,经最低2000
×
g的离心力作用后,待纯化的琼胶酶蛋白即可有效达到纯化的目的,且纯度>90%,可用于后续酶学性质测定。并且,虽然提高
离心力可以提高酶活回收率,但同时有更多的杂质与目标酶蛋白一同离心至了沉淀,降低了蛋白纯度。因此,可选用2000-4000
×
g的转速进行离心,优选为2000
×
g。
46.实施例4温度对β-琼胶酶aga433f活性的影响
47.(1)取相同浓度的β-琼胶酶aga433和β-琼胶酶aga433f各50μl,加入200μl 0.2%琼胶,分别置于30℃、40℃、50℃、60℃、70℃、80℃条件下反应15min,加入750μl dns试剂,100℃金属浴反应5min,冷却10min后离心,取200μl反应液于96孔板中测定od
550
吸光值。每组均以灭活的酶液作为空白对照,并将最高酶活力作为100%,计算其余温度下的相对酶活力;以温度(℃)为横坐标,相对酶活力为纵坐标作图,绘制不同温度下的相对酶活曲线,结果如图3所示。
48.(2)将β-琼胶酶aga433和β-琼胶酶aga433f保温于60℃,分别在保温15min、30min、45min、60min、90min、120min后取50μl琼胶酶溶液加入200μl ph为8.0的0.2%琼胶溶液,于60℃条件下反应15min,加入750μl dns试剂,100℃金属浴反应5min,冷却10min后离心,取200μl反应液于96孔板中测定od
550
吸光值。以时间(min)为横坐标,相对酶活力为纵坐标作图,绘制相对酶活曲线图,结果如图4所示。
49.根据上述结果,本发明提供的改造后的β-琼胶酶的最适作用温度为60℃,且在30℃-70℃的温度范围内能均能保持50%以上的活力,具有较宽的作用温度范围;改造后的β-琼胶酶较改造前具有更好的热稳定性,可用于高效水解高温状态下的琼胶。
50.实施例5ph对β-琼胶酶aga433f活性的影响
51.取50μlβ-琼胶酶aga433和β-琼胶酶aga433f分别加入200μl使用不同ph值缓冲液配制的0.2%琼胶溶液,并在60℃条件下反应15min,加入750μl dns试剂,100℃金属浴反应5min,冷却10min后离心,取200μl反应液于96孔板中测定od
550
吸光值。以ph值为横坐标,相对酶活力为纵坐标作图,绘制不同ph下的相对酶活曲线图,结果如图5所示。
52.根据上述结果,本发明提供的β-琼胶酶的最适作用ph为8.0,在5.0-9.0的ph范围内仍能保持50%以上的活力。
53.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1