一种8-喹啉磺酰胺类化合物及其应用的制作方法
1.本发明属于药物化学技术领域,具体涉及一种8-喹啉磺酰胺类化合物及其应用。
背景技术:
2.类风湿性关节炎(ra)是一种慢性的自身免疫性疾病,其病理特征主要表现为关节腔内出现滑膜炎症细胞浸润以及由于血管翳的形成而造成的骨侵蚀。近年来,随着全球人口的老龄化,ra的患病率逐年增加。ra严重时可导致患者关节畸变、活动受限甚至功能丧失,具有比较强的致残性。
3.ra的发病机制极为复杂,迄今为止尚未有确切的病因。目前ra的发病机制包括免疫因素、环境因素、遗传易感因素等。很多研究报道表明机体的免疫因素在ra的发病机制中有重要作用。白细胞介素(il-1β)和肿瘤坏死因子(tnf-α)是ra发生过程中极其重要的细胞因子,在重症类ra患者的血液及关节中都可发现其水平升高。白细胞介素(il-1β)诱导成纤维细胞增殖,活化破骨细胞,促进关节软骨和骨侵。肿瘤坏死因子(tnf-α)增强炎症细胞的侵蚀力,促进ra关节破坏。所以,降低炎症部位tnf-α和il-1β的生成对于治疗ra非常重要。另外炎症反应中,巨噬细胞表面的膜识别受体被脂多糖(lps)刺激后激活炎症通路,巨噬细胞激活还会导致环氧化酶-2(cox-2)、一氧化氮合酶(inos)过表达。
4.目前fda批准用于治疗ra的药物通常会暂时或不完全缓解症状,并伴有严重的副作用。因此,迫切需要开发更有效的、具有较低副作用的治疗ra药物。
技术实现要素:
5.为了解决上述技术问题,本发明的目的之一在于提供一种8-喹啉磺酰胺类化合物。
6.本发明采用的技术方案如下:
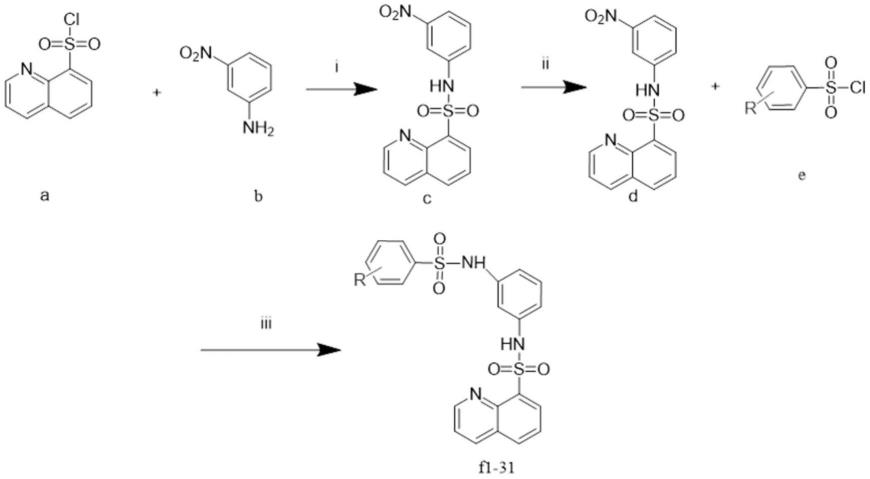
7.一种8-喹啉磺酰胺类化合物,其结构式如式(a)所示:
[0008][0009]
其中r为氢、4-甲基、4-异丙基、2,4,6-三异丙基、4-叔丁基、2,4-二甲氧基、3,4-二甲氧基、2-氟、3-氟、4-氟、2,6-二氟、2-三氟甲基、3-三氟甲基、4-三氟甲基、3,5-二三氟甲基、2-三氟甲氧基、4-三氟甲氧基、2-氯、4-氯、2,6-二氯、3,5-二氯、2-溴、3-溴、4-溴、3-溴-5-三氟甲基、5-溴-2-甲氧基、4-碘、4-氰基、3-硝基、4-硝基、4-乙酰氨基中的任意一种。。
[0010]
该8-喹啉磺酰胺类化合物的制备路线如下:
[0011][0012]
i.根据文献所报道的方法,用8-喹啉磺酰氯与间硝基苯胺发生取代反应,得到化合物c,具体为:8-喹啉磺酰氯与间硝基苯胺溶解在二氯甲烷中,滴加三乙胺使8-喹啉磺酰氯溶解,加入适量四氢呋喃以提供碱性环境,室温下反应过夜后抽滤得到中间体c;
[0013]
ii.化合物c还原得到中间体d,具体为:将中间体c加入甲醇中,当温度升至40度时,加入水合肼和pb/c,随后中间体c发生还原得到中间体d;
[0014]
iii.将中间体d溶于吡啶中,与具有各种取代基的苯磺酰氯反应,柱层析纯化即得到8-喹啉磺酰胺类化合物f1-f31。
[0015]
其中取代基氢、4-甲基、4-异丙基、2,4,6-三异丙基、4-叔丁基、2,4-二甲氧基、3,4-二甲氧基、2-氟、3-氟、4-氟、2,6-二氟、2-三氟甲基、3-三氟甲基、4-三氟甲基、3,5-二三氟甲基、2-三氟甲氧基、4-三氟甲氧基、2-氯、4-氯、2,6-二氯、3,5-二氯、2-溴、3-溴、4-溴、3-溴-5-三氟甲基、5-溴-2-甲氧基、4-碘、4-氰基、3-硝基、4-硝基、4-乙酰氨基中的任意一种。
[0016]
本发明的目的之二在于提供上述是一种8-喹啉磺酰胺类化合物在抗炎药物中的应用。
[0017]
优选的,所属抗炎药物为治疗关节炎的药物。
[0018]
优选的,所述8-喹啉磺酰胺类化合物中r为2,4,6-三异丙基,其结构式如式(b)所示:
[0019][0020]
优选的,所述药物为注射剂、片剂、丸剂、胶囊剂、悬浮剂或乳剂中任意一种。
[0021]
本发明还提供一种用于治疗关节炎的药物,其含有药学上有效剂量的如权利要求1所述的8-喹啉磺酰胺类化合物。
[0022]
优选的,所述8-喹啉磺酰胺类化合物中r为2,4,6-三异丙基。
[0023]
优选的,所述药物还包含有药学上可接受的载体。
[0024]
优选的,所述药学上可接受的载体包括赋形剂、稳定剂、抗氧化剂、着色剂、稀释剂、缓释剂等一种或几种功能的辅料,如淀粉、脂类、蜡、糊精、蔗糖、乳糖、微晶纤维素、明胶、柠檬酸、无机盐类、羟丙基甲基纤维素、羟乙基纤维素等。
[0025]
优选的,所述药物为注射剂、片剂、丸剂、胶囊剂、悬浮剂或乳剂中的任意一种
[0026]
本发明的有益效果为:
[0027]
1.通过细胞实验证明,本发明提供的8-喹啉磺酰胺类化合物能够很好地抑制no的释放,表明该类化合物可以作为抗炎药物应用。
[0028]
2.本发明所提供的8-喹啉磺酰胺类化合物能够以浓度依赖的方式降低炎症相关蛋白环氧化酶-2(cox-2)、一氧化氮合酶(inos)的表达,以剂量依赖性方式降低大鼠血清中的炎症因子tnf-α和il-1β的生成,表明其有潜力发展成为治疗关节炎的药物。
附图说明
[0029]
图1为化合物f1-f33对细胞raw264.7上清中no的影响,**p《0.001,***p《0.0001与lps刺激的细胞相比。
[0030]
图2为化合物(f4、f15、f25、f30)对细胞raw264.7上清中no的ic
50
值分析,*p《0.001,**p《0.001,***p《0.0001与lps刺激的细胞相比。
[0031]
图3为实施例33中化合物f4对细胞raw264.7上清中il-1β和tnf-α的影响,**p《0.001,***p《0.0001与lps刺激的细胞相比。
[0032]
图4为实施例34中化合物f4对炎症相关蛋白质表达的影响。
[0033]
图5为实施例34中化合物f4对炎症相关蛋白质表达的影响,###p《0.0001与对照组相比,*p《0.01,**p《0.001,***p《0.0001与lps刺激的细胞相比。
[0034]
图6为实施例35中各处理组大鼠足部特征结果。
[0035]
图7为实施例35中化合物f4对佐剂诱导的关节炎模型大鼠的影响,其中图7a、图7b、图7c分别对应体重、肿胀度和关节炎指数。
[0036]
图8为实施例35中化合物f4对佐剂诱导关节炎模型大鼠炎症因子的抑制结果,###p《0.0001与对照组相比,**p《0.001与lps刺激的细胞相比。
具体实施方式
[0037]
除非另有说明,本文中所使用的术语均具有本领域技术人员常规理解的含义。下面结合实施例对本发明的技术方案做出更为具体的说明:
[0038]
实施例1
[0039]
化合物f1的合成:
[0040][0041]
将化合物d(299mg,1mm)溶于2ml吡啶中,随后加入苯磺酰氯(取代基r为氢)(176mg,1mm)于室温反应8-12h。tlc检测反应进程。反应结束后,除去反应溶剂。以乙酸乙酯:石油醚(1:4)柱层析纯化即得到化合物f1,f1为白色固体,产率68%。
[0042]1h nmr(500mhz,dmso-d6)δ10.09(d,j=28.9hz,2h),9.11(dd,j=4.3,1.8hz,1h),8.50(d,j=8.4hz,1h),8.28(dd,j=15.5,7.1hz,2h),7.79(d,j=7.0hz,1h),7.60(t,j=7.7hz,1h),7.54(t,j=7.4hz,2h),7.50(d,j=7.1hz,2h),7.40(t,j=7.8hz,2h),7.06(s,1h),6.89(t,j=8.1hz,1h),6.69(d,j=8.1hz,1h),6.54(d,j=8.0hz,1h);
13
c nmr(126mhz,dmso)δ151.38,142.61,139.27,138.10,136.84,134.97,134.14,132.69,132.10,129.23,128.93,127.67,126.37,125.51,122.54,115.39,110.96。
[0043]
实施例2
[0044]
化合物f2的合成:
[0045][0046]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-甲基,得白色固体即化合物f2,产率70%。
[0047]1h nmr(500mhz,dmso-d6)δ10.31(s,2h),9.33(dd,j=4.2,1.9hz,1h),8.72(d,j=8.2hz,1h),8.51(dd,j=23.6,7.9hz,2h),7.98
–
7.86(m,2h),7.61(d,j=8.3hz,2h),7.40(d,j=7.9hz,2h),7.28(s,1h),7.10(t,j=8.1hz,1h),6.89(d,j=8.1hz,1h),6.74(d,j=8.0hz,1h),2.50(s,3h);
13
c nmr(126mhz,dmso)δ151.46,143.07,142.67,138.50,138.31,136.90,136.44,135.00,134.21,132.23,129.44,128.38,126.53,125.57,122.61,115.17,110.63,20.91。
[0048]
实施例3
[0049]
化合物f3的合成:
[0050][0051]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-异丙基,得白色固体即化合物f3,产率76%。
[0052]1h nmr(500mhz,dmso-d6)δ10.15(s,2h),9.12(dd,j=4.2,1.8hz,1h),8.52(dd,j=8.4,1.8hz,1h),8.33(dd,j=7.3,1.5hz,1h),8.28(dd,j=8.3,1.4hz,1h),7.75
–
7.66(m,2h),7.46(d,j=8.5hz,2h),7.27(d,j=8.5hz,2h),7.10(t,j=2.1hz,1h),6.88(t,j=8.1hz,1h),6.67(dd,j=8.1,1.2hz,1h),6.53(dd,j=8.1,1.2hz,1h),2.89(p,j=6.9hz,1h),1.14(d,j=6.9hz,7h);
13
c nmr(126mhz,dmso)δ153.51,151.48,142.71,138.56,138.37,136.95,135.06,134.24,132.25,129.35,128.41,126.98,126.66,125.60,122.63,114.99,110.23,33.27,23.37。
[0053]
实施例4
[0054]
化合物f4的合成:
[0055][0056]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2,4,6-三异丙基,得白色固体即化合物f4,产率79%。
[0057]1h nmr(500mhz,dmso-d6)δ10.12(s,1h),10.03(s,1h),9.08(dd,j=4.2,1.8hz,1h),8.48(dd,j=8.4,1.8hz,1h),8.27
–
8.16(m,2h),7.68(dd,j=8.3,4.2hz,1h),7.64(t,j=7.8hz,1h),7.14(s,2h),6.93(t,j=2.1hz,1h),6.89(t,j=8.1hz,1h),6.64(dd,j=7.8,1.9hz,1h),6.53(dd,j=8.2,2.0hz,1h),4.00(p,j=6.6hz,2h),2.88(p,j=6.9hz,1h),1.17(d,j=6.9hz,6h),0.99(d,j=6.7hz,12h);
13
c nmr(126mhz,dmso)δ151.94,150.37,143.26,139.17,138.62,137.48,135.63,134.72,133.47,132.66,129.70,128.96,126.06,124.19,123.12,115.70,112.46,33.78,29.30,23.90。
[0058]
实施例5
[0059]
化合物f5的合成:
[0060][0061]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-叔丁基,得白色固体即化合物f5,产率70%。
[0062]1h nmr(500mhz,dmso-d6)δ10.10(d,j=15.6hz,2h),9.12(dd,j=4.2,1.8hz,1h),8.52(dd,j=8.4,1.8hz,1h),8.34(dd,j=7.3,1.4hz,1h),8.28(dd,j=8.3,1.4hz,1h),7.73
–
7.70(m,2h),7.52
–
7.44(m,2h),7.44
–
7.39(m,2h),7.11(t,j=2.1hz,1h),6.89(t,j=8.1hz,1h),6.67(ddd,j=8.1,2.1,0.9hz,1h),6.55(ddd,j=8.1,2.2,1.0hz,1h),1.24(s,9h);
13
c nmr(126mhz,dmso)δ155.66,151.39,142.66,138.50,136.84,135.12,134.13,132.10,129.25,128.35,127.33,126.30,125.78,125.52,122.55,114.96,110.21,34.73,30.66。
[0063]
实施例6
[0064]
化合物f6的合成:
[0065][0066]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2,4-二甲氧基,得白色固体即化合物f6,产率61%。
[0067]1h nmr(500mhz,dmso-d6)δ10.04(s,1h),9.75(s,1h),9.10(dd,j=4.2,1.8hz,1h),8.51(dd,j=8.4,1.8hz,1h),8.31
–
8.23(m,2h),7.76
–
7.63(m,2h),7.40(d,j=8.7hz,1h),6.99(t,j=2.1hz,1h),6.86(t,j=8.1hz,1h),6.65
–
6.55(m,2h),6.54(d,j=2.4hz,1h),6.44(dd,j=8.8,2.3hz,1h),3.76(d,j=10.2hz,6h);
13
c nmr(126mhz,dmso)δ164.37,157.84,151.43,142.70,138.57,138.30,136.92,135.11,134.16,132.14,129.03,128.38,125.55,122.59,118.35,115.01,110.74,104.71,99.02,55.71。
[0068]
实施例7
[0069]
化合物f7的合成:
[0070][0071]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3,4-二甲氧基,得白色固体即化合物f7,产率63%。
[0072]1h nmr(500mhz,dmso-d6)δ10.14(s,1h),10.00(s,1h),9.10(dd,j=4.3,1.8hz,1h),8.49(dd,j=8.4,1.8hz,1h),8.29(dd,j=7.3,1.5hz,1h),8.25(dd,j=8.3,1.5hz,1h),7.79
–
7.58(m,2h),7.15(d,j=2.2hz,1h),7.09
–
7.05(m,2h),6.89(dt,j=8.1,3.8hz,2h),6.68
–
6.63(m,1h),6.57(dd,j=8.1,1.1hz,1h),3.79(s,3h),3.68(s,3h);
13
c nmr(126mhz,dmso)δ152.07,151.44,148.43,142.69,138.50,138.48,136.92,135.03,134.23,132.20,130.79,129.29,128.38,125.50,122.60,120.41,115.10,110.78,109.24,55.63。
[0073]
实施例8
[0074]
化合物f8的合成:
[0075][0076]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2-氟,得白色固体即化合物f8,产率55%。
[0077]1h nmr(500mhz,dmso-d6)δ10.54(s,1h),10.14(s,1h),9.09(dd,j=4.2,1.8hz,1h),8.48(dd,j=8.4,1.7hz,1h),8.25(ddd,j=15.7,7.8,1.5hz,2h),7.71
–
7.64(m,2h),7.66
–
7.54(m,2h),7.35
–
7.28(m,1h),7.24(td,j=7.7,1.1hz,1h),7.03(t,j=2.1hz,1h),6.91(t,j=8.1hz,1h),6.68(dd,j=8.1,1.2hz,1h),6.60(dd,j=8.0,1.3hz,1h);
13
c nmr(126mhz,dmso)δ157.00,151.46,142.66,138.58,137.65,136.92,135.85,134.95,134.24,132.22,130.36,129.41,128.36,125.56,124.76,122.61,117.22,115.40,110.54。
[0078]
实施例9
[0079]
化合物f9的合成:
[0080][0081]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3-氟,得白色固体即化合物f9,产率58%。
[0082]1h nmr(500mhz,dmso-d6)δ10.26(s,1h),10.16(s,1h),9.10(dd,j=4.2,1.8hz,1h),8.50(dd,j=8.4,1.8hz,1h),8.28(ddd,j=18.9,7.8,1.5hz,2h),7.74
–
7.65(m,2h),7.52
–
7.40(m,2h),7.31(dd,j=17.5,7.9hz,2h),7.04(t,j=2.1hz,1h),6.92(t,j=8.1hz,1h),6.74
–
6.68(m,1h),6.60
–
6.49(m,1h);
13
c nmr(126mhz,dmso)δ160.46,151.46,142.64,141.26,138.58,137.73,136.94,134.90,134.28,132.22,131.51,129.46,128.36,125.52,122.61,120.18,115.62,113.63,111.09。
[0083]
实施例10
[0084]
化合物f10的合成:
[0085][0086]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-氟,得白色固体即化合物f10,产率54%。
[0087]1h nmr(500mhz,dmso-d6)δ10.11(d,j=34.8hz,2h),9.11(dd,j=4.2,1.8hz,1h),8.50(dd,j=8.4,1.8hz,1h),8.30(dd,j=7.3,1.4hz,1h),8.27(dd,j=8.3,1.5hz,1h),7.73
–
7.67(m,2h),7.56(dd,j=8.9,5.1hz,2h),7.25(t,j=8.8hz,2h),7.02(t,j=2.1hz,1h),6.91(t,j=8.1hz,1h),6.71(ddd,j=8.3,2.2,1.0hz,1h),6.55(ddd,j=8.0,2.2,1.0hz,1h);
13
c nmr(126mhz,dmso)δ165.13,151.39,142.61,138.49,137.90,136.85,134.98,134.15,132.08,129.48,129.31,128.32,125.47,122.54,116.24,115.59,111.15。
[0088]
实施例11
[0089]
化合物f11的合成:
[0090][0091]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2,6-二氟,得白色固体即化合物f11,产率49%。
[0092]1h nmr(500mhz,dmso-d6)δ10.77(s,1h),10.13(s,1h),9.08(dd,j=4.3,1.8hz,1h),8.48(dd,j=8.3,1.8hz,1h),8.23(t,j=8.2hz,2h),7.71
–
7.64(m,3h),7.19(t,j=9.0hz,2h),7.00(s,1h),6.94(t,j=8.1hz,1h),6.70
–
6.63(m,2h);
13
c nmr(126mhz,dmso)δ159.79,151.39,142.61,138.63,137.38,136.90,134.91,134.21,132.08,129.43,128.32,125.48,122.57,115.67,114.42,113.45,110.58。
[0093]
实施例12
[0094]
化合物f12的合成:
[0095][0096]
方法同实施例一,所不同的是苯磺酰氯中取代基r为2-三氟甲基,得白色固体即化合物f12,产率57%。
[0097]1h nmr(500mhz,dmso-d6)δ10.06(s,1h),9.71(s,1h),8.63(dd,j=4.3,1.8hz,1h),8.03(dd,j=8.4,1.8hz,1h),7.79(dd,j=7.8,2.7hz,2h),7.50(d,j=6.7hz,1h),7.35(q,j=7.6hz,2h),7.27
–
7.18(m,3h),6.55(t,j=2.1hz,1h),6.48(t,j=8.1hz,1h),6.26(dd,j=7.3,1.6hz,1h),6.17
–
6.11(m,1h);
13
c nmr(126mhz,dmso)δ151.41,142.63,138.62,138.09,137.67,136.90,134.94,134.23,133.36,133.05,132.14,130.56,129.46,128.33,125.49,123.78,122.58,121.60,115.33,110.66。
[0098]
实施例13
[0099]
化合物f13的合成:
[0100][0101]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3-三氟甲基,得白色固体即化合物f13,产率60%。
[0102]1h nmr(500mhz,dmso-d6)δ10.33(s,1h),10.19(s,1h),9.09(dd,j=4.2,1.8hz,1h),8.48(dd,j=8.4,1.8hz,1h),8.26(ddd,j=20.1,7.8,1.4hz,2h),7.96(d,j=7.8hz,1h),7.87(s,1h),7.73(d,j=8.0hz,1h),7.68(td,j=8.2,3.2hz,3h),7.04(t,j=2.1hz,1h),6.93(t,j=8.1hz,1h),6.73(dd,j=8.2,1.2hz,1h),6.55(dd,j=8.1,1.3hz,1h);
13
c nmr(126mhz,dmso)δ151.43,142.65,140.36,138.68,137.52,136.91,134.92,134.26,132.19,130.66,130.42,129.51,128.36,125.48,124.31,122.58,122.14,115.80,111.37。
[0103]
实施例14
[0104]
化合物f14的合成:
[0105][0106]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-三氟甲基,得白色固体即化合物f14,产率63%。
[0107]1h nmr(500mhz,dmso-d6)δ10.44(s,1h),10.18(s,1h),9.11(dd,j=4.2,1.8hz,1h),8.50(dd,j=8.4,1.8hz,1h),8.31(dd,j=7.3,1.4hz,1h),8.26(dd,j=8.2,1.5hz,1h),7.84(d,j=8.3hz,2h),7.75(d,j=8.2hz,2h),7.73
–
7.65(m,2h),7.05(t,j=2.1hz,1h),6.92(t,j=8.1hz,1h),6.71(dd,j=7.8,1.8hz,1h),6.60
–
6.51(m,1h);
13
c nmr(126mhz,dmso)δ151.49,143.16,142.67,138.65,137.62,136.92,134.97,134.26,132.23,129.54,128.38,127.51,126.38,126.35,125.52,122.63,115.66,110.96。
[0108]
实施例15
[0109]
化合物f15的合成:
[0110][0111]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3,5-二三氟甲基,得白色固体即化合物f15,产率53%。
[0112]1h nmr(500mhz,dmso-d6)δ10.44(s,1h),10.18(s,1h),9.11(dd,j=4.2,1.8hz,1h),8.50(dd,j=8.4,1.8hz,1h),8.31(dd,j=7.3,1.4hz,1h),8.26(dd,j=8.2,1.5hz,1h),7.84(d,j=8.3hz,2h),7.75(d,j=8.2hz,2h),7.73
–
7.65(m,2h),7.05(t,j=2.1hz,1h),6.92(t,j=8.1hz,1h),6.71(dd,j=7.8,1.8hz,1h),6.60
–
6.51(m,1h);
13
c nmr(126mhz,dmso)δ151.38,142.65,141.69,138.86,136.93,134.91,134.29,132.13,131.43,131.16,129.66,128.38,127.07,125.34,123.47,122.55,116.07,111.79。
[0113]
实施例16
[0114]
化合物f16的合成:
[0115][0116]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2-三氟甲氧基,得白色固体即化合物f16,产率57%。
[0117]1h nmr(500mhz,dmso-d6)δ9.59(s,1h),9.26(s,1h),8.22(dd,j=4.2,1.8hz,1h),7.62(dd,j=8.4,1.8hz,1h),7.38(dd,j=7.8,1.6hz,2h),6.96
–
6.75(m,4h),6.60(d,j=8.9hz,1h),6.54(t,j=7.7hz,1h),6.10(t,j=2.1hz,1h),6.04(t,j=8.1hz,1h),5.81(ddd,j=8.1,2.1,0.9hz,1h),5.71(ddd,j=8.1,2.2,0.9hz,1h);
13
c nmr(126mhz,dmso)δ151.43,142.66,138.54,137.63,136.91,135.34,134.97,134.23,132.15,131.30,130.91,129.35,128.36,127.24,125.51,122.59,120.86,115.27,114.67,110.49。
[0118]
实施例17
[0119]
化合物f17的合成:
[0120][0121]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-三氟甲氧基,得白色固体即化合物f17,产率61%。
[0122]1h nmr(500mhz,dmso-d6)δ10.30(s,1h),10.15(s,1h),9.11(dd,j=4.2,1.8hz,1h),8.51(dd,j=8.4,1.8hz,1h),8.29(ddd,j=16.1,7.8,1.5hz,2h),7.70(1h nmr(500mhz,dmso-d6)δ10.30(s,1h),10.15(s,1h),9.11(dd,j=4.2,1.8hz,1h),8.51(dd,j=8.4,1.8hz,1h),8.29(ddd,j=16.1,7.8,1.5hz,2h),7.75
–
7.66(m,2h),7.64(d,j=8.9hz,2h),7.43(d,j=7.8hz,2h),7.04(t,j=2.1hz,1h),6.91(t,j=8.1hz,1h),6.69(ddd,j=8.1,2.1,0.9hz,1h),6.53(ddd,j=8.1,2.2,0.9hz,1h);
13
c nmr(126mhz,dmso)δ151.49,150.96,142.66,138.60,138.17,137.79,136.93,134.97,134.25,132.22,129.48,129.11,128.38,125.54,122.63,121.20,115.56,110.92。
[0123]
实施例18
[0124]
化合物f18的合成:
[0125][0126]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2-氯,得白色固体即化合物f18,产率60%。
[0127]1h nmr(500mhz,dmso-d6)δ10.50(s,1h),10.13(s,1h),9.09(dd,j=4.3,1.8hz,1h),8.49(dd,j=8.4,1.8hz,1h),8.25(dd,j=7.8,3.7hz,2h),7.79(dd,j=7.9,1.6hz,1h),7.74
–
7.63(m,2h),7.55(dt,j=13.3,6.4hz,2h),7.45
–
7.35(m,1h),7.01(s,1h),6.90(t,j=8.1hz,1h),6.63(ddd,j=32.5,8.0,2.1hz,2h);
13
c nmr(126mhz,dmso)δ151.43,142.64,138.54,137.49,136.91,136.26,134.49,131.68,130.60,129.37,128.35,127.50,125.55,122.59,115.22,114.43,110.23。
[0128]
实施例19
[0129]
化合物f19的合成:
[0130][0131]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-氯,得白色固体即化合物f19,产率52%。
[0132]1h nmr(500mhz,dmso-d6)δ10.26(s,1h),10.15(s,1h),9.11(dd,j=4.3,1.8hz,1h),8.50(dd,j=8.4,1.8hz,1h),8.28(ddd,j=18.7,7.8,1.5hz,2h),7.75
–
7.63(m,2h),7.50(s,4h),7.03(t,j=2.1hz,1h),6.92(t,j=8.1hz,1h),6.78
–
6.66(m,1h),6.55(dd,j=8.2,1.5hz,1h).;
13
c nmr(126mhz,dmso)δ151.47,142.65,138.57,138.06,137.83,137.71,136.90,134.95,134.23,132.21,129.45,129.22,128.41,125.53,122.61,115.60,111.03。
[0133]
实施例20
[0134]
化合物f20的合成:
[0135][0136]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2,6-二氯,得白色固体即化合物f20,产率61%。
[0137]1h nmr(500mhz,dmso-d6)δ10.68(s,1h),10.10(s,1h),9.08(dd,j=4.2,1.8hz,1h),8.49(dd,j=8.4,1.8hz,1h),8.23(ddd,j=10.4,7.8,1.5hz,2h),7.80
–
7.60(m,2h),7.60
–
7.39(m,3h),7.13
–
6.78(m,2h),6.64(ddd,j=12.8,8.1,1.6hz,2h);
13
c nmr(126mhz,dmso)δ151.41,142.64,138.60,137.32,136.93,134.94,134.26,133.98,133.85,132.09,131.72,129.37,128.36,125.54,122.59,113.97,110.55。
[0138]
实施例21
[0139]
化合物f21的合成:
[0140][0141]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3,5-二氯,得白色固体即化合物f21,产率56%。
[0142]1h nmr(500mhz,dmso-d6)δ10.37(s,1h),10.24(s,1h),9.09(dd,j=4.2,1.8hz,1h),8.46(dd,j=8.4,1.8hz,1h),8.31(dd,j=7.3,1.5hz,1h),8.23(dd,j=8.3,1.5hz,1h),7.86(t,j=1.9hz,1h),7.72
–
7.60(m,2h),7.48(d,j=1.9hz,2h),7.04(t,j=2.1hz,1h),6.97(t,j=8.1hz,1h),6.77(ddd,j=8.2,2.1,0.9hz,1h),6.57(ddd,j=8.1,2.1,0.9hz,1h);
13
c nmr(126mhz,dmso)δ151.40,142.65,142.24,138.75,137.23,136.94,134.96,134.35,132.64,132.22,129.63,128.35,125.42,125.00,122.55,115.89,111.37。
[0143]
实施例22
[0144]
化合物f22的合成:
[0145][0146]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2-溴,得白色固体即化合物f22,产率49%。
[0147]1h nmr(500mhz,dmso-d6)δ10.49(s,1h),10.12(s,1h),9.09(dd,j=4.3,1.8hz,1h),8.49(dd,j=8.4,1.8hz,1h),8.30
–
8.19(m,2h),7.89
–
7.78(m,1h),7.75
–
7.62(m,3h),7.57
–
7.39(m,2h),7.00(s,1h),6.90(t,j=8.1hz,1h),6.63(dd,j=31.5,8.0hz,2h);
13
c nmr(126mhz,dmso)δ151.41,142.63,138.53,138.02,137.50,136.90,135.26,134.94,134.41,134.21,132.18,131.63,129.33,128.34,128.03,125.53,122.58,119.04,110.12。
[0148]
实施例23
[0149]
化合物f23的合成:
[0150][0151]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3-溴,得白色固体即化合物f23,产率51%。
[0152]1h nmr(500mhz,dmso-d6)δ10.26(s,1h),10.17(s,1h),9.09(dd,j=4.2,1.8hz,1h),8.50(dd,j=8.4,1.8hz,1h),8.28(ddd,j=17.7,7.8,1.5hz,2h),7.78(ddd,j=8.0,2.0,1.0hz,1h),7.75
–
7.64(m,3h),7.45(dt,j=7.9,1.3hz,1h),7.37(t,j=7.9hz,1h),7.04(t,j=2.1hz,1h),6.92(t,j=8.1hz,1h),6.71(ddd,j=8.1,2.1,0.9hz,1h),6.53(ddd,j=8.0,2.1,0.9hz,1h);
13
c nmr(126mhz,dmso)δ151.44,142.64,141.21,138.63,137.66,136.95,135.76,134.89,134.32,132.24,131.28,129.48,128.84,125.48,122.60,122.02,115.62,111.09。
[0153]
实施例24
[0154]
化合物f24的合成:
[0155][0156]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-溴,得白色固体即化合物f24,产率48%。
[0157]1h nmr(500mhz,dmso-d6)δ10.21(s,1h),10.08(s,1h),9.10(dd,j=4.2,1.8hz,1h),8.50(dd,j=8.4,1.8hz,1h),8.34
–
8.20(m,2h),7.75
–
7.67(m,2h),7.64(d,j=8.6hz,2h),7.43(d,j=8.6hz,2h),7.01(t,j=2.0hz,1h),6.91(t,j=8.1hz,1h),6.74
–
6.66(m,1h),6.54(dd,j=8.0,1.2hz,1h);
13
c nmr(126mhz,dmso)δ151.39,142.60,138.51,137.77,136.84,134.96,134.14,132.08,129.35,128.42,128.31,126.62,125.46,122.54,115.60,115.16,111.07。
[0158]
实施例25
[0159]
化合物f25的合成:
[0160][0161]
方法同实施例1,所不同的是苯磺酰氯中取代基r为2-溴-3-三氟甲基,得白色固体即化合物f25,产率51%。
[0162]1h nmr(500mhz,dmso-d6)δ10.40(s,1h),10.24(s,1h),9.07(dd,j=4.2,1.8hz,1h),8.48(dd,j=8.4,1.8hz,1h),8.29(d,j=7.4hz,2h),8.24(dd,j=8.3,1.5hz,1h),7.92(s,1h),7.81(s,1h),7.72
–
7.63(m,2h),7.03(t,j=2.1hz,1h),6.96(t,j=8.1hz,1h),6.76(dd,j=7.8,1.4hz,1h),6.55(dd,j=8.1,1.3hz,1h);
13
c nmr(126mhz,dmso)δ151.39,142.65,142.07,138.80,137.08,136.95,134.88,134.34,132.91,132.66,132.17,131.47,129.63,128.36,125.38,123.30,122.55,122.12,115.99,111.59。
[0163]
实施例26
[0164]
化合物f26的合成:
[0165][0166]
方法同实施例1,所不同的是苯磺酰氯中取代基r为5-溴-2-甲氧基,得白色固体即化合物f26,产率46%。
[0167]1h nmr(500mhz,dmso-d6)δ10.13(s,1h),10.04(s,1h),9.09(dd,j=4.2,1.8hz,1h),8.47(dd,j=8.5,1.8hz,1h),8.24(ddd,j=12.1,7.8,1.5hz,2h),7.74
–
7.61(m,4h),7.07(d,j=8.9hz,1h),7.02(t,j=2.1hz,1h),6.91(t,j=8.1hz,1h),6.63(ddd,j=13.9,8.1,1.2hz,2h),3.77(s,3h);
13
c nmr(126mhz,dmso)δ155.58,151.42,142.68,138.45,137.82,136.95,134.97,134.26,132.18,131.90,129.26,128.34,128.06,125.45,122.57,115.51,115.23,111.31,110.96,56.43。
[0168]
实施例27
[0169]
化合物f27的合成:
[0170][0171]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-碘,得白色固体即化合物f27,产率45%。
[0172]1h nmr(500mhz,dmso-d6)δ10.25(s,1h),10.15(s,1h),9.11(dd,j=4.2,1.8hz,1h),8.51(dd,j=8.5,1.8hz,1h),8.37
–
8.24(m,2h),7.82(d,j=8.5hz,2h),7.75
–
7.66(m,2h),7.26(d,j=8.5hz,2h),7.02(t,j=2.1hz,1h),6.90(t,j=8.1hz,1h),6.69(dd,j=8.2,1.2hz,1h),6.53(dd,j=8.1,1.2hz,1h);
13
c nmr(126mhz,dmso)δ151.48,142.65,138.84,138.55,137.96,136.92,134.94,134.23,132.23,129.44,128.35,128.15,125.57,122.63,115.50,110.84,101.13。
[0173]
实施例28
[0174]
化合物f28的合成:
[0175][0176]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-氰基,得白色固体即化合物f28,产率48%。
[0177]1h nmr(500mhz,dmso-d6)δ10.44(s,1h),10.18(s,1h),9.11(dd,j=4.2,1.8hz,1h),8.51(dd,j=8.4,1.8hz,1h),8.29(t,j=8.0hz,2h),7.94(d,j=8.6hz,2h),7.75
–
7.68(m,2h),7.66(d,j=8.5hz,2h),7.00(t,j=2.1hz,1h),6.93(t,j=8.1hz,1h),6.73(dd,j=7.2,1.7hz,1h),6.55(dd,j=8.1,1.3hz,1h);
13
c nmr(126mhz,dmso)δ151.50,143.22,142.64,138.64,137.44,136.96,134.30,133.29,132.25,129.58,128.36,127.24,125.57,122.65,117.56,115.86,115.30,111.19。
[0178]
实施例29
[0179]
化合物f29的合成:
[0180][0181]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3-硝基,得白色固体即化合物f29,产率58%。
[0182]1h nmr(500mhz,dmso-d6)δ10.46(s,1h),10.18(s,1h),9.08(dd,j=4.3,1.8hz,1h),8.48(dd,j=8.4,1.8hz,1h),8.41(ddd,j=8.2,2.3,1.0hz,1h),8.38(t,j=2.0hz,1h),8.25(ddd,j=14.0,7.8,1.4hz,2h),7.85(dt,j=7.9,1.2hz,1h),7.76
–
7.63(m,3h),7.08
–
6.83(m,2h),6.74(dd,j=8.2,1.2hz,1h),6.60(dd,j=8.1,1.2hz,1h);
13
c nmr(126mhz,dmso)δ150.43,146.77,141.61,139.77,137.66,136.32,135.91,133.89,133.27,131.39,130.10,128.61,127.33,126.56,124.47,121.60,120.33,114.97,110.54。
[0183]
实施例30
[0184]
化合物f30的合成:
[0185][0186]
方法同实施例1,所不同的是苯磺酰氯中取代基r为4-硝基,得白色固体即化合物f30,产率61%。
[0187]1h nmr(500mhz,dmso-d6)δ10.48(s,1h),10.13(s,1h),9.10(dd,j=4.2,1.8hz,1h),8.48(dd,j=8.4,1.8hz,1h),8.32(dd,j=7.4,1.5hz,1h),8.27
–
8.22(m,3h),7.80
–
7.76(m,2h),7.72
–
7.66(m,2h),7.02(t,j=2.1hz,1h),6.94(t,j=8.1hz,1h),6.75(ddd,j=8.2,2.1,1.0hz,1h),6.60(ddd,j=8.1,2.1,0.9hz,1h);
13
c nmr(126mhz,dmso)δ151.42,149.69,144.66,142.63,138.64,137.36,136.85,135.01,134.16,132.11,129.54,128.06,125.48,124.36,122.56,115.91,111.34。
[0188]
实施例31
[0189]
化合物f31的合成:
[0190][0191]
方法同实施例1,所不同的是苯磺酰氯中取代基r为3-硝基,得白色固体即化合物f31,产率66%。
[0192]1h nmr(500mhz,dmso-d6)δ10.26(s,1h),10.02(d,j=13.8hz,2h),9.11(d,j=2.5hz,1h),8.47(d,j=8.3hz,1h),8.27(dd,j=30.4,7.8hz,2h),7.69(d,j=8.1hz,2h),7.61(d,j=8.4hz,2h),7.44(d,j=8.5hz,2h),7.05(s,1h),6.88(t,j=8.1hz,1h),6.68(d,j=7.9hz,1h),6.53(d,j=7.8hz,1h),2.10(s,3h);
13
c nmr(126mhz,dmso)δ169.05,151.44,143.00,142.65,138.44,136.88,135.00,134.17,132.87,132.14,129.25,128.33,127.69,125.50,122.57,118.34,115.32,110.94,24.13。
[0193]
实施例32:
[0194]
no释放的抑制性实验:在lps诱导的raw264.7细胞模型中,通过测试化合物抑制no释放情况来评估其抗炎能力。
[0195]
raw264.7细胞培养在dmem培养基(10%胎牛血清和青霉素100u/ml、链霉素100u/ml)。将raw264.7细胞以每孔6
×
104个接种于48孔板中培养24h(37℃,5%co2)。弃掉旧培养基,加入预先配制好的含药培养基(f1-f31)预处理1小时,然后每孔加入30μl lps(1μg/ml)共孵育24小时。取50μl细胞培养液上清于96孔板中,采用elisa方法,每孔依次加入50μl griess a ssay agent i与griess assay agent ii混合,室温孵育10分钟,在540nm下用多功能酶标仪测定吸光度。
[0196]
测定在30μm下化合物f1-f31分别对no的抑制能力,结果以三次实验的平均值
±
sd表示,结果见表1、图1。
[0197]
表1化合物对no产生的抑制能力(30μm)
[0198]
[0199][0200]
从表1和图1可看出,所有的化合物在30μm对raw264.7细胞no的产生均表现出一定的抑制作用,其中有四个化合物f4、f15、f25和f30的抑制能力比阳性药(吲哚美辛)好,接下来选择这四个化合物测定ic
50
。
[0201]
ic
50
定义为lps刺激raw264.7细胞产生50%no时化合物的浓度,结果以三次实验的平均值
±
sd表示,结果见表2、图2。
[0202]
表2化合物对no产生的抑制作用
[0203][0204]
从表2和图2可看出,四个化合物对no的产生均表现出很好的抑制作用,其中化合物f4表现出最好的抑制活性(ic
50
=20.40
±
0.94μm),并明显优于阳性药。实验表明本发明提供的8-喹啉磺酰胺类化合物在一定程度上能够抑制炎症因子no的释放,表明8-喹啉磺酰胺类化合物有潜力发展成为抗炎药物。
[0205]
实施例33
[0206]
炎症因子il-1β和tnf-α的释放实验
[0207]
在lps诱导的raw264.7细胞模型中,测试化合物f4抑制炎症因子il-1β和tnf-α的释放情况。
[0208]
用阳性药物吲哚美辛(30μm)和不同浓度的f4(7.5μm、15μm、30μm、60μm、80μm)一起孵育细胞,使用elisa试剂盒(基因美,武汉)按照说明书方法测定化合物f4对细胞上清il-1β和tnf-α的影响,结果见图3。
[0209]
从图3可以看出,化合物f4能以剂量依赖性方式降低细胞上清中的炎症因子il-1β和tnf-α的释放。
[0210]
实施例34
[0211]
蛋白质印迹(western blot)实验
[0212]
将raw264.7细胞与不同浓度的化合物f4(5μm、10μm和20μm)和阳性药物bay11-7082(10μm)共同孵育1小时,然后用lps刺激细胞24小时。通过蛋白质印迹分析化合物f4对环氧化酶-2(cox-2)、一氧化氮合酶(inos)的表达的抑制能力,进一步评估化合物的抗炎作用,结果见图4、5。
[0213]
图4为化合物f4对炎症相关蛋白表达的影响图,可以看出随着化合物f4浓度的降低,炎症蛋白cox-2和inos的表达量明显升高。图5中结果显示为至少三个独立实验的平均值
±
sd(n=3),可以看出,与模型组(lps)相比,化合物f4以浓度依赖性方式降低cox-2和inos的表达。表明化合物f4可以抑制炎症蛋白(cox-2、inos)的表达。
[0214]
实施例35
[0215]
佐剂性关节炎(adjuvant arthritis,aa)实验
[0216]
炎症反应中,巨噬细胞表面的膜识别受体被脂多糖(lps)刺激后激活炎症通路,因此巨噬细胞常被用作体外模型研究炎症。巨噬细胞激活会导致环氧化酶-2(cox-2)、一氧化氮合酶(inos)过表达。ra相关动物实验模型的构建多为实验室标准情况下的发病,所以本实验尝试从病证结合动物模型进行研究ra。ra病证结合动物模型建立在ra模型的基础上,ra模型中佐剂型关节炎(aa)模型应用较广泛,其起病急,有自愈性,可以模拟ra急性发病与缓解的病程特点,在这些基础上,本实验选择佐剂性关节炎模型。
[0217]
1)实验动物:
[0218]
雌性sd大鼠(180-220g),安徽医科大学实验中心提供。大鼠在温湿度可控(23℃~25℃,40%~60%,12h)的标准条件下饲养。
[0219]
2)佐剂性关节炎诱导及实验处理:
[0220]
将50只大鼠随机分为5组,模型组给大鼠的左后足注射0.1ml完全弗氏佐剂(fca)引起炎症,正常组给大鼠在同一部位注射等量生理盐水。在fca注射10天后,正常组和模型组采用0.5%羧甲基纤维素钠(cmc-na)溶液灌胃14天,药物组采用具有不同浓度的化合物f4(30mg/kg、10mg/kg)灌胃14天,阳性对照组采用吲哚美辛(10mg/kg)灌胃14天。
[0221]
各处理组的大鼠足部特征结果见图6、图7。可以看出,使用化合物f4(10和30mg/kg)和阳性药物(10mg/kg)用于治疗大鼠佐剂性关节炎(aa)模型,与模型组相比,药物组以浓度依赖性方式减轻了脚的肿胀(图6和图7b),并且当给药剂量≥10mg/kg时,给药组体重得到改善(图7a),在第24天,30mg/kg的化合物f4显着降低了关节炎指数(图7c)。
[0222]
3)il-1β和tnf-α含量的体内测定
[0223]
麻醉各处理组大鼠后,从心脏动脉采血,静置30分钟后以4℃3000r/min离心10分钟收集血清,然后采用elisa方法测定血清中il-1β和tnf-α的水平。实验结果见图8。
[0224]
图8可以看出,大鼠血清中的炎症因子il-1β、tnf-α在正常组、模型组的生成均显著增加,但化合物f4能以剂量依赖性方式降低大鼠血清中的炎症因子il-1β、tnf-α的生成。
[0225]
上述实验表明化合物f4有潜力发展成为治疗关节炎的药物。
[0226]
以上仅为本发明的较佳实用例而已,并不用以限制本发明创造;尽管参照前述实施方式对本发明进行了详细的说明,本领域的普通技术人员应当理解:凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明创造的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1