用于检测鰤鱼诺卡氏菌核酸的引物、荧光探针和试剂盒
buffer和含mg离子的溶液。
11.所述核酸释放试剂包括:无菌水、triton-x100、np-40和tris-hcl。
12.所述阴性质控品为不含鰤鱼诺卡氏菌的its基因的pmt18-t载体质粒dna。
13.所述阳性质控品为含有所述鰤鱼诺卡氏菌的its基因片段的pmt18-t载体质粒dna,浓度为50ng/μl。
14.具体地,所述具有5'
→
3'外切活性的dna聚合酶为taq酶。
15.进一步地,所述pcr反应液中所述taq酶的终浓度为0.01~0.03u/μl,所述dntps的终浓度为0.2~0.4mm,所述10
×
pcr buffer的终浓度为原浓度的1/10,所述mgcl2的终浓度为1.5~3.0mm,溶剂为无菌水。
16.具体地,所述正向引物的终浓度为0.1~0.3μm,所述反向引物的终浓度为0.1~0.3μm,所述荧光探针的终浓度为0.3~0.6μm。
17.具体地,所述核酸释放试剂中所述triton-x100的终浓度为0.03~0.3%,所述np-40的终浓度为0.04~0.4%,所述tris-hcl的终浓度为0.01~0.1m,溶剂为无菌水。
18.进一步地,所述tris-hcl的ph值为7.8~8.2。
19.有益效果是:本发明通过在鰤鱼诺卡氏菌基因组中具有多拷贝的its上选择一段保守序列,并针对该序列设计引物和探针,使得该引物和荧光探针具有高特异性及高灵敏度,不仅可以检测无发病症状鱼类体内是否存在鰤鱼诺卡氏菌,也可检测养殖水体鰤鱼诺卡氏菌丰度。
附图说明
20.图1是本发明实施例2提供的检测灵敏度的荧光扩增曲线;
21.图2是本发明实施例3提供的检测特异性的荧光扩增曲线;
22.图3是本发明实施例4提供的检测临床样本的荧光扩增曲线;
23.图4是本发明实施例5提供的检测环境样本的荧光扩增曲线。
具体实施方式
24.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
25.下述实施例中所用的材料、试剂等,如无特殊说明,均购自宝生物工程(大连)有限公司。
26.实施例1:用于检测引物和荧光探针组合的制备
27.选取鰤鱼诺卡氏菌特异性保守基因its基因作为目标检测基因,通过美国国家生物技术信息中心(national center for biotechnology information,ncbi),获得10条不同鱼类分离的鰤鱼诺卡氏菌基因序列,并处用clustalw2(http://www.ebi.ac.uk/tools/msa/clustalw2/)软件进行序列比对,并从中选出一段保守序列,该序列如序列表中seq id no.4所示,利用实时taqman荧光定量pcr的设计软件beacondesigner 8.0设计引物和荧光探针序列,引物序列如下所示:
[0028][0029]
表中的f:forward,正向;its-f表示用于检测鰤鱼诺卡氏菌核酸的正向引物。
[0030]
表中的r:reverse,反向;its-r表示用于检测鰤鱼诺卡氏菌核酸的反向引物。
[0031]
表中的probe:荧光探针;its-probe表示用于检测鰤鱼诺卡氏菌核酸的荧光探针,该探针为荧光taqman探针,修饰所述5’的荧光报告基团为fam,修饰所述3’端淬灭基团为tamra nhs。
[0032]
表中的引物和荧光探针均委托广州擎科生物技术有限公司合成。
[0033]
实施例2:灵敏度
[0034]
取鰤鱼诺卡氏菌质粒dna,用无菌水进行10倍梯度稀释,得到多个稀释液。
[0035]
鰤鱼诺卡氏菌质粒dna为含有鰤鱼诺卡氏菌its基因的115个碱基对的核苷酸片段的pmt18-t质粒dna,初始拷贝数为1.9
×
109copies/μl。
[0036]
稀释液中含有的鰤鱼诺卡氏菌its基因的拷贝数为1.9
×
108~1.9
×
101copies/μl。
[0037]
反应体系如下:
[0038]
[0039]
扩增条件为:步骤一,95℃30s;步骤二,95℃5s,60℃30s,40个循环,在步骤二60℃终了时读取荧光阈值循环数(ct值)。
[0040]
反应过程中,采用荧光pcr仪检测荧光信号。以循环数为横坐标,荧光信号强度为纵坐标,绘制扩增曲线,自动读取ct值。
[0041]
如果在扩增完成时没出现阳性扩增曲线(即扩增曲线为“s型”扩增曲线)或ct值大于35,表明反应体系中鰤鱼诺卡氏菌质粒dna相应的拷贝数不可以被检测出来。如果在扩增完成时出现阳性扩增曲线且ct值小于35,表明反应体系中鰤鱼诺卡氏菌质粒dna相应的拷贝数可以被检测出来。
[0042]
按照上述方法,将稀释液替换为无菌水,其它步骤均不变,作为阴性对照。
[0043]
实验结果见图1。结果表明,鰤鱼诺卡氏菌dna相应的拷贝数为1.9
×
108~1.9
×
101copies/μl时,在扩增完成时出现阳性扩增曲线且ct值小于35。由此可见,实施例1制备的用于鉴定鰤鱼诺卡氏菌引物组合检测鰤鱼诺卡氏菌质粒dna的灵敏度为19个拷贝数/反应体系。
[0044]
实施例3:特异性
[0045]
待测dna为鰤鱼诺卡氏菌质粒dna、鰤鱼诺卡氏菌基因组dna、以及杂交鳢基嗜水气单胞菌、迟缓爱德华氏菌、杀鱼爱德华氏菌、弗氏柠檬酸杆菌、不动杆菌、舒伯特气单胞菌、恶臭假单胞菌、维氏气单胞菌、无乳链球菌、海豚链球菌、绿藻、红线虫和枝角类基因组dna。
[0046]
反应条件和扩增条件如实施例2所述。
[0047]
按照上述方法,将待测dna溶液替换为无菌水,其它步骤均不变,作为阴性对照。
[0048]
实验结果见图2。采用实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针检测鰤鱼诺卡氏质粒dna和鰤鱼诺卡氏菌基因组dna的时候显示阳性扩增曲线且ct值小于35,检测杂交鳢基嗜水气单胞菌、迟缓爱德华氏菌、杀鱼爱德华氏菌、弗氏柠檬酸杆菌、不动杆菌、舒伯特气单胞菌、恶臭假单胞菌、维氏气单胞菌、无乳链球菌、海豚链球菌、绿藻、红线虫和枝角类基因组dna或阴性对照的时候不显示阳性扩增曲线。
[0049]
上述实验结果表明,实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针组合具有较高的特异性。
[0050]
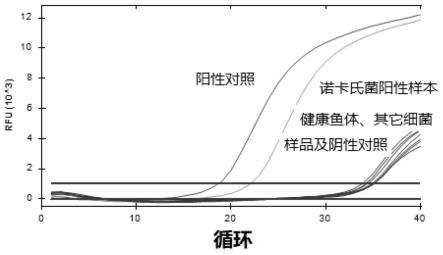
实施例4:临床样本检测
[0051]
待测样本一为发病鱼塘无症状鱼(杂交鳢)的肝脏组织。
[0052]
待测样本二为少量肉芽肿病鱼(杂交鳢)的肝脏组织。
[0053]
待测样本三为大量肉芽肿病鱼(杂交鳢)的肝脏组织。
[0054]
待测样本四为健康鱼(杂交鳢)的肝脏组织。
[0055]
按照诺唯赞(fastpure bateria dna isolation mini kit)试剂盒提取说明书提取滤膜上的总dna。
[0056]
反应条件和扩增条件如实施例2所述。
[0057]
按照上述方法,提取的总dna替换为灭菌水,其它步骤均不变,作为阴性对照。
[0058]
按照上述方法,提取的总dna替换为鰤鱼诺卡氏质粒dna,其它步骤均不变,作为阳性对照。
[0059]
实验结果见图3。采用实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针检测样本一、二、三和鰤鱼诺卡氏质粒dna的时候显示阳性扩增曲线且ct值小于35,检测样本
四或阴性对照的时候不显示阳性扩增曲线。
[0060]
以上结果表明,利用实施例1制备的用于用于检测鰤鱼诺卡氏菌的引物和荧光探针组合可以检出无症状病鱼的鰤鱼诺卡氏菌,结果准确可靠。
[0061]
实施例5:环境样本检测
[0062]
待测样品为广东省佛山南海区无发过鰤鱼诺卡氏病的池塘水,每次取1l,分别往其中添加0、8.25
×
102、8.25
×
103、8.25
×
104cfu的鰤鱼诺卡氏菌,记为待测样品一、二、三和四。
[0063]
对待测样本抽滤浓缩:将待测样本水样,轻微摇匀后在抽滤泵上进行抽滤,将水样过滤至0.22μm微孔滤膜上。
[0064]
按照诺唯赞(fastpure bateria dna isolation mini kit)试剂盒提取说明书提取滤膜上的总dna。
[0065]
按照上述方法,将提取的总dna替换为灭菌超纯水,其它步骤均不变,作为阴性对照。
[0066]
按照上述方法,将提取的总dna替换为鰤鱼诺卡氏质粒dna,其它步骤均不变,作为阳性对照。
[0067]
反应条件和扩增条件如实施例2所述。
[0068]
实验结果见图4。采用实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针检测样本二、三、四和鰤鱼诺卡氏质粒dna的时候显示阳性扩增曲线且ct值小于35,检测样本一或阴性对照的时候不显示阳性扩增曲线。
[0069]
以上结果表明,利用实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针组合可以进行养殖环境中鰤鱼诺卡氏菌的检测,结果准确可靠。
[0070]
实施例6:与现有检测技术比较
[0071]
待测样本一为发病鱼塘无症状鱼(杂交鳢)的肝脏组织,共6份,每份采集一条鱼。
[0072]
待测样本二为少量肉芽肿病鱼(杂交鳢)的肝脏组织,共6份,每份采集一条鱼。
[0073]
待测样本三为大量肉芽肿病鱼(杂交鳢)的肝脏组织,共6份,每份采集一条鱼。
[0074]
待测样本四为健康鱼(杂交鳢)的肝脏组织,共3份,每份采集一条鱼。
[0075]
待测样本五发过鰤鱼诺卡氏病的池塘水,共8份,每份1l。
[0076]
待测样本六为无发过鰤鱼诺卡氏病的池塘水,共3份,每份1l。
[0077]
上述鱼组织样品dna的提取如实施例4所述,水样dna提取如实施例5所述。
[0078]
分别采用实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针,和现有文献已发表的pcr、sybr green
ꢀⅰ
实时荧光定量pcr和lamp检测技术对上述样品进行检测,反应条件和扩增条件如以下文献所述:
[0079]
蒋依依,李安兴.鰤诺卡菌特异性pcr快速检测方法的建立[j].南方水产科学,2011,7(6):5.
[0080]
王国良,刘璐,李思源.蛳鱼诺卡氏菌sybr green
ꢀⅰ
实时荧光定量pcr检测方法的建立与应用[j].水产学报,2012,36(4):509-513.
[0081]
王国良,刘璐,徐益军.鱼类致病鰤鱼诺卡氏菌(nocardiaseriolae)的lamp检测技术建立与应用[j].海洋与湖沼,2011,42(1):27-31.
[0082]
按照上述方法,提取的总dna替换为灭菌水,其它步骤均不变,作为阴性对照。
[0083]
按照上述方法,提取的总dna替换为鰤鱼诺卡氏质粒dna,其它步骤均不变,作为阳性对照。
[0084]
结果判定,采用实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针和sybr green
ꢀⅰ
实时荧光定量pcr检测方法,扩增曲线且ct值小于35判定为阳性;pcr检测方法,在电泳后,琼脂糖凝胶有约150bp大小条带判定为阳性;lamp检测方法,在电泳后,琼脂糖凝胶有多条大小不一的条带判定为阳性。
[0085]
实验结果见表1。采用实施例1制备的用于检测鰤鱼诺卡氏菌的引物和荧光探针检测样本一、二和三的阳性率为100%,样本五的阳性率为87.5%,样本四和六的阳性率为0%;sybr green
ꢀⅰ
实时荧光定量pcr检测样本一的阳性率87.5%,样本二、三、五和六的阳性率为100%,样本四的阳性率为0%;lamp检测方法检测样一、二、、三、五和六的阳性率为100%,样本四的阳性率为0%;pcr检测方法检测样本二的阳性率为50%,样本三的阳性率为100%,样本一、四、五和六阳性率为0%。
[0086]
以上结果表明,sybr green
ꢀⅰ
实时荧光定量pcr和lamp检测方法的灵敏度与本发明所提供的检测方法相近,但针对养殖环境水体存在非特异性扩增;而pcr检测方法的灵敏度低于本发明所提供的检测方法。
[0087]
表1不同检测方法效率
[0088]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1