一株可适用于人用疫苗细胞基质培养的柯萨奇病毒A组10型疫苗株及其应用
一株可适用于人用疫苗细胞基质培养的柯萨奇病毒a组10型疫苗株及其应用
技术领域
1.本发明属于生物制品技术领域,具体涉及一株可适用于人用疫苗细胞基质培养的柯萨奇病毒a组10型疫苗株及其应用。
背景技术:
2.手足口病是一种由人类肠道病毒感染引起的传染病。近年来,除肠道病毒71型(ev-a71)、柯萨奇病毒a16型(cv-a16)、柯萨奇病毒a6型(cv-a6) 外,柯萨奇病毒a组10型(cv-a10型)也引起了手足口病的暴发。cv-a10 在世界范围内不同程度的流行。目前尚无治疗cv-a10感染的有效药物,亦无预防性疫苗进入临床研究。疫苗是预防和控制手足口病的最有效手段。因此,迫切需要开发安全有效的cv-a10疫苗。
3.目前,cv-a10疫苗的研究仍处于实验室阶段。临床上分离的cv-a10 病毒通常可以在人横纹肌肉瘤(rd)细胞中扩增,然而,rd细胞是不被允许作为人用疫苗的细胞基质的,而cv-a10很难在人用疫苗细胞基质如非洲绿猴肾细胞(vero)和人类胚肺二倍体细胞(kmb17)上扩增以制备全病毒疫苗。因此,cv-a10在制备人用疫苗方面存在较大的技术障碍。
技术实现要素:
4.有鉴于此,本发明的目的在于提供一株新型的柯萨奇病毒a组10型疫苗株,可适用于人用疫苗细胞基质培养,具备良好的遗传稳定性和免疫原性,可用于cv-a10全病毒疫苗的开发,为防控手足口病提供保障。
5.本发明提供了一株可适用于人用疫苗细胞基质培养的柯萨奇病毒a组 10型疫苗株ynkg1-7,所述疫苗株ynkg1-7在vero细胞上增殖。
6.优选的,所述疫苗株ynkg1-7在vero细胞上连续传代,从p1代到p22 代,vp1氨基酸序列保持不变。
7.优选的,所述疫苗株ynkg1-7的保藏编号为cgmcc no:24375。
8.本发明提供了一种用于预防手足口病的灭活疫苗,包括所述疫苗株 ynkg1-7和佐剂。
9.优选的,所述疫苗株ynkg1-7的滴度为5.875~7.0lgccid
50
/ml;
10.所述佐剂的终浓度为0.8~1.2mg/ml。
11.优选的,所述佐剂包括al(oh)3。
12.优选的,包括以下步骤:
13.将所述疫苗株ynkg1-7进行灭活,获得灭活病毒株;
14.将所述灭活病毒株和佐剂混合,振荡孵育1~1.5h,得到灭活疫苗。
15.本发明提供了所述疫苗株ynkg1-7在制备防控手足口病的疫苗中的应用。
16.本发明提供了人用疫苗细胞基质在所述疫苗株ynkg1-7增殖或制备所述疫苗株ynkg1-7的培养基中的应用。
17.优选的,人用疫苗细胞基质包括vero细胞。
18.本发明提供的可适用于人用疫苗细胞基质培养的柯萨奇病毒a组10型疫苗株ynkg1-7,在vero细胞上增殖。细胞培养实验表明,所述ynkg1-7 在vero细胞能够较好的稳定快速增殖,满足了大规模制备全病毒人用疫苗的先决条件。通过细胞体外连续传代实验表明,ynkg1-7无论是主要抗原决定区(vp1)还是全基因组的氨基酸序列并无突变,具有良好的遗传稳定性,满足了中国药典对于疫苗种子基因序列的要求,具备良好的遗传稳定性;同时动物免疫实验表明,所述ynkg1-7能够诱导实验动物产生cv-a10特异性免疫应答,说明ynkg1-7株具有良好的免疫原性。因此所述ynkg1-7 可作为疫苗株助力cv-a10全病毒疫苗的成功开发。
附图说明
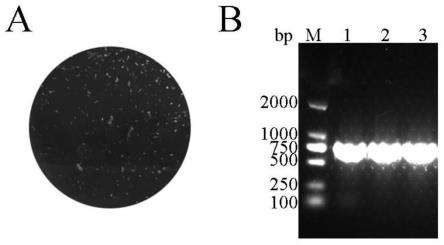
19.图1为一株cv-a10临床分离株的蚀斑形态(a)和pcr鉴定结果(b);
20.图2为ynkg1-7株在vreo细胞上的适应性评价结果;
21.图3为ynkg1-7株各代次病毒株的免疫原性评价结果。
22.图4为三个克隆株在vero细胞基质上的增殖特性结果;
23.图5为三个克隆株来源的灭活疫苗诱导的特异性体液免疫应答,其中a 为第一次免疫后14d结果,b为第一次免疫后28d结果。
24.生物材料保藏信息
25.柯萨奇病毒a组10型疫苗株,毒株保藏在中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏时间为2022年3月28日。地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,生物保藏编号为cgmcc no:24375,菌株编号为ynkg1-7。
具体实施方式
26.本发明提供了一株可适用于人用疫苗细胞基质培养的柯萨奇病毒a组 10型疫苗株ynkg1-7,所述疫苗株ynkg1-7在vero细胞上增殖。
27.在本发明中,所述ynkg1-7是从云南省疑似手足口病患者的咽拭子中分离得到cv-a10临床分离株,经过三次蚀斑克隆纯化获得。所述ynkg1-7 接种至vero细胞上引起细胞病变效应(cpe)。经过滴度检测,从第4代开始,ynkg1-7株的感染性滴度保持在5.875lgccid
50
/ml以上,说明其增殖效力稳定且良好。
28.在本发明中,所述疫苗株ynkg1-7在vero细胞上连续传代。传代的条件优选为按照0.01~0.3moi(感染复数)的接种量将疫苗株接种至细胞。传代的培养条件优选为37℃,5%co2条件,培养2d。从每次传代的疫苗株 ynkg1-7取检测样本,分别检测全基因组序列和主要抗原决定区(vp1区) 序列的突变情况,结果表明,全基因组序列测序结果表明,ynkg1-7的第5 代、第12代和第19代全基因组氨基酸序列在3代中完全一致,vp1序列比对结果,ynkg1-7株第11代病毒vp1区域发生1个无意义的点突变(即氨基酸序列不变),从p11代到p22代,ynkg1-7的vp1氨基酸序列保持不变。ynkg1-7株在vero细胞基质上连续传代时,能够保持良好的遗传稳定性。
29.在本发明中,所述疫苗株ynkg1-7以灭活疫苗形式免疫动物,结果表明,加强免疫后第14天,各组小鼠中和抗体水平均升高,gmt均在16-64 之间。初免后和加强后,ynkg1-7
的免疫原性在不同代次病毒(5、12和 19代)间无显著差异。ynkg1-7不同代次病毒间保持了稳定的免疫原性。
30.在本发明中,从cv-a10临床分离株进行蚀斑克隆时,同时选择了其他两个克隆株(分别命名为ynaj3-20株和ynnw1-16株)进行平行研究。结果表明,虽然ynaj3-20株和ynnw1-16株可适应于vero细胞,但在适应过程中其基因序列稳定性不足,且ynkg1-7株在体内表现出更为稳定的免疫原性,因此出于疫苗安全性和有效性考量,不考虑将ynaj3-20株和 ynnw1-16株作为病毒种子。因此,本发明将ynkg1-7进行生物保藏,所述疫苗株ynkg1-7的保藏编号为cgmcc no:24375。
31.鉴于ynkg1-7在人用疫苗细胞基质中稳定快速增殖,满足人用疫苗的先决条件,同时具有良好的遗传稳定性和免疫原性,满足制备灭活疫苗的生物特性,因此,ynkg1-7作为疫苗株制备防控手足口病的疫苗中的应用。
32.本发明提供了一种用于预防口足病的灭活疫苗,包括所述疫苗株 ynkg1-7和佐剂。
33.在本发明中,所述疫苗株ynkg1-7的滴度优选为5.875~7.0 lgccid
50
/ml,更优选为6.3lgccid
50
/ml。所述佐剂的终浓度优选为1mg/ml,更优选为1mg/ml。所述佐剂优选包括al(oh)3。
34.本发明提供了所述灭活疫苗的制备方法,包括以下步骤:
35.将所述疫苗株ynkg1-7进行灭活,获得灭活病毒株;
36.将所述灭活病毒株和佐剂混合,振荡孵育1~1.5h,得到灭活疫苗。
37.在本发明中,所述灭活的方法,优选为用甲醛溶液处理疫苗株 ynkg1-7。所述灭活病毒株的原液和甲醛溶液的体积比为1:4000。所述甲醇溶液的终浓度优选为200~300μg/ml,更优选为250μg/ml。
38.在本发明中,所述灭活疫苗的免疫方法,优选为以腹腔注射的方式初次免疫小鼠,每次0.5ml/只,初次免疫两周后,以同样剂量加强免疫一次。加强免疫后第14天,各组小鼠中和抗体水平均升高,gmt均在16-64之间。初免后和加强后,ynkg1-7的免疫原性在不同代次病毒间无显著差异。 ynkg1-7不同代次病毒间保持了稳定的免疫原性,为防控手足口病提供了保障。
39.本发明提供了人用疫苗细胞基质在所述疫苗株ynkg1-7增殖或制备所述疫苗株ynkg1-7的培养基中的应用。
40.在本发明中,人用疫苗细胞基质优选包括vero细胞。本发明对所述vero 细胞的来源没有特殊限制,采用本领域所熟知的vero细胞即可。所述培养基优选还包括vero细胞生长液和/或病毒培养基。vero细胞生长液优选由 86%mem(gibico)、10%nbs(杭州四季青)、100iu/ml硫酸卡那霉素、2%gln 和1%nahco3组成。病毒培养基由93%mem、2%nbs、100iu/ml硫酸卡那霉素、2%gln和2%nahco3组成。
41.在本发明中,所述疫苗株ynkg1-7增殖的条件为37℃、5%co2条件下培养2天。培养结束后,收集病毒,用于灭活疫苗制备。
42.下面结合实施例对本发明提供的一株可适用于人用疫苗细胞基质培养的柯萨奇病毒a组10型疫苗株及其应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
43.试剂及材料来源说明
44.1.病毒株:分离自云南省疑似手足口病患者的咽拭子,由本课题组分离并保存。分离株经三次蚀斑纯化后获得单一克隆株,命名为ynkg-1-7株。
45.2.细胞:vero细胞(145~150代)由本单位保存并提供。
46.3.培养基:vero细胞生长液由86%mem(gibico)、10%nbs(杭州四季青)、100iu/ml硫酸卡那霉素、2%gln(单位自配)和1%nahco3(单位自配)组成;病毒培养基由93%mem、2%nbs、100iu/ml硫酸卡那霉素、 2%gln和2%nahco3组成。
47.4.引物:用于vp1区和全基因序列扩增,如表1所示。
48.表1用于cv-a10全基因组序列及vp1序列测定的引物信息
[0049][0050][0051]
5.实验动物:4周龄spf级balb/c小鼠由中国医学科学院医学生物研究所动物实验部提供(许可证号:scxk(dian)k2019-0002)。本研究的动物实验经中国医学科学院医学生物研究所实验动物管理伦理委员会批准(批准文号:dwsp202107002)。
[0052]
实施例1
[0053]
一株柯萨奇病毒株ynkg1-7的筛选纯化方法
[0054]
从云南省疑似手足口病患者的咽拭子中分离得到一株cv-a10临床分离株,经过三次蚀斑克隆纯化,将病毒样品稀释10倍(10-1
~10-5
),以200μl/ 孔接种于单层vero细胞(6孔板),37℃下孵育2h。然后,在6孔板中加入 3ml 1%甲基纤维素,在37℃、5%co2中孵育。在显微镜下采集斑块(图1 中a),并将其转入已长成单层的vero细胞(24孔板)中。从培养物
中提取 rna进行vp1区的rt-pcr扩增(图1中b),pcr产物经测序和blast 比对鉴定为cv-a10的空斑再次以相同操作纯化2次。经过三次蚀斑克隆纯化,获得了单一的克隆株,将其命名为ynkg1-7株。
[0055]
将ynkg-1-7株按感染复数moi=0.1的比例感染vero细胞,37℃条件下培养约48h,即超过90%细胞出现细胞病变效应(cpe)时,取出冻存于
ꢀ‑
30℃,反复冻融两次后,分装冻存于-80℃。取样进行感染性滴度检测、全基因组序列测定和免疫原性检测等。
[0056]
实施例2
[0057]
ynkg1-7株的感染性滴度检测方法
[0058]
将ynkg1-7株在vreo细胞基质上进行连续传代,以期获得vero细胞适应株,通过感染性滴度检测结果判定其适应性。感染性滴度越高、越稳定,说明病毒株在细胞基质上的适应性越好。采用微量细胞病变法检测cv-a10 病毒的感染性滴度。将cv-a10病毒进行梯度稀释10倍(10-1
~10-7
)。稀释后的病毒样本以100μl/孔加入96孔板,加入等体积的vero细胞悬液, 7000~10000个细胞/孔,在37℃、5%co2条件下培养7天。第7天后观察细胞病变情况。用karber's方法计算50%细胞培养感染剂量(ccid
50
)。
[0059]
结果显示,从第4代开始,ynkg1-7株的感染性滴度保持在5.875 lgccid
50
/ml以上(图2),其增殖效力稳定且良好。
[0060]
实施例3
[0061]
ynkg1-7株的遗传稳定性测定
[0062]
使用病毒核酸提取试剂(axygen,杭州,中国)从cv-a10培养物中提取 rna,然后采用一步rt-pcr试剂盒(vazyme,江苏,中国)分别对全基因组和vp1区序列进行rt-pcr。使用的所有引物均列于表1。rt-pcr实验条件如下:
[0063][0064]
所得扩增产物用1%琼脂糖凝胶电泳确认条带大小,然后送tsingke生物技术有限公司有限公司(昆明)进行序列测定。测序结果使用lasergene 7进行整理和编辑。多序列比较采用mega7.0完成。
[0065]
全基因组序列比对结果发现,与母本株(临床分离株)相比,ynkg1-7 株第5代、第12代和第19代全基因组序列出现4个碱基突变,其中vp4 区内1个点突变,792g~a;vp1区内
3个点突变,分别为2591g~a,2884 t~c和3158t~g,其中两个点突变导致两个氨基酸取代,分别为962 met~thr和1053asp~glu。ynkg1-7的第5代、第12代和第19代全基因组氨基酸序列在3代中完全一致。
[0066]
vp1序列比对结果发现,ynkg1-7株第11代病毒vp1区域发生1个无意义的点突变,即氨基酸序列不变,从p11代到p22代,ynkg1-7的vp1 氨基酸序列保持不变。
[0067]
以上结果表明,ynkg1-7株在vero细胞基质上连续传代时,能够保持良好的遗传稳定性。
[0068]
实施例4
[0069]
ynkg1-7株的免疫原性检测
[0070]
为了评价ynkg1-7株在vero细胞适应过程中的免疫原性变化,分别用第5、12和19代病毒试制一批实验性疫苗经腹腔免疫4周龄balb/c小鼠。在ynkg1-7病毒收获原液中按体积比1:4000加入甲醛溶液,37℃孵育72 小时后实现病毒灭活。灭活病毒与al(oh)3佐剂(终浓度为1mg/ml)混合,室温震荡1小时,制备成实验性灭活疫苗。将灭活疫苗以腹腔注射途径免疫 4周龄雌性balb/c小鼠,0.5ml/只,每组5只。初次免疫两周后,以相同剂量相同途径加强免疫一次。对照组小鼠给予0.01mol/l pbs。
[0071]
结果如图3所示,初始免疫后第14天即加强免疫前,ynkg1-7株不同代次病毒诱导小鼠产生的中和抗体水平较低,各组的中和抗体效价-几何平均滴度(gmt)在8.0~32之间。加强免疫后第14天,各组小鼠中和抗体水平均升高,gmt均在16-64之间。初免后和加强后,ynkg1-7的免疫原性在不同代次病毒间无显著差异。可以看出,ynkg1-7不同代次病毒间保持了稳定的免疫原性。
[0072]
比对例1
[0073]
在cv-a10临床分离株进行蚀斑克隆时,同时选择了其他两个克隆株(分别命名为ynaj3-20株和ynnw1-16株)进行平行研究,按照实施例1~4 的方法将其接种至vero细胞进行连续传代培养,分别测定病毒滴度、遗传稳定性和免疫原性。
[0074]
结果表明,ynaj3-20株和ynnw1-16株亦可适应于vero细胞,但在适应过程中其基因序列稳定性不足,且ynkg1-7株在体内表现出更为稳定的免疫原性,因此出于疫苗安全性和有效性考量,不考虑将ynaj3-20株和 ynnw1-16株作为病毒种子。
[0075]
感染性滴度比较
[0076]
将ynkg1-7、ynaj3-20、ynnw1-16株同时在vero细胞上由p3代培养至p28代。三个克隆株均表现为明显且稳定的cpe,各代次感染滴度在6.5~7.0lgccid
50
/ml范围内波动(图4)。可以看出,三个克隆株在vero细胞基质上均可稳定稳定增殖,三者增殖特性无明显差别。
[0077]
遗传稳定性比较
[0078]
分别比较了三个克隆株在适应vero细胞过程中,与母本株的全基因组核苷酸和氨基酸序列(3’utr部分除外)。参与序列比对的序列长度为7356 bp。
[0079]
从表3可以看出,与母本株(临床分离株)相比,ynkg1-7第5代、第12代和第19代全基因组序列出现4个碱基突变,其中vp4区内1个点突变,792g~a;vp1区内3个点突变,分别为2591g~a,2884t~c和3158 t~g,其中两个点突变导致两个氨基酸取代,分别为962met~thr和1053 asp~glu)。ynkg1-7的第5代、第12代和第19代全基因组氨基酸序列在3 代中
完全一致。ynnw1-16第5代、第12代和第19代序列间出现4个碱基突变,其中vp3区内1个点突变(2131g~a)导致氨基酸替换(711ser~asn), vp1区内3个点突变分别导致3个氨基酸替换(913ala~thr;916asn~thr;962 met~thr)。ynaj3-20第5代、第12代和第19代全基因组序列有4个碱基突变,其中vp3区1个碱基突变(2265a~t)导致相应氨基酸替换(756 asn~tyr),vp1区内3个碱基突变分别导致3个氨基酸替换(913ala~thr;916 asn~thr;962met~thr)。
[0080]
表3三个克隆株各代次病毒及其与母本株的全基因组序列比较
[0081][0082][0083]
与母本株相比,ynnw1-16和ynaj3-20在vp1区域分别有一个和两个氨基酸取代(表4)。ynkg1-7 vp1区氨基酸序列则无突变。
[0084]
表4三个克隆株vp1区序列比对
[0085][0086]
免疫原性比较
[0087]
如图5所示,初始免疫后第14天即加强免疫前,3个克隆株不同代次病毒诱导小鼠产生的中和抗体水平较低,各组的中和抗体效价-几何平均滴度 (gmt)在8.0~27.9之间。ynaj3-20 p19代gmt(27.9)高于p5代(16.0)和p12 代(9.2)(p=0.0161,p=0.0039)。加强免疫后第14天,各实验组小鼠中和抗体水平均升高。各组gmt均在18.4~73.5之间。ynnw1-16 p5组gmt 为48.5,高于p12代(gmt=18.4)和p19代(gmt=21.1)(p=0.0086,p=0.0111)。第一次免疫后第14天和第28天,ynkg1-7的免疫原性在不同代次病毒间无显著差异。可以看出,这三个克隆株均能诱导机体产生特异性免疫应答。与ynaj3-20和ynnw1-16相比,ynkg1-7不同代次病毒间保持了更稳定的免疫原性。
[0088]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1