一种基于离心法的寡肽合成及纯化方法与流程
1.本技术属于生物技术领域,尤其涉及一种基于离心法的寡肽合成及纯化方法。
背景技术:
2.寡肽在护肤、保健和医疗等领域具有重要的应用价值,但其工业化合成方式仍然是一个很大的难点。传统的短肽合成方法是基于化学反应合成技术,这种方法需要复杂的反应步骤和剧烈的反应条件,会生成大量的副产物,严重影响降低了寡肽的产量和提高了提纯的难度。这种化学合成方式往往会造成较大的环境污染和产生有毒的副产物。因此,更加环境友好和产物单一的生物合成法在寡肽制备上具有很大的优势。生物合成法利用人工构建的遗传编码信息在宿主中高效快速的产生寡肽产物,具有合成成本低、效率高、副产物少等优势。为了能够将寡肽特异性地分离提纯出来,在设计人工构建的遗传编码信息时,需要在寡肽上游加上亲和标签(如his标签或gst标签),并在标签和寡肽序列之间加上蛋白酶切割位点。整体的流程包括蛋白表达、菌体破碎、介质富集、目标蛋白洗脱、超滤除盐浓缩、蛋白酶切割、分子筛富集纯化等多道生产工艺,这使得寡肽的生物合成法变得极为繁琐,提高了生产的损耗和成本。因此,更加方便的寡肽生物合成及分离纯化技术,在寡肽的工业化生产上,是迫切的需求。
技术实现要素:
3.鉴于此,本技术提供了一种基于离心法的寡肽合成及纯化方法,有效解决现有的寡肽生物合成方法存在的纯化困难,操作繁琐和损耗大等问题。
4.本技术提供了一种基于离心法的寡肽合成及纯化方法,包括:
5.步骤1、构建含有融合蛋白的表达载体质粒,其中,所述融合蛋白由相互串联的内含肽和目标寡肽组成;所述内含肽为产生c末端自切割的蛋白分子;
6.步骤2、将所述表达载体质粒转化至宿主菌中,并使所述宿主菌诱导表达所述融合蛋白以形成包涵体;
7.步骤3、将表达融合蛋白的宿主菌依次进行破碎和第一次离心处理,弃上清后,收集沉淀;
8.步骤4、将激活内含肽切割的缓冲液与所述沉淀混合孵育以激活所述内含肽进行自切割,得到含有内含肽和目标寡肽的第二混合物;
9.步骤5、将所述第二混合物进行第二次离心处理,离心后上清为含有分子量小于3kda的目标寡肽。
10.具体的,所述目标寡肽为现有常规的寡肽或短肽,如乳四肽或四肽-9等。
11.具体的,所述表达载体质粒可以为原核生物表达载体质粒或真核生物表达载体质粒,优选为原核生物表达载体质粒,将现有常规的原核生物表达载体质粒经过常规酶切和连接与融合蛋白结合,构建得到含有融合蛋白的表达载体质粒。
12.进一步的,所述原核生物表达载体质粒可以为大肠杆菌菌株表达载体质粒。
13.另一实施例中,所述目标寡肽的氨基酸数目为2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个或25个。
14.具体的,所述目标寡肽的氨基酸数目为2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个或20个。
15.另一实施例中,所述融合蛋白的数量可以为1个或复数个,所述融合蛋白的数量为2个时,两个相邻所述融合蛋白间以所述表达载体的核糖体结合位点rbs相隔。
16.另一实施例中,所述内含肽选自ssp dnab、ssp dnae、mtu reca、mth rir1、sce vma、mtuδi-cm和gp41-1中的一种或多种。
17.另一实施例中,步骤2中,采用诱导表达剂诱导所述宿主菌表达所述融合蛋白以形成包涵体。
18.具体的,步骤2中,通过强诱导表达环境;是指加入高浓度的诱导表达剂如iptg,来快速大量地产生靶融合蛋白,使得融合蛋白聚集在一起形成不溶的包涵体复合物。
19.另一实施例中,步骤3中,所述破碎菌体方法为现有常规的破碎菌体方法,镜检染色直至没有明显的菌体。所述破碎的方式为加热破碎法、裂解液超声破碎法或高压破碎法中的一种。
20.具体的,所述加热破碎法中加热条件为:加热温度为50~70℃,加热时间为30~120min。
21.具体的,所述裂解液超声破碎法采用的裂解液包括20mm tris和500mm nacl,裂解液的ph为8.0,所述裂解液超声破碎法中超声条件为现有常规破碎菌体的超声条件。
22.具体的,步骤3中,所述破碎还可以包括离心过滤处理,如将表达融合蛋白的宿主菌破碎后进行10000rpm,4℃离心20min,收集菌体沉淀,将菌体沉淀用缓冲液如pbs清洗1~3次。
23.具体的,第一次离心用于获得含有内含肽和目标寡肽的沉淀物,因此第一次离心的速率和时间为获得含有内含肽和目标寡肽的沉淀物条件即可。
24.另一实施例中,步骤3中,所述第一次离心的速率为10000-12000g,所述第一次离心的时间为10-60min。
25.另一实施例中,步骤4中,所述激活内含肽切割的缓冲液选自ph 5~7的磷酸缓冲液、ph 5~7的三羟甲基氨基甲烷缓冲液和ph 5~7哌嗪-1,4-二乙磺酸缓冲液中的一种或多种。
26.另一实施例中,步骤4中,所述混合孵育的条件为37℃孵育2h或4℃孵育6~24h。
27.具体的,步骤4中,所述缓冲液优选为ph 6.0的磷酸缓冲液,其目的是在酸性条件下激活的内含肽自切割活性,释放出目标寡肽。
28.具体的,第二次离心用于将内含肽和目标寡肽分离,获得含有目标寡肽的上清液,因此第二次离心的速率和时间为分离内含肽和目标寡肽条件即可。
29.另一实施例中,步骤5中,所述第二次离心的速率为10000-12000g,所述第二次离心的时间为10-60min。
30.为解决目前寡肽的生物合成法存在的缺陷,本技术开发了一种基于离心工艺的寡肽生物合成及纯化的方法,本技术的方法在设计人工构建的遗传编码信息时,在寡肽上游
插入内含肽序列,通过生物合成产生内含肽-寡肽融合蛋白。通过剧烈的诱导条件将内含肽-寡肽融合蛋白诱导表达成不溶的包涵体。破碎菌体后,离心获得蛋白沉淀,加入激活内含肽切割的缓冲液,以激活内含肽的自切割和寡肽的释放。再利用离心除去沉淀,即可高效大量地获得目标寡肽。这种寡肽生物合成及纯化方案仅需要经过蛋白强诱导表达、菌体破碎、第一次离心、寡肽释放和第二次离心技术共五个步骤,避免了传统生物合成法中复杂的蛋白纯化和蛋白酶切割方法,极大地提高了寡肽的生产效率和生产品质,适用于寡肽类物质的工业化大规模生产。
附图说明
31.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
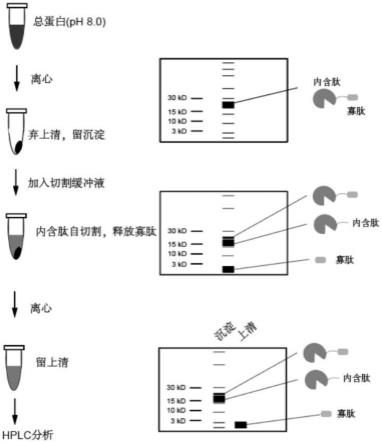
32.图1为本技术实施例提供的基于离心法的寡肽合成及纯化方法的原理图;其中,图1左边从上到下为总蛋白(ph为8)离心后弃上清,获得沉淀,然后将激活内含肽切割的缓冲液与该沉淀混合,以激活内含肽自切割,释放寡肽,接着对寡肽进行离心处理,取得上清进行hplc分析。图1右边从上到下为总蛋白的分子量为15kda~30kda,将激活内含肽切割的缓冲液与该沉淀混合后,离心得到的上清液为小于3kda的寡肽,离心得到的沉淀为15kda~30kda的蛋白;
33.图2为本技术实施例提供的寡肽1和寡肽2的沉淀和上清的sds-page图;
34.图3为本技术实施例提供的寡肽3和寡肽4的沉淀和上清的sds-page图;
35.图4为本技术实施例提供的合成纯化后寡肽1的hplc结果图,其中横坐标为时间(min),纵坐标为电信号(mau);
36.图5为本技术实施例提供的合成纯化后寡肽2的hplc结果图,其中横坐标为时间(min),纵坐标为电信号(mau);
37.图6为本技术实施例提供的合成纯化后寡肽3的hplc结果图,其中横坐标为时间(min),纵坐标为电信号(mau);
38.图7为本技术实施例提供的合成纯化后寡肽4的hplc结果图,其中横坐标为时间(min),纵坐标为电信号(mau)。
具体实施方式
39.本技术提供了一种基于离心法的寡肽合成及纯化方法,用于解决现有技术中的技术缺陷。
40.下面将对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
41.其中,以下实施例所用原料或试剂均为市售或自制。
42.以下实施例中所用的寡肽-1、寡肽-2、寡肽-3和寡肽-4为现有成熟的寡肽,本技术不对寡肽-1、寡肽-2、寡肽-3和寡肽-4作具体赘述。
43.实施例1
44.本技术实施例提供了一种基于离心法的寡肽合成及纯化方法,基于离心法的寡肽合成及纯化方法原理请参阅图1,具体步骤包括:
45.1)融合蛋白表达:按照表1的融合蛋白中内含肽种类和寡肽种类,采用分子生物学方法构建含有不同融合蛋白的表达载体质粒,其中,寡肽连接在内含肽的c末端,即得到含有融合蛋白1的表达载体质粒、含有融合蛋白2的表达载体质粒、含有融合蛋白3的表达载体质粒和含有融合蛋白4的表达载体质粒,将这四种质粒转入大肠杆菌中。
46.将表达不同对的内含肽-寡肽融合蛋白的大肠杆菌菌株在lb培养基中扩大培养中od
600
值为0.8,加入1/20体积1m tris-hcl缓冲液(ph 8.5)和终浓度为4mm的iptg,37℃200rpm继续培养5h。10000rpm,4℃离心20min,收集菌体。菌体用pbs清洗2次。
47.2)菌体破碎:将菌体重悬在裂解液(20mm tris,50mm nacl,ph 8.0)中,使用超声进行菌体破碎,镜检染色直至没有明显的菌体。然后量破碎产物经12000rpm,4℃离心20min,弃上清后,收集沉淀。
48.经过步骤1)和步骤2)诱导表达剂诱导转化菌表达融合蛋白,诱导表达产物经过离心后进行sds-page测定,结果如图2和图3,四种内含肽-寡肽融合蛋白在诱导表达剂诱导条件下,主要表达为不可溶的包涵体蛋白。
49.3)内含肽切割:于上述沉淀中加入三分之一至十分之一体积的ph 6.0的50mm磷酸缓冲液,调节上述沉淀的ph值至6.5,混匀后37℃孵育2h,得到含有内含肽和目标寡肽的第二混合物。然后将该第二混合物于12000rpm,4℃离心30min,收集上清,上清为各种目标寡肽。
50.表1:不同寡肽的纯度和产量
[0051] 融合蛋白1融合蛋白2融合蛋白3融合蛋白4内含肽种类sspdnabsspdnabsspdnabsspdnab寡肽种类寡肽-1寡肽-2寡肽-3寡肽-4纯度94.3%89.7%92.1%91.5%产量mg/l1.210.830.710.17
[0052]
将上述各种目标寡肽经过hplc测定,结果如附图4~7和表1,对于不同的寡肽,本技术提供的方法都具有很好的产量和纯度。这说明本技术提供的寡肽纯化工艺具有操作简单、成本低、产量高和纯度好等明显的优势。
[0053]
综上所述,1)传统的寡肽生物合成方法需要利用亲和标签进行亲和纯化,整个纯化步骤繁琐,需要预处理、挂柱、洗杂、洗脱、除盐等多个步骤,适合小量的蛋白生产,在大量蛋白的工业化生产上难以应用,且整个过程导致蛋白损耗较多,生产成本较高。本技术不需要蛋白纯化步骤,仅仅需要两步离心即可,这个在大规模工业化生产上比较容易实现,因此这种方法的生产工艺在放大应用上更好。
[0054]
2)传统的寡肽生物合成方法需要利用蛋白酶切割亲和标签,对于寡肽几个氨基酸的底物,蛋白酶切割的效率和亲和性较差,且在切割过程中会引入额外的蛋白酶污染,导致寡肽的纯度不够。此外,蛋白酶切割往往会在寡肽的n端留下1~2个氨基酸残基,这些残基对于只有几个氨基酸的寡肽而言,可能会很大程度上影响寡肽的性质和功能。因此蛋白酶切割的方式不太适用于寡肽的生产和纯化上。本技术选用了能够进行自切割的内含肽,内含肽的自切割只需要将采用激活内含肽切割的缓冲液即可,无需加入额外的蛋白酶,保证
了寡肽的纯度。此外,内含肽的切割不会在寡肽的n端留下氨基酸残基,使得获得的短肽更符合原本的结构和性质。
[0055]
以上所述仅是本技术的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本技术的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1