外泌体miRNA-485-3p和miRNA-885-5p作为肝癌诊断标志物的应用的制作方法
外泌体mirna-485-3p和mirna-885-5p作为肝癌诊断标志物的应用
技术领域
1.本发明属于生物技术和医学领域,具体涉及血浆外泌体mirna-485-3p和mirna-885-5p作为肝癌诊断标志物的应用。
背景技术:
2.原发性肝癌是我国最常见的恶性肿瘤之一,其发病率在所有恶性肿瘤中位居第四位,而病死率高居第三位,其中肝细胞肝癌(hepatocellular carcinoma,hcc)占所有原发性肝癌的85%~90%。hcc预后不良,主要归咎于在其隐匿的发病过程,因此很多患者在首诊时即为中晚期,失去根治性治疗机会。而afp作为主要的血清学标志物,其标志其敏感度为40-65%,特异性为76-90%,有近1/3的肝癌患者afp阴性。所以afp作为早期诊断指标并不理想。因此寻找敏感性高的hcc血清学标志物,不仅在肝癌早期诊断中发挥着重要作用,同时对于早期hcc根治术后患者病情监测、复发预测以及预后评估等均有重要意义。
3.外泌体由细胞分泌释放出来,在血液等体液内传播,是细胞间通讯的重要介质。肿瘤外泌体携带来源于肿瘤细胞的生物学信息(蛋白、dna和microrna等),其内容物的浓度与肿瘤细胞的侵袭能力及肿瘤微环境相关,通过分析外泌体的表面标记或内部成分可以直接获得癌细胞的基本信息。由于外泌体有脂质膜保护,其内容物如dna、rna和蛋白质不易被降解破坏,使得无论新鲜的还是长期保存的样本皆可用于分析。更重要的是,外泌体可以从众多体液中获得(血液、尿液等),这使得外泌体检测在肿瘤诊疗中极具前途,成为一种较为理想的“液体活检”方法。
4.外泌体在肝癌方面的诊断还没有明确的相关报道,仅有文献称与传统肝癌标志物afp相比,外泌体中mirna表达水平在肝癌早期即发生改变且变化水平较大[belov l1,matic kj2,hallal s2,best og2,3,mulligan sp2,3,christopherson ri2.extensive surface protein profiles of extracellular vesicles from cancer cells may provide diagnostic signatures from blood samples.j extracell vesicles.2016apr15;5:25355],与afp联用有助于提高早期肝癌筛查的诊断效能。刚刚发表在《hepatology》上的研究表明,血浆和外泌体中的microrna let-7与慢性丙肝病人肝纤维化进展有一定的关系[circulating let-7levels in plasma and extracellular vesicles correlate with hepatic fibr osis progression in chronic hepatitis c.hepatology.2016may 26.doi:10.1002/hep.28660]。mirnas被发现参与了多种癌症的发生与发展,mirna表达与功能分析证明mirna显著影响了肿瘤的发生,其表达失调促进恶性表型的形成,使其成为潜在的肿瘤诊断预后判断的生物标记物,也是肿瘤治疗的潜在靶点。
[0005]
mirna-485-3p和mirna-885-5p是一种已知的小分子rna。本发明提供血浆外泌体mirna-485-3p和mirna-885-5p作为肝癌(早期)的诊断标志物的应用,所述mirna-485-3p和mirna-885-5p的序列分别为5
’‑
agagaggagagccguguaugac-3’和5
’‑
uccauuacacuacccugccucu-3’。
[0006]
现有的关于mir-485-3p的报道发现,外泌体mir-485-3p的高表达与大于或等于1cm的肿瘤大小、临床晚期、腺体外浸润、braf突变和淋巴结转移有关。血浆外泌体mir-485-3p还可作为甲状腺乳头状癌诊断的无创生物标志物。
[0007]
mirna-885-5p是由mirna-885的5’端剪切而成,其基因座位于3p25.3。有研究发现,mirna-885-5p可以抑制恶性胶质瘤和神经母细胞瘤的转移。此外,mir-885-5p已被报道是在胃癌血浆中有潜力的诊断分子。
[0008]
本发明首次发现mirna-485-3p和mirna-885-5p的表达异常和早期肝癌的发生发展相关。
技术实现要素:
[0009]
原发性肝癌是我国最常见的恶性肿瘤之一,由于缺乏有效的早期诊断标志物,很多患者失去了根治性治疗机会。本发明意外的发现,外泌体mirna-485-3p和mirna-885-5p联合诊断可以使早期肝癌诊断的敏感性和特异性达到80-90%。非常适合用于早期肝癌的诊断。
[0010]
本发明的目的是克服现有技术中对肝癌诊断的不足,提供血浆外泌体mirna-485-3p和/或mirna-885-5p作为肝癌(早期)的诊断标志物的应用。
[0011]
外泌体是一种直径约30-150nm的双层膜性小囊泡,多种组织和细胞都可分泌形成,存在于血液、脑脊液、唾液和尿液等体液中。它们含有来自宿主细胞的microrna和蛋白质等多种成分,是细胞间重要的信息交流媒介,同时也是无创性疾病诊断标志物研究的理想对象。本发明将分析血浆中的mirna-485-3p和/或mirna-885-5p在早期肝癌患者血浆外泌体中的表达,并探讨其作为肝癌(早期)标志物的可能性。
[0012]
提取血浆中的外泌体及外泌体mirna,实时荧光定量聚合酶链式反应(pcr)技术分析mirna-485-3p和/或mirna-885-5p在早期肝癌患者、慢性hbv患者和健康人群血浆外泌体中的表达和差异。
[0013]
本发明的另一个目的在于提供外泌体mirna-485-3p和/或mirna-885-5p在诊断肝癌方面的应用。
[0014]
本发明的另一个目的在于提供外泌体mirna-485-3p和/或mirna-885-5p在诊断早期肝癌方面的应用。
[0015]
本发明的另一个目的在于提供外泌体mirna-485-3p和/或mirna-885-5p作为肿瘤标记物在诊断早期肝癌方面的应用。
[0016]
本发明的另一个目的在于提供所述的外泌体mirna-485-3p和/或mirna-885-5p在制备早期肝癌诊断标记物的产品中的应用。
[0017]
本发明的另一个目的在于提供所述的外泌体mirna-485-3p和/或mirna-885-5p在制备肝癌诊断试剂盒中的应用。
[0018]
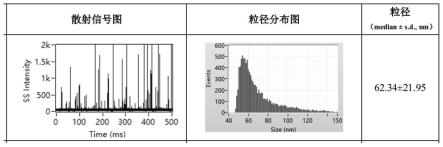
其中,所述肝癌为早期肝癌。
[0019]
本发明所述的应用,包括以下步骤:
[0020]
1)血浆样品的制备
[0021]
在采血管中加入edta抗凝剂,采集完血液后,将采血管缓慢颠倒混匀,混匀的全血4℃1,000-2,000
×
g离心5-10min,上层黄色半透明液体即为待收集的血浆,吸出血浆时贴
着页面逐渐往下吸,切勿吸出细胞成分;收集到的血浆可直接用于后续实验或分装好-80℃冰箱保存,
[0022]
2)外泌体的提取
[0023]
将血浆室温,2,000
×
g离心20min,去除残留细胞及碎片;转移上清到新的离心管中,注意不要吸到底部沉淀;室温,10,000
×
g离心20min,去除残留碎片;用移液器转移上清到新的离心管中,1ml血浆样品,加入500ul 1
×
pbs及300ulvexexosome isolation reagent溶液,混匀后将混合液竖直放于2-8℃静置30min进行孵育,室温10,000
×
g离心5min去上清,然后室温10,000
×
g离心30s,用移液器吸除残留液体,血浆外泌体即存在于管底部沉淀中,
[0024]
3)外泌体mirna的提取
[0025]
外泌体mirna提取使用试剂盒,主要操作步骤如下:
①
取外泌体,加入1ml trizol充分匀浆,振荡器振荡或移液器吸打数次混匀,室温静置5min,使得核酸蛋白复合物完全分离,
②
4℃12,000rpm(13,400
×
g)离心5min,取上清,转入一个新的无rnase的离心管中,
③
加入200μl氯仿,盖好管盖,剧烈振荡15sec,室温放置5min,
④
4℃12,000rpm(13,400
×
g)离心15min,样品会分成三层:黄色的有机相,中间层和无色的水相,rna主要在水相中,水相的体积约为所用裂解液mz试剂的50%,把水相转移到新管中,进行下一步操作,
⑤
量取转移液的体积,缓慢加入转移液体积0.43倍的无水乙醇,混匀,将得到的溶液和沉淀一起转入向吸附柱mirspin中,室温12,000rpm(13,400
×
g)离心30sec,若一次不能将全部溶液和混合物加入向吸附柱mirspin中,请分两次转入,离心后弃掉向吸附柱mirspin,保留流出液,
⑥
量取流出液的体积,缓慢加入流出液体积0.75倍的无水乙醇,混匀,将得到的溶液和沉淀一起转入吸附柱mirelute中,室温12,000rpm(13,400
×
g)离心30sec,
⑦
向吸附柱mirelute中加入500μl去蛋白液mrd,室温静置2min,室温12,000rpm(13,400
×
g)离心30sec,弃废液,
⑧
向吸附柱mirelute中加入500μl漂洗液rw,室温静置2min,室温12,000rpm(13,400
×
g)离心30sec,弃废液,
⑨
重复操作步骤7,
⑩
将吸附柱mirelute放入2ml收集管中,室温12,000rpm(13,400
×
g)离心1min,去除残余液体,将吸附柱mirelute转入一个新的rnase-free 1.5ml离心管中,加15μl rnase-freeddh2o,室温放置2min,室温12,000rpm(13,400
×
g)离心2min,
[0026]
4)cdna合成
[0027]
取20ngrna,基于revertra ace qpcrrt kit:fsq-101,toyobo逆转录试剂盒进行,加入2ul 5
×
rt buffer,0.5ul primer mix,0.5ul rt enzyme mix,加无酶水至10ul总体系,37℃条件下,进行15min的逆转录反应
→
在98℃条件下,进行5min的酶失活反应
→
反应结束后,取部分进行10
×
浓度稀释,每一个mirna都要一条特异的反转录引物,所以每一个mirna的反转录反应都是独立进行的,
[0028]
5)cdna产物进行荧光定量pcr反应
[0029]
按照rr820a takara premix ex taq
tm
ii(takara,rr820a)相应不走进行,所有反应均做3个复孔,10ul premix,上下游引物各0.5ul,1ul模板样品,灭菌水8ul,共计20ul反应体系,pcr反应条件为50℃,2min,95℃,10min;95℃,1min;95℃,15s,60℃,30s,40个循环,终点采集荧光,通过该反应可以得到各个mirna在不同样本中的表达量,进而进行后续分析,
[0030]
6)数据分析
[0031]
荧光定量pcr检测mirna相对表达量,最终结果以2
‑△△
ct
分析,采用专业作图软件graphpad prism7进行作图并统计分析,p<0.05时,有显著性差异,分析内容为mirna在早期肝癌患者、肝硬化患者、慢性hbv患者和健康人群中表达的个体差异分析。
[0032]
本发明的检测方法用于非诊断的目的。
[0033]
本发明的另一个目的在于提供所述的外泌体的制备方法,主要包括以下3个部分:
[0034]
1)分离血浆中的外泌体;
[0035]
2)提取外泌体中mirna;
[0036]
3)荧光定量pcr反应检测mirna。
[0037]
本发明的有益效果在于:成功分离和鉴定人血浆外泌体。早期肝癌患者血浆外泌体中mirna-485-3p和mirna-885-5p的水平较慢性hbv感染组和健康对照组显著增加(p<0.05)。本发明很好的弥补了缺乏早期肝癌诊断标志物的现状,并有广阔的市场应用前景。同时,通过实时荧光定量pcr技术对早期肝癌血浆中外泌体microrna水平的检测,定量准确,相对于芯片技术、分子杂交技术或者高通量测序技术,该方法简单快速、经济实用且便于临床开展。
[0038]
本发明中的肝癌主要是以乙肝导致的肝癌,不同诱因引发的肝癌可能导致不同的肿瘤标志物。以我们最为常见的肝癌标志物afp为例:经过系统治疗的慢性乙肝患者转变为肝癌,这些肝癌患者外周血中的afp水平一般不高,甚至在正常范围内。而药物或酒精引起的肝癌患者外周血中的afp水平一般会很高。这个现象说明,不同原因引发的肝癌可能导致肿瘤标志物的不同。因此,不能从(taa)诱导肝癌的标志物来推断乙肝引发肝癌的标志物。
附图说明
[0039]
图1是用透射电镜的方法鉴定所提取的尿液外泌体;
[0040]
图2是纳米流式检测的外泌体的粒径及粒径浓度;
[0041]
图3是用外泌体特异蛋白(cd9)标记后超分变率共聚焦荧光显微镜下观察到的外泌体;
[0042]
图4是用aminis成像流式观察到的含有肝癌特异蛋白(gpc3-绿色)的外泌体(cd9-红色);
[0043]
图5是健康对照组(control)、慢性hbv患者组(a1)、肝硬化患者组(b2)和早期肝癌患者组(c3)血浆外泌体中mirna-885-5p和mirna-485-3p的表达,注:肝癌组与其他三组比较,*p<0.05;
[0044]
图6是肝癌患者血浆外泌体中mirna的诊断灵敏度比较.(a)肝癌患者血浆外泌体中mirna-885-5p的诊断灵敏度。(b)肝癌患者血浆外泌体中mirna-485-3p的诊断灵敏度。(c)肝癌患者血浆外泌体中mirna-885-5p和mirna-485-3p的联合诊断灵敏度。
具体实施方式
[0045]
为了加深对本发明的理解,下面将结合实施例和附图对本发明做进一步详述,该实施例仅用于解释本发明,并不构成对本发明的保护范围的限定。
[0046]
实施例1、
[0047]
一、研究对象:选取2018年7月至2020年12月首都医科大学附属北京佑安医院的早期肝癌患者21例设为研究组。其中男11例,女10例。年龄40~72岁,平均(63.1
±
11.6)岁。早期肝癌诊断标准根据国家卫计委印发《原发性肝癌诊疗规范(2017年版)》,所有留取血浆的肝癌患者的肿瘤体积≤5cm且为单发肿瘤。慢性hbv感染组患者28例,其中男15例、女13例,年龄42~69岁,平均(54.2
±
8.7)岁。慢性乙型肝炎的诊断标准根据中华医学会肝病学分会中华医学会感染病学分会发布的《慢性乙型肝炎诊断标准(2015年版)》。将同期医院临检中心确诊的健康志愿者30例设为对照组,其中男16例、女14例,年龄32~69岁,平均(60.3
±
7.3)岁。本研究获医院伦理委员会批准。
[0048]
研究组和健康对照组、慢性hbv感染组在性别、年龄间无统计学差异(p>0.05);
[0049]
组别例数年龄(岁)男性女性健康对照组3060.3
±
7.31614慢性hbv组2854.2
±
8.71513早期肝癌组2163.1
±
11.61110p值0.690.590.610.62
[0050]
二、实验过程
[0051]
1.血浆样品的制备
[0052]
在采血管中加入edta抗凝剂,采集完血液后,将采血管缓慢颠倒混匀,混匀的全血4℃1,000-2,000
×
g离心5-10min,上层黄色半透明液体即为待收集的血浆,吸出血浆时贴着页面逐渐往下吸,切勿吸出细胞成分;收集到的血浆可直接用于后续实验或分装好-80℃冰箱保存。
[0053]
2.外泌体的提取
[0054]
将血浆(新鲜样品或保存于-80度的血浆在冰上融化)室温,2,000
×
g离心20min,去除残留细胞及碎片;转移上清到新的离心管中,注意不要吸到底部沉淀;室温,10,000
×
g离心20min,去除残留碎片;用移液器转移上清到新的离心管中(注意不要吸到底部沉淀及残留的剩液),1ml血浆样品,加入500ul 1
×
pbs及300ulvex exosome isolation reagent溶液,混匀后将混合液竖直放于2-8℃静置30min进行孵育,室温10,000
×
g离心5min去上清,然后室温10,000
×
g离心30s,用移液器吸除残留液体,血浆外泌体即存在于管底部沉淀中。本实验通过该方法获得的血浆外泌体的粒径并不均一,纳米流式分析显示平均粒径主要分布在62nm附近(图1);外泌体大致呈圆形、部分有凹陷,粒径在30-150nm之间(图2);表达cd9外泌体的特异性标志分子(图3和图4)。在早期肝癌患者组内提取的外泌体含有肝癌特异性的标志蛋白——磷脂酰肌醇蛋白聚糖(glypican-3,gpc3),所以为肝癌特异的外泌体(图4),说明成功分离了人血浆外泌体,并且可以分离到肝癌特异性的外泌体。
[0055]
3.外泌体mirna的提取
[0056]
外泌体mirna提取使用试剂盒(tiangen biotech(beijing)co.,ltd)。主要操作步骤如下:
①
取外泌体,加入1ml trizol充分匀浆,振荡器振荡或移液器吸打数次混匀。室温静置5min,使得核酸蛋白复合物完全分离。
②
4℃12,000rpm(13,400
×
g)离心5min,取上清,转入一个新的无rnase的离心管中。
③
加入200μl氯仿,盖好管盖,剧烈振荡15sec,室温放置5min。
④
4℃12,000rpm(13,400
×
g)离心15min,样品会分成三层:黄色的有机相,中间层和无色的水相,rna主要在水相中,水相的体积约为所用裂解液mz试剂的50%。把水相转移到
新管中,进行下一步操作。
⑤
量取转移液的体积,缓慢加入转移液体积0.43倍的无水乙醇(如:500μl的转移液加215μl无水乙醇),混匀。将得到的溶液和沉淀一起转入向吸附柱mirspin中,室温12,000rpm(13,400
×
g)离心30sec,若一次不能将全部溶液和混合物加入向吸附柱mirspin中,请分两次转入,离心后弃掉向吸附柱mirspin,保留流出液。
⑥
量取流出液的体积,缓慢加入流出液体积0.75倍的无水乙醇(如:700μl的流出液加525μl无水乙醇),混匀。将得到的溶液和沉淀一起转入吸附柱mirelute中,室温12,000rpm(13,400
×
g)离心30sec。
⑦
向吸附柱mirelute中加入500μl去蛋白液mrd,室温静置2min,室温12,000rpm(13,400
×
g)离心30sec,弃废液。
⑧
向吸附柱mirelute中加入500μl漂洗液rw,室温静置2min,室温12,000rpm(13,400
×
g)离心30sec,弃废液。
⑨
重复操作步骤7。
⑩
将吸附柱mirelute放入2ml收集管中,室温12,000rpm(13,400
×
g)离心1min,去除残余液体。将吸附柱mirelute转入一个新的rnase-free 1.5ml离心管中,加15μl rnase-freeddh2o,室温放置2min,室温12,000rpm(13,400
×
g)离心2min。
[0057]
4.cdna合成
[0058]
取20ngrna,基于revertra ace qpcrrt kit:fsq-101,toyobo逆转录试剂盒进行。加入2ul 5
×
rt buffer,0.5ul primer mix,0.5ul rt enzyme mix,加无酶水至10ul总体系,37℃条件下,进行15min的逆转录反应
→
在98℃条件下,进行5min的酶失活反应
→
反应结束后,取部分进行10
×
浓度稀释。每一个mirna都要一条特异的反转录引物,所以每一个mirna的反转录反应都是独立进行的。
[0059]
5.cdna产物进行荧光定量pcr反应
[0060]
按照rr820a takarapremix ex taq
tm
ii(takara,rr820a)相应步骤进行,所有反应均做3个复孔,10ulpremix,上下游引物各0.5ul,1ul模板样品,灭菌水8ul,共计20ul反应体系。pcr反应条件为50℃,2min,95℃,10min;95℃,1min;95℃,15s,60℃,30s,40个循环,终点采集荧光,通过该反应可以得到各个mirna在不同样本中的表达量,进而进行后续分析。
[0061]
6.数据分析
[0062]
荧光定量pcr检测mirna相对表达量,最终结果以2
‑△△
ct
分析,采用专业作图软件graphpad prism7进行作图并统计分析,p<0.05时,有显著性差异。分析内容为mirna在早期肝癌患者、肝硬化患者、慢性hbv患者和健康人群中表达的个体差异分析。如图5所示,早期肝癌患者组mir-885-5p和mirna-485-3p的表达与慢性hbv患者组和健康对照组比较显著增高(p<0.05)。因此mir-885-5p和mirna-485-3p可作为肝癌诊断(早期)的标志物。
[0063]
实施例2、
[0064]
本发明中,为了研究肝癌诊断血浆非编码rna分子标志物,通过文献调研和本实验室建立的rt-pcr技术,针对10例hbv携带者、肝硬化患者、肝癌患者的血浆样本和10例正常对照血浆外泌体样本进行检测,发现10个mirna的表达水平在患者组与正常组之间的差异。随后在扩大早期肝癌患者、慢性hbv患者和健康人群的样本分析,获得了一个候选mirna分子标志物群mirna1323、mirna-885-5p、mirna-509-3p、mirna-498、mirna-485-3p、mirna-516a-5p、mirna-216b-5p、mirna-194-3p、mirna-455-3p、mirna-498-3p。检测这10个mirna分子,检测结果利用生物信息学分析和医学统计方法发现mirna分子mir-485-3p、mir-885-5p在患者组与正常组间表达水平差异具有统计学意义,其相对表达水平如图5所示。利用
spss作图软件,以真阳性率(灵敏度)为纵坐标、假阳性率(特异性)为横坐标,绘制roc(receiver operating characteristic)曲线,对mir-885-5p和mirna-485-3p进行分析,其结果见图6,图中可见,单独使用mir-885-5p或单独用mirna-485-3p诊断早期肝癌的特异度和敏感度可达65%,如图6(a)和75%,如图6(b),联合mir-885-5p和mirna-485-3p的auc(曲线下面积)达到83.7%,如图6(c)。通过roc曲线分析后,结果发现当mir-485-3p、mir-885-5p的联合诊断时,比临床现有的肿瘤标志物能准确描述早期肝癌的发生。上述研究结果为进一步研发早期肝癌诊断mirna分子标志物提供了重要研究基础,这对于辅助诊断、治疗检测和预后判断的有效性有重要意义。
[0065]
实施例3、
[0066]
用于肝癌早期筛查的检查方法,主要是各种免疫检测技术,此类技术成熟,对蛋白质类肝癌标志物可进行准确的定性定量检测。mirna在不同肿瘤中的表达谱具有明显差异,因此也可将mirna表达谱作为肿瘤诊断标志物。近年来围绕mirna种类及其表达做了大量研究,旨在探明mirna的表达机制,以期为临床早期诊断肝癌提供更多有效标志物。
[0067]
本发明中肝癌早期诊断的主要步骤:血浆样品制备;外泌体的提取;外泌体mirna的提取;cdna合成;cdna产物进行荧光定量pcr反应;荧光定量pcr检测mirna相对表达量,最终结果以2
‑△△
ct分析,评估肝癌风险。
[0068]
本发明的有益效果在于:成功分离和鉴定人血浆外泌体,提供了一种所述外泌体的制备方法,主要包括3个部分:分离血浆中的外泌体;提取外泌体中mirna;荧光定量pcr反应检测mirna。同时,通过实时荧光定量pcr技术对早期肝癌血浆中外泌体microrna水平的检测,定量准确,相对于芯片技术、分子杂交技术或者高通量测序技术,该方法简单快速、经济实用且便于临床开展。
[0069]
序列表
[0070]
《110》首都医科大学附属北京佑安医院,北京市肝病研究所,
[0071]
《120》外泌体mirna-485-3p和mirna-885-5p作为肝癌诊断标志物的应用
[0072]
《160》2
[0073]
《210》1
[0074]
《211》22
[0075]
《212》rna
[0076]
《213》人源
[0077]
《220》
[0078]
《223》
[0079]
《400》1
[0080]
agagaggaga gccguguaug ac 22
[0081]
《210》2
[0082]
《211》22
[0083]
《212》rna
[0084]
《213》人源
[0085]
《400》2
[0086]
uccauuacac uacccugccu cu 22
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1