与湖羊的褪黑素性状相关的SNP标记及其应用
与湖羊的褪黑素性状相关的snp标记及其应用
技术领域
1.本发明生物工程技术领域,具体地,本发明涉及与湖羊的褪黑素性状相关的snp标记、特异性扩增snp标记的引物对、特异性扩增snp标记的试剂盒、鉴定湖羊的snp标记的方法、预测湖羊的褪黑素表达的方法、及引物对或试剂盒的应用。
背景技术:
2.我国是种业大国,却不是种业强国,绵羊品种资源丰富,却缺少当家品种。湖羊(hu sheep)属绵羊属(ovis aries),是我国特有的绵羊品种,主要在南方地区饲养,内蒙古自治区也有饲养。湖羊的性成熟较早,四季发情,可终年配种,而且多胎性强,在良好的饲养条件下一胎可产2-3羔,平均产羔率达256%,高繁殖率选育群可达以上300%,其繁殖力之强是世界绵羊品种中少有的。对湖羊多胎机理的研究,主要是探讨了它们的生殖内分泌、卵泡发育、排卵率、子宫内环境以及其产地的生态环境等对其的影响,尚没有确定多胎的主导因素。目前,从分子遗传机制上探讨我国湖羊多胎机理还比较少,现在证明湖羊存在多胎基因fecb,且为一个高度纯化的高产品种。
3.褪黑素(melatonin,mt)化学名称为n-乙酰基-5-羟色胺,是一种主要由松果体分泌的激素。在动物体内,褪黑素通过下丘脑-垂体-性腺轴直接调控繁殖活动。现在研究证明,生殖系统、消化系统、免疫系统等多种组织和器官均能分泌褪黑素。在大多数哺乳动物体内,褪黑素的合成主要分为三个主要步骤:1)色氨酸经过色氨酸羟化酶(tryptophanehydroxylase, tph)和l-芳香氨基酸脱羧酶(l-aromatic amino acid decarboxylase, aaad)的催化作用后生成5-羟色胺(5-hydroxy tryptamine, 血清素)。2)5-羟色胺在芳烷基胺n-乙酰转移酶(arylalkylamine-n-acetyltransferase, aanat)的作用下产生n-乙酰-5-羟色胺(n-actylserotonin)。3)n-乙酰-5-羟色胺(n-actylserotonin)在羟基吲哚-氧-甲基转移酶(hydroxyindole-o-methyl transferase,asmt)的催化作用下发生甲基化生成n-乙酰基-5-甲氧基色胺(n-acetyl-5-methoxytryptamine),即褪黑素。褪黑素发挥其生物学作用,主要通过mt1、mt2途径发挥调控作用。近年来,很多研究证明,应用褪黑素可以提高肉羊生产性能。因此,选育高褪黑素湖羊个体进行品种培育,不仅有利于肉羊产业振兴,更有利于种业振兴战略的开展。
4.单核苷酸多态性(single nucleotide polymorphism,snp),是指染色体基因组水平上单个核苷酸的变异引起的dna序列多态性,而其中一种等位基因在群体中的频率不少于1%。其是限制性片段长度多态性、微卫星标记之后的第3代分子标记。随着snp的迅速发展,snp巳经成为羊基因组分析的一个重要的研究工具,广泛应用于经济性状qtl位点的定位以及优良性状的选育。目前正广泛应用与羊分子育种领域。
技术实现要素:
5.本发明的目的在于提供了与湖羊的褪黑素性状相关的snp标记、特异性扩增snp标记的引物对、特异性扩增snp标记的试剂盒、鉴定湖羊的snp标记的方法、预测湖羊的褪黑素
表达的方法、及引物对或试剂盒的应用,为选育湖羊提供技术支持。
6.第一方面,本发明提供了一种与湖羊的褪黑素性状相关的snp标记。所述snp标记包括:所述基因组nc_040262.1的第7981372位和/或第7981866位碱基;基因组nc_040277.1的第17355171位碱基。
7.基因组nc_040262.1位于第11号染色体上芳烷基胺-n-乙酰基转移酶(aanat)基因的编码区。
8.基因组nc_040277.1位于第26号染色体上褪黑素i型受体(mtnr1a)基因的编码区。
9.在一些实施方式中,所述snp标记包括:所述基因组nc_040262.1的第7981372位碱基是g或c。
10.在一些实施方式中,所述snp标记包括:所述基因组nc_040262.1的第7981866位碱基是g或a。
11.在一些实施方式中,所述snp标记包括:所述基因组nc_040277.1的第17355171位碱基是g或t。
12.在一些实施方式中,所述基因组nc_040262.1的第7981372位碱基对应的氨基酸发生突变。
13.在一些实施方式中,所述基因组nc_040262.1的所述第7981372位碱基对应的氨基酸由e突变为d。
14.在一些实施方式中,所述基因组nc_040262.1的第7981866位碱基对应的氨基酸发生突变。
15.在一些实施方式中,所述基因组nc_040262.1的所述第7981866位碱基对应的氨基酸由r突变为q。
16.在一些实施方式中,所述基因组nc_040277.1的第17355171位碱基对应的氨基酸发生突变。
17.在一些实施方式中,所述基因组nc_040277.1的所述第17355171位碱基对应的氨基酸由a突变为d。
18.第二方面,本发明提供了一种特异性扩增本发明第一方面提供的snp标记的引物对。所述引物对包括;如seq id no:1和seq id no:2所示的引物对,其用于特异性扩增所述第7981372位的snp标记和/或所述第7981866位的snp标记;和/或如seq id no:9和seq id no:10所示的引物对,其用于特异性扩增所述第17355171位的snp标记。
19.seq id no:1所示的核苷酸序列为catctctgtctccggcaact。
20.seq id no:2所示的核苷酸序列为gagtcagcggtcactgttcc。
21.seq id no:9所示的核苷酸序列为ctgacagcacattagctcagacat。
22.seq id no:10所示的核苷酸序列为cctctgctacgtgttcctgatct。
23.第三方面,本发明提供了一种试剂盒。所述试剂盒包括本发明第二方面提供的引物对。
24.第四方面,本发明提供了一种鉴定湖羊的snp标记的方法。所述方法包括以下步
骤:提取湖羊的基因组dna;以所述基因组dna为模板,使用本发明第二方面提供的引物对进行pcr扩增反应,得到扩增产物;分析所述扩增产物。
25.在一些实施方式中,所述方法还包括:当所述基因组nc_040262.1的第7981372位基因型为cg或cc、第7981866位基因型为ga或aa,和/或所述基因组nc_040277.1的第17355171位的基因型为gg时,对应的湖羊的褪黑素表达量高。
26.在一些实施方式中,所述方法还包括:当所述基因组nc_040262.1的第7981372位基因型为cc,和/或第7981866位基因型为aa时,对应的湖羊的褪黑素表达量更高。
27.第五方面,本发明提供了一种预测湖羊的褪黑素表达的方法。所述方法包括以下步骤:提取湖羊的基因组dna;以所述基因组dna为模板,使用本发明第二方面提供的引物对进行pcr扩增反应,得到扩增产物;分析所述扩增产物。
28.在一些实施方式中,所述方法还包括:当所述基因组nc_040262.1的第7981372位基因型为cg或cc、第7981866位基因型为ga或aa,和/或所述基因组nc_040277.1的第17355171位的基因型为gg时,对应的湖羊的褪黑素表达相关度高。
29.在一些实施方式中,所述方法还包括:当所述基因组nc_040262.1的第7981372位基因型为cc,和/或第7981866位基因型为aa时,对应的湖羊的褪黑素表达量更高。
30.第六方面,本发明提供了本发明第二方面提供的引物对在湖羊(hu sheep)育种中的应用。
31.第七方面,本发明提供了本发明第三方面提供的试剂盒在湖羊(hu sheep)育种中的应用。
32.本发明提供的snp标记与湖羊的褪黑素性状表达显著相关。基因组nc_040262.1第7981372位基因型为cg或cc、第7981866位基因型为ga或aa,和基因组nc_040277.1第17355171位基因型为gg时,湖羊的褪黑素表达量显著增高,为选育湖羊提供技术支持。
附图说明
33.图1显示了snp距离累积分布曲线。
34.图2显示了aanat基因snp分析结果。
35.图3显示了asmt基因snp分析结果。
36.图4显示了mtnr1a基因snp分析结果。
37.图5显示了mtnr1b基因snp分析结果。
38.图6显示了与褪黑素性状显著相关的snp位点基因型。
具体实施方式
39.下面通过实施例对本发明作进一步说明,应该理解的是,本发明的实施例仅是用
于说明本发明,而不是本发明的限制,在本发明的构思前提下对本发明的简单改进都属于本发明要求保护的范围。
40.基因组nc_040262.1位于第11号染色体上芳烷基胺-n-乙酰基转移酶(aanat)基因的编码区。
41.基因组nc_040278.1位于x染色体上n-乙酰基-5-羟色胺-甲基转移酶(asmt)基因的编码区。
42.基因组nc_040277.1位于第26号染色体上褪黑素i型受体(mtnr1a)基因的编码区。
43.基因组nc_040272.1位于第21号染色体上褪黑素ii型受体(mtnr1b)基因的编码区。
44.实施例:1. 褪黑素检测(高效液相色谱法)配制1mg/ml褪黑素甲醇色谱级溶液,甲醇依次稀释为100、50、20、10、5ng/l检测峰面积,绘制标准曲线。取200μl血液,加800μl甲醇,漩涡振荡30min,4℃,使用14000r/min进行离心,时间为20min,吸取上清液进行过滤,储存于棕色样品瓶,-20℃保存,滤器规格为0.22μm。样品检测后根据样品峰面积计算褪黑素浓度。
45.2. 高褪黑素湖羊个体选择在高等动物中,褪黑素是由松果体产生的。松果体产生的褪黑素是内分泌激素,会进入血液。因此,本研究应用高效液相色谱法进行褪黑素测定,依据血液中褪黑素检测结果选择高褪黑素湖羊个体。
46.3. 全基因组检测基因组重测序包括样品基因组dna的提取与质检,测序文库构建和上机测序。实验过程质控合格后,以目标数据量为参考进一步调整文库体积,数个文库混合后进行illumina hiseq测序。具体实验步骤如下:(1)基因组dna的提取与质量检测。
47.(2)将基因组dna打断。
48.(3)对dna片段的粘性末端进行补平修复,使用添加碱基“a”的修复方法,将3
′
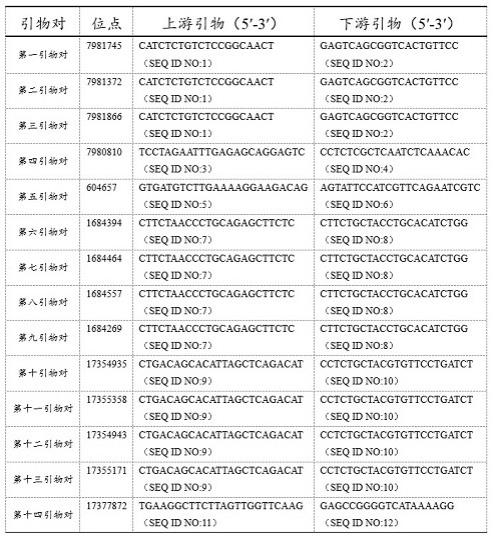
端转换为粘性末端。
49.(4)粘性末端两侧添加index序列dna接头。
50.(5)使用磁珠进行筛选,收集长度合适的目的片段。
51.(6)pcr扩增在目的片段末端添加index,构建测序文库。
52.(7)通过桥式pcr将测序文库结合到测序芯片上。
53.(8)illumina hiseq上机测序。
54.4. 生物信息分析流程(1)对测序结果原始图像数据利用软件bcf2fastq(version 2.17.1.14)进行图像碱基识别(base calling)初步质量分析,得到测序样本的原始数据(pass filter data,pf),测序数据以fastq(简称fq)文件格式存储。
55.(2)使用二代测序数据质量统计软件cutadapt(version 1.9.1)对测序原始数据(pass filter data)去除接头以及低质量序列,得到后续信息分析用的clean data。
56.(3)利用dragen genome pipline,将clean data比对到参考基因组序列上,统计
比对结果,包括比对上参考序列reads数量,平均深度及覆盖率等。
57.(4)基于比对结果,使用dragen genome pipline进行snp(单碱基突变的检测,对参考基因组每个位点进行检测,检测位点是否存在snp,并将检测结果保存于variant call format(vcf)格式文件中。
58.(5)根据物种的已知基因,将物种的基因组划分为不同的功能单位。然后依据突变所发生的位置,将每个突变位点进行功能区域分类,并对各样本所检测到的突变位点依据功能区进行分类统计。
59.5. 非同义突变位点验证引物长度在15bp-30bp,其有效长度一般不大于38bp,否则pcr的最适延伸温度会超过taq酶的最佳作用温度,从而降低产物的特异性。gc含量应在40%-60%之间,最适tm值在58℃-60℃。引物自身不能含有自身互补序列,否则会形成发夹样二级结构。引物之间不应有多于4个的互补或同源碱基,不然会形成引物二聚体,尤应避免3
′
端的互补重叠。引物对的核苷酸序列请参见表1。在表1中,第7981745位、第7981372位、第7980810位和第7981866位碱基位于基因组nc_040262.1芳烷基胺-n-乙酰基转移酶(aanat)上;第604657位碱基位于基因组nc_040278.1(asmt)上;第17354935位、第17355358位、第17354943位、第17377872位、和第17355171位碱基位于基因组nc_040277.1(mtnr1a)上;第1684394位、第1684464位、第1684557位、和第1684269位碱基位于基因组nc_040272.1(mtnr1b)上。
60.表1 引物对的核苷酸序列
6. snp位点与性状关联性分析引物长采用r语言软件进行snp位点与表型之间的关联性分析,所用模型如下:yij=μ+gi+pj+eij,其中,yij为性状观察值;μ为性状总平均值;gi为基因型效应;pj为固定效应;eij为随机误差。
61.7. 实验结果7.1湖羊褪黑素浓度结果检测对195只湖羊血清进行褪黑素检测,其中含量在0-0.5ng/ml共100只占比51.3%,0.5-1ng/ml共42只占比21.5%,1ng/ml以上53只占比27.2%。确定3只高褪黑素湖羊个体(表2中编号b1-1至b1-3)及3只低褪黑素湖羊个体(表2中编号b2-1至b2-3)进行褪黑素浓度复检,进行全基因组测序分析,结果如表2所示:表2 全基因组测序分析样本
7.2 测序原始数据质控对6个湖羊血液样本进行全基因组重测序,原始数据(pass filter data,pf)如表3所示。对原始数据去除低质量序列结果,获得clean date如表4所示,qc后的clean data在pf data中均达到99%以上,统计如表5所示。实验获得的测序数据良好,能够进行后续的相关生信分析。
62.表3 pf data统计注:q20(%):分别计算phred数值大于20的碱基占总体碱基的百分比;q30(%):分别计算phred数值大于30的碱基占总体碱基的百分比;gc(%):计算碱基g和c的数量总和占总碱基数量的百分比;n(ppm):测序无法判定的碱基n在每百万碱基中含量。
63.表4 clean data数据统计
注:q20(%):分别计算phred数值大于20的碱基占总体碱基的百分比;q30(%):分别计算phred数值大于30的碱基占总体碱基的百分比;gc(%):计算碱基g和c的数量总和占总碱基数量的百分比;n(ppm):测序无法判定的碱基n在每百万碱基中含量。
64.表5 clean data ratio数据统计7.3 测序过滤数据质控统计利用dragen genome pipline将clean data与参考基因组序列进行比对,比对比例平均达99.89%,比对到参考基因组唯一reads数占所有比对上参考基因组的81.12%,具体如表6所示。平均覆盖率达96.415%,平均覆盖深度达29.105%,具体如表7所示。
65.表6 测序比对统计
表7 基因组覆盖率统计7.4 snp检测及注释基于比对结果,使用dragen genome pipline进行snp(单碱基突变)的检测。6个样品的全基因组测序snp的统计如表8所示。根据突变位点所引起的功能改变,将snp划分多种类型,不同的类型snp的统计结果如表9所示。
66.表8 全基因组snp/indel统计
表9 全基因组snp类型统计碱基类型有a,t,c,g四种类型,以参考基因组正链a突变为c为例,结合基因组的正负链关系,实际突变方式为a:t配对碱基,突变为c:g配对碱基,负链中的突变类型则为t》g,因此a》c和t》g类型突变可划归为一类突变,标示为a:t》c:g。因此snp突变方式可以划分为6类,分别为a:t》t:a,a:t》c:g,a:t》g:c,c:g》t:a,c:g》g:c,c:g》a:t。如图1全基因组范围snp突变主要集中在c:g》t:a和a:t》c:g这两种类型。在图1中,横坐标为不同突变类型的snp位点数目;纵坐标为6种突变类型分类。
67.7.5 aanat基因snp分析对高褪黑素湖羊组和低褪黑素湖羊组的不同个体aanat基因的snp位点进行突变功能区域分类。高褪黑素湖羊组和低褪黑素湖羊组之间snp数量存在显著的差异,对不同个体之间的snp的突变进行统计,主要存在于c:g》t:a和a:t》g:c两种类型,差异snp位点23个,非同义突变4个,其中2个与褪黑素显著相关,如图2所示(a:snpvenn分析;b:snp-突变体类型)。
68.7.6 asmt基因snp分析对高褪黑素湖羊组和低褪黑素湖羊组的不同个体asmt基因的snp位点进行突变功
能区域分类。高褪黑素湖羊组和低褪黑素湖羊组之间snp数量存在显著的差异,对不同个体之间的snp的突变进行统计,主要存在于c:g》t:a和a:t》g:c两种类型,差异snp位点168个,非同义突变1个,如图3所示(a:snp-venn分析;b:snp-突变体类型)。
69.7.7 mtnr1a基因snp分析对高褪黑素湖羊组和低褪黑素湖羊组的不同个体mtnr1a基因的snp位点进行突变功能区域分类。高褪黑素湖羊组和低褪黑素湖羊组之间snp数量上不存在显著的差异,对不同个体之间的snp的突变进行统计,主要存在于c:g》t:a和a:t》g:c两种类型,差异突变snp位点89个,非同义突变5个,其中1个与褪黑素表达显著相关,如图4所示(a:snpvenn分析;b:snp-突变体类型)。
70.7.8 mtnr1b基因snp分析对高褪黑素湖羊组和低褪黑素湖羊组的不同个体mtnra1b基因的snp位点进行突变功能区域分类。对不同个体之间的snp的突变进行统计,主要存在于c:g》t:a和a:t》g:c两种类型,非同义突变5个,如图5所示(a:snpvenn分析;b:snp-突变型类型)。
71.7.9 褪黑素合成酶及受体基因非同义突变位点相关性分析为了进一步验证所发现的snp位点与褪黑素的相关性,使用7.1中提到的195只湖羊,对高褪黑素湖羊和低褪黑素湖羊的褪黑素合成酶及受体基因的snp突变位点进行统计,其中位于外显子区域发生氨基酸突变的非同义位点14个(表10)。采用r语言软件进行snp位点与表型之间的关联性分析,p《0.05表明snp位点与褪黑素表达显著相关。结果示于表11中,其中可以看到3个位点与湖羊褪黑素表达呈现显著相关性,分别为p02(对应于基因组nc_040262.1(aanat)的第7981372位)、p04(对应于基因组nc_040262.1(aanat)的第7981866位)和p14(对应于基因组nc_040277.1(mtnr1a)的第17355171位)。
72.基因组nc_040262.1的第7981372位基因型cg、第7981866位基因型ga和基因组nc_040277.1的第17355171位基因型gg的湖羊的褪黑素浓度高于该群体内的褪黑素平均浓度1.64ng/ml。如图6所示,第7981372位snp标记的基因型为gg,相关性为89.4%,基因型cg相关性为10.6%;第7981866位snp标记的基因型为gg,相关性为86.8%,基因型ga相关性为13.4%;第17355171位snp标记的基因型为gg,相关性为84.1%,基因型gt相关性为15.6%。
73.表10 非同义突变汇总
表11 突变位点显著性检验注:p《0.05表示在0.05水平(双侧)上显著相关,p《0.01表示在0.01水平(双侧)上显著相关,表11中的p01-p14依次对应表10中的p01-p14。
74.表12 显著性位点基因型对应褪黑素浓度可见,本发明提供了与湖羊的褪黑素性状相关的snp标记。基因组nc_040262.1的第7981372位基因型为cg、第7981866位基因型为ga和基因组nc_040277.1第17355171位基因型为gg时,湖羊的褪黑素表达量显著增高,为选育湖羊提供技术支持。
75.以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中
的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
76.另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
77.此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1