一种基于编辑基因型选择的黑棕色中国美利奴细毛羊育种方法
1.本发明属于绵羊遗传育种和分子生物学技术领域,涉及一种基于编辑基因型选择的黑棕色中国美利奴细毛羊育种方法。
背景技术:
2.在绵羊的遗传育种工作中,毛色作为重要的品种特征,在确定杂交组合、鉴定品种纯度和亲缘关系等方面发挥重要作用。同时,在绵羊育种上,毛色与适应性、抗病性以及生长发育相关,被作为重要的选育性状之一。asip(agouti signaling protein)是由agouti位点编码的一种信号蛋白,是影响绵羊毛色的主要候选基因,在色素形成中起重要的调控作用。中国美利奴细毛羊(新疆型)(又称为中国美利奴羊(新疆型))为新疆毛肉兼用细毛羊,经长期选育毛色单一,以白色为主,其他颜色的个体极少。而随着市场的发展变化、人们生活质量的提高和对化工印染副作用的认识,人们对天然彩色羊毛的需求也逐渐增强。
3.随着近几年分子遗传学和生物新技术的飞速发展,不断出现的新技术不仅突破了绵羊传统育种领域无法解决的遗传难题,而且实现了对特定性状的改变,大大提高了绵羊品种遗传改良的速度。如果能够通过人工干预动物毛色基因的表达从而改变动物毛色,进一步通过基因型选择、杂交育种建立稳定且毛色一致的群体,将会满足这一市场需求,提高毛皮动物的生产价值和经济效益。同时,可以大大加快毛色性状选择和育种工作的进程。
4.动物毛色因受多基因控制,会导致不同品种绵羊杂交后代的毛色分离情况也各有不同。而理想的毛色分离情况是遵循孟德尔一对性状的分离规律,即在子一代均为杂合子,表现为显性;子二代出现毛色分离,且显性和隐性的分离比接近3:1。但由于毛色基因遗传复杂且影响毛色基因众多,后代个体毛色分离类型和比例也会大相径庭。而且毛色在遗传上具有显隐性表现,常规育种手段选育并固定一种毛色常常要经历几个甚至十几个世代的时间,育种周期长、技术难度大,被认为是动物遗传育种的主要技术难点之一。此外,若仅根据绵羊毛色的表型性状进行选留配种,也存在后代群体发生性状分离的问题。
技术实现要素:
5.本发明的一个目的是提供一种非白色中国美利奴细毛羊扩繁或培育方法。
6.本发明提供的方法,包括如下步骤:
7.1)以具有如下2种基因型且毛色为非白色的中国美利奴细毛羊公羊与野生型中国美利奴细毛羊母羊配种,生产f1代羊;
8.2)从所述f1代羊中选取具有所述2种基因型中任一种基因型的f1代asip基因编辑羊的母羊与f0代asip基因编辑公羊配种,得到f2代目标羊(为黑色或棕色目标羊);
9.所述2种基因型为如下1)和2):
10.1)27bp碱基缺失伴随1bp插入基因型;
11.2)4bp碱基缺失基因型;
12.所述4bp碱基缺失基因型为中国美利奴细毛羊两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22338-22341位缺失4bp碱基;
13.所述27bp碱基缺失伴随1bp碱基插入基因型为中国美利奴细毛羊两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22322-22348位共缺失27bp碱基,且在序列1第22339-22340位插入1bp碱基t。
14.上述方法中,所述从f1代羊中选取具有2种基因型中任一种基因型的f1代asip基因编辑羊的母羊的方法为如下a)或b):
15.a所示的方法包括如下:用序列4所示的引物和序列5所示的引物组成的引物组对待测羊基因组进行扩增,测序扩增产物,确定基因型;
16.b所示的方法包括如下:用序列6所示的引物和序列7所示的引物组成的引物组对待测羊基因组进行扩增,测序扩增产物,确定基因型。
17.上述方法中,所述非白色中国美利奴细毛羊为黑色或棕色中国美利奴细毛羊;其中,黑色或棕色中国美利奴细毛羊为周身毛色黑色或棕色占80%以上。
18.具有如下2种基因型的中国美利奴细毛羊公羊在培育黑色或棕色中国美利奴细毛羊中的应用也是本发明保护的范围;
19.或具有如下2种基因型的中国美利奴细毛羊公羊在扩繁非白色中国美利奴细毛羊中的应用也是本发明保护的范围;
20.所述2种基因型为如下:1)27bp碱基缺失伴随1bp插入基因型;2)4bp碱基缺失基因型;
21.所述4bp碱基缺失基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22338-22341位缺失4bp碱基;
22.所述27bp碱基缺失伴随1bp碱基插入基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22322-22348位缺失27bp碱基,且在序列1第22339-22340位插入1bp碱基t。
23.具有如下2种基因型的中国美利奴细毛羊公羊和基因型鉴定采用的引物在培育黑棕色中国美利奴细毛羊中的应用也是本发明保护的范围;
24.所述引物由序列4所示的引物和序列5所示的引物组成的引物组或由序列6所示的引物和序列7所示的引物组成的引物组;
25.所述2种基因型为如下:1)27bp碱基缺失伴随1bp插入基因型;2)4bp碱基缺失基因型;
26.所述4bp碱基缺失基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22338-22341位缺失4bp碱基;
27.所述27bp碱基缺失伴随1bp碱基插入基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22322-22348位缺失27bp碱基,且在序列1第22339-22340位插入1bp碱基t。
28.上述具有如下2种基因型的中国美利奴细毛羊公羊(记作f0代asip基因编辑公羊)可以为采用现有常规技术手段对野生型中国美利奴细毛羊(新疆型)的asip基因进行定点缺失或插入或基因编辑,得到具有如下2种基因型的公羊,且其周身毛色为棕白相间(棕色占80%以上);也可以利用成纤维细胞进行体细胞克隆和胚胎移植方式获得的后代公羊,该
后代公羊仍然为具有2种基因型的公羊,且其周身毛色为棕白相间(棕色占80%以上)。本发明中,中国美利奴细毛羊均为新疆型,又名中国美利奴细毛羊(新疆型)。
29.目前利用crispr/cas9技术对控制中国美利奴细毛羊(新疆型)毛色的关键基因asip进行修饰突变,获得了不同毛色的基因编辑细毛羊。由于无法控制基因编辑细毛羊繁殖过程中出现的毛色基因分离和重组,因此为了获得毛色一致的后代,本发明首先确定育种毛色的基因型,通过对毛色基因型的育种设计,在制定配种方案时事先选育出特定基因型的种群,通过人工授精或自然交配进行指导育种,实现群体逐步扩繁,经过扩繁选育后,才能培育出毛色较为整齐、能够稳定遗传的黑棕色细毛羊群体,为进一步确定毛色育种方向提供了理论依据,也为培育不同毛色的绵羊新品种以及研究毛色基因遗传机理提供了难得的种质资源和遗传材料。
附图说明
30.图1为本发明实施例的基于编辑基因型选择培育黑棕色中国美利奴细毛羊(新疆型)方法的流程示意图。
31.图2为hi-tom pcr扩增电泳结果,a为第一轮pcr扩增,b为第二轮pcr扩增纯化后。
32.图3为asip基因编辑羊两种基因型编辑位点的测序峰图结果。
33.图4为asip基因编辑羊自然突变、编辑修饰和移码突变示意图。
34.图5为高通量测序的asip基因编辑效率结果。
具体实施方式
35.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
36.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
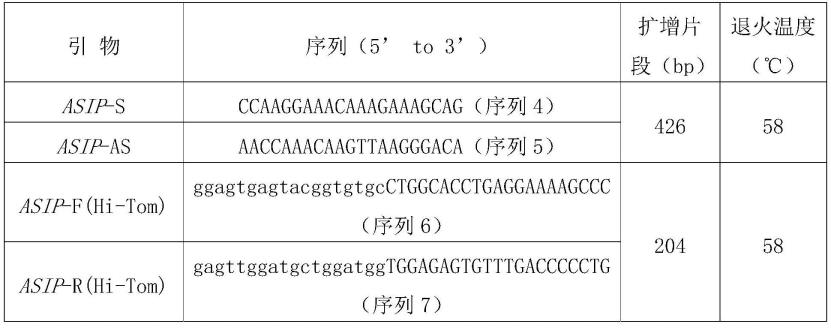
37.下述实施例中相关引物的核苷酸序列见表1。
38.表1为asip基因相关引物的核苷酸序列
[0039][0040]
注:各引物均为单链dna分子。
[0041]
下述实施例中具有2种基因型的公羊(记作f0代asip基因编辑公羊)可以为采用现有常规技术手段对野生型的中国美利奴细毛羊(新疆型)的asip基因进行定点缺失或插入或基因编辑,得到具有如下2种基因型的公羊,且其周身毛色为棕白相间(棕色占80%以上);也可以利用成纤维细胞进行体细胞克隆和胚胎移植方式获得的后代公羊,该后代公羊仍然为具有2种基因型的公羊,且其周身毛色为棕白相间(棕色占80%以上)。
[0042]
上述2种基因型为4bp碱基缺失基因型和27bp碱基缺失伴随1bp碱基插入基因型:
[0043]
4bp碱基缺失基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22338-22341位缺失4bp碱基;;
[0044]
27bp碱基缺失伴随1bp碱基插入基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因(核苷酸序列为序列1)均在序列1第22322-22348位缺失27bp碱基,且在序列1第22339-22340位插入1bp碱基t;其中缺失27bp碱基跨越3个内含子;
[0045]
野生型中国美利奴细毛羊(新疆型)为自然繁育未经过编辑或突变的中国美利奴细毛羊(新疆型),该羊asip基因的核苷酸序列为序列表中序列1;
[0046]
上述f0代asip基因编辑公羊制备方法举例采用基因编辑的形式获得,记载在如下文献中:xuemei zhang,wenrong li,chenxi liu,xinrong peng,jiapeng lin,sangang he,xuejiao li,bing han,ning zhang,yangsheng wu,lei chen,liqin wang,mayila,juncheng huang,and mingjun liu*,alteration of sheep coat color pattern by disruption of asip gene via crispr/cas9,sci rep,2017,7:8149.构建具体如下:
[0047]
crispr/cas9系统包括如下:
[0048]
靶序列为序列表的序列1自5’末端第22323至22342位核苷酸;
[0049]
asip-sgrna的核苷酸序列为序列2;
[0050]
cas9 mrna如序列表的序列3所示;
[0051]
待中国美利奴细毛羊(新疆型)供体母羊人工授精后,手术法从输卵管中冲取原核胚;再将asip-sgrna和cas9 mrna混合注射入处于单细胞期的受精卵的胞质内,培养,得到胚胎,移植到母体输卵管,母羊生产子代羊,即可获得具有上述基因型的f0代asip基因编辑公羊。
[0052]
实施例1、基因编辑羊的基因型鉴定方法
[0053]
1、引物设计与合成
[0054]
按照ncbi数据库中发布的绵羊asip基因序列(登录号为:nc_040264),采用oligo 7.0软件针对绵羊asip基因外显子2序列设计特异性引物asip-s和asip-as用于扩增asip基因426bp长度的编码区,引物相关信息详见表1,引物由生工生物工程(上海)股份有限公司合成。
[0055]
2、dna提取
[0056]
用tianamp genomic dna kit试剂盒(北京天根)提取f0代或f1代asip基因编辑公羊尾组织基因组dna,实验操作严格按照说明书进行,提取好的dna用0.8%的琼脂糖凝胶电泳检测,nanodrop超微量分光光度计测定dna浓度,存于-20℃低温冰箱。本发明所提取dna最后吸光度od值在1.8-2.0之间,将dna浓度稀释至100ng/μl用于pcr扩增。
[0057]
3、测序
[0058]
可以采用如下方法进行扩增测序:
[0059]
1)sanger测序
[0060]
以上述2的dna作为模板,使用步骤1的上游引物asip-s和下游引物asip-as进行pcr扩增。
[0061]
pcr扩增体系为:2
×
pcr master mix 25μl,模板dna 100ng,上、下游引物(浓度10μmol/l)各1μl,灭菌超纯水补足至50μl。pcr扩增程序为:95℃预变性5min;95℃变性30s,58
℃退火30s,72℃延伸30s,35个循环;最后72℃延伸7min,pcr产物用2%的琼脂糖凝胶电泳进行检测。
[0062]
将上述得到的pcr产物进行sanger测序,比对参考基因组的序列(ncbi reference sequence:nc_040264.1locus nc_040264 27563bp dna linear con 06-feb-2019),由测序峰图初步获得基因突变的信息。
[0063]
2)hi-tom高通量测序
[0064]
采用hi-tom高通量测序法对所设计的asip靶向编辑区域进行深度测序,方法如下:
[0065]
以上述2的dna作为模板,用asip-f(hi-tom)(在正向特异引物5’端前添加正向搭桥序列)和asip-r(hi-tom)(反向特异引物5’端前添加反向搭桥序列)为引物,进行第一轮pcr扩增。
[0066]
将hi-tom第一轮pcr产物分别加入到预装好的hi-tom mix试剂盒(北京诺禾致源生物科技有限公司,产品货号:pt045)中进行第二轮pcr反应,将扩增好的第二轮pcr产物混合后切胶回收纯化,用干冰密封运输,寄往天津诺禾致源生物信息科技有限公司进行illumina测序,测序1g数据。
[0067]
hi-tom第一轮pcr产物和第二轮pcr产物纯化后的电泳检测结果如图2a和图2b所示,可以看出,扩增产物片段大小与预期一致。
[0068]
4、测序结果比对和分析
[0069]
hi-tom测序结果返回后,将测序数据上传到网站(http://www.hi-tom.net/hi-tom/),逐个对样本进行编辑类型和位置,包括reads读数、比率、突变类型、突变碱基和dna序列的分析。
[0070]
sanger测序结果用chromas和clustalx软件进行峰图和序列比对分析。
[0071]
f0代asip基因编辑公羊的asip基因型峰图如图3所示,a图为野生型峰图(以野生型细毛羊为对照),b图为4bp碱基缺失基因型的峰图,c图为27bp碱基缺失伴随1bp碱基插入基因型的峰图。
[0072]
自然突变、编辑修饰和移码突变如图4所示,f0、f1只要编辑基因型一致,移码突变就一致。
[0073]
将上述hi-tom高通量测序和sanger测序结果相结合精准确定基因型、编辑效率和自然突变类型。编辑效率(靶突变读数/靶位点总读数)低于1%的样本被认为是阴性(靶位点没有编辑),而突变率》1%的样本被认为是突变。
[0074]
实施例2、基于编辑基因型选择的黑棕色中国美利奴细毛羊(新疆型)育种方法
[0075]
基于编辑基因型选择培育黑棕色中国美利奴细毛羊(新疆型)方法的流程示意图如图1所示。具体如下:
[0076]
一、杂交配种
[0077]
1、f0代asip基因编辑公羊和野生细毛母羊的选择
[0078]
根据sanger测序和hi-tom测序结果确定的基因型,周岁时选择周身毛色为棕白相间(棕色占80%以上),具有4bp碱基缺失基因型和27bp碱基缺失伴随1bp碱基插入基因型这2种基因型的f0代asip基因编辑公羊做配种用采精公羊,该公羊体重达到45kg以上,体高达60cm以上,单次射精量2.0ml以上,精液检测优良(精子活力0.8以上)。配种前一个月公羊每
天补饲胡萝卜鸡蛋,早晚各运动1小时。
[0079]
选择体躯被毛白色、体重在40kg以上、膘情好、无繁殖疾病的野生中国美利奴细毛羊(新疆型)母羊做配种用母羊。
[0080]
2、同期发情和人工授精
[0081]
母羊阴道放入海绵栓记为0天,在第12天取出海绵栓,清洗母羊阴道,并肌肉注射孕马血清330iu(中国宁波三生公司)。撤栓48h后进行人工输精,并肌肉注射促排3号25μg(中国宁波三生公司),间隔6-8小时再次进行输精。受孕母羊生产后得到f1代个体。
[0082]
3、自然交配
[0083]
上述人工授精配种后45天左右进行妊娠b超检查,将未受孕的母羊挑出与f0代asip基因编辑公羊混圈35天,使其自由交配。受孕母羊生产后得到f1代个体。
[0084]
上述2和3步骤共获得28只f1代个体。
[0085]
4、基因型鉴定和毛色的观测
[0086]
按照实施例1的方法对出生15-20天的f1代个体进行基因型检测,采用sanger测序结合hi-tom测序。
[0087]
结果如下:
[0088]
经基因型检测,
[0089]
其中,21只f1代个体均遗传到其亲本f0代asip基因编辑公羊的2种编辑基因型,命名为f1代asip基因编辑羊,
[0090]
统计这21只f1代asip基因编辑羊的毛色和对应基因型如下:
[0091]
10只f1代asip基因编辑羊的基因型仅为4bp碱基缺失基因型,其周身毛色黑//棕色和白色相间(黑/棕色占80%以上;2只,1只母羊,1只公羊)和白色(8只,4只母羊,4只公羊)两种;
[0092]
11只f1代asip基因编辑羊的基因型仅为27bp碱基缺失伴随1bp碱基插入基因型,其周身毛色黑白相间(黑色占80%以上;1只母羊)和白色(10只,5只母羊,5只公羊)两种。
[0093]
另外,7只个体不具有亲本f0代asip基因编辑公羊的2种编辑基因型,不作为进一步研究对象,其中,3只f1代个体不具有4bp碱基缺失基因型和27bp碱基缺失伴随1bp碱基插入基因型,但是其asip基因也发生缺失和插入,具体为asip基因(序列1)第22328-22348位缺失21bp,且在第22338-22339位插入2bp碱基aa;另外4只f1代个体的asip基因为野生型(序列1)。
[0094]
再次分析21只f1代asip基因编辑羊,其基因型相同,但是毛色不同,可能是由于其产生了自然突变,继续分析21只f1代asip基因编辑羊中asip基因,发现不同毛色具有不同的自然突变类型:
[0095]
2只周身毛色黑/棕色和白色相间且基因型仅为4bp碱基缺失基因型的f1代asip基因编辑羊中,1只发生了5bp、9bp均未缺失的纯合基因型(n5n5,n9n9),1只发生了自然突变为5bp、9bp均缺失的杂合基因型(n5d5,n9d9);
[0096]
8只白色且基因型仅为4bp碱基缺失基因型的f1代asip基因编辑羊中,均发生了5bp缺失的杂合基因型(n5d5)和9bp未缺失的纯合基因型(n9n9)。
[0097]
1只周身毛色黑白相间且基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的f1代asip基因编辑羊中,发生了自然突变为5bp、9bp均缺失的杂合基因型(n5d5,n9d9)。
[0098]
10只白色且基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的f1代asip基因编辑羊中,7只发生了自然突变为5bp缺失的杂合基因型(n5d5)和9bp未缺失的纯合基因型(n9n9),3只发生了自然突变为5bp、9bp均未缺失的纯合基因型(n5n5,n9n9)。
[0099]
上述5bp、9bp均未缺失的纯合基因型(n5n5,n9n9)为细毛羊两条同源染色体中的asip基因在序列1第22285-22289位不存在5bp缺失,在序列1第22195-22203位也不存在9bp缺失;
[0100]
上述5bp、9bp均缺失的杂合基因型(n5d5,n9d9)为细毛羊1条同源染色体中的asip基因在序列1第22285-22289位缺失5bp,且序列1第22195-22203位缺失9p,另一条同源染色体中的asip基因不存在该5bp和9bp的缺失。
[0101]
上述5bp缺失的杂合基因型(n5d5)和9bp未缺失的纯合基因型(n9n9)为细毛羊1条同源染色体中的asip基因在序列1第22285-22289位缺失5bp,且另一条同源染色体中的asip基因不存在该5bp缺失,且细毛羊2条同源染色体中的asip基因在序列1第22195-22203位也不存在9bp缺失。
[0102]
hi-tom测序结果显示,f1代asip基因编辑羊的突变程度从1.27%到65.73%,平均编辑效率为30.34%(发生编辑的reads数占总reads数的比例)(图5)。
[0103]
二、回交
[0104]
部分f1代asip基因编辑羊夭折无法进一步作为f2代亲本。
[0105]
将4只上述基因型仅为4bp碱基缺失基因型f1代asip基因编辑存活至1.5周岁的母羊和5只基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的存活至1.5周岁的母羊同期发情,采集f0代asip基因编辑公羊精液进行人工授精,获得f2代,共得到11只f2代群体,其中周身黑/棕色和白色相间的羊为8只,白色的羊为3只,周身黑/棕色和白色相间的羊为目的f2代羊或其群体。
[0106]
具体如下:
[0107]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为4bp碱基缺失基因型的1只毛色为周身黑/棕色和白色相间(黑/棕色占80%以上)的f1代asip基因编辑羊母羊配种,结果得到2只f2代个体,毛色表型均为周身毛色黑/棕色和白色相间(黑/棕色占80%以上),记作f2代目的个体。
[0108]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为4bp碱基缺失基因型的3只毛色为白色的f1代asip基因编辑羊母羊配种,结果得到3只f2代个体,其中1只周身毛色黑/棕色和白色相间(黑/棕色占80%以上)记作f2代目的个体;另外2只为白色。
[0109]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的1只周身毛色黑白相间(黑色占80%以上)f1代asip基因编辑羊母羊配种,结果得到1只f2代个体,毛色表型为周身毛色黑/棕色和白色相间(黑/棕色占80%以上),记作f2代目的个体。
[0110]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的4只毛色为白色的f1代asip基因编辑羊母羊配种,结果得到5只f2代目的个体,其中4只毛色表型均周身毛色黑/棕色和白色相间(黑/棕色占80%以上)记作f2代目的个体,另1只为白色,。
[0111]
对照实验:将f1代个体不具有4bp碱基缺失基因型和27bp碱基缺失伴随1bp碱基插入基因型但是发生第22328-22348位缺失21bp,且在第22338-22339位插入2bp碱基aa的1只母羊与1只f0代asip基因编辑公羊配种,产生1只f2代个体中,其周身白色,表明,该f1代基因缺失和插入基因型不能够产生目的f2代非白色毛色羊。
[0112]
从上述可以看出,f2代个体的毛色不受f1代毛色(即自然突变)影响,仅与基因型相关。
[0113]
上述基因型检测是按照实施例1的方法对上述f2代目的个体进行基因型检测,采用sanger测序和hi-tom高通量测序。
[0114]
hi-tom测序结果显示,f2代asip基因编辑羊不同基因型的编辑效率从1.61%到98.67%,平均编辑效率高达62.04%(图5)。
[0115]
经毛色基因型测定和毛色表型、体型外貌、生产性能等方面选择,组成黑棕色中国美利奴细毛羊(新疆型)育种核心群,开展世代选育。基因编辑后代的遗传分析说明,f1代、f2代asip基因编辑细毛羊的基因型和毛色表型能够稳定遗传f0代亲本的编辑类型,后代毛色变异的多样性也体现了毛色显隐性遗传的特点。
[0116]
综上所述,可以看出,通过选取具有27bp碱基缺失伴随1bp碱基插入基因型f1代个体或具有4bp碱基缺失基因型f1代个体与f0代个体回交后培育非白色毛色的f2代个体或群体,从而培育更多非白色毛色的细毛羊。
[0117]
具体方法如下:
[0118]
1)以f0代asip基因编辑公羊与中国美利奴细毛羊(新疆型)母羊配种,生产f1代羊;
[0119]
2)从所述f1代羊中选取具有如下2种基因型中任一种的f1代asip基因编辑羊的母羊与f0代asip基因编辑公羊回交,得到的f2代羊,其中黑/棕色和白色相间(黑/棕色占80%以上)的为目的羊;
[0120]
具有如下2种基因型的f1代asip基因编辑羊的母羊为如下任一种:
[0121]
1)基因型为27bp碱基缺失伴随1bp插入;
[0122]
2)基因型为4bp碱基缺失;
[0123]
所述4bp碱基缺失基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因均在序列1第22338-22341位缺失4bp碱基;
[0124]
27bp碱基缺失伴随1bp碱基插入基因型为中国美利奴细毛羊(新疆型)两条同源染色体中的asip基因均在序列1第22322-22348位缺失27bp碱基,且在序列1第22339-22340位插入1bp碱基t,其中缺失27bp碱基跨越3个内含子。
[0125]
上述选取具有如下2种基因型的f1代asip基因编辑羊的母羊采用基因型鉴定方法为提取待测羊尾部基因组dna,用sanger测序引物asip-s和asip-as进行pcr扩增,测序获得基因型;或者用hi-tom高通量测序引物asip-f(hi-tom)和asip-r(hi-tom)进行pcr扩增,测序获得基因型。
[0126]
实施例3、黑棕色中国美利奴细毛羊(新疆型)育种方法
[0127]
一、杂交配种
[0128]
1、f0代asip基因编辑公羊和野生细毛母羊的选择
[0129]
与实施例1相同;
[0130]
2、同期发情和人工授精
[0131]
3、自然交配
[0132]
4、基因型鉴定
[0133]
上述2和3步骤共获得30只f1代个体。
[0134]
按照实施例1的方法,基因型鉴定,
[0135]
30只f1代个体中23只f1代个体均遗传到其亲本f0代asip基因编辑公羊的2种编辑基因型任一种,命名为f1代asip基因编辑羊,
[0136]
选取具有2种编辑基因型任一种的f1代asip基因编辑羊母羊作为回交亲本:
[0137]
1)基因型为27bp碱基缺失伴随1bp;
[0138]
2)基因型为4bp碱基缺失。
[0139]
二、回交
[0140]
将6只上述基因型仅为4bp碱基缺失基因型f1代asip基因编辑存活至1.5周岁的母羊和6只基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的存活至1.5周岁的母羊同期发情,采集f0代asip基因编辑公羊精液进行人工授精,获得f2代,共得到15只f2代群体,其中周身黑/棕色和白色相间的羊为12只,白色的羊为3只,周身黑/棕色和白色相间的羊为目的f2代羊或其群体。
[0141]
具体如下:
[0142]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为4bp碱基缺失基因型的2只毛色为周身黑/棕色和白色相间(黑/棕色占80%以上)的f1代asip基因编辑羊母羊配种,结果得到4只f2代个体,毛色表型均为周身毛色黑/棕色和白色相间(黑/棕色占80%以上),记作f2代目的个体。
[0143]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为4bp碱基缺失基因型的4只毛色为白色的f1代asip基因编辑羊母羊配种,结果得到4只f2代个体,其中2只毛色表型为黑/棕色和白色相间(黑/棕色占80%以上)的记作f2代目的个体,另外2只为白色。
[0144]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的1只毛色为黑色和白色相间(黑色占80%以上)的f1代asip基因编辑羊母羊配种,结果得到1只f2代个体,毛色表型为黑/棕色和白色相间(黑/棕色占80%以上)记作f2代目的个体。
[0145]
将1只f0代asip基因编辑公羊分别与生长状况良好、体重大于40公斤且基因型仅为27bp碱基缺失伴随1bp碱基插入基因型的5只毛色为白色的f1代asip基因编辑羊母羊配种,结果得到6只f2代个体,其中5只毛色表型为黑棕色的记作f2代目的个体,另1只为白色。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1