海藻酸钠和阿魏酸在提高产油微生物的EPA产量中的应用和微生物油脂的制备方法
海藻酸钠和阿魏酸在提高产油微生物的epa产量中的应用和微生物油脂的制备方法
技术领域
1.本发明涉及发酵领域,具体涉及一种海藻酸钠和阿魏酸在提高产油微生物的epa产量中的应用和微生物油脂的制备方法。
背景技术:
2.二十二碳五烯酸(epa)是一种重要的ω-3长链多不饱和脂肪酸,epa能使人体血液中的血浆甘油三酯、总胆固醇、极低密度脂蛋白和低密度脂蛋白降低,增加高密度脂蛋白的含量,从而改善血液循环,降低血液黏度,增进胆固醇的排泄,降低血液中胆固醇的含量。epa还能通过控制花生四烯酸代谢途径的脱氢酶和环氧化酶,抑制血小板凝集,降低血栓和动脉硬化形成的几率,被称为“血管清道夫”。epa目前主要以保健品形式是市场售卖,但绝大部分epa都是深海鱼油来源,但是我国海洋资源有限。微生物生产epa近年来成为了研究热点,微生物来源的epa具有生产安全,不受季节限定等优点,被认为是未来最有潜力的epa生产来源。
3.近些年来,微生物依然是商业化大规模生产多不饱和脂肪酸的最具潜力的资源,epa已在包含微藻、细菌和真菌等各种微生物中被发现。通过微生物发酵进行商业化生产epa一直是研究的热点。
4.海洋微藻被认为是epa的极好的天然来源,但是由于大多数藻类生长速度缓慢,总生物量和油脂含量相对较低,因此目前为止从藻类中商业生产epa的成本较高,用藻类大规模生产epa被认为仍有一定难度;大多数的海洋细菌,如希瓦氏菌(shewanella)、弧菌(vibrio)、发光杆菌(photobacterium)等都能够生产epa,但是目前真正利用细菌生产epa的报道较少,而且产量较低;现有报道的真菌epa产量相比微藻和细菌更高,此外,以裂殖壶菌为代表的海洋产油真菌,由于油脂含量高、易培养、生物量高等特性,已被用于dha的商业化生产,也是优秀的潜在epa生产者。
5.目前主要通过发酵优化手段和代谢工程手段来调控微生物产epa,专利cn108707630通过发酵优化手段首次将氟咤酮应用到脂肪酸合成途径的调控中,为提高裂殖壶菌中epa含量提供了新的思路。通过添加氟咤酮,显著提高了裂殖壶菌油脂中epa的含量,相比于未添加提高了42.31%。为使用氟咤酮提高裂殖壶菌内epa含量提供了基础;专利cn113005154通过发酵优化手段采用变温及低溶氧的培养方式能在工厂中有效实施,最大限度提高了底物利用效率,并且提高产物中的二十碳五烯酸的含量;杨瑞雄等人利用代谢工程同源重组技术将shewanella sp.scrc2738的烯酰还原酶基因(enoyl-reductase,sh-er)分别敲入schizochytrium limacinum sr21的orfb-er和orfc-er基因中,调控多不饱和脂肪酸合成的偏好性以提高epa的产量。
技术实现要素:
6.本发明的目的是为了克服现有技术存在的产油微生物产epa成本高、生物量低、
epa含量低问题,提供一种海藻酸钠和阿魏酸在提高产油微生物的epa产量中的应用和微生物油脂的制备方法,能够有效提高产油微生物生产的微生物油脂中的epa含量。
7.为了实现上述目的,本发明一方面提供一种海藻酸钠和阿魏酸在提高产油微生物的epa产量中的应用。
8.优选地,所述海藻酸钠和所述阿魏酸的质量比为1000:1.5-2.5。
9.本发明第二方面提供一种提高产油微生物的epa产量的方法,该方法包括:将产油微生物接入含有海藻酸钠的培养基中进行发酵,并在发酵过程中加入阿魏酸。
10.优选地,相对于1l的所述培养基,所述海藻酸钠的添加量为20-50g,所述阿魏酸的添加量为50-80mg。
11.进一步优选地,所述海藻酸钠和所述阿魏酸的质量比为1000:1.5-2.5。
12.优选地,所述阿魏酸的加入时间为发酵开始后的12-72h。
13.进一步优选地,所述阿魏酸的加入时间为发酵开始后的48-72h。
14.优选地,所述发酵包括:将所述产油微生物接种至第一培养基中进行种子培养后得到种子液,将所述种子液以体积比8-12%接种至第二培养基中进行发酵培养,其中,所述海藻酸钠添加在第一培养基中和/或第二培养基中,所述阿魏酸在所述种子培养的阶段加入和/或在所述发酵培养的阶段加入。
15.优选地,所述海藻酸钠添加在第一培养基中和第二培养基中。
16.优选地,所述阿魏酸在所述种子培养的阶段加入和在所述发酵培养的阶段加入。
17.优选地,所述第一培养基含有:20-30g/l海藻酸钠、1-5g/l kh2po4、10-14g/l na2so4、2-5g/l mgso4、1-3g/l kcl、2-5g/l(nh4)2so4、0.06-1g/l cacl2、0.1-1g/l k2so4、8-12g/l味精和9-15g/l酵母粉。
18.优选地,所述第二培养基含有:30-50g/l海藻酸钠、1-5g/l kh2po4、10-14g/l na2so4、2-5g/l mgso4、1-3g/l kcl、2-5g/l(nh4)2so4、0.06-1g/l cacl2、0.1-1g/l k2so4、1-5g/l苹果酸、8-12g/l味精、9-15g/l酵母膏、3-7g/l玉米浆干粉和0.5-1g/l重金属离子溶液,其中,所述重金属离子溶液含有zn
2+
和cu
2+
,所述zn
2+
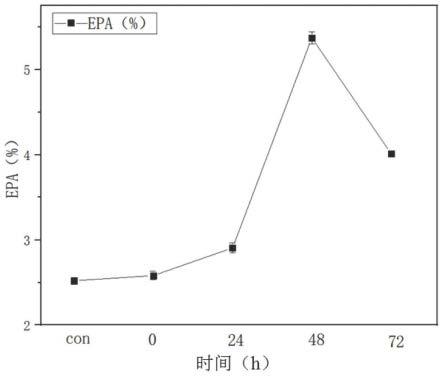
和所述cu
2+
的质量比为1:0.5-1。
19.进一步优选地,所述种子培养和所述发酵培养的条件包括:初始ph为4.5-5.5,转速为150-200rpm,温度为25-35℃。
20.优选地,所述产油微生物选自裂殖壶菌、硅藻、微拟球藻和高山被孢霉中的至少一种,优选为裂殖壶菌。
21.本发明第三方面提供一种微生物油脂的制备方法,该方法包括:将产油微生物采用上述第二方面所述的方法进行发酵得发酵液,将所述发酵液进行破壁、提取。
22.优选地,采用破壁酶酶解方法进行所述破壁。
23.进一步优选地,所述破壁的条件包括:所述破壁酶的用量为2-4g/l,ph为10-12,转速为150-200rpm,温度为25-35℃,时间为3-6h。
24.优选地,所述提取溶剂为正己烷和/或乙醇。
25.通过上述技术方案,本发明的有益效果为:
26.本发明首次将海藻酸钠和阿魏酸应用于提高产油微生物的epa产量,为提高产油微生物的epa产量提供了新思路,且海藻酸钠和阿魏酸能够有效提高产油微生物生产的油脂中的epa含量。
27.本发明提供的方法采用还有海藻酸钠的培养基进行微生物发酵,并在发酵过程中加入阿魏酸,能够进一步提高产油微生物生产的油脂中的epa占总脂肪酸的质量比,相比于未添加提高了602%。
附图说明
28.图1为测试例1中不同发酵培养时间添加阿魏酸得到的发酵液中脂质含量和生物量条形图;
29.图2为测试例1中不同发酵培养时间添加阿魏酸得到的微生物油脂中epa含量折线图;
30.图3为不同碳源对裂殖壶菌epa占总脂肪酸占比的影响。
具体实施方式
31.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
32.本发明一方面提供一种海藻酸钠和阿魏酸在提高产油微生物的epa产量中的应用。
33.根据本发明,海藻酸钠和阿魏酸可以在发酵前添加进培养基中,也可以在发酵过程中添加进培养基中。可以同时将海藻酸钠和阿魏酸添加进培养基中,也可以将海藻酸钠和阿魏酸分别添加进培养基中。
34.本发明的发明人在研究过程中发现,海藻酸钠和阿魏酸的添加能够有效提高产油微生物生产的油脂中的epa含量。而且,阿魏酸能够促进产油微生物对营养物质的吸收,提高培养基中营养的利用率。
35.为了能够进一步提高产油微生物生产的油脂中的epa含量,优选地,所述海藻酸钠和所述阿魏酸的质量比为1000:1.5-2.5。
36.本发明第二方面提供一种提高产油微生物的epa产量的方法,该方法包括:将产油微生物接入含有海藻酸钠的培养基中进行发酵,并在发酵过程中加入阿魏酸。
37.具体地,阿魏酸可以在发酵开始后加入培养基中。
38.本发明的发明人在研究过程中发现,先将海藻酸钠加入到培养基中,然后在发酵过程中再添加阿魏酸能够进一步提高产油微生物生产的油脂中的epa含量。且能够促进产油微生物对培养基中营养物质的吸收,提高营养物质的利用率。
39.优选地,相对于1l的所述培养基,所述海藻酸钠的添加量为20-50g,所述阿魏酸的添加量为50-80mg。在培养基中添加上述含量的海藻酸钠和阿魏酸能够进一步提高产油微生物生产的油脂中的epa含量。从更进一步提高产油微生物生产的油脂中的epa含量来考虑,优选地,所述海藻酸钠和所述阿魏酸的质量比为1000:1.5-2.5,具体可以为1000:1.5、1000:2、1000:2.5或上述任意两个数值所构成的范围中的任意值。
40.优选地,所述阿魏酸的加入时间为发酵开始后的12-72h。在上述情况下加入阿魏酸能够进一步提高产油微生物生产的油脂中的epa含量。从更进一步提高产油微生物生产
的油脂中的epa含量来考虑,优选地,所述阿魏酸的加入时间为发酵开始后的48-72h。
41.为了能够进一步提高产油微生物生产的油脂中的epa含量,优选地,所述发酵包括:将所述产油微生物接种至第一培养基中进行种子培养后得到种子液,将所述种子液以体积比8-12%接种至第二培养基中进行发酵培养,其中,所述海藻酸钠添加在第一培养基中和/或第二培养基中,所述阿魏酸在所述种子培养的阶段加入和/或在所述发酵培养的阶段加入。从更进一步提高产油微生物生产的油脂中的epa含量来考虑,优选地,所述海藻酸钠添加在第一培养基中和第二培养基中。更优选地,所述阿魏酸在所述种子培养的阶段加入和在所述发酵培养的阶段加入。
42.所述第一培养基和所述第二培养基的氮源、金属离子、盐、微量元素等可以是任意能够用于生物发酵的氮源、金属离子、盐、微量元素等。为了能够进一步提高产油微生物生产的油脂中的epa含量,优选地,所述第一培养基含有:20-30g/l海藻酸钠、1-5g/l kh2po4、10-14g/l na2so4、2-5g/l mgso4、1-3g/l kcl、2-5g/l(nh4)2so4、0.06-1g/l cacl2、0.1-1g/l k2so4、8-12g/l味精和9-15g/l酵母粉。所述第二培养基含有:30-50g/l海藻酸钠、1-5g/l kh2po4、10-14g/l na2so4、2-5g/l mgso4、1-3g/l kcl、2-5g/l(nh4)2so4、0.06-1g/l cacl2、0.1-1g/l k2so4、1-5g/l苹果酸、8-12g/l味精、9-15g/l酵母膏、3-7g/l玉米浆干粉和0.5-1g/l重金属离子溶液,其中,所述重金属离子溶液含有zn
2+
和cu
2+
,所述zn
2+
和所述cu
2+
的质量比为1:0.5-1,具体可以为1:0.5、1:0.6、1:0.7、1:0.8、1:0.9、1:1或上述任意两个数值所构成的范围中的任意值。具体地,提供zn
2+
的锌源可以为任意一种锌盐,如硫酸锌、氯化锌、硝酸锌等,提供cu
2+
的铜源可以为任意一种铜盐,如硫酸铜、氯化铜、硝酸铜等。其中,第一培养基的接种量一般为0.5-2体积%,若以甘油管保藏的微生物菌种进行接种,则每个甘油管内的菌种接种至100ml的第一培养基中。从更进一步提高产油微生物生产的油脂中的epa含量来考虑,优选地,所述提供zn
2+
的锌源为硫酸锌,所述提供cu
2+
的铜源为硫酸铜。
43.优选地,所述种子培养和所述发酵培养的条件包括:初始ph为4.5-5.5,转速为150-200rpm,温度为25-35℃。研究发现在上述条件进行种子培养和发酵培养能够进一步提高产油微生物生产的油脂中的epa含量。
44.所述产油微生物可以是任意一种能够通过发酵产生微生物油脂的微生物,优选地,所述产油微生物选自裂殖壶菌、硅藻、微拟球藻和高山被孢霉中的至少一种。从更进一步提高产油微生物生产的油脂中的epa含量来考虑,优选为裂殖壶菌。
45.本发明第三方面提供一种微生物油脂的制备方法,该方法包括:将产油微生物采用上述第二方面所述的方法进行发酵得发酵液,将所述发酵液进行破壁、提取。
46.本发明人的发明人在研究过程中发现才有上述方法制备得到的微生物油脂中epa的含量较高。
47.根据本发明,微生物的细胞破壁可以采用本领域常规的方式,优选地,采用破壁酶酶解方法进行所述破壁,以能够提高破壁效率,减小对微生物细胞中代谢产物的破坏。
48.根据本发明,优选地,所述破壁的条件包括:所述破壁酶的用量为2-4g/l,具体可以为2g/l、3g/l、4g/l,或上述任意两个数值所构成的范围中的任意值;ph为10-12,具体可以为10、11、12,或上述任意两个数值所构成的范围中的任意值;转速为150-200rpm,具体可以为150rpm、160rpm、170rpm、180rpm、190rpm、200rpm,或上述任意两个数值所构成的范围中的任意值;温度为25-35℃,具体可以为25℃、30℃、35℃,或上述任意两个数值所构成的
范围中的任意值;时间为3-6h,具体可以为3h、4h、5h、6h,或上述任意两个数值所构成的范围中的任意值。
49.根据本发明,为了提高对微生物油脂的提取效率,优选地,所述提取溶剂为正己烷和/或乙醇,优选为正己烷和乙醇,以利用乙醇破碎微生物细胞的同时,利用正己烷萃取油脂。所提取的油脂中含有油酸、棕榈酸、亚油酸、二十碳五烯酸、二十二碳六烯酸等多不饱和脂肪酸。
50.根据本发明一种特别优选的实施方式,提供一种微生物油脂的制备方法,该方法包括:将所述产油微生物接种至第一培养基中在初始ph为4.5-5.5、转速为150-200rpm、温度为25-35℃的条件下进行种子培养后得到种子液,将所述种子液以体积比8-12%接种至第二培养基中在初始ph为4.5-5.5、转速为150-200rpm、温度为25-35℃的条件下进行发酵培养,将破壁酶以2-4g/l的添加量加入发酵液中,在ph为10-12、转速为150-200rpm、温度为25-35℃的条件下酶解3-6h得到破壁液,将破壁液与乙醇、正己烷以体积比1:1:1进行混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂。
51.其中,所述海藻酸钠添加在第一培养基中和第二培养基中,所述阿魏酸在所述种子培养的阶段加入和在所述发酵培养的阶段加入;
52.所述第一培养基含有:20-30g/l海藻酸钠、1-5g/l kh2po4、10-14g/l na2so4、2-5g/l mgso4、1-3g/l kcl、2-5g/l(nh4)2so4、0.06-1g/l cacl2、0.1-1g/l k2so4、8-12g/l味精和9-15g/l酵母粉。所述第二培养基含有:30-50g/l海藻酸钠、1-5g/l kh2po4、10-14g/l na2so4、2-5g/l mgso4、1-3g/l kcl、2-5g/l(nh4)2so4、0.06-1g/l cacl2、0.1-1g/l k2so4、1-5g/l苹果酸、8-12g/l味精、9-15g/l酵母膏、3-7g/l玉米浆干粉和0.5-1g/l重金属离子溶液;其中,所述重金属离子溶液含有zn
2+
和cu
2+
,所述zn
2+
和所述cu
2+
的质量比为1:0.5-1;所述产油微生物选自裂殖壶菌、硅藻、微拟球藻和高山被孢霉中的至少一种。
53.上述优选实施例提供的方法制备得到的微生物油脂中epa的含量更高。
54.以下将通过实施例对本发明进行详细描述。以下实施例和对比例中,裂殖壶菌为schizochytrium sp.hx-308,由本实验室自主从沿海区域分离筛选获得,现保藏在中国典型培养物保藏中心(简称cctcc),保藏号为cctcc m 209059。
55.海藻酸钠可以商购得到,也可以制备得到,在本发明的实施例中,海藻酸钠为本实验室自己制备得到,其制备方法包括:
56.(1)将海藻或海草碾碎后,水洗3次,加入ph为9的氢氧化钠溶液萃取,澄清后取上层清液为粗海藻酸盐溶液;
57.(2)在粗海藻酸盐溶液中加入氯化钙使其含量为15-20%(w/v),待反应完成后取上层泡沫,加入盐酸酸化控制其ph为6-7.5,水洗离心,得到海藻酸钙固体;
58.(3)将海藻酸钙固体溶于水,加入碳酸钠,过滤,对滤液进行浓缩,得到海藻酸钠浓缩液,干燥粉碎后得到海藻酸钠。
59.阿魏酸购买于阿拉丁公司,产品编号为537-73-5,其他原料和试剂均为商购获得。
60.生物量的测量方法为:取1ml的发酵液于已称重的离心管中,离心去上清,于烘箱干燥至恒重。
61.脂质含量的测量方法为:将得到的微生物油脂置于烘箱中65℃干燥至恒重,称重。
62.微生物油脂中的epa含量的测试方法为:
63.取0.5g油脂,用正己烷定容至10ml;然后移取1ml至容器中,加入3ml 0.5mol/l的koh-甲醇溶液,于65℃水浴15-20min,冷却;再加入2ml bf3-乙醚-甲醇溶液(bf3-乙醚:甲醇=3:7,v/v),水浴65℃5-10min,冷却;再加饱和nacl溶液、正己烷各2ml,振荡后静置、分层,取上层至另一个容器中,取1ml正己烷相上气相进行脂肪酸分析。
64.气相分析条件:色谱柱:db-23(60m*0.25mm*0.25μm);检测器:fid;载气:氮气;分流比:30/1;进样口温度:250℃;检测器温度:280℃;进样量:1μl;升温程序:初始柱温为100℃,先以25℃/min的速度升至196℃,再以2℃/min的速度升至220℃,保持12min。柱流速:3.0ml/min;尾吹流速:30ml/min;氢气流速:40ml/min;空气流速:400ml/min。
65.气相色谱仪购于日本岛津,仪器型号为spd-m20a。
66.实施例1
67.(1)第一培养基的配方为:海藻酸钠25g/l、kh2po
4 3g/l、na2so
4 12g/l、mgso
4 3g/l、kcl 2g/l、(nh4)2so
4 3g/l、cacl
2 0.5g/l、k2so
4 0.5g/l、味精10g/l、酵母粉12g/l,121℃高温灭菌20min后备用;第二培养基的配方为:海藻酸钠40g/l、kh2po
4 3g/l、na2so
4 12g/l、mgso
4 3g/l、kcl 2g/l、(nh4)2so
4 3g/l、cacl
2 0.5g/l、k2so
4 0.5g/l、苹果酸3g/l、味精10g/l、酵母膏12g/l、玉米浆干粉5g/l、金属离子溶液0.8g/l(znso4中锌离子和cuso4中铜离子的质量比为1:0.725),121℃高温灭菌20min后备用;
68.(2)将裂殖壶菌菌种按照1体积%接种量接种至第一培养基中,在初始ph为5、转速为180rpm、温度为30℃的条件下培养24h后得到一代种子液,再将一代种子液按照1体积%接种量接种至第一培养基中,然后加入阿魏酸使其含量为60mg/l,在初始ph为5、转速为180rpm、温度为30℃的条件下培养24h后得到二代种子液,将二代种子液按照10体积%接种量接种至第二培养基中,在初始ph为5、转速为180rpm、温度为30℃的条件下培养,培养48h后加入阿魏酸使其含量为60mg/l,再培养72h,得到发酵液;
69.(3)将破壁酶以3g/l的添加量加入发酵液中,在ph为11、转速为180rpm、温度为30℃的条件下酶解4h得到破壁液,将破壁液与乙醇、正己烷以体积比1:1:1进行混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂;
70.对微生物油脂进行测量得到epa含量如表1所示。
71.实施例2
72.(1)第一培养基的配方为:海藻酸钠20g/l、kh2po
4 5g/l、na2so
4 14g/l、mgso
4 5g/l、kcl 3g/l、(nh4)2so
4 5g/l、cacl
2 1g/l、k2so
4 1g/l、味精12g/l、酵母粉15g/l,121℃高温灭菌20min后备用;第二培养基的配方为:海藻酸钠30g/l、kh2po
4 5g/l、na2so
4 14g/l、mgso
4 5g/l、kcl 3g/l、(nh4)2so
4 5g/l、cacl
2 1g/l、k2so
4 1g/l、苹果酸5g/l、味精12g/l、酵母粉15g/l、玉米浆干粉7g/l、金属离子溶液1g/l(znso4中锌离子和cuso4中铜离子的质量比为1:0.5),121℃高温灭菌20min后备用;
73.(2)将裂殖壶菌菌种按照1体积%接种量接种至第一培养基中,在初始ph为4.5、转速为200rpm、温度为25℃的条件下培养24h后得到一代种子液,再将一代种子液按照1体积%接种量接种至第一培养基中,然后加入阿魏酸使其含量为50mg/l,在初始ph为4.5、转速为200rpm、温度为25℃的条件下培养24h后得到二代种子液,将二代种子液按照12体积%接种量接种至第二培养基中,在初始ph为4.5、转速为200rpm、温度为25℃的条件下培养,培养72h后加入阿魏酸使其含量为50mg/l,再培养48h,得到发酵液;
74.(3)将破壁酶以2g/l的添加量加入发酵液中,在ph为12、转速为200rpm、温度为35℃的条件下酶解3h得到破壁液,将破壁液与乙醇、正己烷以体积比1:1:1进行混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂;
75.对微生物油脂进行测量得到epa含量如表1所示。
76.实施例3
77.(1)第一培养基的配方为:海藻酸钠30g/l、kh2po
4 1g/l、na2so
4 10g/l、mgso
4 2g/l、kcl 1g/l、(nh4)2so
4 2g/l、cacl
2 0.06g/l、k2so
4 0.1g/l、味精8g/l、酵母粉9g/l,121℃高温灭菌20min后备用;第二培养基的配方为:海藻酸钠50g/l、kh2po
4 1g/l、na2so
4 10g/l、mgso
4 2g/l、kcl 1g/l、(nh4)2so
4 2g/l、cacl
2 0.06g/l、k2so
4 0.1g/l、苹果酸1g/l、味精8g/l、酵母粉9g/l、玉米浆干粉3g/l、金属离子溶液0.5g/l(znso4中锌离子和cuso4中铜离子的质量比为1:1),121℃高温灭菌20min后备用;
78.(2)将裂殖壶菌菌种按照1体积%接种量接种至第一培养基中,在初始ph为5.5、转速为150rpm、温度为35℃的条件下培养24h后得到一代种子液,再将一代种子液按照1体积%接种量接种至第一培养基中,然后加入阿魏酸使其含量为80mg/l,在初始ph为5.5、转速为150rpm、温度为35℃的条件下培养24h后得到二代种子液,将二代种子液按照8体积%接种量接种至第二培养基中,在初始ph为5.5、转速为150rpm、温度为35℃的条件下培养,培养72h后加入阿魏酸使其含量为80mg/l,再培养108h,得到发酵液;
79.(3)将破壁酶以4g/l的添加量加入发酵液中,在ph为10、转速为160rpm、温度为25℃的条件下酶解6h得到破壁液,将破壁液与乙醇、正己烷以体积比1:1:1进行混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂;
80.对微生物油脂进行测量得到epa含量如表1所示。
81.实施例4
82.按照实施例2的方法制备微生物油脂,不同的是,步骤(2)中,种子培养过程中以及发酵培养过程中,加入阿魏酸使其含量为80mg/l。
83.对微生物油脂进行测量得到epa含量如表1所示。
84.实施例5
85.按照实施例3的方法制备微生物油脂,不同的是,步骤(2)中,种子培养过程中以及发酵培养过程中,加入阿魏酸使其含量为50mg/l。
86.对微生物油脂进行测量得到epa含量如表1所示。
87.实施例6
88.按照实施例3的方法制备微生物油脂,不同的是,步骤(2)替换为:
89.将裂殖壶菌菌种按照1体积%接种量接种至第一培养基中,在初始ph为5.5、转速为150rpm、温度为35℃的条件下培养12h后得到一代种子液,再将一代种子液按照1体积%接种量接种至第一培养基中,然后加入阿魏酸使其含量为80mg/l,在初始ph为5.5、转速为150rpm、温度为35℃的条件下培养24h后得到二代种子液,将二代种子液按照8体积%接种量接种至第二培养基中,在初始ph为5.5、转速为150rpm、温度为35℃的条件下培养,培养12h后加入阿魏酸使其含量为80mg/l,再培养108h,得到发酵液。
90.对微生物油脂进行测量得到epa含量如表1所示。
91.实施例7
92.按照实施例2的方法制备微生物油脂,不同的是,步骤(2)中,种子培养中不加入阿魏酸。
93.对微生物油脂进行测量得到epa含量如表1所示。
94.实施例8
95.按照实施例3的方法制备微生物油脂,不同的是,步骤(2)中,发酵培养中不加入阿魏酸。
96.对微生物油脂进行测量得到epa含量如表1所示。
97.实施例9
98.(1)第一培养基的配方为:海藻酸钠20g/l、阿魏酸80mg/l、kh2po
4 5g/l、na2so
4 14g/l、mgso
4 5g/l、kcl 3g/l、(nh4)2so
4 5g/l、cacl
2 1g/l、k2so
4 1g/l、味精12g/l、酵母粉15g/l,121℃高温灭菌20min后备用;第二培养基的配方为:海藻酸钠30g/l、阿魏酸80g/l、kh2po
4 5g/l、na2so
4 14g/l、mgso
4 5g/l、kcl 3g/l、(nh4)2so
4 5g/l、cacl
2 1g/l、k2so
4 1g/l、苹果酸5g/l、味精12g/l、酵母粉15g/l、玉米浆干粉7g/l、金属离子溶液1g/l(znso4中锌离子和cuso4中铜离子的质量比为1:0.5),121℃高温灭菌20min后备用;
99.(2)将裂殖壶菌菌种按照1体积%接种量接种至第一培养基中,在初始ph为4.5、转速为200rpm、温度为25℃的条件下培养,培养48h得到种子液,将种子液按照12体积%接种量接种至第二培养基中,在初始ph为4.5、转速为200rpm、温度为25℃的条件下培养,培养120h,得到发酵液;
100.(3)将破壁酶以2g/l的添加量加入发酵液中,在ph为12、转速为200rpm、温度为35℃的条件下酶解3h得到破壁液,将破壁液与乙醇、正己烷以体积比1:1:1进行混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂。
101.对微生物油脂进行测量得到epa含量如表1所示。
102.对比例1
103.按照实施例6的方法制备微生物油脂,不同的是,步骤(1)中,采用葡萄糖替换海藻酸钠。
104.对微生物油脂进行测量得到epa含量如表1所示。
105.对比例2
106.按照实施例6的方法制备微生物油脂,不同的是,步骤(2)中,种子培养和发酵培养中均不加入阿魏酸。
107.对微生物油脂进行测量得到epa含量如表1所示。
108.对比例3
109.按照实施例6的方法制备微生物油脂,不同的是,步骤(1)中,采用葡萄糖替换海藻酸钠;
110.步骤(2)中,种子培养和发酵培养中均不加入阿魏酸。
111.对微生物油脂进行测量得到epa含量如表1所示。
112.表1
[0113][0114][0115]
通过表1的结果可以看出,采用本发明实施例中epa含量相比于对比例得到了显著的提高,说明本发明中的海藻酸钠和阿魏酸能够显著提高产油微生物发酵中epa的产量。而且,实施例1-9的生物量和油脂高于对比例2,说明阿魏酸的添加能够促进产油微生物对培养基中营养物质的吸收,提高培养基中营养物质的利用率。
[0116]
测试例1
[0117]
(1)第一培养基的配方为:海藻酸钠25g/l、kh2po
4 3g/l、na2so
4 12g/l、mgso
4 3g/l、kcl 2g/l、(nh4)2so
4 3g/l、cacl
2 0.5g/l、k2so
4 0.5g/l、味精10g/l、酵母粉12g/l,121℃高温灭菌20min后备用;第二培养基的配方为:海藻酸钠40g/l、kh2po
4 3g/l、na2so
4 12g/l、mgso
4 3g/l、kcl 2g/l、(nh4)2so
4 3g/l、cacl
2 0.5g/l、k2so
4 0.5g/l、苹果酸3g/l、味精10g/l、酵母膏12g/l、玉米浆干粉5g/l、金属离子溶液0.8g/l(znso4中锌离子和cuso4中铜离子的质量比为1:0.725),121℃高温灭菌20min后备用;
[0118]
(2)将裂殖壶菌菌种按照1体积%接种量接种至第一培养基中,在初始ph为5、转速为180rpm、温度为30℃的条件下培养24h后得到一代种子液,再将一代种子液按照1体积%接种量接种至第一培养基中,在初始ph为5、转速为180rpm、温度为30℃的条件下培养24h后得到二代种子液,将二代种子液按照10体积%接种量接种至第二培养基中,在初始ph为5、转速为180rpm、温度为30℃的条件下培养,培养ah后加入阿魏酸使其含量为60mg/l,再培养bh,得到发酵液;
[0119]
其中,a为0、24、48、72,a+b=120;
[0120]
(3)将破壁酶以3g/l的添加量加入到发酵液中,在ph为11、转速为180rpm、温度为30℃的条件下酶解4h得到破壁液,将破壁液与乙醇、正己烷以体积比1:1:1进行混合提取得
到正己烷相,将正己烷相经旋蒸去除正己烷得到微生物油脂;
[0121]
其脂质含量和生物质含量如图1所示,对微生物油脂进行测量得到epa含量如图2所示,其中,con为发酵过程中不添加阿魏酸。
[0122]
由图2可以看出,在发酵培养48h后添加阿魏酸能够大幅度提高油脂中epa的含量。
[0123]
测试例2
[0124]
按照实施例6和对比例1的方法,不同的是:步骤(3)为:
[0125]
将破壁酶以4g/l的添加量加入到发酵培养24h、48h、72h、96h和120h的发酵液中,在ph为10、转速为160rpm、温度为25℃的条件下酶解6h得到破壁液,将破壁液与乙醇、正己烷以体积比1:1:1进行混合提取得到正己烷相,将正己烷相经旋蒸去除正己烷得到不同发酵时间的微生物油脂;
[0126]
对微生物油脂进行测量得到epa含量如图3所示。
[0127]
图3为不同碳源对裂殖壶菌发酵120h产epa占总脂肪酸占比的影响,可以看出,当将葡萄糖碳源替换为海藻酸钠碳源时,epa占总脂肪酸百分比从0.89%提高到2.521%,提高了283%。说明海藻酸钠和阿魏酸两者协同能够有效提高油脂中epa的含量。
[0128]
在图3中,以葡萄糖为碳源发酵120h时epa占总脂肪酸的质量比为0.89%,在图2中,以海藻酸钠为碳源并且在发酵48h加入阿魏酸,并再发酵72h后测得epa占总脂肪酸比为5.36%,相比于葡萄糖为碳源且不加阿魏酸提高了602%。
[0129]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1