一种一体化核酸提取与数字化检测芯片及其制备方法和应用
1.本发明涉及微流控芯片及核酸提取与检测技术领域,尤其涉及一种一体化核酸提取与数字化检测芯片及其制备方法和应用。
背景技术:
2.核酸检测在生物医学研究、疾病诊断等许多领域都具有重要价值。在众多方法中,聚合酶链式反应(polymerase chain reaction,pcr)是应用最广泛的核酸检测技术之一。目前,pcr技术已经从第二代定量pcr(quantitative pcr,qpcr)迅速发展到了如今的第三代数字pcr(digital pcr,dpcr)。这种数字化核酸检测方法的基本原理是:首先将待测样品分配到大量均一且相互独立的反应小室中,使每个反应小室仅包含0或1个目标核酸分子,经pcr扩增后,只有包含目标核酸分子的反应小室发荧光,因此对这些荧光小室进行计数,即可得到目标核酸分子的浓度。与传统的qpcr相比,dpcr具有许多独特的优势,包括单分子核酸扩增,无需标准曲线即可绝对定量目标分子拷贝数,具有超高的灵敏度和准确性,更适用于复杂样本分析等。这些优势决定了dpcr在生物医学研究、临床诊断等许多方面都具有非常好的应用前景。
3.特别是随着微流控芯片技术的发展,使得样品可以被分配到更小体积、更多数量的反应小室内,因此dpcr技术也得到了进一步发展和应用。目前,根据样本分配策略,dpcr技术主要可以分为两类,一类是腔室型dpcr(chamber-based dpcr,cdpcr),另一类是微滴型dpcr(droplet-based dpcr,ddpcr)。其中,cdpcr主要是在微流控芯片上将待测样品分配到相互物理隔离的微腔或微井等结构中,而ddpcr则是利用微流控芯片生成大量粒径均匀的油包水微滴作为反应小室。这两种类型的dpcr技术均有其各自的优势,因而在近年来都获得了十分迅速的发展。此外,除了dpcr,近年来还出现了多种基于恒温方法【如环介导等温扩增(loop-mediated isothermal amplification,lamp)、重组酶聚合酶扩增(recombinase polymerase amplification,rpa)、交叉引物扩增(crossing priming amplification,cpa)、滚环扩增(rolling circle amplification,rca)、链置换扩增(strand displacement amplification,sda)、以及基于crispr的核酸检测方法等】的数字化检测技术,它们不但具有类似于dpcr的灵敏度和准确性,而且在即时检验(point-of-care test,poct)方面具有更好的应用前景。
4.尽管数字化核酸检测技术已历经多年发展,但检测之前必不可少的核酸提取环节却仍主要在芯片外进行,不但集成化、自动化程度低,操作过程复杂,而且需要不断地开盖、转移样品,极易造成气溶胶污染,导致核酸检测结果不准确。目前国内外已经报道了一些基于微流控芯片的一体化核酸提取与检测技术。根据流体的操控形式,可以分为流道微流控(channel-based microfluidics,cmf)与数字微流控(digital microfluidics,dmf)两种类型。其中,基于cmf的核酸提取主要是利用负压辅助、外接管路、非混相过滤等方式,虽然实现了与数字化检测的简单集成,但目前仍存在着流体精准操控困难、自动化程度低等问题。与之相比,dmf是利用介电润湿效应,通过控制施加在芯片电极阵列上的电压来驱动离
散液滴,具有液滴操控简单、精准、自动化程度高等优势。然而,当前的dmf芯片也存在诸多问题,例如,芯片封装工艺粗糙、密封性差,容易发生泄漏和交叉污染;芯片难以与外界接口结合,不能实现连续的进、出样流体控制;芯片的通道结构设计有限,即,难以在电极阵列上方制作具有不同功能的通道或微结构,从而实现更加复杂、精确的流体操控。近年来,cmf与dmf的集成逐渐引起了研究人员的高度关注,这将有望实现二者的优势互补。然而,目前的集成方案更多是在解决二者的接口问题,而非真正意义上的一体化集成。此外,由于难以引入接地上极板,目前报道的集成流道数字微流控芯片仍缺少液滴生成和分裂功能,芯片表面的疏水修饰过程也很复杂、稳定性较差。上述这些问题导致了目前在dmf芯片上仅能实现核酸提取与qpcr检测的集成,尚无很好的方法将dmf核酸提取与数字化核酸检测集成于一体。
技术实现要素:
5.针对上述问题,本发明公开了一种一体化核酸提取与数字化检测芯片。该芯片集成了数字微流控核酸提取与数字化核酸检测,可以实现全程闭盖的、一体化、自动化核酸提取与高灵敏检测;此外,该芯片可实现液滴生成、分裂、移动、融合全部基本功能,这将使得核酸提取与数字化检测所涉及的流体操控过程更加灵活。
6.具体技术方案如下:
7.一种一体化核酸提取与数字化检测芯片,包括数字微流控核酸提取区和数字化核酸检测区;
8.所述数字微流控核酸提取区,包括进样口、图案化电极阵列、核酸提取腔室、以及核酸溶液出样通道;
9.所述进样口与外界管路连接,用于载入核酸提取试剂和待测样本;
10.所述图案化电极阵列位于核酸提取腔室下方,由多个电极组成,并与外部控制电路连接,用于精准操控液滴,进行核酸提取操作;
11.所述数字化核酸检测区,包括样本分配通道、核酸扩增区、以及选择性增加的出样口;
12.所述样本分配通道与所述核酸溶液出样通道相连通,用于将在数字微流控核酸提取区提取的核酸溶液运输至核酸扩增区;
13.所述核酸扩增区包含反应小室阵列,所述反应小室阵列由大量均一且相互独立的反应小室构成;所述核酸溶液被均匀分配至所述反应小室阵列,进行核酸扩增反应与数字化检测。
14.本发明公开的一体化核酸提取与数字化检测芯片,通过将通道结构与图案化电极阵列有机地集成在一起,形成了封闭式、一体化的集成流道数字微流控芯片,既可以精准操控离散液滴,又可以对连续流体进行控制;该芯片集成了数字微流控核酸提取与数字化核酸检测,可以实现全程闭盖的、一体化、自动化核酸提取与高灵敏检测;此外,芯片制作过程简单,可以很方便地在通道结构层与支撑层之间嵌入导电层,以形成双极板数字微流控结构,从而实现液滴生成、分裂、移动、融合全部基本功能,这将使得核酸提取与数字化检测所涉及的流体操控过程更加灵活。
15.本发明中,所述数字微流控核酸提取区与所述数字化核酸检测区由带有通道结构
的通道结构层与介质层封接后得到。
16.将所述通道结构的高度设为h,则h选自20~500μm;
17.经试验发现,当h选自20~500μm时,液滴驱动性能较好。若h过小,由接触角变化引起的液滴形变减小,导致液滴驱动变得困难;若h过大,一方面液滴受重力作用影响明显,另一方面如果大于液滴直径,则液滴难以与上下表面同时接触,造成液滴驱动困难。
18.所述通道结构层的材质选自聚二甲基硅氧烷和/或光固化材料;
19.本发明中:
20.所述光固化材料包括含有光固化官能团的单体和/或含有光固化官能团的低聚物,所述光固化官能团选自丙烯酸酯官能团、甲基丙烯酸酯官能团、巯基官能团、烯基官能团、乙烯基醚官能团、环氧基官能团中的一种或多种。
21.所述光固化材料中还包括光引发剂,选自苯偶酰类化合物、烷基苯酮类化合物、酰基磷氧化物中的一种或多种。
22.所述通道结构层的上方设有支撑层,所述通道结构层与所述支撑层共同构成流道层。
23.所述支撑层的材质选自聚二甲基硅氧烷、弹性支撑体或者光固化官能团修饰的玻璃。
24.优选的:
25.当通道结构层的材料为聚二甲基硅氧烷时,支撑层材料选自聚二甲基硅氧烷,二者通过热固化相连或等离子体处理后封接;
26.当通道结构层的材料为光固化材料时,支撑层材料选自弹性支撑体或者光固化官能团修饰的玻璃,二者通过紫外光照相连;
27.所述弹性支撑体的制备工艺可以参考申请人之前的专利申请(一种基于弹性支撑体的光固化微流控芯片及其制备方法和应用,申请号202110161473.x)。
28.所述通道结构层具有疏水性表面,当制备通道结构层采用的材质为非疏水性材料时,可通过疏水修饰试剂对通道结构层进行表面处理,使其表面具有疏水性;或者,直接采用具有疏水性的材料制备通道结构层。
29.本发明中,所述疏水修饰试剂选自特氟龙、含氟硅烷偶联剂、疏水性光修饰试剂中的一种或多种;
30.所述疏水性光修饰试剂选自1h,1h,2h,2h-全氟癸基丙烯酸酯、2-(全氟辛基)乙基甲基丙烯酸酯、1h,1h,2h,2h-全氟癸硫醇、烯丙基1h,1h-全氟辛基醚中的一种或多种。
31.优选的:
32.为构建双极板数字微流控芯片结构,使得液滴驱动更加容易,而且将具有液滴生成、分裂、移动、融合全部基本功能,可以在通道结构层与支撑层间加设导电层。所述导电层可与外部电极连接,此时,流道层由通道结构层、导电层与支撑层共同组成。
33.所述导电层选自表面涂覆导电材料的薄膜,或者由导电材料加工形成的薄层;
34.所述导电材料选自导电氧化物(如ito等)、导电金属(如cr、ag等)、导电聚合物(如pedot等)、石墨烯中的一种或多种。
35.优选的,所述导电层具有良好的透明性,以便于观察及光学检测。
36.具体的,所述导电层可以嵌入流道层的全部区域,或者仅嵌入流道层的核酸提取
腔室区域,即图案化电极阵列的上方。
37.当所述导电层位于所述图案化电极阵列的上方且涉及数字微流控液滴操控时:
38.所述通道结构层的厚度设为h,0<(h-h)≤50μm;
39.所述导电层中导电材料的厚度为50~300nm,所形成导电面的方阻为5~500欧。
40.经试验发现,要想获得良好的驱动能力,一方面导电层与通道内的液滴之间还需要存在合适厚度(h-h)的通道结构层材料,优选为0<(h-h)≤50μm,若(h-h)过大,液滴与导电层之间由通道结构层材料所造成的阻抗就越大,从而导致液滴的驱动性能变差,甚至失去液滴分裂功能。另一方面导电层中导电材料具有合适的厚度与方阻,厚度优选为50~300nm,所形成导电面的方阻优选为5~500欧;经试验发现,导电材料厚度越小,导电面的方阻越大,导致液滴的运动效果越差。
41.进一步优选:
42.(h-h)=20μm,厚度为100~200nm,方阻为5~150欧。
43.由于本发明中采用的芯片设计与加工方面的灵活性和简便性,所述进样口数量可以设置成一个(顺序引入各种试剂)或多个(分别引入各种试剂);所述进样口也可以用于引入油相试剂,用以充满芯片的腔室区域或者驱动流体流动。
44.本发明中,所述图案化电极阵列沉积于基底上,形成含有图案化电极阵列的基底;
45.所述图案化电极阵列的材质选自导电氧化物(如ito等)、导电金属(如cu、cr、ag等)、导电聚合物(如pedot等)、石墨烯中的一种或多种;
46.所述基底选自玻璃、印刷电路板、硅片、塑料板、橡胶板中的一种或多种。
47.所述含有图案化电极阵列的基底表面覆盖有所述介质层。
48.优选的:
49.所述介质层为疏水性的介质层材料薄层,或者为利用光固化介质层材料制备的复合疏水介质层;
50.进一步优选:
51.所述介质层材料的相对介电常数选自3~10;
52.所述光固化介质层材料的相对介电常数选自3~10;
53.所述介质层的厚度选自1~50μm。
54.经试验发现,当介质层的介电常数和厚度在该限定的参数范围内,可以保证芯片具有良好的液滴驱动性能。
55.所述疏水性的介质层材料薄层,可直接采用具有疏水性的介质层材料制备得到,若采用的材料没有疏水性,也可以先制备介质层材料薄层,再通过疏水修饰试剂对介质层材料薄层进行表面处理。
56.所述介质层材料选自光刻胶、派瑞林(聚对二甲苯)、及光固化介质层材料中的一种或多种。
57.所述光固化介质层材料为具有高介电常数的光固化材料,选自四(3-巯基丙酸)季戊四醇酯、三[2-(3-巯基丙酸基)乙基]异氰尿酸酯、三羟甲基丙烷三(3-巯基丙酸酯)、四(2-巯基乙酸)季戊四醇酯、1,3,5-三烯丙基-1,3,5-三嗪-2,4,6(1h,3h,5h)-三酮、三羟甲基丙烷二烯丙基醚中的一种或多种;
[0058]
所述复合疏水介质层按如下方法之一加工:
[0059]
a)将光固化介质层材料形成薄层,并在光辐照作用下固化,之后在该薄层上叠加固化疏水性光固化材料薄层,形成复合疏水介质层;
[0060]
b)将光固化介质层材料与疏水性光固化材料混合均匀后形成薄层,在光辐照作用下,该薄层固化形成复合疏水介质层。
[0061]
所述疏水性光固化材料选自1h,1h,2h,2h-全氟癸基丙烯酸酯、2-(全氟辛基)乙基甲基丙烯酸酯、1h,1h,2h,2h-全氟癸硫醇、烯丙基1h,1h-全氟辛基醚、聚硅氧烷丙烯酸酯低聚物、全氟聚醚丙烯酸酯低聚物、聚硅氧烷甲基丙烯酸酯低聚物、全氟聚醚甲基丙烯酸酯低聚物、巯基聚硅氧烷低聚物、巯基全氟聚醚低聚物、烯基聚硅氧烷低聚物、烯基全氟聚醚低聚物、环氧基聚硅氧烷低聚物、环氧基全氟聚醚低聚物中的一种或多种。
[0062]
当采用方法a)加工复合疏水介质层时,优选的,所述叠加固化疏水性光固化材料薄层的厚度小于5μm。
[0063]
本发明中,所述核酸扩增区包含的反应小室阵列选自微滴型阵列或者腔室型阵列;
[0064]
所述微滴型阵列由大量油包水微滴组成,此时所述样本分配通道选自t型微滴生成通道、流动聚焦型微滴生成通道、阶梯乳化式微滴生成通道或离心式微滴生成通道;
[0065]
所述腔室型阵列选自微井结构阵列或微腔结构阵列。
[0066]
用于将在数字微流控核酸提取区提取的核酸溶液运输至核酸扩增区的所述样本分配通道,其侧面还可以选择性增加反应试剂通道和/或油相通道,用以引入扩增反应所需试剂、生成油包水微滴或者封闭微井/微腔结构所需的油相试剂。
[0067]
本发明中还公开了所述一体化核酸提取与数字化检测芯片的制备方法,包括:加工流道层、加工含有图案化电极阵列的基底、加工介质层、芯片封接。
[0068]
当流道层仅包含支撑层和通道结构层,且支撑层和通道结构层的材质均选自聚二甲基硅氧烷时,加工流道层包括:
[0069]
将聚二甲基硅氧烷液体材料置于模具之上,加热固化成通道结构层,再通过热封接或等离子体处理封接与聚二甲基硅氧烷支撑层连接,一起构成流道层。
[0070]
当流道层仅包含支撑层和通道结构层,且通道结构层的材质选自光固化材料、支撑层的材质选自弹性支撑体时,所述流道层按如下方法之一加工:
[0071]
a)将光固化材料置于模具之上,加盖弹性支撑体,然后在光辐照下使光固化材料固化成通道结构层,并与弹性支撑体连接,一起构成流道层;
[0072]
b)将光固化材料覆盖于模具之上,在光辐照作用下固化成通道结构层,再与弹性支撑体连接,一起构成流道层。
[0073]
该情况下,所述通道结构层的疏水表面可通过疏水光修饰试剂进行表面处理后得到,或者直接利用疏水性光固化材料加工得到;前者的疏水性官能团通过共价连接,后者的通道结构层本身含有疏水性官能团,因此二者的疏水性能均非常稳固持久;由于后者可以省去繁琐的表面疏水修饰步骤,因此可以作为进一步优选。
[0074]
当流道层包含通道结构层、导电层与支撑层时,流道层按如下方法之一加工:
[0075]
a)将聚二甲基硅氧烷或光固化材料置于模具之上,通过旋涂或者刮涂方法形成薄膜后加盖导电层与支撑层,或者直接将导电层与支撑层加盖于上述液态材料之上使之形成薄膜,再固化聚二甲基硅氧烷或光固化材料形成通道结构层,一起构成流道层;
[0076]
b)将聚二甲基硅氧烷或光固化材料置于模具之上,通过旋涂或者刮涂方法形成薄膜,固化后形成通道结构层,然后连接导电层和支撑层,一起构成流道层。
[0077]
本发明中,含有图案化电极阵列的基底可选用本领域常见的方式加工,如掩模光刻、湿法刻蚀、激光刻蚀、电子印刷、喷墨打印、3d打印等。
[0078]
所述介质层加工,直接将制备介质层的材料涂覆含有图案化电极阵列的基底的上表面,再通过加热或光固化的方式使介质层与电极图案层紧密吸附。
[0079]
所述芯片封接,可通过等离子处理、紫外光照射以及热压等方式实现。
[0080]
优选的:
[0081]
当通道结构层材料为聚二甲基硅氧烷时,介质层材料选自光刻胶,二者通过等离子处理实现封接,之后通入疏水修饰试剂特氟龙或者含氟硅烷偶联剂进行表面处理,使得通道结构层和介质层具有疏水效果。
[0082]
当通道结构层材料为光固化材料时,介质层材料选自光固化介质层材料,二者在紫外光照下实现封接,之后通入疏水修饰试剂特氟龙进行表面处理,或者通入疏水性光修饰试剂并在紫外光照下进行更加稳固的疏水修饰,使得通道结构层和介质层具有疏水效果;
[0083]
进一步优选:
[0084]
所述通道结构层材料选自疏水性光固化材料,介质层为复合疏水介质层,二者在紫外光照下实现封接,由于通道表面本身具有疏水特性,因此无需疏水处理即可获得持久稳固的疏水表面。
[0085]
本发明还公开了所述的一体化核酸提取与数字化检测芯片在核酸提取与检测、细菌与细胞分析领域中的应用。
[0086]
用于核酸提取与检测时,具体包括:
[0087]
1)先将油相经进样口通入芯片的通道结构中,排出空气后,再将核酸提取所需试剂经一个或多个进样口分多次或一次载入核酸提取腔室内;
[0088]
2)在核酸提取腔室内进行核酸提取操作,包括但不限于样本裂解、核酸吸附、清洗漂洗、核酸洗脱等步骤;
[0089]
3)将提取后的核酸溶液经核酸溶液出样通道、样本分配通道后进入核酸扩增区内的反应小室阵列,并均匀分配进独立的反应小室,设置温控程序,在核酸扩增区进行核酸扩增反应;
[0090]
4)采集反应小室阵列的荧光图像,统计反应小室个数,进行数字化核酸检测。
[0091]
所述样本裂解:将样本与裂解溶液混合进行裂解,释放核酸分子;
[0092]
所述核酸吸附:将核酸分子吸附在磁珠、微柱等硅载体上;
[0093]
所述清洗漂洗:纯化核酸,除去蛋白质、多糖、脂类等干扰杂质;
[0094]
所述核酸洗脱:将核酸从硅载体上洗脱下来,并与核酸检测反应液混合配置成核酸溶液。
[0095]
所述核酸提取可以采用磁珠法、有机溶剂法、热裂解法。
[0096]
优选的,当选用磁珠法进行核酸提取时,所述核酸提取区的下方或上方放置有磁铁,用于在核酸提取操作过程中吸附、释放磁珠;
[0097]
进一步优选,为配合磁珠法进行核酸提取,所述一体化核酸提取与数字化检测芯
片的核酸提取腔室内还包括用于引入和储存磁珠及裂解后的样本溶液的样本储液区,用于储存缓冲液的缓冲液储液区,用于储存漂洗液的漂洗液储液区,用于储存洗脱缓冲液的洗脱液储液区,核酸提取所涉及的液滴分裂、混合、运输等过程的核酸提取工作区,用于将含有核酸的液滴推入后续通道的核酸溶液出样区,以及用于收集和储存各步骤产生的废液的废液区。
[0098]
以上各功能区的实现是通过控制各区所对应的特殊结构图案化电极阵列,使得通道结构中通入的核酸提取所需试剂按照各区功能,在上述特殊结构图案化电极阵列上进行工作。
[0099]
所述核酸扩增反应选自聚合酶链式反应,或者各种恒温方法中的一种或多种,包括但不限于环介导等温扩增、重组酶聚合酶扩增、交叉引物扩增、滚环扩增、链置换扩增、以及基于crispr的核酸检测方法。
[0100]
与现有技术相比,本发明具有如下有益效果:
[0101]
本发明公开了一种一体化核酸提取与数字化检测芯片,该芯片集成了数字微流控的图案化电极阵列与流道式微流控的通道结构,形成了上下游无缝衔接的数字微流控核酸提取区与数字化核酸检测区;基于数字微流控的核酸提取,具有液滴操控简单、精准、自动化程度高等优势,可以简便灵活地对各种样品进行核酸提取与纯化;基于流道式微流控的通道结构设计可以方便地将样本分配于微滴型或腔室型的反应小室阵列,从而实现数字化核酸检测,因而具有更高的灵敏度和准确性;通过将数字微流控核酸提取与数字化核酸检测集成于一块芯片上,可以实现全程闭盖的、一体化、自动化核酸提取与高灵敏检测,有效解决了当前数字化核酸检测技术中核酸提取环节分离,集成化、自动化程度低,操作过程复杂,气溶胶污染严重等问题,有望在生物医学研究与临床诊断等领域获得广泛应用。
[0102]
本发明公开的一体化核酸提取与数字化检测芯片是一种新型集成流道数字微流控芯片,既可以精准操控离散液滴,又可以对连续流体进行控制;该芯片中带有通道结构的流道层与介质层紧密地封接,形成了全封闭式结构,可以有效避免液体泄漏以及实验过程中的交叉污染风险;除了本发明公开的用于一体化核酸提取与数字化检测的芯片设计外,还可以将其他各种通道结构与图案化电极阵列有机地集成在一起,从而实现更加灵活、精准的微流体控制,是一种真正意义上的一体化集成芯片,在数字微流控、液滴微流控、生物化学反应、生物医学研究等领域中都将具有广泛的应用前景。该一体化核酸提取与数字化检测芯片不仅可以选用常规的聚二甲基硅氧烷材料,还可以采用光固化材料制备,此时优选弹性支撑体作为支撑层,并优选疏水性光固化材料作为通道结构层,使得芯片的加工过程简单快速,且无需疏水处理;针对介质层,更优选为复合疏水介质层,同时具有合适的介电常数与稳定的疏水特性,而且与通道结构层适配,在紫外光照下即可快速、紧密地封接,从而形成封闭式、一体化的核酸提取与数字化检测芯片。
[0103]
本发明还公开了一体化核酸提取与数字化检测芯片的制备方法,不但过程简单,而且可以很方便地在通道结构层与支撑层之间嵌入导电层,以形成双极板数字微流控结构,从而实现液滴生成、分裂、移动、融合全部基本功能,这将使得核酸提取与数字化检测所涉及的流体操控过程更加灵活。
附图说明
[0104]
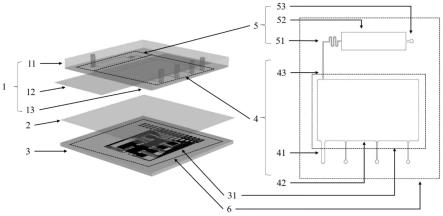
图1为本发明的一种一体化核酸提取与数字化检测芯片的结构示意图,图中:
[0105]
1-流道层,11-支撑层,12-导电层,13-通道结构层,2-介质层,3-含有图案化电极阵列的基底,31-图案化电极阵列,4-数字微流控核酸提取区,41-进样口,42-核酸提取腔室,43-核酸溶液出样通道,5-数字化核酸检测区,51-样本分配通道,52-核酸扩增区,53-出样口,6-芯片外轮廓;
[0106]
图2为实施例1中用于加工含有图案化电极阵列的基底的掩膜图,图中:
[0107]
7-外接电极,8-连接导线,9-图案化电极阵列;
[0108]
图3为实施例1中用于加工通道结构层模具的掩膜图,图中:
[0109]
4-数字微流控核酸提取区,41-进样口,42-核酸提取腔室,43-核酸溶液出样通道,5-数字化核酸检测区,51-样本分配通道,52-核酸扩增区,53-出样口,54-油相通道;
[0110]
图4为实施例1制备的一体化核酸提取与数字化检测芯片实物图;
[0111]
图5为实施例1中数字微流控核酸提取区的图案化电极阵列平面示意图,图中:
[0112]
421-样本储液区,422-缓冲液储液区,423-漂洗液储液区,424-洗脱液储液区,425-核酸提取工作区,426-磁珠,427-圆形电磁铁,428-核酸溶液出样区,429-废液区;
[0113]
图6为应用例1中在实施例1制备的一体化核酸提取与数字化检测芯片内的磁珠法核酸提取过程图;
[0114]
图7为应用例1中在实施例1制备的一体化核酸提取与数字化检测芯片内微滴生成的显微镜照片;(a)在t型微滴生成结构处生成的油包水微滴,(b)大量均一且相同独立的微滴收集于核酸扩增区内;
[0115]
图8为应用例1中利用实施例1制备的一体化核酸提取与数字化检测芯片对沙门氏菌进行一体化核酸提取与ddpcr检测的典型荧光显微图像;图a~d分别对应于不同的沙门氏菌进样量(5、1、0.5和0μl)。
具体实施方式
[0116]
为了进一步理解本发明,下面结合附图及实施例对本发明进行具体描述,但本发明并不限于这些实施例,该领域技术人员在本发明核心指导思想下做出的非本质改进和调整,仍然属于本发明的保护范围。
[0117]
图1为本发明公开的一体化核酸提取与数字化检测芯片的结构示意图,由流道层1、介质层2与含有图案化电极阵列的基底3组成,其中,介质层2覆盖于含有图案化电极阵列的基底3上方,流道层1又位于介质层2的上方,并与介质层2封接。
[0118]
流道层1由上至下依次为支撑层11、导电层12与通道结构层13,通道结构层13与介质层2封接形成的通道结构中包含数字微流控核酸提取区4与数字化核酸检测区5;数字微流控核酸提取区4包括四个进样口41、核酸提取腔室42、以及核酸溶液出样通道43;进样口41与外界管路连接,用于载入核酸提取试剂和待测样本;含有图案化电极阵列的基底3上的图案化电极阵列位于核酸提取腔室42下方,其由多个电极组成,并与外部控制电路连接,用于精准操控液滴进行核酸提取操作;数字化核酸检测区5包括样本分配通道51、核酸扩增区52以及出样口53;样本分配通道51与核酸溶液出样通道43相连通,用于将在数字微流控核酸提取区提取的核酸溶液运输至核酸扩增区52。
[0119]
图2为实施例1中用于加工含有图案化电极阵列的基底的掩膜图,图中:
[0120]
7为外接电极,用于与硬件控制电路的转接弹针连接,8为连接导线,用于连接外接电极与图案化电极阵列,9为图案化电极阵列,用于驱动液滴;
[0121]
图3为实施例1中用于加工通道结构层模具的掩膜图,图中:
[0122]
4为数字微流控核酸提取区,41为进样口,用于载入核酸提取试剂和待测样本,42为核酸提取腔室,位于图案化电极阵列上方,43为核酸溶液出样通道,5为数字化核酸检测区,51为样本分配通道,52为核酸扩增区,53为出样口,还在样本分配通道51的侧面增加了油相通道54。
[0123]
在实施例1的芯片设计中,采用了多个进样口设计,用以分别引入不同的试剂;反应小室阵列选用了微滴型阵列,采用t型微滴生成通道制备,因而在样本分配通道侧面增加了油相通道,用以引入生成油包水微滴所需的油相试剂;模具加工采用双层结构,用以获得不同深度的通道,对应的掩膜分别为图3a和图3b。
[0124]
图4为实施例1制备的一体化核酸提取与数字化检测芯片实物图,从图中可知,图案化电极阵列与通道结构层中数字微流控核酸提取区的位置重叠。通过将图案化电极阵列设计成特殊的结构,在其驱动下,可以在通道结构中对应位置实现不同的功能,从而实现核酸提取。
[0125]
图5为实施例1中数字微流控核酸提取区的图案化电极阵列平面示意图,图中:
[0126]
421为样本储液区,用于引入和储存磁珠及裂解后的样本溶液;422为缓冲液储液区,用于储存缓冲液;423为漂洗液储液区,用于储存漂洗液;424为洗脱液储液区,用于储存洗脱缓冲液;425为核酸提取工作区,核酸提取所涉及的液滴分裂、混合、运输等过程均在此区域进行;426为磁珠,用于吸附核酸(磁珠是放置在通道结构中,此图中仅为说明磁珠在核酸提取腔室42中存在的位置);427为圆形电磁铁,用于固定或释放磁珠(电磁铁具体放置在芯片的最下方,此图中也仅为说明其在核酸提取腔室42中存在的位置);428为核酸溶液出样区,用于将含有核酸的液滴推入后续通道;429为废液区,用于收集和储存各步骤产生的废液。
[0127]
图1中通道结构层13中四个进样口41,从右至左分别用于通入样本溶液、缓冲液、漂洗液与洗脱缓冲液;样本溶液通入后储存在核酸提取腔室42中的样本储液区,该区域与图案化电极阵列中的样本储液区421的位置相重叠;缓冲液通入后储存在核酸提取腔室42中的缓冲液储液区,该区域与图案化电极阵列中的缓冲液储液区422的位置相重叠;漂洗液通入后储存在核酸提取腔室42中的漂洗液储液区,该区域与图案化电极阵列中的漂洗液储液区423的位置相重叠,洗脱缓冲液通入后储存在核酸提取腔室42中的洗脱液储液区,该区域与图案化电极阵列中的洗脱液储液区424的位置相重叠;通道结构层13中的核酸溶液出样通道43与图案化电极阵列中的核酸溶液出样区428的位置重叠;在通道结构层13中与图案化电极阵列中的废液区429的位置相重叠的位置,还设有用于收集和储存各步骤产生的废液的废液区以及废液出口。
[0128]
实施例1通道结构层材料为光固化材料的一体化核酸提取与数字化检测芯片的制备
[0129]
a)通道结构层模具加工:在洁净干燥的硅片上旋涂光胶(microchem,su-8 3050),厚度约为100μm,之后进行前烘;将第一层掩膜(图3a)紧贴光胶,曝光13s,后烘;之后再次旋
涂光胶(microchem,su-8 3050),厚度约为100μm,前烘;将第二层掩膜(图3b)放置在单面光刻机上,利用对准系统将第一层光胶图案与第二层掩膜对齐,曝光13s,后烘;最后显影,硬烘;模具使用前用三甲基氯硅烷(阿拉丁,c104813)浸泡处理,便于后续芯片的翻模。
[0130]
b)支撑层加工:按质量分数计算,配制含有59.4%的聚氨酯丙烯酸酯(长兴材料公司,6115j-80)、39.6%的甲基丙烯酸烯丙酯(西格玛,234931)和1%的光引发剂2-羟基-2-甲基-1-苯基-1-丙酮(西格玛,405655)的溶液;之后将该溶液置于两块洁净玻璃板之间,在紫外光照下(365nm,2.5mw/cm2)固化成厚度约为50μm的光固化薄层;移除上层玻璃板后,将30g质量比为5:1的聚二甲基硅氧烷预聚物和固化剂(迈图,rtv615)倾倒在光固化薄层之上;加热固化后与光固化薄层紧密连接,整体从玻璃板上揭下,形成弹性支撑体,按需切割成指定大小,作为支撑层备用。
[0131]
c)流道层加工:按质量分数计算,配制含有99%的全氟聚醚丙烯酸酯(fluorolink公司,md 700)和1%的光引发剂2-羟基-2-甲基-1-苯基-1-丙酮(西格玛,405655)的疏水性光固化材料溶液,并滴加于步骤a)加工的模具之上;然后在步骤b)制备的支撑层的光固化薄层一侧贴上与电极图案区尺寸相同的ito导电薄膜(洛阳古洛玻璃有限公司),作为导电层(ito导电材料厚度为200nm,导电面的方阻为7欧);之后加盖于疏水性光固化材料溶液之上,轻轻按压,使该液态材料形成厚度约为220μm的薄膜;在紫外光照(365nm,2.5mw/cm2)下,疏水性光固化材料溶液固化,形成通道结构层(h为220μm,h为200μm),并与支撑层、导电层一起构成流道层,整体从模具上翻下来,最后用打孔器在进、出样口的位置打通孔。
[0132]
d)含有图案化电极阵列的基底加工:在洁净干燥的铬片(长沙韶光铬版有限公司,铬层厚180nm)上旋涂正性光刻胶(苏州中芯启恒芯片科技有限公司,az5214e),80℃烘烤2min;利用掩膜2曝光后,80℃烘烤4min;无掩膜泛曝后,显影,除铬,去胶;最后在热板上125℃烘烤,除去有机溶剂。
[0133]
e)复合疏水介质层加工:按质量分数计算,配制含有74%的四(3-巯基丙酸)季戊四醇酯(阿拉丁,p160529)、25%的1,3,5-三烯丙基-1,3,5-三嗪-2,4,6(1h,3h,5h)-三酮(阿拉丁,t123406)和1%的光引发剂2-羟基-2-甲基-1-苯基-1-丙酮(西格玛,405655)的硫醇烯混合物溶液;配制含有99.5%的全氟聚醚丙烯酸酯(fluorolink公司,md 700)和0.5%的光引发剂2-羟基-2-甲基-1-苯基-1-丙酮(西格玛,405655)的疏水性光固化试剂;之后在步骤d)加工的含有图案化电极阵列的基底上旋涂硫醇烯混合物溶液,并在紫外光照(365nm,2.5mw/cm2,200s)下固化,形成厚度约为5μm的薄层;再在该薄层上旋涂疏水性光固化试剂,施加紫外光照(365nm,2.5mw/cm2,400s),由于存在较强的氧抑制情况,因此只在紧贴硫醇烯薄层的表面该疏水性光固化试剂固化,形成厚度约为2μm的疏水性薄层,同时与硫醇烯薄层交联;最后用无水乙醇洗去未固化的光固化试剂,去离子水冲洗,氮气吹干,80℃烘烤15min,形成复合疏水介质层。
[0134]
f)芯片封接:将步骤c)流道层与步骤e)的介质层对齐紧贴,在氮气环境中施加紫外光照(365nm,2.5mw/cm2,100s)进行封接,形成一体化核酸提取与数字化检测芯片。
[0135]
实施例2通道结构层材料为聚二甲基硅氧烷的一体化核酸提取与数字化检测芯片的制备
[0136]
a)通道结构层模具加工:与实施例1中步骤a)完全相同。
[0137]
b)流道层加工:按质量比10:1配制聚二甲基硅氧烷预聚物和固化剂(迈图,
rtv615),混合均匀后除气泡,取10g置于步骤a)加工的模具之上,经过旋涂形成厚度约为220μm的薄层,加热固化,形成通道结构层(h为220μm,h为200μm);之后在该通道结构层上旋涂导电聚合物pss-pedot溶液(ossila,ph 1000),烘烤后,形成导电层(厚度为100nm,导电面的方阻为150欧);再倾倒30g聚二甲基硅氧烷在导电层上,加热固化作为支撑层,并与通道结构层、导电层一起构成流道层;整体从模具上翻下,并用打孔器在进、出样口的位置打通孔。
[0138]
c)含有图案化电极阵列的基底加工:基于印刷电路板(printed circuit board,pcb)的含有图案化电极阵列的基底在深圳捷多邦科技有限公司定制加工。
[0139]
d)介质层加工:在步骤c)加工的含有图案化电极阵列的基底上旋涂光刻胶(microchem,su-8 1040),厚度约为10μm;之后进行前烘,泛曝,后烘;最后在烘箱中坚膜,使介质层与含有图案化电极阵列的基底紧密吸附。
[0140]
e)芯片封接:将步骤b)的流道层和步骤d)的介质层进行等离子体处理后(500v,13.56mhz,45s),对齐封接,形成一体化核酸提取与数字化检测芯片。
[0141]
f)疏水修饰:按质量分数计算,将1%的含氟硅烷偶联剂1h,1h,2h,2h-全氟癸基三乙氧基硅烷(阿拉丁,p122385)溶于氟油(3m,fc-40)配置成疏水修饰溶液;在步骤e)的一体化核酸提取与数字化检测芯片内通入疏水修饰溶液,最后烘干溶剂,使得通道结构层和介质层具有疏水表面。
[0142]
实施例3
[0143]
本实施例的制备方法与实施例1基本相同,区别仅在于步骤c)中的疏水性光固化液态材料薄膜厚度约为250μm,固化形成通道结构层,其中h为250μm,对应的(h-h)为50μm。在该参数下,可以操控液滴进行移动、生成、分裂、融合,但与实施例1相比,液滴运动速度减慢,原因可能是液滴与导电层之间由通道结构层材料所造成的阻抗较大,从而导致液滴的驱动性能变差。
[0144]
实施例4
[0145]
本实施例的制备方法与实施例1基本相同,区别仅在于步骤c)中的疏水性光固化液态材料薄膜厚度约为280μm,固化形成通道结构层,其中h为280μm,对应的(h-h)为80μm。在该参数下,液滴运动速度缓慢,且难以实现液滴的分裂,原因可能是液滴与导电层之间由通道结构层材料所造成的阻抗过大,从而导致液滴的驱动性能变差,甚至失去液滴分裂功能。
[0146]
根据实施例1~4可以发现,集成流道数字微流控芯片的通道结构层中,(h-h)需要在合适的范围内才能满足良好的液滴驱动性能,且随着(h-h)的增加,液滴运动效果越差。
[0147]
实施例5
[0148]
本实施例的制备方法与实施例2基本相同,区别仅在于步骤b)中在通道结构层上所旋涂的导电聚合物pss-pedot溶液(ossila,ph1000),厚度约300nm,烘烤后形成中间导电层,测得方阻约为15欧。虽然在该参数下,由于导电材料较厚,透明性较差,但可以较好地进行液滴的移动、生成、分裂、融合,因此在对芯片的透明性要求不高、无需光学检测的应用场合下可以采用。
[0149]
实施例6
[0150]
本实施例的制备方法与实施例2基本相同,区别仅在于步骤b)中在通道结构层上
所旋涂的导电聚合物pss-pedot溶液(ossila,ph1000),厚度约50nm,烘烤后形成中间导电层,测得方阻约为500欧。在该参数下,可以实现液滴的移动、生成、分裂、融合,但液滴运动速度缓慢,原因可能在于导电材料厚度较小,所形成的薄层导电性较差,阻抗较大。
[0151]
根据实施例2、5、6可以发现,集成流道数字微流控芯片中导电层的导电材料厚度及其方阻需要在合适的范围内才能满足良好的液滴驱动性能,且随着导电材料厚度的增加,方阻越小,液滴运动效果越好。应用例1沙门氏菌核酸提取与ddpcr检测
[0152]
将实施例1制备的一体化核酸提取与数字化检测芯片安装在数字化微流液滴控制仪上,通过仪器配套的软件microfluid,可以控制电极的电压、频率以及时间,从而控制液滴移动;利用聚四氟乙烯管将注射泵上的注射器与芯片的进样口和出样口相连,通过注射泵控制芯片内连续流体的进样、出样以及微滴的制备;为了进行磁珠法核酸提取实验,将一块电磁铁置于芯片下方,由24v直流电压供电,用于固定磁珠。实验前,预先将氟油通入并充满芯片,排出空气。
[0153]
将沙门氏菌培养液加入到组织消化液和裂解液中混匀,作为样品溶液;配制pcr反应液,包括2μl的无核酸酶水,2.5μl的2
×
核酸扩增反应液,0.5μl的10
×
引物探针反应液;从图1中的四个进样口41,从右至左分别载入2.5μl磁珠溶液、10μl的缓冲液、10μl的漂洗液、5μl的pcr反应液(此处pcr反应液也被用作洗脱液,以简化操作同时便于后续的pcr反应);取5μl样品溶液注入芯片并与磁珠溶液混合,之后在数字微流控核酸提取区依次进行样本裂解、核酸吸附、缓冲液清洗、漂洗液漂洗、核酸洗脱的核酸提取过程。
[0154]
图6为一体化核酸提取与数字化检测芯片内的磁珠法核酸提取过程图,其中白色曲线代表通道结构内的液滴轮廓以及磁珠426位置,其具体步骤为:
[0155]
(a)预先向通道结构中分别对应缓冲液储液区422(为方便对功能区进行说明,以下制备工艺中提及的各区标记实际上是通道结构中与各区相重叠的位置区域)、漂洗液储液区423和洗脱液储液区424的区域载入对应溶液,之后向通道结构中对应样本储液区421的位置载入磁珠溶液和样品溶液,并混合均匀;
[0156]
(b)打开电磁铁427,固定磁珠426,按箭头方向将液滴运输至一边,保留固定的磁珠426;
[0157]
(c)从缓冲液储液区422中分离出部分缓冲液和磁珠426混合均匀,关闭电磁铁427,在电极上循环转动液滴,对磁珠426进行清洗;
[0158]
(d)清洗磁珠426后,打开电磁铁427,固定磁珠426,按箭头方向将废液移至废液池429;
[0159]
重复一次c、d步骤清洗磁珠426,保留固定的磁珠426;
[0160]
(e)从漂洗液储液区423中分离出部分漂洗液;
[0161]
(f)关闭电磁铁427,将漂洗液与磁珠426混合均匀,之后按箭头指示方向运输到电磁铁427的左端,在电极上循环转动液滴,对磁珠426进行漂洗;
[0162]
(g)漂洗磁珠426后,打开电磁铁427,固定磁珠426,按箭头方向将废液移至废液池429;
[0163]
重复一次f、g步骤漂洗磁珠426,保留固定的磁珠426;
[0164]
(h)从洗脱液储液区424中分裂出部分洗脱液与磁珠426混合均匀,关闭电磁铁427,在电极上循环转动液滴,洗脱磁珠426吸附的核酸;
[0165]
(i)洗脱核酸后,打开电磁铁427,固定磁珠426,将包含核酸的液滴按箭头方向运输到核酸溶液出样区428,即得到提取纯化后的核酸溶液。
[0166]
细菌裂解后,释放出的dna与磁珠吸附结合,在电磁铁的作用下,磁珠被固定在电磁铁右端,裂解液的液滴被移走弃掉(图6中a,b);之后,将缓冲液的液滴与磁珠进行混合以清洗磁珠(图6中c,d);再将漂洗液的液滴与磁珠混合,并包裹着磁珠,转移到电磁铁左端,多次混合清洗后,将磁珠上残留的蛋白质、多糖、脂类等干扰杂质洗掉(图6中e,f,g);最后,将洗脱液(即pcr反应液)的液滴与磁珠混合,将磁珠上吸附的dna洗脱下来,与磁珠分离后,得到的液滴即为含有沙门氏菌dna的溶液,将其运输到数字微流控核酸提取区的核酸溶液出样区(图6中h,i),以便后续微滴生成与ddpcr检测。
[0167]
核酸提取完成后,将含有核酸及pcr反应液的液滴运输到数字微流控核酸提取区4的核酸溶液出样通道43,从洗脱液储液区424对应的进样口41连续通入油相以推动液滴进入到数字化核酸检测区5的样本分配通道51,之后与油相溶液(含有1%表面活性剂pico-surf的hfe 7500,100μl/h)在t型微滴生成结构处生成油包水微滴;之后把芯片转移到热板上进行pcr反应,设置温控程序为:95℃保持5min:然后以95℃15s和60℃30s进行40次热循环,最后,冷却至10℃;pcr反应完成后,将芯片放置在倒置荧光显微镜上,采集核酸扩增区52内的反应小室内微滴阵列的荧光图像。
[0168]
图7为一体化核酸提取与数字化检测芯片内微滴生成的显微镜照片。在数字微流控核酸提取区4提取的核酸溶液可以经核酸溶液出样通道43直接进入到数字化核酸检测区5的样本分配通道51,并与从油相通道泵入的油相在t型微滴生成结构处稳定地生成油包水微滴(图7a),之后收集于核酸扩增区(图7b),进行ddpcr实验与荧光检测。
[0169]
图8为一体化核酸提取与数字化检测芯片内对沙门氏菌进行一体化核酸提取与ddpcr实验后的典型荧光图像。图中,a~d分别对应于不同的沙门氏菌进样量(5μl、1μl、0.5μl、0μl)。结果表明,随着进样体积的增加,提取得到的dna浓度将增高,因此ddpcr反应后的荧光微滴数量也随之增多。以上结果充分证明本发明的一体化核酸提取与数字化检测芯片用于核酸提取与检测的有效性。
[0170]
以上是本发明的优选案例,并不能因此而理解为对本发明的限制。对于本技术领域的技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1