与水稻籽粒暗胚乳性状相关的SSCP分子标记、基因及其应用
与水稻籽粒暗胚乳性状相关的sscp分子标记、基因及其应用
技术领域
1.本发明涉及分子生物学与遗传育种技术领域,尤其涉及与水稻籽粒暗胚乳性状相关的sscp分子标记、基因及其应用。
背景技术:
2.水稻杂交技术的应用已经实现水稻产量大幅度提高,但杂交稻品质却普遍偏低。
3.稻米的外观品质包括主要包括粒形、垩白和透明度等,食味品质主要包括直链淀粉含量、胶稠度和糊化温度。两者均与稻米胚乳淀粉含量及淀粉颗粒的理化特性相关。调节直链淀粉含量可以培育适口性更好的优质稻米,而提高蛋白质含量可以培育营养价值高的优质稻米。通过挖掘调控直链淀粉含量和蛋白质含量的基因,开发基于目标基因上的分子标记,可以结合分子标记辅助技术,提高水稻品质。这样既可以满足消费者需求,也具有重要的生产意义,适应人们的消费新需求。
4.因此,水稻暗胚乳相关的分子标记的开发可以快速、精确筛选水稻胚乳和稻米食味品质表型,用于指导分子辅助育种和优质稻米培育。
技术实现要素:
5.本发明的目的是提供了一种与水稻籽粒暗胚乳性状相关的sscp分子标记和基因,同时提供了该sscp分子标记用于筛选水稻籽粒,该sscp分子标记可应用于筛选水稻籽粒品质的种质资源,同时在水稻遗传育种领域可用于培育籽粒具有暗胚乳性状的水稻新品种。
6.具体技术方案如下:
7.本发明提供了一种与水稻籽粒暗胚乳性状相关的sscp分子标记,所述单链构象多态性(sscp)分子标记的碱基序列如seq id no.1所示,野生型和突变体的多态性位点位于扩增片段的第91bp处,碱基差异为a/g。
8.本发明中暗胚乳的表征为:与正常胚乳相比,水稻籽粒的胚乳呈现半透明,透光性降低且颜色发暗,直链淀粉含量显著降低,总淀粉含量无显著变化,总蛋白质含量显著升高。
9.进一步地,本发明根据上述sscp分子标记的位点设计了扩增引物,用于扩增所述sscp分子标记的引物对序列,如下所示:
10.上游引物f为:5
’‑
gtggaggaaaccgatggaga-3’;
11.下游引物r为:5
’‑
ctaggctgggaacgttggg-3’;
12.扩增产物为158bp,序列如seq id no.1所示(gtggaggaaaccgatggag atggagtagaaactcagggaagaggccacatgccctggccgtggccgcggccg gcggcgacgcgagaggtaacataacatggccgtgggcattattccactcttatat ctagcgaaataacccaacgttcccagcctag),sscp位点位于扩增片段的第91bp 处。
13.本发明还提供了osde6基因在调控水稻籽粒胚乳品质中的应用,所述osde6基因开放阅读框架的碱基序列如seq id no.2所示。
14.进一步地,所述水稻籽粒胚乳品质的表征指标为胚乳表型、直链淀粉含量、总淀粉含量和总蛋白质含量。
15.本发明还提供了一种用于扩增所述sscp分子标记的引物对,序列如下所示:
16.上游引物f为:5
’‑
gtggaggaaaccgatggaga-3’;
17.下游引物r为:5
’‑
ctaggctgggaacgttggg-3’。
18.本发明还提供了所述的引物对在水稻分子标记辅助育种中的应用。
19.本发明还提供了所述的引物对在筛选不同水稻籽粒品质的种质资源中的应用。
20.进一步地,所述水稻籽粒胚乳品质的表征指标为胚乳表型、直链淀粉含量、总淀粉含量和总蛋白质含量。
21.进一步地,所述的应用,包括以下步骤:
22.(1)将待筛选水稻植株与突变体de6杂交后获得f1,f1进行自交,构建得到f2群体;所述突变体de6的6号染色体rm340标记和rm439标记之间如seq id no.2 所示碱基序列的第80bp处碱基由a突变为g;
23.(2)取f2群体植株的基因组dna,采用sscp标记方法进行筛选;
24.筛选规则为:当条带为野生型或者父本一致时,则判定为aa;当条带为de6突变体一致时,则判定为aa;当条带兼有两种类型,则判定为aa。
25.与现有技术相比,本发明具有以下有益效果:
26.本发明对通过暗胚乳水稻材料de6进行图位克隆,并首次公开了一个与水稻暗胚乳相关联的sscp1分子标记。该分子标记可用于分子标记辅助选择育种,具有检测效率高、准确性高、方便操作和成本较低的优点。
附图说明
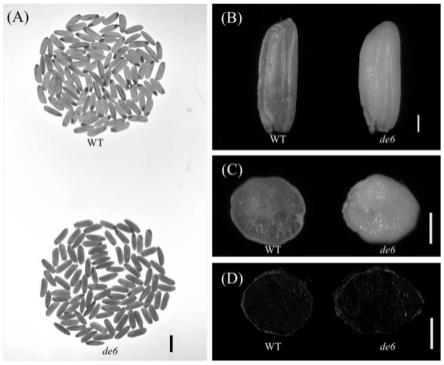
27.图1为实施例1中野生型93-11和突变体de6的籽粒形态;
28.其中,(a)野生型和突变体de6籽粒(100粒)照片,标尺10mm;(b)野生型和突变体de6糙米形态比较。标尺1mm;(c)野生型和突变体de6糙米横截面比较;标尺1mm;(d)野生型和突变体de6籽粒经i
2-ki染色后的比较。
29.图2为实施例1中野生型93-11和突变体de6成熟籽粒的扫描电镜观察结果;
30.其中,(a)野生型籽粒,放大倍数30;标尺1mm;(b)突变体de6籽粒,放大倍数30。标尺1mm;(c)野生型籽粒,放大倍数1500;标尺30μm;(d)突变体de6 籽粒,放大倍数1500;标尺30μm;(e)野生型籽粒,放大倍数5000;标尺10μm;(f)突变体de6籽粒,放大倍数5000;标尺10μm。
31.图3为实施例1中突变体de6图位克隆过程示意图;n代表用于定位的极端个体数。
32.图4为实施例2中分子标记sscp1电泳胶图;
33.其中,m:突变体de6;93-11:野生型93-11;f:日本晴;dark endosperm f
3 plants: 20株暗胚乳植株;normal f
3 plants:10株正常胚乳植株。
具体实施方式
34.下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。
35.实施例1
36.1、突变体de6的鉴定及分析
37.通过对水稻籼稻品种93-11进行ems诱变获得暗胚乳突变体de6,该突变体的糙米和精米均呈现出胚乳颜色发暗且半透明的外观品质。连续多代种植,该突变体胚乳表型稳定。在背光灯照射下,野生型糙米籽粒表现出均一的透光性,突变体de6糙米籽粒则表现为透光性均一但透光性降低(如图1a所示)。通过光学显微镜观察,野生型呈现透明胚乳表型,突变体de6则呈现半透明的暗胚乳表型(图1b、图1c)。i
2-ki 染色表明,野生型和突变体de6糙米籽粒均可被染成蓝黑色,说明突变体de6并非糯质胚乳。
38.此外,通过扫描电镜分析发现,当放大倍数为30倍时,两者无显著差异(图2a、图2b);放大倍数为1500和5000倍时,野生型的横断面淀粉颗粒大小均一且棱角分明,颗粒之间排列紧密无空隙,突变体de6的横断面则表现为淀粉颗粒大小不均、分布不均,有些淀粉颗粒聚集在一起,有些则呈现游离状态。此外,扫描电镜也可观察出突变体de6淀粉颗粒的形态变化。突变体de6部分淀粉颗粒呈现多边体或球状,导致部分淀粉颗粒间存在空腔(图2c、图2d、图2e、图2f),而野生型的淀粉颗粒则表现为规则的多边形。据此分析,突变体de6和野生型93-11胚乳表型的差异是由于淀粉粒形态和分布出现变化引起的。
39.2、突变体de6的遗传分析及图位克隆
40.突变体de6和野生型93-11进行杂交得f1群体,f1自交得f2群体。在突变体de6 和野生型93-11构建的f2遗传分析群体中,正常表型和突变表型籽粒分别为1314粒和440粒,计算可知χ2=0.002<χ
20.05
=3.841。卡方结果显示,实际比值符合理论3:1 的比值;因此,可以判断突变体de6为单基因隐性突变。
41.以突变体de6和粳稻品种日本晴配制组合,在f3群体的正常表型和突变表型植株中分别随机选取10株植株,提取dna,构建混池,bsa法筛选连锁标记,发现突变位点与水稻6号染色体rm340标记存在连锁关系(图3)。然后,进行初步定位,发现该位点位于水稻6号染色体rm340标记和rm439标记之间。利用1320株突变单株进行精细定位,定位到6ys33181和6myh-12之间共60kb的区间内(以籼稻为参考基因组,参考基因组获取网站为https://www.gramene.org)。
42.为了进一步确定候选基因,后续用生物信息学网站(https://www.gramene.org)进行预测,发现在该区间内共有10个开放阅读框(open reading frame,orf)。通过对表达量和基因注释的分析对该区间内的十个基因进行测序(表1),并将其位置和大小标注在图3中。最终发现在loc_os06g48560起始密码子atg上游71bp处发生了一个碱基由a到g的替换(图3),将该基因命名为osde6。
43.表1目的区间内的候选基因
[0044][0045]
3、突变体de6的淀粉含量测定和总蛋白质含量测定
[0046]
制备野生型和突变体de6的精米粉,称取100mg于小烧杯中,加入1ml无水乙醇,随后加入9ml 1mol/l氢氧化钠溶液,于室温下静置24h。同时,在另一个小烧杯中加入2.5ml 0.09mol/l氢氧化钠溶液,进行同样的操作,静置24小时,该烧杯设置为样品的空白对照。设置分光光度计数值为620nm,对不同样本分别进行吸光值测定,每个样本测定三次,取平均值,用标准曲线函数进行计算,即可得到直链淀粉含量。总淀粉含量使用合肥莱尔生物科技有限公司的总淀粉含量测定试剂盒(分光光度计法),按照试剂盒提供的说明书进行测定。总蛋白质含量使用元素分析仪定氮法测定。在盛样囊(型号:elementar vario el cube,德国艾力蒙塔有限公司)中加入25mg 精米粉,用元素分析仪(型号:elementar vario el cube 16003975,德国艾力蒙塔有限公司)对气体含量及组分进行测定。然后利用前人测得的回归方程计算样品中总蛋白质含量。使用的回归方程为y=0.24884+5.95092x,y是样品中总蛋白质含量,x是元素分析仪测定值。
[0047]
总淀粉和直链淀粉含量测定结果显示,野生型和突变体de6总淀粉含量差异不显著,突变体de6相比野生型含量轻微降低;但是突变体de6的直链淀粉含量显著降低(表2)。总蛋白质含量测定结果显示,突变体de6总蛋白质含量为8.67%,野生型总蛋白质含量为8.27%,突变体总蛋白质含量显著高于野生型(表2)。结果表明该突变基因也可能影响了总蛋白质含量。
[0048]
表2野生型与突变体de6淀粉含量和总蛋白质含量测定
[0049][0050]
4、突变体de6的质构分析和胶稠度测定
[0051]
将野生型和突变体de6成熟籽粒以gb/t 15682-2008为参考标准制作米饭样品。使用质构仪(型号:ta-xtc-18,上海保圣有限公司)和柱形探头(型号:ta/36r,上海保圣有限公司),测试制备好的米饭样品的质构数据。测试方法设定为大米全质构测试。测试时将样品放置于挤压装置中,探头位于装置的正上方。每个样本设置5次重复。测试完成后用仪器自带的ta.xtc-18软件(上海保圣有限公司)进行分析。
[0052]
胶稠度按照ny147-88标准进行测定。称取0.1g烘干至恒重的精米粉样品,倒入至长玻璃管内,将玻璃管置于试管架上,向玻璃管底部加入0.2ml百里酚蓝和2ml 0.2 mol/l
的氢氧化钠溶液,轻轻摇动使所有液体和米粉混合均匀。打开水浴锅盖,将玻璃管垂直放入沸水中,选择大小匹配的玻璃球堵住玻璃试管。用隔热夹子夹住玻璃管,控制其米胶高度不高于试管总高度的三分之二,使米胶糊化8min。然后将玻璃管在室温中静置10min至玻璃管不烫手,再放置于冰上静置30min。随后将玻璃管拿出并擦干,水平放置1.5h至米胶不再流动,期间保持玻璃管所处环境温度在23℃-27℃之间。胶稠度为试管最底部到米胶最前端的总长度,每个样本设置两个玻璃管进行测定。
[0053]
表3野生型与突变体de6质构分析和胶稠度测定
[0054][0055][0056]
对野生型和突变体de6进行质构分析和热力学特性分析,结果显示,突变体de6 脆度和硬度下降、黏性上升,胶稠度变软。因为直链淀粉含量与脆度、硬度成正相关,与黏性、胶稠度成负相关,因此证明突变体de6直链淀粉含量下降。
[0057]
实施例2胚乳表型和籽粒品质改良及分子辅助育种
[0058]
1)配制育种组合
[0059]
将需要改良的水稻材料93-11为母本,突变体de6材料为父本,获得f1种子,自交后获得f2群体。说明:f2群体有多个单株,有些单株表型和突变体亲本一致,为暗胚乳表型,有些单株表型和正常表型的亲本一致。
[0060]
2)选择水稻单株,提取dna
[0061]
具体步骤如下:
[0062]
取生长旺盛的叶片或初生根约200mg剪碎,放入2ml离心管中。加入800μlctab提取液,于65℃放置30min。加入800μl氯仿,剧烈震荡,使之与ctab溶液充分反应,于4℃离心机中8000-12000rpm离心10min。将离心后的样品置于冰上,吸取上清液约400-600μl于1.5ml离心管中,加入等体积异丙醇,于-20℃放置约0.5 h。取出样本后于4℃离心机中8000rpm离心约5min,弃上清液。在离心管中加入1 ml 70%乙醇溶液洗涤沉淀,于4℃离心机中8000rpm离心5min。室温下晾干离心管。加入100-200μl双蒸水,于-20℃保存备用。
[0063]
3)pcr扩增目的片段
[0064]
用于扩增所述sscp分子标记的引物对序列,如下所示:
[0065]
上游引物f为:5
’‑
gtggaggaaaccgatggaga-3’;
[0066]
下游引物r为:5
’‑
ctaggctgggaacgttggg-3’;
[0067]
pcr反应体系(10μl),如表4。
[0068]
表4 pcr反应体系
[0069]
[0070]
pcr反应程序,如表5。
[0071]
表5 pcr反应程序
[0072][0073][0074]
4)单链构象多态性(sscp)电泳
[0075]
野生型93-11和突变体de6仅有单碱基多态性差异(snp),因此开发了单链构象多态性(sscp)分子标记。
[0076]
具体操作过程如下:
[0077]
(1)按表5所示配好10%聚丙烯酰胺凝胶溶液,缓慢倒入组合好的两块玻璃板的缝隙中。
[0078]
表5 sscp配制体系
[0079][0080]
(2)待玻璃板间隙的胶液凝固后,并取下底部的琼脂封胶条,将玻璃板放入垂直电泳槽,往电泳槽中加入1
×
的电泳液至电泳液液面高于凹版最低处0.5cm,缓慢拔出梳子。
[0081]
(3)设置电压300v,电泳时间30min,预热胶块至胶块微微发热。
[0082]
(4)取0.4-1.2μl的pcr产物加入15μl 2
×
上样缓冲液,用pcr仪100℃处理 10min,然后迅速置于冰上对产物进行冷却。
[0083]
(5)将冷却后的变性产物迅速加样2.5μl至上样孔,快速完成点样。点样结束后,打开电泳仪开始电泳。将电压设置为250v,电泳五分钟,然后将电压调低至100-150 v继续电泳。
[0084]
(6)电泳结束后,取下胶块,用10%硝酸银染液染色10min。用含1.5%naoh、 0.019%nahco3和0.0375%甲醛的显色液处理至胶块中有条带显现,拍照记录sscp 的带型结果(图4)。
[0085]
扩增产物的双链经过变性后,形成了两条单链dna,并保留了胶图最下沿的未变性双链扩增片段。
[0086]
把与突变体de6对应带型一致的基因型标记为aa,与父本带型一致的标记为aa,杂合基因型则为aa,对群体中的植株进行了基因型鉴定,根据特异性分子标记sscp1 的带型,检测显性基因a和隐性基因a的存在与否。
[0087]
即:判断规则是当条带为野生型或者父本一致时,则判定为aa;当条带为de6 突变体一致时,则判定为aa;当条带兼有两种类型,则判定为aa。
[0088]
实施例3基因功能互补实验
[0089]
以93-11叶片dna为模版,扩增目标基因上游启动子序列、目标基因全长及下游终止序列(seq id no:3),构建互补载体pcambia1301-de6,转入农杆菌eha105 中。
[0090]
选用de6糙米,75%酒精消毒1min,20%次氯酸钠溶液浸泡20min,然后用无菌水将以上溶液清洗干净。于超净台吹3min后将其置于nbd诱导培养基上两周。培养带有pcambia1301-de6的农杆菌,调整菌液od
600
=0.2-0.4,与浅黄色致密胚性愈伤组织共培养。将愈伤组织从共培养基中分离出来,转入筛选培养基。在28℃下暗培养2周至出现新的颗粒状的抗性愈伤组织。预分化一周后转入分化培养基,直至愈伤组织萌发出绿点,并长出幼苗。当幼苗生长到3厘米时,转移到生根培养基中。当植株生长至培养瓶口后,可以将瓶盖打开,加入少量的水炼苗。将附着于根部的培养基冲洗干净,继续用营养液炼苗2-3天。
[0091]
对阳性植株进行了表型鉴定及淀粉、蛋白质含量检测;结果显示,突变体de6表型及相关物质含量恢复正常。因此,本发明的目的基因osde6可以影响种子表型和淀粉及蛋白质含量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1