一种1-苯基吡咯烷的合成方法
1.本发明属于有机合成中间体的制备技术领域,具体涉及一类由芳香类硝基化合物和1,4-丁二基双(4-甲基苯磺酸酯)作为底物,制备有机中间体1-苯基吡咯烷的方法。
背景技术:
2.1-苯基吡咯烷是一种重要有机合成中间体,被广泛应用于科学研究、药物合成、生物碱合成、化工生产等多个领域。在天然生物碱、托烷类药物分子、新药先导化合物中广泛存在。同时这类化合物也是药物合成中常用的合成砌块,常被应用于一些其他具有广泛生物活性的天然产物的全合成研究。因此,类似1-苯基吡咯烷的n-芳基取代氮杂环在有机合成和药学研究中具有很高的应用价值。
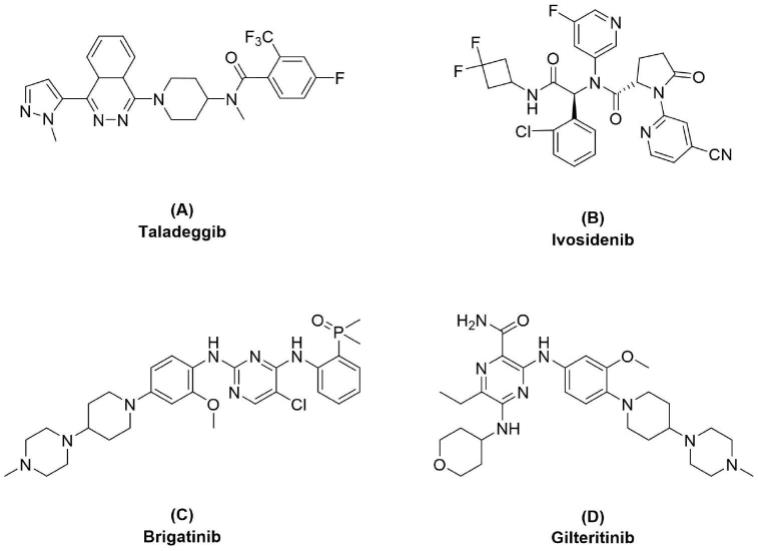
3.目前1-苯基吡咯烷及其衍生物被发现具有广泛的生理活性,可以作为生物酶抑制剂或具有抗癌作用。一些在药学研究中被发现的受到广泛关注的相关化合物举例如下:被批准用于治疗局部晚期基底细胞癌的taladegib(a);第一个在人体试验中获得临床验证midh1酶抑制剂ivosidenib(b);新一代间变性淋巴瘤激酶抑制剂brigatinib(c)对alk阳性的非小细胞肺癌患者有很强的疗效。此外,gilteritinib(d)可以提高一些急性髓系白血病患者的存活率。
[0004][0005]
目前,1-苯基吡咯烷可以通过以下方法进行合成。
[0006]
1)苯基-2-吡咯烷酮与二异丁基硼氢化铝的还原反应:首先需要由二异丁基氢化铝(dibal)和硼烷二甲硫醚(bms)合成二异丁基硼氢化铝,将1-苯基-2-吡咯烷酮(1当量)、二异丁基硼氢化铝(1.1当量)与无水thf在0℃混合。一旦添加了所有的氢化物,就移除冰浴并且在氩气氛围下将反应混合物继续搅拌1小时再经过后处理即可得到产品。该方法所用
二异丁基硼氢化铝(ibu)2albh4无法直接购买,需要复杂的合成步骤,且反应需要在0℃和氩气氛围下进行,反应条件苛刻。参考:gabriella amberchan,rachel a.snelling,enrique moya,j.org.chem.2021,86,6207.。
[0007]
2)苯胺与环醚的脱氧胺化反应:该反应首先需要将苯胺、环丁醚,i2、nah2po2添加到密闭的反应管当中,在160℃的温度下反应11h,分离即可得到1-苯基吡咯烷,该反应160℃的反应温度要求非常苛刻,温度略微降低产率就会出现极大的下降,而且副产物有hi,具有强腐蚀性,处理过程复杂。参考:ying lin,dongyang li,jingjing zhang,zhi tang,new j.chem.,2021,45,21011.。
[0008]
3)苯硼酸与n-杂环化合物的c-n交叉偶联反应:该反应采用一种新型的纳米粒子作为催化剂,将苯硼酸、n-杂环化合物、k3po4、蒸馏水和催化剂在60℃下反应一段时间即可得到目标产物,但该反应所需的纳米粒子合成复杂,而且催化剂中所用到的金属钴具有很强的毒性,操作过程复杂。参考:seyyedeh ameneh alavi g,mohammad ali nasseri,milad kazemnejadi,new j.chem.,2021,45,7741.。
[0009]
4)镍催化的芳基氯化物与酰胺的偶联胺化反应:该反应需要保持在35℃的氮气气氛下,在反应管中加入溶剂甲苯、芳基氯、酰胺、ni(cod)2、apr
·
hcl、ko
t
bu和h2o反应24h。该反应的需要时刻保持在氮气氛围下,且所用溶剂甲苯是管制药品,条件要求苛刻。参考:jinpeng li,changyu huang,daheng wen,qingshu zheng,org.lett.2021,23,687.。
[0010]
5)芳基卤化物的加氢脱卤化反应:该反应在氮气气氛下进行,向压力管中加入2-碘-1-苯基-吡咯烷、催化剂、微量钾、ko
t
bu,溶剂为二甲基亚砜和二恶烷按照一定比例配制而成,反应24h。该反应需要氮气保护且用到压力管,原料中用到了活泼的钾金属,反应的危险性较大,所用底物需要自己合成,不易获得,并且反应不易操作。参考:bhagat singh,jasimuddin ahmed,amit biswas,rupankar paira,j.org.chem.2021,86,7242.。
[0011]
综上所述,尽管1-苯基吡咯烷是一种重要的有机合成中间体,但是到目前为止,现有的合成方法都是伯芳胺作为原料的反应或使用二羰基化合物进行还原胺化,但这些方法底物的功能耐受性存在局限性,而且条件要求高,操作复杂,不利于工业化生产。因此,开发一种新的合成方法,有着十分重要意义。
技术实现要素:
[0012]
本发明的目的是提供一种1-苯基吡咯烷的合成方法,该方法简单、成本低、产率高且能够一步反应合成1-苯基吡咯烷,该方法拓宽了现有合成技术。
[0013]
为实现上述目的,本发明采用的技术方案为:
[0014]
一种1-苯基吡咯烷的合成方法,具体为:在氮气氛围下,向干燥的schlenk反应管中依次加入催化剂cu(ii),锌粉,以及有机溶剂,随后加入芳香类硝基化合物和1,4-丁二基双(4-甲基苯磺酸酯),在50~80℃下反应8h,待芳香类硝基化合物完全转化后,向反应液中加入蒸馏水和乙酸乙酯的混合液萃取,合并有机相并加入无水硫酸镁进行干燥,40℃下浓缩有机相,经柱层析得到目标产物1-苯基吡咯烷。
[0015]
进一步,所述芳香类硝基化合物为硝基苯或杂芳基苯。
[0016]
进一步,所述硝基苯的结构式为所述杂芳基苯结构式为
其中r1为氢、卤素、烷基、芳基、-ome、-cho、-cn、-sch3中的任意一种或两种,但不仅限于这些基团。
[0017]
进一步,所述1,4-丁二基双(4-甲基苯磺酸酯)与芳香类硝基化合物的摩尔比为2-3:1。
[0018]
进一步,所述催化剂cu(ii)为硫酸铜(ii)、草酸铜(ii)、氯化铜(ii)、硝酸铜(ii)、溴化铜(ii)、三氟甲磺酸铜(ii)、氢氧化铜(ii)、乙基乙酰乙酸铜(ii)、三氟乙酸铜(ii)水合物中的一种,但不仅限于上述催化剂cu(ii)。
[0019]
进一步,所述催化剂cu(ii)的用量为芳香类硝基化合物的3~5mol%。
[0020]
进一步,所述有机溶剂为toluene、1,4-dioxane、thf、dmso、ch3cn、nmp、dmf中的一种,但不仅限于上述有机溶剂。
[0021]
进一步,所述有机溶剂用量为每毫摩尔芳香类硝基化合物对应1ml~4ml的有机溶剂。
[0022]
进一步,所述锌粉与芳香类硝基化合物的摩尔比为1.5:1,锌粉用于还原硝基苯或杂芳基苯。
[0023]
进一步,所述柱层析的洗脱剂为乙酸乙酯和石油醚的混合物,乙酸乙酯与石油醚的体积比为50:1。
[0024]
当反应底物之一为硝基苯时,本发明反应方程式如下:
[0025][0026]
其中,r1可以为氢、卤素、烷基或者芳基等取代基团,但不仅限于这些基团。本发明所用的各种取代基的硝基苯均可商业所得;x为3~5,y为1.5,t为50~80,式a为目标产物1-苯基吡咯烷。
[0027]
当反应底物之一为杂芳基苯时,本发明的反应方程式与上述反应方程式类似,将上述反应方程式中的硝基苯的苯环替换为氮杂环即可。
[0028]
与现有技术相比,本发明的有益效果为:
[0029]
1、本发明方法中原料廉价易得,符合工业化生产的要求。
[0030]
2、本发明方法中反应无复杂的中间环节,对实验操作水平要求较低。
[0031]
3、本发明方法从硝基苯为原料,合成目标产物,拓宽了1-苯基-吡咯烷的合成方法。
具体实施方式
[0032]
下面结合具体的实施例对本发明的技术方案及效果做进一步描述,但本发明的保护范围并不限于此。
[0033]
以下实施例的反应方程式中,i表示硝基苯或杂芳基苯,ii表示1,4-丁二基双(4-甲基苯磺酸酯)。
[0034]
实施例1
[0035]
本实施例1-苯基吡咯烷1的合成为:
[0036][0037]
在氮气氛围下,向干燥的25mlschlenk反应管中依次加入氯化铜(ⅱ)[2mg,0.015mmol],锌粉(49mg,0.75mmol),溶剂dmf(2ml),硝基苯(51μl,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(321μl,1mmol)。在转速为360rpm,65℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,经柱层析分离,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体67mg,产率94%。
[0038]1h nmr(400mhz,cdcl3)δ7.17
–
7.13(m,2h),6.59
–
6.56(t,1h),6.50
–
6.48(d,2h),3.22
–
3.18(m,4h),1.93
–
1.90(m,4h).
13
c{1h}nmr(100mhz,cdcl3)δ147.5,128.3,114.5,110.3,46.1,24.2.ms(ei):m/z=147.5[m]+.
[0039]
实施例2
[0040]
本实施例1-(对甲苯基)吡咯烷2的合成为:
[0041][0042]
在氮气氛围下,向干燥的25ml schlenk反应瓶中依次加入硫酸铜(ii)[4mg,0.025mmol],锌粉(49mg,0.75mmol),溶剂toluene(0.5ml),对硝基甲苯(69mg,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(468μl,1.5mmol)。在转速为200rpm,50℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体76mg,产率94%。
[0043]1h nmr(400mhz,cdcl3)δ7.01(d,2h),6.54(d,2h),3.25(t,4h),2.27(s,3h),2.05
–
1.94(m,4h).
13
c{1h}nmr(100mhz,cdcl3)δ146.7,129.5,124.3,111.6,47.5,25.3,20.5.ms(ei):m/z=161.5[m]+.
[0044]
实施例3
[0045]
本实施例1-(4-氟苯基)吡咯烷3的合成为:
[0046][0047]
在氮气氛围下,向干燥的25ml schlenk反应瓶中依次加入草酸铜(ii)[3.8mg,0.025mmol],锌粉(49mg,0.75mmol),溶剂nmp(2ml),4-氟硝基苯(70.5mg,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(468μl,1.5mmol)。在转速为150rpm,80℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体77.6mg,产率94%。
[0048]1hnmr(400mhz,cdcl3)δ7.01
–
6.84(m,2h),6.57
–
6.48(m,2h),3.23(t,4h),2.03
–
1.95(m,4h).
13
c{1h}nmr(100mhz,cdcl3)δ155.1,144.5,115.4,112.1,48.7,25.6.
19
f nmr(376mhz,cdcl3)δ-130.93.ms(ei):m/z=165.5[m]+.
[0049]
实施例4
[0050]
本实施例1-(4-氯苯基)吡咯烷4的合成为:
[0051][0052]
在氮气氛围下,向干燥的25ml schlenk反应瓶中依次加入硝酸铜(ii)[2.80mg,0.015mmol],锌粉(49mg,0.75mmol),溶剂dmso(2ml),4-氯硝基苯(79mg,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(312μl,1mmol)。在转速为150rpm,70℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体87mg,产率96%。
[0053]1h nmr(400mhz,cdcl3)δ7.24
–
7.11(m,2h),6.54
–
6.42(m,2h),3.24(t,4h),2.01
–
1.95(m,4h).
13
c{1h}nmr(100mhz,cdcl3)δ146.5,128.2,120.8,112.3,47.4,25.4.ms(ei):m/z=181.3[m]+.
[0054]
实施例5
[0055]
本实施例4-(吡咯烷-1-基)苄腈5的合成为:
[0056][0057]
在氮气氛围下,向干燥的25ml schlenk反应瓶中依次加入氢氧化铜(ii)[1.46mg,
0.015mmol],锌粉(49mg,0.75mmol),溶剂1,4-dioxane(1ml),对硝基苯甲腈(74mg,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(312μl,1mmol)。在转速为150rpm,70℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体82mg,产率95%。
[0058]1h nmr(400mhz,cdcl3)δ7.46
–
7.41(m,2h),6.53(d,2h),3.34
–
3.21(m,4h),2.13
–
1.96(m,4h).
13
c{1h}nmr(100mhz,cdcl3)δ150.3,133.4,121.5,111.3,96.3,47.7,25.5.ms(ei):m/z=172.6[m]+.
[0059]
实施例6
[0060]
本实施例1-(4-(三氟甲基)苯基)吡咯烷6的合成为:
[0061][0062]
在氮气氛围下,向干燥的25ml schlenk反应瓶中依次加入无水醋酸铜(ii)[2.72mg,0.015mmol],锌粉(49mg,0.75mmol),溶剂ch3cn(2ml),4-硝基三氟甲苯(95.6mg,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(468μl,1.5mmol)。在转速为200rpm,70℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体104mg,产率97%。
[0063]1h nmr(400mhz,cdcl3)δ7.43(d,2h),6.54(d,2h),3.33(t,4h),2.02(td,4h).
13
c{1h}nmr(100mhz,cdcl3)δ148.4,125.5(q,),124.2,115.3,109.5,46.3,24.7.
19
f nmr(376mhz,cdcl3)δ-60.55.ms(ei):m/z=215.3[m]+.
[0064]
实施例7
[0065]
本实施例8-(1-吡咯烷基)-喹啉7的合成为:
[0066][0067]
在氮气氛围下,向干燥的25ml schlenk反应瓶中依次加入三氟甲磺酸铜(ii)[5.42mg,0.015mmol],锌粉(49mg,0.75mmol),溶剂thf(2ml),7-硝基喹啉(87mg,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(468μl,1.5mmol)。在转速为200rpm,80℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体92mg,产率93%。
[0068]1hnmr(400mhz,cdcl3)δ8.77
–
8.74(m,1h),8.05
–
8.01(m,1h),7.42
–
7.25(m,2h),7.18
–
7.14(m,1h),6.84
–
6.81(m,1h),3.74
–
3.72(m,4h),2.06
–
1.92(m,4h).
13
c{1h}nmr(100mhz,cdcl3)δ146.5,141.3,135.4,129.5,127.1,120.5,116.5,111.2,52.3,25.3.ms(ei):m/z=198.3[m]+.
[0069]
实施例8
[0070]
本实施例5-吡咯苯并[b]噻吩8的合成为:
[0071][0072]
在氮气氛围下,向干燥的25ml schlenk反应瓶中依次加入溴化铜(ii)[3.35mg,0.015mmol],锌粉(49mg,0.75mmol),溶剂n-甲基吡咯烷酮(2ml),5-硝基苯并噻吩(89.6mg,0.5mmol),1,4-丁二基双(4-甲基苯磺酸酯)(468μl,1.5mmol)。在转速为200rpm,80℃的加热器上反应8h,经tlc检测原料反应完全,停止反应,将反应混合液用体积比为1:2的蒸馏水和乙酸乙酯混合液少量多次萃取,合并有机相,并用无水硫酸镁进行干燥,浓缩有机相,后经柱层析,洗脱剂为(乙酸乙酯/石油醚=50/1),得到产品浅黄色液体116mg,产率96%。
[0073]1h nmr(400mhz,cdcl3)δ7.65(d,1h),7.33(d,1h),7.14(d,1h),6.94(d,1h),6.78
–
6.73(m,1h),3.38
–
3.23(m,4h),2.08
–
1.92(m,4h).
13
c{1h}nmr(100mhz,cdcl3)δ146.1,141.3,127.5,126.4,123.7,112.9,112.3,104.5,48.3,25.7.ms(ei):m/z=203.3[m]+.
[0074]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1