一种γ-硫蛋白或花生肽核酸γ-硫蛋白复合体及应用的制作方法
application in dough."food microbiology 73(2018):111-121.)。
4.我们从经济作物花生中鉴定出具有抗真菌活性的γ-硫蛋白,但是该蛋白的稳定性有限,容易被蛋白酶攻击而降解(老田茂."麹菌
プロテアーゼによる
抗菌
ペプチド
·
α
‑チオニンの
分解."日本醸造協会誌95,no.10(2000):776-779.)。肽核酸肽核酸是其中磷酸二酯骨架被聚酰胺结构取代的寡核苷酸类似物。由于其多种有利特性而备受关注,包括对核酸酶和蛋白酶消化的抗性、在血清和细胞提取物中的稳定性,能增强对蛋白酶的抗性(rathee,permender,dharmender rathee,ashima hooda,vikash kumar,and sushila rathee."peptide nucleic acids:an overview."the pharma innovation 1,no.7,part a(2012):25.)。因此肽核酸具有足够的生物稳定性以降低γ-硫蛋白的降解。并探索了肽核酸γ-硫蛋白复合体抗真菌活性。
技术实现要素:
5.从花生的蛋白序列数据库中搜素到γ-硫蛋白(genbank:ryq94245.1)序列,进行了化学合成。合成一种高稳定的肽核酸(patil,nitin a.,varsha j.thombare,rong li,xiaoji he,jing lu,heidi h.yu,hasini wickremasinghe et al."an efficient approach for the design and synthesis of antimicrobial peptide-peptide nucleic acid conjugates."frontiers in chemistry 10(2022).),同时通过化学方法制备了花生肽核酸γ-硫蛋白复合体:其氨基酸序列为:γ-硫蛋白序列merkpsslglffllikwwciqrqgcvsqrttcsrvdagvtsdhncalvcrnegfsggrchrfhrrcfctklcseq。γ-硫蛋白具有抗真菌活性,对花生病原体尖孢镰刀菌和立枯丝核菌具有抗真菌活性。但γ-硫蛋白的稳定性有限。本发明目的合成的肽核酸(cys-peg4-cyt-thy-cyt-ade-thy-ade-cyt-thy-cyt-thy-thy-gua-lys-nh2)增加抗真菌花生γ-硫蛋白的稳定性。
6.所述的γ-硫蛋白的稳定性有限。肽核酸增强γ-硫蛋白抵抗蛋白酶的攻击,降低γ-硫蛋白的降解。
7.肽核酸增强γ-硫蛋白抵抗蛋白酶的攻击,肽核酸具有足够的生物稳定性以降低γ-硫蛋白的降解。抗真菌花生肽核酸γ-硫蛋白复合体在抑制花生病原体尖孢镰刀菌和立枯丝核菌中的一种或二种以上过程中的长期稳定应用。
8.γ-硫蛋白是花生中的一种抗真菌蛋白,花生γ-硫蛋白对花生病原体尖孢镰刀菌和立枯丝核菌的抗真菌活性。但是该蛋白不稳定,容易被蛋白酶攻击。肽核酸增加花生抗真菌花生γ-硫蛋白稳定性。一种抗真菌花生肽核酸γ-硫蛋白复合体,该复合体有两部分组成,一部分是γ-硫蛋白具有如序列表seq id no.1所示的氨基酸序列。另外一部分是肽核酸,具有如序列表seq id no.2所示的核苷酸和氨基酸交杂序列。花生肽核酸γ-硫蛋白复合体是通过化学合成的方法是制备。
附图说明
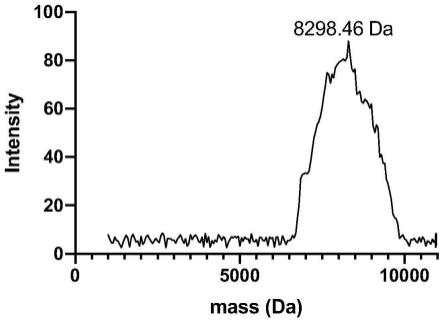
9.图1.质谱分析化学合成的γ-硫蛋白分子量。
10.图2.电喷雾质谱分析实施例2合成的肽核酸(具体序列见id no.2)的分子量。
11.图3.电喷雾质谱分析(阳离子模式)化学合成的肽核酸γ-硫蛋白分子量。
12.图4.γ-硫蛋白和肽核酸γ-硫蛋白对菌丝体生长的抑制,其中a为尖孢镰刀菌。b
为茄病菌。
13.图5.肽核酸γ-硫蛋白提高了γ-硫蛋白的抗真菌活性的稳定性
具体实施方式
14.根据下述实施例可以更好的理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书所详细描述的本发明。
15.实施例1:花生γ-硫蛋白的化学合成
16.花生γ-硫蛋白(序列:merkpsslglffllikwwciqrqgcvsqrttcsrvdagvtsdhncalvcrnegfsggrchrfhrrcfctklcseq)化学合成委托常州康龙生物科技有限公司完成。也可以参考9-芴甲氧羰基(fmoc)的固相肽合成的标准做法,基本原理:在fmoc固相肽合成中,肽链是逐步组装的,一次一个氨基酸,同时连接到不溶性树脂支持物上。这允许通过简单的洗涤在每个步骤中去除反应副产物。氨基酸在其氨基末端受到fmoc(9-芴基甲氧羰基)基团的保护,并在羧酸末端活化后与生长链偶联。然后通过哌啶处理除去fmoc基团并重复该过程。肽组装完成后,通过用三氟乙酸(tfa)处理将其从树脂中去除。同时,氨基酸侧链上的保护基也被去除,得到粗线性肽。通过反相hplc一步纯化通常足以获得纯度》95%的肽。详细流程请参考(https://www.chem.uci.edu/~jsnowick/groupweb/files/standard_practices_for_fmoc_based_solid_phase_peptide_synthesis_in_the_nowick_laboratory_v_1.7.2.pdf)和(https://d1wqtxts1xzle7.cloudfront.net/53338258/standard_practices_for_fmoc_based_solid_phase_peptide_synthesis_in_the_nowick_laboratory_v_1point6-with-cover-page-v2.pdf?expires=1649683014&signature=rzpbaow-xyuozirtohtgaj8denwxlhl-3zurknp7wes8e~ai19zxazj~jg0rzbnmgrv2wgxgrcwmj5jewxd~0flw~ru4t6mxyhvzuexcckcrneo7kysljrovbftttuqftb8tk~4cmwgz2j742~ajq99es9bpyfmueyf-pgehsnspd6axpxf8rslqbbvozeelg4xigy0kb3cvvbg8jnpat0i4lourwyv6movv~yyqbhex88kxirhazb2nc2nmk1lfxrd~~cwgwyy9vydkx3on5uh9cdzpqdtdwnwrm3o6pmhqqtfsgsq9im-zwacpzx9ppvonz-x0hcdufvyqvz0lsg__&key-pair-id=apkajlohf5ggslrbv4za)。
17.飞行质谱对γ-硫蛋白进行分子量鉴定
18.在1ml含有0.1%三氟乙酸(体积含量)和35%乙腈(体积含量)水溶液中加入1mg合成的γ-硫蛋白,将溶液超声处理1分钟,然后以2000
×
g离心5分钟。并将所得溶液分别取1μl一式三份分别点样在基质辅助激光解吸电离(maldi)靶板上,并在室温下干燥。使用高分辨基质辅助激光解析串联飞行时间质谱仪(ab sciex malditof/tof 5800)(absciex,弗雷明翰,马萨诸塞州,美国)以线性模式获得基质辅助激光解析飞行时间(maldi-tof)质谱,该系统配备有λ=345nm波长的二极管泵浦nd:ylf激光器。对于sa中的maldi ms测量,应用了以下设置:箱大小设置为4ns,最终检测器电压为2.070kv,乘数为0.75;每个光谱累积了2000次激光射击。使用含有牛胰岛素(mh+)的5800质量标准试剂盒(ab sciex,弗雷明翰,马萨诸塞州,美国)通过外部校准校准ms数据5734.59)、硫氧还蛋白(mh+11674.48)和马脱肌红蛋白(mh+16952.56)。对于数据采集和处理,使用了data explorer 4.11版软件(ab sciex,弗雷明翰,马萨诸塞州,美国)。每个光谱都经过基线校正,应用了平滑处理并进行了
acids:methods and protocols(methods in molecular biology,208)2002nd edition,peter e.nielsen(editor),asin:0896039765,出版商:humana;2002年版(2002年7月23日);语言:英语;isbn-10:9780896039766;isbn-13:978-0896039766)。
38.参考肽核酸合成教程第43-48页(peptide nucleic acids:methods and protocols(methods in molecular biology,208)2002nd edition,peter e.nielsen(editor),asin:0896039765,出版商:humana;2002年版(2002年7月23日);语言:英语;isbn-10:9780896039766;isbn-13:978-0896039766),可以利用硫的氧化还原化学来形成二硫化物(-s-s-)桥接共轭物。我们利用γ-硫蛋白c末端的cys肽与肽核酸的二硫键偶联。
39.过程简述如下:
40.1.将实施例1合成的γ-硫蛋白(1.0μmole)和二硫苏糖醇(dtt)(1mg)溶解在100μl 0.1m nh4hco3中,并在室温下放置2小时。
41.2.在100μl dmf中加入二吡啶基二硫化物(11mg),在室温下再放置2小时。
42.3.将反应混合物立即与实施例2合成的肽核酸(1μmole)反应3h。
43.4.参考教程第40页(peptide nucleic acids:methods and protocols(methods in molecular biology,208)2002nd edition,peter e.nielsen(editor),asin:0896039765,出版商:humana;2002年版(2002年7月23日);语言:英语;isbn-10:9780896039766;isbn-13:978-0896039766)用hplc分析和纯化产物,用下面的电喷雾质谱法表征。
44.肽核酸是基于n-(2-氨基乙基)甘氨酸假肽骨架的dna合成类似物。碱基(对应于a、g、c、t)通过亚甲基羰基接头连接到主链上,由此产生的肽核酸寡聚体能够与互补的dna和rna形成非常稳定的复合物。它们还具有对核酸酶(和蛋白酶)具有抗性的巨大优势,这使它们成为反义和反基因应用的潜在理想试剂。已经开发了许多用肽修饰寡核苷酸的方法以应用于治疗和诊断应用或用于纳米结构的组装。我们开发了一种使用肽核酸作为支架构建基于γ-硫蛋白的方法。γ-硫蛋白与肽核酸的之间形成二硫键提高了其稳定性,从而扩大了功能性肽核酸的应用。
45.电喷雾质谱对合成的肽核酸γ-硫蛋白进行分子量鉴定
46.肽核酸γ-硫蛋白电喷雾质谱实验在waters-usa的xevo tq ms上进行。esms光谱以正离子模式记录。肽核酸γ-硫蛋白合成产物1毫克溶解在1毫升溶液中(体积比1:1甲醇-水),取10微升并引入质谱仪,溶剂流量设置为5μl/min。在质量范围为m/z 50-1000的两种电离模式下,通过施加5kv的电压对稀释的样品进行喷雾。esi源参数设置为3500v的毛细管电压,氮气用作雾化器气体,压力为30.00psi,流速为650l/h。毛细管温度设置为250℃。图3显示了阳离子模式esims谱图,表明存在肽核酸-γ-硫蛋白偶联物,分子量为12355.74。从seq id no.2可以看出两侧是半胱氨酸和赖氨酸,所以外加γ-硫蛋白与肽核酸的一侧半胱氨酸结合形成酰胺键(肽键),形成seq id no.3。
47.制备肽核酸γ-硫蛋白复合体。蛋白具体长度为72个天然氨基酸的序列,具体见序列表seq id no.1。
48.(a)序列特征:
49.·
长度:72
50.·
类型:氨基酸序列
quantitative assay for fungal growth inhibition.fems microbiol lett 69:55
–
60.)。真菌病原体、尖孢镰刀菌、立枯丝核菌、罗夫氏菌核、黄曲霉、黑曲霉和致病疫霉分别依次用于检查肽核酸γ-硫蛋白的抗真菌活性。对于分光光度测定,将10μl不同浓度(1,2,3,4,5,6,7,8,9,10mg/ml)的花生肽核酸γ-硫蛋白样品与90μl含有真菌孢子(1x107孢子/ml)的sabouraud葡萄糖肉汤(sdb,himedia)混合,该孢子已在96孔微量滴定板中37℃培养16小时。通过在酶联免疫吸附测定(elisa)酶标仪(moleculardevices,美国)中观察595nm处的吸光度来估计真菌生长。ic50值是通过双重稀释步骤计算的(terras fr,schoofs hm,de bolle mf,van leuven f,rees sb,vanderleyden j,cammue bp,broekaert wf(1992)analy-sis of two novel classes of plant antifungal proteins from rad-ish(raphanus sativus l.)seeds.j biolchem 267:15301
–
15309.)。
80.肽核酸γ-硫蛋白的尖孢镰刀菌和茄病菌活性
81.抗真菌研究中使用的固体培养基包括用于真菌的马铃薯葡萄糖琼脂(pda)(马铃薯,200g;葡萄糖,20g;琼脂,18g;和蒸馏水,1l)。为测试抗真菌活性,分别将1ml尖孢镰刀菌和茄病菌的真菌孢子悬液(1x107孢子/ml)均匀加入100ml pda培养基中,温度为40-50℃,制备固体板(平板厚度3-4mm),放置牛津杯不锈钢小管(内径6mm,外径8mm,高10mm)的。然后在牛津杯中点加入5μl不同浓度的肽核酸γ-硫蛋白(1,2,3,4,5,6,7,8,9,10mg/ml),在30℃培养48h,测量抗菌圈直径。对照组,加入等体积的生理盐水,用同样的条件培养。通过透明圈形成对肽核酸γ-硫蛋白的抗真菌活性进行初步筛选表明,肽核酸γ-硫蛋白对尖孢镰刀菌和茄病菌的ic50值分别为11.1(图4a)和102μg/ml(图4b),γ-硫蛋白对尖孢镰刀菌和茄病菌的ic50值分别为13.8μg/ml(图4a)和110μg/ml(图4b)。
82.图4.γ-硫蛋白和肽核酸γ-硫蛋白对菌丝体生长的抑制。a尖孢镰刀菌。b茄病菌。
83.实施例5:肽核酸γ-硫蛋白提高了γ-硫蛋白的抗真菌活性的稳定性各取1ml肽核酸γ-硫蛋白或γ-硫蛋白(5mg/ml),30℃放置20天,每天取5μl肽核酸γ-硫蛋白或γ-硫蛋白(5mg/ml)进行下面的抑菌实验。抗真菌研究中使用的固体培养基包括用于真菌的马铃薯葡萄糖琼脂(pda)(马铃薯,200g;葡萄糖,20g;琼脂,18g;和蒸馏水,1l)。为测试抗真菌活性,将1ml真菌尖孢镰刀菌孢子悬液(1x107孢子/ml)均匀加入100ml pda培养基中,温度为40-50℃,制备固体板(平板厚度3-4mm),放置牛津杯不锈钢小管(内径6mm,外径8mm,高10mm)的。然后在牛津杯中点加入5μl肽核酸γ-硫蛋白或γ-硫蛋白(5mg/ml),在30℃培养48h,测量抗菌圈直径。对照组,加入等体积的生理盐水,用同样的条件培养。放置24小时的肽核酸γ-硫蛋白或γ-硫蛋白相对抗真菌活性拟定为100%,其它放置时间的肽核酸γ-硫蛋白或γ-硫蛋白与放置24小时的肽核酸γ-硫蛋白或γ-硫蛋白跟菌抗菌圈直径对比,得出相应的活性。
84.图5.肽核酸γ-硫蛋白提高了γ-硫蛋白的抗真菌活性的稳定性借助肽核酸的骨架结构,结果表明肽核酸γ-硫蛋白提高了γ-硫蛋白的抗真菌活性的稳定性,可以从10天提高到20天(图5),该方法可行,考虑将来在生产中推广。
85.附录
86.序列表
87.seq id no.1
88.花生γ-硫蛋白蛋白氨基酸序列
89.merkpsslglffllikwwciqrqgcvsqrttcsrvdagvtsdhncalvcrnegfsggrchrfhrrcfctklc
90.seq id no.2为:
91.肽核酸序列
92.c-peg4-ctcatactcttg-k-nh2
93.seq id no.3为:
94.merkpsslglffllikwwciqrqgcvsqrttcsrvdagvtsdhncalvcrnegfsggrchrfhrrcfctklc-s-s-c-peg4-ctcatactcttg-k-nh2
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1