一种β-卤代吡咯类化合物的合成方法
一种
β-卤代吡咯类化合物的合成方法
技术领域
1.本发明属于有机合成领域,具体涉及一种β-卤代吡咯类化合物的 合成方法。
背景技术:
2.吡咯骨架常见于天然的或合成的活性功能分子中,大多具有特殊 生物药理活性或光电材料特性,在药物化学,材料科学以及农药等领 域得到了广泛应用。其中,β-卤代吡咯类化合物是一些海洋生物碱的 重要组成部分,此外,由于卤素的引入可以改善化合物脂溶性、影响 电荷分布,部分β-卤代吡咯类化合物也被发现具有特殊的抗菌活性。 与此同时,在有机合成领域,过渡金属催化卤代吡咯碳-卤键转化反 应是构建官能化吡咯化合物的实用策略。因此合成这类杂环化合物在 有机化学中十分重要。
3.构建β-卤代吡咯类化合物最经典的方法是利用n-琥珀酰亚胺 (nbs)和吡咯直接卤代,但由于吡咯具有多个反应位点,该方法在 底物范围和选择性上具有一定限制,一般情况下会得到多取代产物, 很难得到单一β-卤代吡咯化合物(h.m.gilow,d.e.burton.j.org. chem.1981,46,2221.)。而当吡咯环中α位被取代基占据,仅留下β 位c-h键时,通过nbs卤化也可以得到β-卤代吡咯化合物(w. debrouwer,t.s.a.heugebaert,c.v.stevens.j.org.chem.2014,79, 4322.)。此外,一种精心设计的联烯类化合物可以在银催化下发生 分子内胺氯化反应构建3-氯取代的吡咯啉化合物,但需要经过ddq 氧化才能得到β-氯代吡咯(m.sai,s.matsubara.org.lett.2011,13, 4676.)。近年来,利用炔溴中炔烃部分和n-烯丙基苯胺之间的[2+3] 氧化环化反应已被用于构建β-溴代吡咯化合物(j.zheng,l.huang,z. li,w.wu,j.li,h.jiang.chem.commun.2015,51,5894.)。总的来说, 这些已报道的反应虽然在合成方法方面进步很大,但其中部分反应选 择性差,或者使用特定的取代基使底物的多样性被限制,亦或原料需 要多步反应制备,操作较为繁琐。考虑到β-卤代吡咯骨架在天然产物 研究、有机合成以及医药材料应用等领域的巨大作用,发展更多便捷 高效的合成方法十分必要。
[0004]
炔卤化合物同时含有碳-碳三键和碳-卤键,在过渡金属催化下, 其三键和碳-卤键均可参与转化,既可以作为加成反应的受体参与亲 核加成反应及环化反应,又可以作为易得的炔基化试剂参与炔基化反 应,在有机合成中是一类结构简单、功能强大、用途广泛的有机合成 子(w.wu,h.jiang.acc.chem.res.,2014,47,2483;g.jiang,w.hu,j. li,c.zhu,w.wu,h.jiang.chem.commun.2018,54,1746;y.ano,n. kawaia,n.chatani.chem.sci.2021,12,12326.)。虽然已有单分子炔 溴参与构建β-卤代吡咯的报道,但通过两分子炔卤和一分子n-取代 苯胺直接环化构建β-卤代吡咯化合物的反应还未有报道。从反应多样 性及成键高效性以及原料易得性考虑,该三组分反应是合成β-卤代吡 咯更为新颖高效的方法。此外,在同一反应体系下实现相同两组分不 同化学键选择性转化反应仍然具有一定难度。综上所述,利用两分子 炔卤和一分子n-取代苯胺有序串联环化高效合成β-卤代吡咯类化合 物具有非常重要的意义。
技术实现要素:
[0005]
本发明的目的在于针对现有技术的缺点和不足,提供了一种β
‑ꢀ
卤代吡咯类化合物的合成方法。该方法以简单易得的n-取代苯胺与 炔卤为原料,以常见的钯盐作为催化剂,二苯基磷酸为配体,锂盐和 钠盐组合作为混合碱,甲基叔丁基醚为溶剂,采用有序串联环化的策 略,选择性地构建了β-卤代吡咯类化合物,具有原料易得、反应选择 性高、操作便捷安全及底物适用性广等优点,在实际生产和研究中具 备良好的应用前景。
[0006]
本发明的目的通过如下技术方案实现。
[0007]
一种β-卤代吡咯类化合物的合成方法,包含如下步骤:
[0008]
在反应器中,加入底物n-取代苯胺类化合物、炔卤、钯盐催化 剂、配体、碱和溶剂,在100~110℃下搅拌反应,反应结束后冷却至 室温,产物经分离纯化,得到所述β-卤代吡咯类化合物。
[0009]
进一步地,合成过程的化学反应方程式如下所示:
[0010][0011]
式中,r1选自异丙基或甲基;
[0012]
r2选自氢、4-甲基、4-苯氧基、4-氟、3-甲基、3-氯-4-氟中的一 种以上;
[0013]
r3选自氢、4-甲基、4-氯、4-醛基、3-甲基中的一种以上;
[0014]
x为氯或溴。
[0015]
进一步地,所述钯盐催化剂为氯化钯,钯盐催化剂的加入量与 n-取代苯胺类化合物的摩尔比为0.1~0.12:1。
[0016]
进一步地,所述配体为二苯基磷酸,配体的加入量与n-取代苯 胺类化合物的摩尔比为0.20~0.24:1。
[0017]
进一步地,所述炔溴化合物的加入量与n-取代苯胺类化合物的 摩尔比为6.0~7.0:1。
[0018]
进一步地,所述碱为一水合氢氧化锂和醋酸钠按摩尔比为 0.875~1:1的混合物。
[0019]
进一步地,所述碱的加入量与n-取代苯胺类化合物的摩尔比为2~3:1。
[0020]
进一步地,所述溶剂为甲基叔丁基醚。
[0021]
进一步地,所述搅拌反应的时间为24~30小时。
[0022]
进一步地,所述分离纯化的操作为:将反应液用乙酸乙酯萃取, 合并有机相,使用无水硫酸镁干燥,过滤,减压蒸除有机溶剂,得粗 产物,经柱层析提纯,得到所述β-卤代吡咯类化合物。
[0023]
更进一步地,所述柱层析的洗脱液为石油醚或石油醚和乙酸乙酯 按体积比10~150:1的混合溶剂,优选为石油醚或石油醚和乙酸乙酯 按体积比20~100:1的混合溶剂。
[0024]
本发明合成方法的反应原理是在碱的促进下,n-取代苯胺和二价 钯以及配体发生配位形成氮钯物种,之后炔卤碳-碳三键发生迁移插 入得到烯基钯物种,再与另一分子炔卤氧化加成,之后通过还原消除 得到炔烯胺,再在体系中的溴离子和钯作用下经由环化
用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸镁干燥,过 滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗脱液为石油 醚,得到目标产物,产率60%。
[0053]
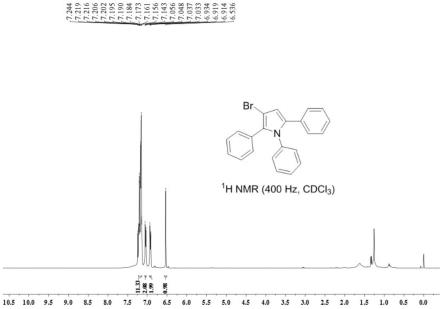
所得目标产物的氢谱图和碳谱图分别如图1和图2所示,结构表 征数据如下所示:
[0054]1h nmr(400mhz,cdcl3)δ7.22-7.14(m,11h),7.06-7.03(m, 2h),6.93-6.91(m,2h),6.54(s,1h);
[0055]
13
c nmr(100mhz,cdcl3)δ138.4,134.9,132.8,132.1,130.9, 130.8,128.7,128.7,128.7,128.0,127.7,127.4,127.3,126.8,112.2,97.8;
[0056]
ir:ν
max
(kbr)=3055,2923,2852,1596,1488,1340,1173,1072, 1026,920,844,761,696,620,523cm-1
;
[0057]
hrms(esi)m/z:calcd for c
22h17
brn[m+h]
+
,374.0539;found 374.0534.
[0058]
经以上数据推断目标产物的结构如下:
[0059][0060]
实施例2
[0061]
在反应管中加入0.1毫摩尔n-异丙基-4-甲基苯胺、0.01毫摩尔氯 化钯、0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫 摩尔醋酸钠、0.6毫摩尔苯基溴乙炔,1.0毫升甲基叔丁基醚作为溶剂, 在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加入5ml 水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸镁干燥, 过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗脱液为石 油醚,得到目标产物,产率51%。
[0062]
所得目标产物的氢谱图和碳谱图分别如图3和图4所示,结构表 征数据如下所示:
[0063]1h nmr(400mhz,cdcl3)δ7.27-7.19(m,8h),7.11-7.09(m,2h), 7.00-6.98(m,2h),6.85-6.83(m,2h),6.56(s,1h),2.30(s,3h);
[0064]
13
c nmr(100mhz,cdcl3)δ137.2,135.8,134.9,132.8,132.3, 131.1,130.8,129.3,128.6,128.4,128.0,127.7,127.2,126.7,112.1,97.6, 21.1;
[0065]
ir:ν
max
(kbr)=3036,2917,2850,1594,1473,1338,1160,1076, 1024,918,825,761,693,617,516cm-1
;
[0066]
hrms(esi)m/z:calcd for c
23h19
brn[m+h]
+
,388.0695;found 388.0692
[0067]
经以上数据推断目标产物的结构如下:
[0068][0069]
实施例3
[0070]
在反应管中加入0.1毫摩尔n-异丙基-4-苯氧基苯胺、0.01毫摩尔 氯化钯、0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16 毫摩尔醋酸钠、0.7毫摩尔苯基溴乙
炔,1.0毫升甲基叔丁基醚作为溶 剂,在100℃下转速700rpm下搅拌反应30小时;停止搅拌,加入5 ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸镁干 燥,过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗脱液 为体积比30:1的石油醚:乙酸乙酯混合溶剂,得到目标产物,产率 43%。
[0071]
所得目标产物的氢谱图和碳谱图分别如图5和图6所示,结构表 征数据如下所示:
[0072]1h nmr(400mhz,cdcl3)δ7.33-7.29(m,2h),7.28-7.17(m,8h), 7.11-7.07(m,3h),6.93-6.86(m,4h),6.80-6.77(m,2h),6.53(s,1h);
[0073]
13
c nmr(100mhz,cdcl3)δ156.6,156.3,135.0,133.5,132.8, 132.1,130.9,130.8,130.0,129.8,128.7,128.0,127.7,127.4,126.8, 123.7,119.0,118.7,112.1,97.7;
[0074]
ir:ν
max
(kbr)=3052,2914,2848,1590,1486,1343,1237,1163, 1072,1023,919,841,757,694,615,500cm-1
;
[0075]
hrms(esi)m/z:calcd for c
28h21
brno[m+h]
+
,466.0801;found 466.0800
[0076]
经以上数据推断目标产物的结构如下:
[0077][0078]
实施例4
[0079]
在反应管中加入0.1毫摩尔n-异丙基-4-氟苯胺、0.01毫摩尔氯化 钯、0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫摩 尔醋酸钠、0.7毫摩尔苯基溴乙炔,1.0毫升甲基叔丁基醚作为溶剂, 在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加入5ml 水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸镁干燥, 过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗脱液为石 油醚,得到目标产物,产率61%。
[0080]
所得目标产物的氢谱图和碳谱图分别如图7和图8所示,结构表 征数据如下所示:
[0081]1h nmr(400mhz,cdcl3)δ7.26-7.22(m,3h),7.22-7.17(m,3h), 7.16-7.13(m,2h),7.06-7.03(m,2h),6.92-6.84(m,4h),6.53(s,1h);
[0082]
13
c nmr(100mhz,cdcl3)δ161.4(d,j=246.4hz),135.0,134.5 (d,j=3.4hz),132.9,131.9,130.8,130.8,130.3(d,j=8.6hz),128.7, 128.1,127.8,127.5,127.0,115.7(d,j=22.7hz),112.3,97.9;
[0083]
19
f nmr(376mhz,cdcl3)δ-113.64;ir:ν
max
(kbr)=3053,2915, 2847,1591,1502,1340,1218,1074,1021,914,841,759,692,519cm-1
;
[0084]
hrms(esi)m/z:calcd for c
22h16
brfn[m+h]
+
,392.0445;found 392.0440.
[0085]
经以上数据推断目标产物的结构如下:
[0086][0087]
实施例5
[0088]
在反应管中加入0.1毫摩尔n-异丙基-3-甲基苯胺、0.01毫摩尔氯 化钯、0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫 摩尔醋酸钠、0.7毫摩尔苯基溴乙炔,1.0毫升甲基叔丁基醚作为溶剂, 在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加入5ml 水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸镁干燥, 过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗脱液为石 油醚,得到目标产物,产率49%。
[0089]
所得目标产物的氢谱图和碳谱图分别如图13和图14所示,结构 表征数据如下所示:
[0090]1h nmr(400mhz,cdcl3)δ7.24-7.15(m,8h),7.07-7.02(m,3h), 6.99-6.97(m,1h),6.73-6.72(m,2h),6.52(s,1h),2.14(s,3h);
[0091]
13
c nmr(100mhz,cdcl3)δ138.6,138.3,134.9,132.8,132.2, 131.0,130.8,129.3,128.6,128.3,128.1,128.0,127.6,127.2,126.7, 125.8,112.1,97.7,21.1;
[0092]
ir:ν
max
(kbr)=3050,2918,2851,1593,1537,1478,1390,1339, 1183,1025,913,762,692,534cm-1
;
[0093]
hrms(esi)m/z:calcd for c
23h19
brn[m+h]
+
,388.0695;found 388.0694.
[0094]
经以上数据推断目标产物的结构如下:
[0095][0096]
实施例6
[0097]
在反应管中加入0.1毫摩尔n-异丙基-3-氯-4-氟苯胺、0.01毫摩尔 氯化钯、0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16 毫摩尔醋酸钠、0.7毫摩尔苯基溴乙炔,1.0毫升甲基叔丁基醚作为溶 剂,在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加入5 ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸镁干 燥,过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗脱液 为石油醚,得到目标产物,产率42%。
[0098]
所得目标产物的氢谱图和碳谱图分别如图15和图16所示,结构 表征数据如下所示:
[0099]1h nmr(400mhz,cdcl3)δ7.30-7.22(m,6h),7.16-7.14(m,2h), 7.06-7.04(m,2h),6.98(dd,j=6.4,2.4hz,1h),6.93(t,j=8.6hz,1h), 6.82-6.78(m,1h),6.52(s,1h);
[0100]
13
c nmr(100mhz,cdcl3)δ157.0(d,j=249.1hz),135.1,135.0, 132.9,131.6,130.8,130.7,130.4,128.8,128.4(d,j=7.5hz),128.3, 128.0,127.8,127.3,121.1(d,j=18.7hz),116.4(d,j=22.1hz),112.6, 98.3;
[0101]
ir:ν
max
(kbr)=3067,2912,2847,1703,1554,1493,1337,1175, 1070,831,768,694,635,526,441cm-1
;
[0102]
hrms(esi)m/z:calcd for c
22h15
brclfn[m+h]
+
,426.0055; found 426.0050.
[0103]
经以上数据推断目标产物的结构如下:
[0104][0105]
实施例7
[0106]
在反应管中加入0.1毫摩尔n-异丙基苯胺、0.01毫摩尔氯化钯、 0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫摩尔醋 酸钠、0.7毫摩尔1-(溴乙炔基)-4-甲苯,1.0毫升甲基叔丁基醚作 为溶剂,在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加 入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸 镁干燥,过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗 脱液为石油醚,得到目标产物,产率62%。
[0107]
所得目标产物的氢谱图和碳谱图分别如图17和图18所示,结构 表征数据如下所示:
[0108]1h nmr(400mhz,cdcl3)δ7.21-7.14(m,3h),7.05-7.00(m,4h), 6.98-6.96(m,2h),6.95-6.91(m,4h),6.49(s,1h),2.28(s,3h),2.27(s, 3h);
[0109]
13
c nmr(100mhz,cdcl3)δ138.6,137.0,136.5,134.8,132.6, 130.6,129.3,128.8,128.7,128.6,128.5,128.5,128.0,127.2,111.8,97.6, 21.2,21.1;
[0110]
ir:ν
max
(kbr)=3058,2920,2855,1542,1494,1448,1340,1180, 1115,1023,941,820,777,696,600,517cm-1
;
[0111]
hrms(esi)m/z:calcd for c
24h21
brn[m+h]
+
,402.0852;found 402.0850.
[0112]
经以上数据推断目标产物的结构如下:
[0113][0114]
实施例8
[0115]
在反应管中加入0.1毫摩尔n-异丙基苯胺、0.01毫摩尔氯化钯、 0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫摩尔醋 酸钠、0.7毫摩尔1-(溴乙炔基)-4-氯苯,1.0毫升甲基叔丁基醚作 为溶剂,在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加 入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸 镁干燥,过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗 脱液为石油醚,得到目标产物,产率56%。
[0116]
所得目标产物的氢谱图和碳谱图分别如图19和图20所示,结构 表征数据如下所示:
[0117]1h nmr(400mhz,cdcl3)δ7.25-7.18(m,5h),7.16-7.13(m,2h), 7.08-7.05(m,2h),
6.97-6.93(m,2h),6.92-6.90(m,2h),6.52(s,1h);
[0118]
13
c nmr(100mhz,cdcl3)δ137.9,134.0,133.4,132.9,131.9, 131.8,130.4,129.8,129.2,129.0,128.6,128.3,128.1,127.8,112.6,98.2;
[0119]
ir:ν
max
(kbr)=2923,2852,1591,1481,1341,1275,1081,1091, 1012,889,830,743,640,500,445cm-1
;
[0120]
hrms(esi)m/z:calcd for c
22h15
brcl2n[m+h]
+
,441.9759;found 441.9757.
[0121]
经以上数据推断目标产物的结构如下:
[0122][0123]
实施例9
[0124]
在反应管中加入0.1毫摩尔n-异丙基苯胺、0.01毫摩尔氯化钯、 0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫摩尔醋 酸钠、0.7毫摩尔1-(溴乙炔基)-苯甲醛,1.0毫升甲基叔丁基醚作 为溶剂,在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加 入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸 镁干燥,过滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗 脱液为体积比20:1的石油醚:乙酸乙酯混合溶剂,得到目标产物,产 率53%。
[0125]
所得目标产物的氢谱图和碳谱图分别如图21和图22所示,结构 表征数据如下所示:
[0126]1h nmr(400mhz,cdcl3)δ9.96(s,1h),9.93(s,1h),7.74(d,j= 8.0hz,2h),7.70(d,j=8.4hz,2h),7.32(d,j=8.4hz,2h),7.30-7.22 (m,3h),7.18(d,j=8.0hz,2h),6.99-6.96(m,2h),6.71(s,1h);
[0127]
13
c nmr(100mhz,cdcl3)δ191.7,191.5,137.7,137.5,136.6, 134.9,134.5,134.5,132.7,131.1,129.5,129.3,129.1,128.6,128.5, 128.3,114.4,99.5;
[0128]
ir:ν
max
(kbr)=2922,2849,2735,1695,1600,1494,1344,1299, 1212,1169,834,728,503cm-1
;
[0129]
hrms(esi)m/z:calcd for c
24h17
brno2[m+h]
+
,430.0437;found 430.0433.
[0130]
经以上数据推断目标产物的结构如下:
[0131][0132]
实施例10
[0133]
在反应管中加入0.1毫摩尔n-异丙基苯胺、0.01毫摩尔氯化钯、 0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫摩尔醋 酸钠、0.7毫摩尔1-(溴乙炔基)-3-甲苯,1.0毫升甲基叔丁基醚作 为溶剂,在100℃下转速700rpm下搅拌反应24小时;停止搅拌,加 入5ml水,用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸 镁干燥,过滤,减压浓
缩,再通过柱层析分离纯化,所用的柱层析洗 脱液为石油醚,得到目标产物,产率48%。
[0134]
所得目标产物的结构表征数据如下所示:
[0135]1h nmr(400mhz,cdcl3)δ7.17-7.13(m,3h),7.10-7.06(m,1h), 7.04-6.99(m,3h),6.97-6.91(m,5h),6.77(d,j=7.6hz,1h),6.52(s, 1h),2.23(s,3h),2.21(s,3h);
[0136]
13
c nmr(100mhz,cdcl3)δ138.5,137.6,137.2,134.9,132.8, 132.0,131.5,130.8,129.4,128.7,128.5,128.0,127.9,127.8,127.5, 127.5,127.3,125.7,112.1,97.6,21.3,21.3;
[0137]
ir:ν
max
(kbr)=3045,2921,2855,1560,1490,1331,1167,1085, 962,901,781,702,643,533,441cm-1
;
[0138]
hrms(esi)m/z:calcd for c
24h21
brn[m+h]
+
,402.0852;found 402.0850.
[0139]
经以上数据推断目标产物的结构如下:
[0140][0141]
实施例11
[0142]
在反应管中加入0.1毫摩尔n-异丙基苯胺、0.01毫摩尔氯化钯、 0.02毫摩尔二苯基磷酸、0.14毫摩尔一水合氢氧化锂、0.16毫摩尔醋 酸钠、0.7毫摩尔苯基氯乙炔,1.0毫升甲基叔丁基醚作为溶剂,在 100℃下转速700rpm下搅拌反应24小时;停止搅拌,加入5ml水, 用乙酸乙酯萃取3次,合并有机相并使用0.5g无水硫酸镁干燥,过 滤,减压浓缩,再通过柱层析分离纯化,所用的柱层析洗脱液为石油 醚,得到目标产物,产率51%。
[0143]
所得目标产物的结构表征数据如下所示:
[0144]1h nmr(400mhz,cdcl3)δ7.23-7.13(m,11h),7.06-7.04(m, 2h),6.95-6.93(m,2h),6.47(s,1h);
[0145]
13
c nmr(100mhz,cdcl3)δ138.3,133.9,132.2,130.9,130.6, 130.3,128.8,128.7,128.7,128.0,127.7,127.4,127.2,126.8,112.2, 109.9;
[0146]
ir:ν
max
(kbr)=2997,2892,2824,1636,1541,1479,1344,1221, 1096,997,936,789,726,672cm-1
;
[0147]
hrms(esi)m/z:calcd for c
22h17
cln[m+h]
+
,330.1044;found 330.1042.
[0148]
经以上数据推断目标产物的结构如下:
[0149][0150]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不 受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下 所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都 包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1