一种蛋白纳米结构及其自组装方法和应用
1.本发明属于纳米材料技术领域,具体涉及一种体相纳米气泡调控蛋白自组装纳米颗粒和纳米纤维,及其自组装制备方法和应用。
背景技术:
2.纳米颗粒和纳米纤维是包封具有生物活性的功能因子或药物的重要递送体系,近年来受到研究者的广泛关注。纳米尺寸效应给予了颗粒和纤维更加优良的稳定性、提高了两者在胃肠道消化过程中的滞留时间、增加了两者的组织穿透性和被上皮细胞的摄取能力。然而,不同纳米结构的消化和吸收行为具有明显差异,因此选择合适的纳米结构在改善功能因子或药物的释放和吸收过程具有重要意义。与化学合成材料相比,天然生物基材料制备的纳米颗粒或纳米纤维具有较低的毒性、良好的生物相容性和突出的生物可降解性,而蛋白质作为一种天然的两亲性生物材料是制备纳米颗粒和纳米纤维的理想原材料之一。
3.实心纳米颗粒和空心纳米颗粒是两种常见的纳米颗粒类型。研究表明,相较于实心纳米颗粒,空心纳米颗粒具有更高的包埋效率和更加突出的缓释效果,但与此同时空心纳米颗粒的制备难度也更高。在空心纳米颗粒的制备过程中,需要添加多种化学原料用于在纳米颗粒内部构建空腔并用毒性强烈的试剂将纳米颗粒的内核去除,通常制备工艺较为繁琐,制备周期长。因此,寻求一种毒性低、制备工艺简单、制备周期短的蛋白空心纳米结构制备方法是亟待解决的问题。
4.目前,通常采用静电纺丝法、化学蒸汽沉积法和自组装法制备纳米纤维。相较于实心纳米纤维,空心纳米纤维具有更大的比表面积和更加广泛的应用。然而,采用静电纺丝法制备的纳米纤维通常堆叠在一起呈现薄膜状,且大多难溶于水;采用化学蒸汽沉积法的反应温度高,不适用于生物基材料;单一自组装法的反应温度适中,适用于生物基材料,但形成的纳米纤维通常为实心。因此,寻求一种调控生物基材料自组装过程,并最终形成空心纳米纤维的方法是亟待解决的问题。
技术实现要素:
5.本发明公开了一种利用体相纳米气泡调控自组装蛋白纳米结构的制备方法,具体公开了一种利用体相纳米气泡调控蛋白质自组装形成核壳纳米颗粒和空心纳米纤维的制备方法。
6.为实现上述目的,本发明采用的技术方案包括:(1)提供一种利用体相纳米气泡形成核壳结构蛋白纳米颗粒的制备方法,该方法利用体相纳米气泡同时具有的作为气体的疏水特性和气泡表面携带电荷而具有的亲水特性,以及水溶性蛋白天然具有的两亲性和在气-液界面易于吸附的特性,通过调节静电相互作用力和疏水相互作用力的大小,促使蛋白去部分折叠化,并吸附在体相纳米气泡表面,形成具有不同纳米尺寸的核壳结构纳米颗粒。
7.具体的,将水溶性蛋白溶液与纳米气泡水溶液均匀混合,得到水溶性蛋白浓度在
40 mg/ml以下,纳米气泡的浓度在1.4
×
10^8 个/ml以上的混合溶液;调节ph至3~7中的任一非等电点,在低于蛋白的变性温度下,蛋白部分去折叠化,并吸附在体相纳米气泡表面,得到具有核壳结构的蛋白纳米颗粒溶液。
8.单独球状蛋白质在气泡影响下会产生部分去折叠化,并吸附在气泡表面形成纳米颗粒,但是这种去折叠化不足以让整体结构稳定,因此本发明还可以采用加热方式扩大蛋白质的去折叠化程度,稳定整体结构。
9.另外还可以通过调整反应体系中蛋白质的浓度、体相纳米气泡的浓度、ph值和离子强度(0~400 mmol/l),对体相纳米气泡与蛋白之间的静电相互作用力和疏水相互作用力大小进行调节,改变体相纳米气泡界面处蛋白的吸附量、吸附强度和吸附稳定性。
10.(2)提供一种利用体相纳米气泡形成空心结构纳米纤维的制备方法,通过加热使核壳结构纳米颗粒完全变性,并在远离蛋白质等电点的ph值处发生蛋白自组装,形成具有不同纳米尺寸的空心结构纳米纤维。
11.具体的,将核壳结构蛋白纳米颗粒的溶液的ph值调节至2.0~3.0或6.0~7.0,均匀加热至变性温度以上,冷却后获得具有空心结构的蛋白纳米纤维。
12.在某些实施例中,所述纳米气泡水溶液通过以下方法制备得到:1)将超纯水置于密闭容器中,并将惰性气体缓慢通入超纯水,使得水中的惰性气体含量达到饱和;2)降低密闭容器的压力,再逐渐加压,经过反复减压和加压,在溶液中生成体相纳米气泡,得到纳米气泡水溶液。
13.通常的,将惰性气体通入超纯水中,保持10~30 min;所述超纯水的电导率为18.2 mω
·
cm;所述惰性气体为氢气、氮气、氧气、纯净空气中的至少一种;更为优选的,所述惰性气体为纯净空气。
14.为了在超纯水中制备相应气体类型的体相纳米气泡,反复减压和加压程序为:降低密闭容器的压力至4.0~10.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡。
15.进一步地,反复减压和加压程序为:密闭容器中的压力降低至4.5~5.5 kpa,反复减压和加压混合;更为优选的,所述密闭容器中的压力降低至5.0 kpa,以获得气泡尺寸更小、尺寸分布更均一、气泡浓度更高的体相纳米气泡溶液。
16.为了将蛋白质充分溶解和分散在溶液中,并除去溶液中未溶解的蛋白质聚集体,所述水溶性蛋白溶液通过一下方法得到:将蛋白与超纯水充分混合,在15~25 ℃搅拌2 h,之后于2~8 ℃静置12~36 h,使得蛋白充分水化,随后于4~8 ℃下离心20~40 min。
17.为了避免纳米气泡的浓度在混合过程中显著降低,影响核壳结构蛋白纳米颗粒的形成,将纳米气泡水溶液逐滴滴加至水溶性蛋白溶液中。
18.本发明还提供上述方法制备得到的自组装蛋白纳米结构,所述核壳结构自组装蛋白纳米颗粒的水合直径为223.9~361.7 nm,ζ电位值为-31.7~24.3 mv。所述空心自组装蛋白纳米纤维的直径为7.8~16.8 nm,长度为355.2~1741.5 nm。
19.本发明还提供上述自组装蛋白纳米结构于食品、医药或化妆品领域中的应用。
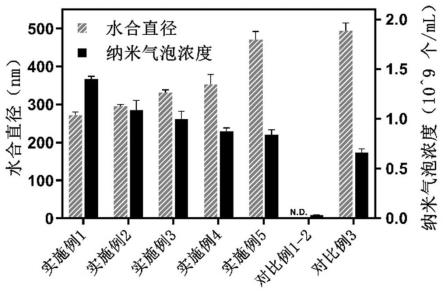
20.与现有技术相比,本发明具有如下有益效果:(1)本发明调控自组装蛋白纳米结构的方法中,采用体相纳米气泡诱导蛋白去折
叠化,并在气-液界面处自组装形成核壳结构,体相纳米气泡由通入液体的气体在压力变化时经气泡成核过程形成,自身绿色无毒,不存在安全问题。
21.(2)本发明调控自组装蛋白纳米结构的方法中,蛋白具有广泛来源,成本低廉,利用体相纳米气泡同时具有的作为气体的疏水特性,以及气泡表面携带电荷而具有的亲水特性,结合蛋白质固有的两亲性和在气-液界面易于吸附的特性,自发吸附在体相纳米气泡表面,形成具有不同纳米尺寸的核壳结构纳米颗粒。
22.(3)本发明调控自组装蛋白纳米结构的方法中,形成的核壳结构纳米颗粒主要通过静电相互作用力和疏水相互作用力来稳定,辅以氢键,可以通过调整反应体系中体相纳米气泡的浓度、蛋白质的浓度、ph值、离子强度和反应温度,改变溶液中的体相纳米气泡含量、体相纳米气泡气-液界面处蛋白的吸附量、吸附强度和吸附稳定性,控制形成的核壳结构纳米颗粒的大小和稳定性。
23.(4)本发明调控自组装蛋白纳米结构的方法中,形成空心结构纳米纤维的反应底物基于上述核壳结构纳米颗粒,不引入其它物质,制备过程具有连续性。
24.(5)本发明调控自组装蛋白纳米结构的方法中,形成的空心结构纳米纤维主要通过疏水相互作用促进蛋白聚集,通过静电相互作用促进纤维结构有序生长,可以通过调整反应体系中蛋白质的浓度、体相纳米气泡的浓度、ph值、离子强度和反应温度,改变纤维的长度、直径和生长速度。
25.(6)本发明调控自组装蛋白纳米结构的方法,制备过程简单,容易操作,不需要复杂的设备,成本低廉,安全可靠,易于推广。
附图说明
26.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是申请中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可根据这些附图获得其他的附图。
27.图1是本技术实施例1~5和对比例1~3中分别采用不同压力混合方式制备获得的体相纳米气泡的平均水合直径和平均体相纳米气泡浓度。
28.图2是本技术实施例1和对比例1中不同ph值下蛋白纳米颗粒的平均水合直径。
29.图3是本技术实施例1和对比例1中不同ph值下蛋白纳米颗粒的平均ζ电位值。
30.图4是本技术实施例1~5和对比例1~3中,在ph值为6.0时形成的核壳或非核壳结构蛋白纳米颗粒的平均水合直径以及体相纳米气泡与超纯水采用相同混合比例混合后在相同ph值下溶液中的平均体相纳米气泡浓度。
31.图5是本技术实施例1中ph值为4.0时体相纳米气泡诱导形成的核壳结构蛋白纳米颗粒的透射电镜示意图。
32.图6是本技术实施例1中ph值为6.0时体相纳米气泡诱导形成的核壳结构蛋白纳米颗粒的透射电镜示意图。
33.图7是本技术实施例1中ph值为2.0时形成的空心结构蛋白纳米纤维的透射电镜示意图。
34.图8是本技术实施例1中ph值为7.0时形成的空心结构蛋白纳米纤维的透射电镜示
意图。
具体实施方式
35.通过应连同所附图示一起阅读的以下具体实施方式将更完整地理解本发明。本文中揭示本发明的详细实施例;然而,应理解,所揭示的实施例仅具本发明的示范性,本发明可以各种形式来体现。因此,本文中所揭示的特定功能细节不应解释为具有限制性,而是仅解释为权利要求书的基础且解释为用于教示所述领域的技术人员在事实上任何适当详细实施例中以不同方式采用本发明的代表性基础。
36.体相纳米气泡是尺寸在50~1000 nm范围内的游离在体相溶液中的类球状气泡,能够在水溶液中做稳定的布朗运动,并且在数十天至数个月的静置过程中保持尺寸和浓度不发生显著性变化。体相纳米气泡具有稳定性、气体溶解量高,比表面积、ζ电位绝对值大等特点。通过研究发现,利用体相纳米气泡的物理性质,同时选择恰当的反应条件,能够改变蛋白质分子的结构,例如通过改变空间构象影响酶活力、通过静电相互作用形成蛋白颗粒组装体或改变蛋白纤维的表面形貌。本案发明人经长期研究和大量实践,得以提出本发明的技术方案,其主要是针对现有蛋白质纳米颗粒和纳米纤维的制备方法中存在的缺陷,通过研制一种体相纳米气泡调控的自组装蛋白纳米结构的方法,使制备流程简单,且使制备的自组装核壳结构蛋白纳米颗粒和空心结构蛋白纳米纤维具有可控的水合直径、长度和直径,较高的稳定性,良好的生物相容性等优点。如下将对该技术方案、其实施过程及原理作进一步的解释说明。
37.本发明的反应原理为利用体相纳米气泡同时具有的作为气体的疏水特性和气泡表面携带电荷而具有的亲水特性,以及蛋白天然具有的两亲性和在气-液界面易于吸附的特性,通过调节静电相互作用力和疏水相互作用力的大小,促使蛋白去折叠化,并吸附在体相纳米气泡表面,形成具有不同纳米尺寸的核壳结构纳米颗粒。通过短时加热使蛋白质部分变性,提高核壳结构纳米颗粒的稳定性。通过延长加热时间,使核壳结构纳米颗粒完全变性,并在远离蛋白质等电点的ph值处发生蛋白质自组装,形成具有不同纳米尺寸的空心结构纳米纤维。
38.本发明实施例的一个方面提供的一种自组装核壳结构蛋白纳米颗粒和一种空心结构蛋白纳米纤维的制备方法,包括:制备体相纳米气泡,并使含有体相纳米气泡的溶液与蛋白均匀混合;调节反应体系的ph值、蛋白质浓度和体相纳米气泡浓度等因素,改变蛋白与体相纳米气泡之间的疏水相互作用和静电相互作用强度,并使蛋白稳定地吸附在体相纳米气泡的气-液界面处,形成自组装核壳结构蛋白纳米颗粒;短时加热所获混合液,使蛋白部分变性,形成稳定的自组装核壳结构蛋白纳米颗粒;升高反应温度和延长加热时间,使蛋白完全变性,形成自组装空心结构蛋白纳米纤维。
39.在一些优选实施例中,所述的制备方法,包括以下步骤:(1)将超纯水置于密闭容器中,并将惰性气体缓慢通入超纯水,使得水中的惰性气体含量达到饱和;
(2)降低密闭容器的压力,再逐渐加压,经过反复减压和加压混合,在溶液中生成体相纳米气泡;(3)将蛋白与水充分混合,离心去除不溶性聚集体,得到可溶性蛋白溶液;(4)将步骤(3)获得的蛋白溶液与步骤(2)中优选的体相纳米气泡水溶液均匀混合,得到水溶性蛋白浓度在40 mg/ml以下,纳米气泡的浓度在1.4
×
10^8 个/ml以上的混合溶液;调节ph至3~7中的任一非等电点,在低于蛋白的变性温度下反应,冷却,获得具有核壳结构的蛋白纳米颗粒溶液;(5)调节步骤(4)获得的含有核壳结构蛋白纳米颗粒的溶液ph值,并加热搅拌反应,冷却,获得具有空心结构的豌豆蛋白纳米纤维;在一些优选实施例中,所述的自组装核壳结构蛋白纳米颗粒和自组装空心结构蛋白纳米纤维的制备方法,步骤(1)具体包括:将惰性气体以50~350 ml/min的流动速率通入超纯水中,保持10~30 min;在一些更为优选的实施例中,所述超纯水的电导率为18.2 mω
·
cm;优选的,所述惰性气体为氢气、氮气、氧气、纯净空气中的至少一种;在一些更为优选的实施例中,所述惰性气体为纯净空气。
40.在一些优选实施例中,所述的自组装核壳结构蛋白纳米颗粒和自组装空心结构蛋白纳米纤维的制备方法,步骤(2)具体包括:降低密闭容器的压力至4.0~10.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡;优选的,所述密闭容器中的压力降低至4.5~5.5 kpa,反复减压和加压混合;在一些更为优选的实施例中,所述密闭容器中的压力降低至5.0 kpa。
41.在一些优选实施例中,所述的自组装核壳结构蛋白纳米颗粒和自组装空心结构蛋白纳米纤维的制备方法,步骤(3)具体包括:将蛋白与超纯水充分混合,在15~25 ℃搅拌2 h,之后于2~8 ℃静置12~36 h,使得蛋白充分水化,随后于4~8 ℃下离心;在一些更为优选的实施例中,所述蛋白溶液中蛋白的浓度为0.4~2.0 mg/ml。
42.在一些优选实施例中,所述的自组装核壳结构蛋白纳米颗粒和自组装空心结构蛋白纳米纤维的制备方法,步骤(4)具体包括:将步骤(2)中优选的体相纳米气泡水溶液逐滴滴加至持续搅拌的步骤(3)获得的蛋白溶液中,形成含有体相纳米气泡的蛋白溶液,之后调节溶液的ph值,均匀搅拌,加热处理并冷却,获得具有核壳结构的蛋白纳米颗粒;优选的,所述混合水溶液的离子强度为0~400 mmol/l;优选的,所述优选的体相纳米气泡水溶液的滴加速度为0.2~4.0 ml/min;在一些更为优选的实施例中,所述混合水溶液中蛋白与体相纳米气泡的混合体积比为2:1~1:3;在一些更为优选的实施例中,所述混合水溶液的ph值为3.0~4.0和6.0~7.0;在一些更为优选的实施例中,所述加热温度为30~55 ℃,加热时间为5~15 min;在一些更为优选的实施例中,所述搅拌转速为50~350 rpm;在一些更为优选的实施例中,所述制备方法包括:采用冰水浴将加热后的反应液
冷却至15~25 ℃。
43.在一些优选实施例中,所述的自组装核壳结构蛋白纳米颗粒和自组装空心结构蛋白纳米纤维的制备方法,步骤(5)具体包括:将步骤(4)获得的含有核壳结构蛋白纳米颗粒的溶液的ph值调节至2.0~3.0或6.0~7.0,加热同时缓慢搅拌,冷却,获得具有空心结构的蛋白纳米纤维;在一些更为优选的实施例中,所述搅拌转速为50~350 rpm;在一些更为优选的实施例中,所述加热温度为70~95 ℃;在一些更为优选的实施例中,所述加热时间为18~36 h。
44.在一些更为优选的实施例中,所述制备方法包括:采用冰水浴将加热后的反应液冷却至15~25 ℃。
45.本发明实施例的另一个方面还提供了一种自组装核壳结构蛋白纳米颗粒和一种自组装空心结构蛋白纳米纤维,是由上述的方法制备而成。
46.在一些优选实施例中,所述自组装核壳结构蛋白纳米颗粒的水合直径为223.9~361.7 nm,ζ电位为-31.7~24.3 mv。
47.在一些优选实施例中,所述自组装空心结构蛋白纳米纤维的直径为7.8~16.8 nm,长度为355.2~1741.5 nm。
48.本发明实施例还提供了所述核壳结构自组装蛋白纳米颗粒和空心自组装蛋白纳米纤维于食品、医药或化妆品领域中的应用。
49.其中,在一些更为具体的实施案例之中,本发明提供的一种自组装核壳结构蛋白纳米颗粒和一种自组装空心结构蛋白纳米纤维的制备方法,包括一些步骤:(1)将电导率为18.2 mω
·
cm的超纯水置于密闭容器中,并将纯净空气以50~350 ml/min的流动速率通入超纯水中,保持10~30 min,使得水中的纯净空气含量达到饱和。
50.(2)降低密闭容器的压力至5.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合50次,在溶液中生成体相纳米气泡。
51.(3)将蛋白与超纯水充分混合,在15~25 ℃搅拌2 h,之后于2~8 ℃静置12~36 h,使得蛋白充分水化,随后于4~8 ℃下离心,收集得到1.2~2.0 mg/ml的可溶性蛋白溶液。
52.(4)将步骤(2)中的体相纳米气泡水溶液以0.2~4.0 ml/min的速度逐滴滴加至持续搅拌的步骤(3)获得的蛋白溶液中,形成含有体相纳米气泡的蛋白溶液,其中蛋白与体相纳米气泡的混合体积比为2:1~1:3,添加适量nacl使得溶液的离子强度为0~400 mmol/l,之后调节溶液的ph值至3.0~4.0或6.0~7.0,在30~55 ℃下加热5~15 min,然后采用冰水浴将加热后的反应液冷却至15~25 ℃,得到稳定的自组装核壳结构蛋白纳米颗粒。
53.(5)将步骤(4)获得的含有核壳结构豌豆蛋白纳米颗粒的溶液的ph值调节至2.0~3.0或6.0~7.0,在70~95 ℃下加热24 h,然后采用冰水浴将加热后的反应液冷却至15~25 ℃,获得具有空心结构的豌豆蛋白纳米纤维。
54.为使本发明的上述目的、特征和优点能够更为明显易懂,下面结合附图对本发明的具体实施做详细的说明。
55.实施例1(1)将电导率为18.2 mω
·
cm的超纯水置于密闭容器中,并将纯净空气以350 ml/min的流动速率通入超纯水中,保持10 min,使得水中的纯净空气含量达到饱和。
56.(2)降低密闭容器的压力至5.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡。
57.(3)将豌豆分离蛋白与超纯水充分混合,在25 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为1.2 mg/ml的溶液,之后于4 ℃静置24 h,使得豌豆分离蛋白充分水化,随后于4 ℃和8000 rpm下离心20 min,收集得到可溶性豌豆分离蛋白溶液。
58.(4)将步骤(2)中的体相纳米气泡水溶液以2.0 ml/min的速度逐滴滴加至持续搅拌的步骤(3)获得的豌豆分离蛋白溶液中,形成含有体相纳米气泡的豌豆分离蛋白溶液,其中豌豆分离蛋白与体相纳米气泡的混合体积比为1:1,之后调节溶液的ph值至4.0、6.0、7.0,在55 ℃下加热5 min,搅拌转速为350 rpm,然后采用冰水浴将加热后的反应液冷却至25 ℃,获得稳定的自组装核壳结构蛋白纳米颗粒。
59.(5)将步骤(4)获得的含有核壳结构豌豆蛋白纳米颗粒的溶液的ph值调节至2.0或7.0,在85 ℃下加热24 h同时以350 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至25 ℃,获得具有空心结构的豌豆蛋白纳米纤维。
60.如图1可以看出,相较于对比例和其它实施例,实施例1采用的优选的压力参数制备的体相纳米气泡水合直径更小,气体浓度更高,更加有利于形成核壳结构蛋白纳米颗粒,如图2可以看出,随着含有体相纳米气泡的豌豆分离蛋白溶液ph值降低,溶液中蛋白纳米颗粒的平均水合直径从223.9 nm增加到361.7 nm,显著高于对比例中相同ph值下蛋白纳米颗粒的平均水合直径,如图3可以看出,随着含有体相纳米气泡的豌豆分离蛋白溶液ph值降低,溶液中蛋白纳米颗粒的平均ζ电位值从-31.7 mv增加到24.3 mv,显著低于对比例中相同ph值下蛋白纳米颗粒的平均ζ电位值。
61.如图4可以看出,相较于对比例1和对比例2,实施例1和实施例2添加体相纳米气泡后在溶液中形成了核壳结构蛋白纳米颗粒,随着溶液中蛋白浓度的升高,实施例2~5形成的核壳结构蛋白纳米颗粒的水合直径显著高于实施例1,在对比例3中,当混合溶液中的体相纳米气泡浓度不足1.4
×
10^8 个/ml时,蛋白纳米颗粒的水合直径没有明显升高,此时核壳结构蛋白纳米颗粒难以形成,此外,实施例1~5的结果还表明,体相纳米气泡诱导的核壳结构蛋白纳米颗粒形成过程适用于多种类型的蛋白质。如图5和图6可以看出,在ph分别为4.0和6.0条件下形成的蛋白纳米颗粒呈现核壳结构,透射电镜观察下的颗粒尺寸与对应的平均水合直径接近。
62.如图7和图8可以看出,在ph值分别为2.0和7.0条件下核壳结构蛋白纳米颗粒经过加热反应形成了具有空心结构的豌豆蛋白纳米纤维,ph值为2.0时形成的纤维直径为10.1~16.8 nm,长度为1107.1~1741.5 nm,ph值为7.0时,形成的纤维直径为7.8~14.6 nm,长度为355.2~756.4 nm。
63.实施例2(1)将电导率为18.2 mω
·
cm的超纯水置于密闭容器中,并将纯净空气以200 ml/min的流动速率通入超纯水中,保持20 min,使得水中的纯净空气含量达到饱和。
64.(2)降低密闭容器的压力至4.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡。
65.(3)将豌豆分离蛋白与超纯水充分混合,在20 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为3.0 mg/ml的溶液,之后于8 ℃静置36 h,使得豌豆分离蛋白充分水化,随后
于4 ℃和4000 rpm下离心40 min,收集得到可溶性豌豆分离蛋白溶液。
66.(4)将步骤(2)中的体相纳米气泡水溶液以1.0 ml/min的速度逐滴滴加至持续搅拌的步骤(3)获得的豌豆分离蛋白溶液中,形成含有体相纳米气泡的豌豆分离蛋白溶液,其中豌豆分离蛋白与体相纳米气泡的混合体积比为1:2,添加适量nacl使得溶液的离子强度为100 mmol/l,之后调节溶液的ph值至6.0,在50 ℃下加热7 min,搅拌转速为350 rpm,然后采用冰水浴将加热后的反应液冷却至20 ℃,获得稳定的自组装核壳结构蛋白纳米颗粒。
67.(5)将步骤(4)获得的含有核壳结构豌豆蛋白纳米颗粒的溶液的ph值调节至2.0,在95 ℃下加热18 h同时以300 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至25 ℃,获得直径为11.37~17.27 nm,长度为1587.7~2124.6 nm的空心结构豌豆蛋白纳米纤维。
68.实施例3(1)将电导率为18.2 mω
·
cm的超纯水置于密闭容器中,并将纯净空气以50 ml/min的流动速率通入超纯水中,保持30 min,使得水中的纯净空气含量达到饱和。
69.(2)降低密闭容器的压力至6.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡。
70.(3)将大豆分离蛋白与超纯水充分混合,在15 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为10 mg/ml的溶液,之后于4 ℃静置12 h,使得大豆分离蛋白充分水化,随后于4 ℃和6000 rpm下离心30 min,收集得到可溶性大豆分离蛋白溶液。
71.(4)将步骤(2)中的体相纳米气泡水溶液以0.2 ml/min的速度逐滴滴加至持续搅拌的步骤(3)获得的大豆分离蛋白溶液中,形成含有体相纳米气泡的大豆分离蛋白溶液,其中大豆分离蛋白与体相纳米气泡的混合体积比为2:1,添加适量nacl使得溶液的离子强度为200 mmol/l,之后调节溶液的ph值至6.0,在30 ℃下加热15 min,搅拌转速为350 rpm,然后采用冰水浴将加热后的反应液冷却至15 ℃,获得稳定的自组装核壳结构蛋白纳米颗粒。
72.(5)将步骤(4)获得的含有核壳结构大豆蛋白纳米颗粒的溶液的ph值调节至2.0,在75 ℃下加热30 h同时以50 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至15 ℃,获得直径为12.7~17.8 nm,长度为1864.8~2241.4 nm的空心结构大豆蛋白纳米纤维。
73.实施例4(1)将电导率为18.2 mω
·
cm的超纯水置于密闭容器中,并将纯净空气以175 ml/min的流动速率通入超纯水中,保持15 min,使得水中的纯净空气含量达到饱和。
74.(2)降低密闭容器的压力至8.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡。
75.(3)将鹰嘴豆蛋白与超纯水充分混合,在25 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为20 mg/ml的溶液,之后于5 ℃静置24 h,使得鹰嘴豆蛋白充分水化,随后于4 ℃和6000 rpm下离心30 min,收集得到可溶性鹰嘴豆蛋白溶液。
76.(4)将步骤(2)中的体相纳米气泡水溶液以1.0 ml/min的速度逐滴滴加至持续搅拌的步骤(3)获得的鹰嘴豆蛋白溶液中,形成含有体相纳米气泡的鹰嘴豆蛋白溶液,其中鹰嘴豆蛋白与体相纳米气泡的混合体积比为1:3,添加适量nacl使得溶液的离子强度为300 mmol/l,之后调节溶液的ph值至7.0,在45 ℃下加热9 min,搅拌转速为350 rpm,然后采用
冰水浴将加热后的反应液冷却至25 ℃,获得稳定的自组装核壳结构蛋白纳米颗粒。
77.(5)将步骤(4)获得的含有核壳结构鹰嘴豆蛋白纳米颗粒的溶液的ph值调节至2.0,在70 ℃下加热36 h同时以200 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至20 ℃,获得直径为16.4~21.3 nm,长度为2450.2~3517.6 nm的空心结构鹰嘴豆蛋白纳米纤维。
78.实施例5(1)将电导率为18.2 mω
·
cm的超纯水置于密闭容器中,并将纯净空气以200 ml/min的流动速率通入超纯水中,保持20 min,使得水中的纯净空气含量达到饱和。
79.(2)降低密闭容器的压力至10.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡。
80.(3)将乳清分离蛋白与超纯水充分混合,在25 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为120 mg/ml的溶液,之后于4 ℃静置24 h,使得乳清分离蛋白充分水化,随后于4 ℃和8000 rpm下离心20 min,收集得到可溶性乳清分离蛋白溶液。
81.(4)将步骤(2)中的体相纳米气泡水溶液以0.8 ml/min的速度逐滴滴加至持续搅拌的步骤(3)获得的乳清分离蛋白溶液中,形成含有体相纳米气泡的乳清分离蛋白溶液,其中乳清分离蛋白与体相纳米气泡的混合体积比为1:2,添加适量nacl使得溶液的离子强度为400 mmol/l,之后调节溶液的ph值至3.0,在45 ℃下加热9 min,搅拌转速为350 rpm,然后采用冰水浴将加热后的反应液冷却至20 ℃,获得稳定的自组装核壳结构蛋白纳米颗粒。
82.(5)将步骤(4)获得的含有核壳结构乳清蛋白纳米颗粒的溶液的ph值调节至7.0,在85 ℃下加热24 h同时以300 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至15 ℃,获得直径为14.9~21.7 nm,长度为2167.4~3785.9 nm的空心结构乳清蛋白纳米纤维。
83.对比例1(1)将豌豆分离蛋白与电导率为18.2 mω
·
cm的超纯水充分混合,在25 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为1.2 mg/ml的溶液,之后于4 ℃静置24 h,使得豌豆分离蛋白充分水化,随后于4 ℃和8000 rpm下离心20 min,收集得到可溶性豌豆分离蛋白溶液。
84.(2)将超纯水以2.0 ml/min的速度逐滴滴加至持续搅拌的步骤(1)获得的豌豆分离蛋白溶液中,其中豌豆分离蛋白与超纯水的混合体积比为1:1,之后调节溶液的ph值至4.0、6.0、7.0,在55 ℃下加热5 min,搅拌转速为350 rpm,然后采用冰水浴将加热后的反应液冷却至25 ℃,获得豌豆蛋白纳米颗粒。
85.(3)将步骤(2)获得的豌豆蛋白纳米颗粒溶液的ph值调节至2.0或7.0,在85 ℃下加热24 h同时以350 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至25 ℃,获得豌豆蛋白纳米纤维。
86.对比例2(1)将豌豆分离蛋白与电导率为18.2 mω
·
cm的超纯水充分混合,在20 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为3.0 mg/ml的溶液,之后于8 ℃静置36 h,使得豌豆分离蛋白充分水化,随后于4 ℃和4000 rpm下离心40 min,收集得到可溶性豌豆分离蛋白溶液。
87.(2)将超纯水以1.0 ml/min的速度逐滴滴加至持续搅拌的步骤(1)获得的豌豆分
离蛋白溶液中,其中豌豆分离蛋白与超纯水的混合体积比为1:2,添加适量nacl使得溶液的离子强度为100 mmol/l,之后调节溶液的ph值至6.0,在50 ℃下加热7 min,搅拌转速为350 rpm,然后采用冰水浴将加热后的反应液冷却至20 ℃,获得豌豆蛋白纳米颗粒。
88.(3)将步骤(2)获得的豌豆蛋白纳米颗粒溶液的ph值调节至2.0,在95 ℃下加热18 h同时以300 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至25 ℃,获得豌豆蛋白纳米纤维。
89.对比例3(1)将电导率为18.2 mω
·
cm的超纯水置于密闭容器中,并将纯净空气以200 ml/min的流动速率通入超纯水中,保持20 min,使得水中的纯净空气含量达到饱和。
90.(2)降低密闭容器的压力至20.0 kpa,再逐渐加压使容器内部的压力恢复至大气压,经过反复减压和加压混合,在溶液中生成体相纳米气泡。
91.(3)将豌豆分离蛋白与超纯水充分混合,在20 ℃下以500 rpm持续搅拌2 h,配制蛋白质浓度为1.2 mg/ml的溶液,之后于8 ℃静置36 h,使得豌豆分离蛋白充分水化,随后于4 ℃和4000 rpm下离心40 min,收集得到可溶性豌豆分离蛋白溶液。
92.(4)将步骤(2)中的体相纳米气泡水溶液以1.0 ml/min的速度逐滴滴加至持续搅拌的步骤(3)获得的豌豆分离蛋白溶液中,形成含有体相纳米气泡的豌豆分离蛋白溶液,其中豌豆分离蛋白与体相纳米气泡的混合体积比为2:1,添加适量nacl使得溶液的离子强度为100 mmol/l,之后调节溶液的ph值至6.0,在50 ℃下加热7 min,搅拌转速为350 rpm,然后采用冰水浴将加热后的反应液冷却至20 ℃,获得豌豆蛋白纳米颗粒。
93.(5)将步骤(4)获得的豌豆蛋白纳米颗粒溶液的ph值调节至2.0,在95 ℃下加热18 h同时以300 rpm的转速缓慢搅拌,然后采用冰水浴将加热后的反应液冷却至25 ℃,获得豌豆蛋白纳米纤维。
94.综上所述,藉由本发明的上述技术方案获得的一种自组装核壳结构蛋白纳米颗粒和自组装空心结构蛋白纳米纤维具有可控的尺寸,且具有良好的稳定性和安全性;其中,自组装核壳结构蛋白纳米颗粒主要通过疏水相互作用和静电相互作用来稳定,辅以氢键;两种自组装蛋白纳米结构的制备过程简单,具有连续性,容易操作,不引入额外反应底物,不需要复杂的设备,成本低廉,安全可靠,易于推广。
95.此外,本案发明人还参照实施例1~5的方式,以本说明书中列出的其它原料和条件等进行了试验,并同样制得了自组装核壳结构蛋白纳米颗粒和空心结构蛋白纳米纤维。
96.尽管已参考说明性实施例描述了本发明,但所述领域的技术人员将理解,在不背离本发明的精神及范围的情况下可做出各种其它改变、省略及/或添加且可用实质等效物替代所属实施例的元件。另外,可在不背离本发明的范围的情况下做出许多修改以使特定情形或材料适应本发明的教示。因此,本文并不打算将本发明限制于执行本发明的所揭示特定施例,而是打算使本发明将包含归属于所附权利要求书的范围内的所有实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1