不对称的供体-受体型近红外二区探针分子及其制备方法和应用
1.本发明属于有机荧光探针领域,涉及不对称的供体-受体(d-a)型近红外二区探针分子及其制备方法和应用。
背景技术:
2.分子影像学是利用影像技术显示组织、细胞和亚细胞水平的特定分子,对活体生理和病理状态下的观察,进行定性和定量研究的科学,为探索疾病的发生、发展和转化,评价药物的疗效,起到连接分子生物学和临床医学之间的桥梁作用。临床上使用的成像手段包括核磁共振成像(magnetic resonance imaging,mri)、正电子发射断层扫描成像(positron emission tomography,pet)、单光子发射型计算机断层成像(single photon emission computed tomography,spect)、计算机x射线断层成像(computerized tomography,ct)、超声成像(ultrasound,us)以及光学成像(optical imaging,oi)。
3.与传统成像手段相比,光学成像具有高灵敏度、高分辨率、高对比度、实时反馈、无电离辐射、设备简单等优点,成为了生物成像领域发展迅速、应用广泛的成像技术之一。光学成像区域可具体分为可见光区域(400-700nm)、近红外一区(nir-i,700-900nm)和近红外二区(nir-ii,900-1700nm)。
4.目前,近红外一区(nir-i,700-900nm)荧光成像在临床上得到了广泛的应用。nir-i荧光染料吲哚菁绿(icg)和亚甲蓝(mb)被美国食品和药品监督管理局(fda)批准用于临床,在临床诊断上做出了贡献,主要用于心血管造影、淋巴造影、胃肠造影以及肿瘤切除手术等,协助外科医生的诊断和治疗。虽然nir-i成像取得了不错的成果,但仍受到穿透深度的限制。
5.研究发现,近红外二区(nir-ii,1000-1700nm)在活体成像方面显示出优越的成像性能,由于降低了组织的吸收、散射和自荧光增加了成像分辨率和组织穿透深度,显示出更高的穿透深度、分辨率和信噪比(sbr)。
6.nir-ii探针主要包括无机材料(碳纳米管、量子点和稀土掺杂的纳米颗粒)共轭聚合物和有机小分子。然而无机材料与共轭聚合物荧光团具有较差的药代动力学,生物相容性差,这限制了它们在临床上的应用。而有机小分子探针,特别是供体-受体-供体(d-a-d)型结构的小分子,由于分子量小、结构明确、代谢快、生物相容性好,获得了更大的优势,具有临床转换的潜力。
技术实现要素:
7.本发明的技术目的是提供一类近红外二区(nir-ii)探针,其更易代谢,可以有效地用于全身血管成像、淋巴成像、疾病的诊断与检测、肿瘤成像及手术导航等。
8.一方面,本发明提供一类不对称的供体-受体型nir-ii探针分子,其由以下通式1表示:
[0009][0010]
在以上通式1中,
[0011]
环a选自b和b’各自独立地选自各自独立地选自
[0012]
x为s、o、se或nr5;
[0013]
r1选自
[0014]
r2选自
[0015]
其中,r6和r7各自独立地选自h、羟基、氨基(-nh2)、羧基(-cooh)、卤素、羧基c
1-c7烷基、c
1-c8烷基、c
1-c8烷氧基、取代或未取代的c6-c12芳基或者5-12元含有选自n、o、s的杂原子的杂芳基(当所述芳基或杂芳基被取代时,取代基选自c
1-c8烷基、c
1-c8烷氧基、c
1-c8烷基硅基、羟基c
1-c8烷基、氨基c
1-c8烷基、醛基c
1-c8烷基、羧基c
1-c8烷基、磺酸基c
1-c8烷基、巯基c
1-c8烷基或卤代c
1-c8烷基)、-(ch2)n
1-(och2ch2)n
2-r((n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基(-cho)、羧基、巯基(-sh)、炔基(-c≡ch)、叠氮基(-n3)、卤素、及);
[0016]
r8和r9各自独立地选自h、羟基、氨基、羧基、卤素、羧基c
1-c7烷基、c
1-c8烷基、c
1-c8烷氧基、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨
基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及),或者r8和r9与其相连接的c一起形成5-10元含选自n、o和s的杂原子的杂环基;
[0017]
y2选自s、o、se和nr5;
[0018]
r5选自h、c
1-c
12
烷基、c
1-c
12
烷氧基、c
1-c8烷基硅基、羟基c
1-c8烷基、氨基c
1-c8烷基、醛基c
1-c8烷基、羧基c
1-c8烷基、酰基c
1-c8烷基、磺酸基c
1-c8烷基、巯基c
1-c8烷基、卤代c
1-c8烷基、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、
[0019]
及);
[0020]
r3和r4各自独立地选自h、c
1-c
12
烷基、c
1-c
12
烷氧基、c
1-c8烷基硅基、羟基c
1-c8烷基、氨基c
1-c8烷基、醛基c
1-c8烷基、羧基c
1-c8烷基、酰基c
1-c8烷基、磺酸基c
1-c8烷基、巯基c
1-c8烷基、卤代c
1-c8烷基、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及)、-(ch2)n
3-cooch2ch2si(ch3)3(n3为1-10的整数)、取代或未取代的c6-c12芳基或5-12元含有选自n、o、s的杂原子的杂芳基(当所述芳基或杂芳基被取代时,取代基选自c
1-c8烷基、c
1-c8烷氧基、c
1-c8烷基硅基、羟基c
1-c8烷基、氨基c
1-c8烷基、醛基c
1-c8烷基、羧基c
1-c8烷基、磺酸基c
1-c8烷基、巯基c
1-c8烷基或卤代c
1-c8烷基);
[0021]
y为s、o、se或nr5;
[0022]
y1为cr5或n;
[0023]
r5选自h、c
1-c
12
烷基、c
1-c
12
烷氧基、c
1-c8烷基硅基、羟基c
1-c8烷基、氨基c
1-c8烷基、醛基c
1-c8烷基、羧基c
1-c8烷基、酰基c
1-c8烷基、磺酸基c
1-c8烷基、巯基c
1-c8烷基、卤代c
1-c8烷基、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及);
[0024]
d选自如下基团:
[0025][0026]
其中,r
10
至r
46
各自独立选自h、取代或未取代的c
1-c
12
烷基、取代或未取代的c
1-c
12
烷氧基、取代或未取代的c
1-c8烷基硅基、氨基、卤素、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及)、-(ch2)n
2-cooch2ch2si(ch3)3(n2为1-10的整数)、-(ch2)n
4-conhch2ch2so3h(n4为0-10的整数);
[0027]
其中,所述c
1-c
12
烷基、c
1-c
12
烷氧基和c
1-c8烷基硅基的取代基选自羟基、氨基、炔基、叠氮基、巯基、醛基、羧基、磺酸基、卤素、raoc(=o)-、rac(=o)o-、ranhc(=o)-和吡咯烷二酮-nh-,其中ra选自c
1-c8烷基、羟基c
1-c8烷基、氨基c
1-c8烷基、醛基c
1-c8烷基、羧基c
1-c8烷基、磺酸基c
1-c8烷基、炔基c
1-c8烷基、叠氮基c
1-c8烷基、巯基c
1-c8烷基、卤代c
1-c8烷基和-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟
基、甲氧基、醛基、羧基、巯基、炔基、叠氮、卤素、及);
[0028]
或者,r
10
至r
46
各自独立地选自其中r’和r”选自c
1-c8亚烷基,c为h、环状rgd肽c(rgdyk)、c(rgdfk)、c(radyk)、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及)、(ch2ch2o)
n2-r(n2=1-1000的整数,r为c
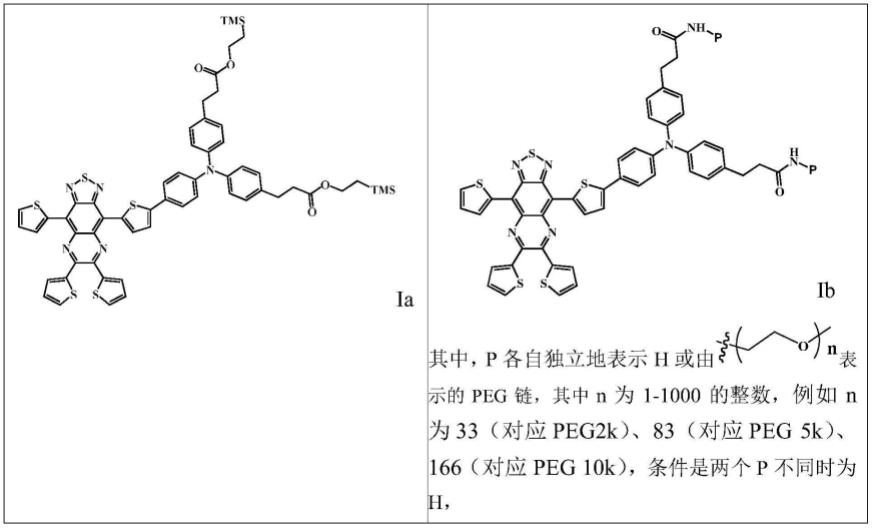
1-c8烷基)、多肽前列腺特异性模抗原多肽分子(psma)基团(所述psma可包括psma-617、psma-11、psma-1007)、奥曲肽基团、单糖及多糖基团(其中,单糖可选自葡萄糖、半乳糖、果糖、阿拉伯糖、鼠李糖、核糖、乳糖及麦芽糖,多糖可为环糊精);d选自含有fv段的分子,例如,d为单抗、双抗、或scfv;
[0029]
或者,r
10
至r
46
各自独立地选自
[0030]
其中r
”’
为c
1-c8亚烷基。
[0031]
在具体实施方式中,所述通式1的探针分子可选自通式i、ii、iii和iv:
[0032][0033]
在以上通式i、ii、iii和iv中,各取代基的定义分别如上文所定义。
[0034]
在具体实施方式中,在通式1中,
[0035]
环a为
[0036]
一组b和b’分别选自以及
[0037]
x为s;
[0038]
r1选自
[0039]
r2选自
[0040]
其中,r6和r7各自独立地选自h、羟基、氨基(-nh2)、羧基(-nh2)、卤素、羧基c
1-c7烷基、c
1-c8烷基、c
1-c8烷氧基、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基(-cho)、羧基、巯基(-sh)、炔基(-c≡ch)、叠氮基(-n3)、卤素、及);
[0041]
r8和r9各自独立地选自h、羟基、氨基、羧基、卤素、羧基c
1-c7烷基、c
1-c8烷基、c
1-c8烷氧基、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及),或者r8和r9与其相邻的c形成5-10元含o的杂环基;
[0042]
r3和r4各自独立地为h或-(ch2)n
3-cooch2ch2si(ch3)3,其中n3为1-10的整数;d选自如下基团:
[0043][0044]
其中,r
10
、r
11
、r
14
、r
15
、r
45
和r
46
各自独立地选自h、取代或未取代的c
1-c
12
烷基、取代或未取代的c
1-c
12
烷氧基、取代或未取代的c
1-c8烷基硅基、氨基、卤素、-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及)、-(ch2)n
2-cooch2ch2si(ch3)3(n2为1-10的整数)、-(ch2)n
4-conhch2ch2so3h(n4为0-10的整数);
[0045]
其中,所述c
1-c
12
烷基、c
1-c
12
烷氧基和c
1-c8烷基硅基的取代基选自羟基、氨基、炔基、叠氮基、巯基、醛基、羧基、磺酸基、卤素、raoc(=o)-、rac(=o)o-、ranhc(=o)-和吡咯烷二酮-nh-,其中ra选自c
1-c8烷基、羟基c
1-c8烷基、氨基c
1-c8烷基、醛基c
1-c8烷基、羧基c
1-c8烷基、磺酸基c
1-c8烷基、炔基c
1-c8烷基、叠氮基c
1-c8烷基、巯基c
1-c8烷基、卤代c
1-c8烷基和-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、);
[0046]
或者,r
10
、r
11
、r
14
、r
15
、r
45
和r
46
各自独立地选自其中r’和r”选自c
1-c8亚烷基,c为h或-(ch2)
n1-(och2ch2)n
2-r(n1=0-10的整数,n2=1-1000的整数,r选自c
1-c8烷基、氨基、羟基、甲氧基、醛基、羧基、巯基、炔基、叠氮基、卤素、及),d选自含有fv段的分子,例如,d为单抗、双抗、或scfv。
[0047]
在具体实施方式中,所述探针分子选自以下各化合物:
[0048]
[0049]
[0050][0051]
术语“卤素”是指氟、氯、溴或碘。
[0052]
术语“c
1-c
12
烷基”是指链上具有1至12个碳原子的直链或支链饱和烃基,非限制性地包括甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基等。c
1-c8烷基、c
1-c6烷基、c
1-c4烷基的含义以此类推。
[0053]
术语“烷氧基”是指上述烷基末端连接氧所得的基团,例如,甲氧基、乙氧基、正丙氧基、仲丁氧基、叔丁基、正己氧基等。
[0054]
术语“c
1-c8烷基硅基”为结构rarbrcsi-,其中,ra、rb和rc中至少有一个为c
1-c8烷基,其余为氢的基团,例如,三甲基硅烷、三乙基硅烷。
[0055]
术语“磺酸基”是指-so3h。
[0056]
术语“氨基”是指-nh2。
[0057]
术语“羧基”是指-cooh。
[0058]
术语“c6-c12芳基”是指具有6至12个环碳原子的芳基,非限制性地包括苯基、萘基等。
[0059]
术语“5-12元杂芳基”是指具有5至12个环原子且含有选自n、o、s的杂原子的芳香性环状基团,非限制性地包括呋喃基、噻吩基、噻喃基、吡咯基、三唑基、四唑基、吡啶基、嘧啶基、苯并呋喃基、苯并噻吩基、苯并噻喃基、吲哚基、苯并三唑基、苯并吡啶基、吡啶并呋喃基、吡啶并吡咯基等。
[0060]
杂环基是指含有一个或多个饱和和/或部分饱和环且包括3至10个环原子的环状
基,其中一个或多个环原子选自氮、氧或硫的杂原子,其余环原子为碳;例如,环氧丙烷基、四氢呋喃基、吡咯烷基、四氢吡喃基、哌啶基、哌嗪基、吗啉基、硫代吗啉基等。
[0061]
另一方面,本发明提供上述探针分子的制备方法,如以下反应路线所示,所述方法包括:
[0062][0063]
在以上反应式中,各取代基的定义分别如上文所定义;r’为硼酸或硼酸酯,锡盐;
[0064]
步骤1:化合物1与化合物2经suzuki反应得到化合物3;
[0065]
步骤2:化合物3经还原反应得到化合物4;以及
[0066]
步骤3:化合物4与n-亚磺酰苯胺(pnso)进行成环反应得到通式i的化合物;或者
[0067]
步骤3’:化合物4与化合物(5-2)、(5-3)或(5-4)进行生成schiff碱的反应,分别得到通式ii、iii或iv的化合物。
[0068]
特别地,各步骤如下操作:
[0069]
步骤1:称取化合物1与催化剂四(三苯基膦)钯于反应瓶,置换氮气,加入甲苯与碳酸钾水溶液溶解,置换氮气,将体系搅拌,缓慢滴加化合物2的甲苯溶液进行反应,反应结束后进行提纯,得到化合物3;
[0070]
步骤2:将化合物3溶于二氯甲烷与甲醇溶液体系,在冰浴条件下加入适量锌粉与氯化铵水溶液。反应条件从0℃至室温,进行反应,反应结束后进行提纯,得到化合物4;以及
[0071]
步骤3:在步骤2之后,称取化合物4于反应瓶,置换氮气,加入溶剂吡啶后再次置换氮气,随后加入n-亚磺酰苯胺(pnso),置换氮气,加入三甲基氯硅烷(tmscl),进行反应,反应结束后进行提纯,得到通式i的化合物;或者
[0072]
步骤3’:在步骤2之后,称取化合物4,以及称取化合物(5-2)、(5-3)或(5-4)于反应
瓶,置换氮气后加入醋酸溶液溶解,置换氮气,进行反应,反应结束后进行提纯,分别得到通式ii、iii或iv的化合物。
[0073]
在具体实施方式中,在步骤1中,化合物1:化合物2:碳酸钾、四(三苯基膦)钯的摩尔比为1:1:1.2:0.05,反应温度为110℃,反应时间为12-24h。
[0074]
在具体实施方式中,在步骤2中,在二氯甲烷与甲醇溶液体系中,二氯甲烷与甲醇体积比为10:1,反应时间为4h。
[0075]
在具体实施方式中,在步骤3中,反应温度为80℃,反应时间为12-16h。
[0076]
在具体实施方式中,在步骤3’中,反应温度为110℃,反应时间为12-16h。
[0077]
再一方面,本发明提供所述探针分子在制备显影剂中的用途。
[0078]
所述显影剂可以用于在生物组织及样品中进行体外定量检测和体内成像以及非生物组织的指示定量。例如,所述显影剂可以用于活体荧光成像指导肿瘤切除,例如龋齿类动物活体成像及荧光成像指导荷瘤鼠肿瘤切除;所述显影剂可用于龋齿类动物血液循环系统成像、淋巴管及淋巴结成像、肿瘤血管成像、血栓成像及脑血管成像;所述显影剂可用于坏死组织成像,例如龋齿类动物无水乙醇诱导的肌肉坏死组织成像。
[0079]
在具体实施方式中,所述显影剂可用于全身血管成像、骨成像或淋巴成像。
[0080]
在具体实施方式中,所述显影剂可用于肿瘤成像。
[0081]
在具体实施方式中,所述显影剂可用于手术导航。
[0082]
又一方面,本发明提供所述探针分子在制备光热治疗剂中的用途,特别地,所述光热治疗剂用于肿瘤的治疗。
[0083]
在具体实施方式中,在所述探针分作为光热治疗剂时,使用方法如下:显影剂经给药后到达指定部位(例如为肿瘤组织)聚集,随后给予激光照射,通过显影剂产生的热以达到杀死肿瘤细胞的目的。
[0084]
又一方面,本发明提供所述探针分子在制备肿瘤诊断试剂中的用途。
[0085]
本发明又一方面涉及一种显影剂,其包含上述探针分子。
[0086]
有益效果
[0087]
本技术提供了一系列不对称的供体-受体(d-a)型nir-ii探针,其发射光谱也能到达nir-ii区域。与d-a-d结构的探针相比,本技术探针的d-a结构减少了分子量,更容易化学修饰及代谢,可以对动物模型全身血管成像、淋巴成像、疾病的诊断与检测、肿瘤成像及手术导航等,并且预期可用于人类全身血管成像、淋巴成像、疾病的诊断与检测、肿瘤成像及手术导航等。
附图说明
[0088]
图1为化合物ia和ib(0.5k2,2k2,2k,5k,10k)的紫外吸收光谱。
[0089]
图2为化合物ia和ib(0.5k2,2k2,2k,5k,10k)的荧光发射光谱。
[0090]
图3为化合物ib(0.5k2,2k2,2k,5k,10k)在正常小鼠体内近红外二区1400nm在不同时间点的生物分布图。
[0091]
图4为化合物ib(2k,10k)在肿瘤小鼠中的成像,可用于长时间窗口的荧光成像肿瘤切除手术,虚线框指示肿瘤位置。
[0092]
图5示出,a:化合物ib(10k)在小鼠淋巴系统中的成像,b:可检测的4根淋巴管的荧
光信号强度。
[0093]
图6为化合物ib(0.5k2,2k2,2k,5k,10k)在808nm激光下的升温曲线。
具体实施方式
[0094]
以下实施方法中,对本发明的部分d-a型近红外二区探针分子进行阐述。这些实施例为解释说明目的,不用于限制本发明的范围。
[0095]
实施例
[0096]
实施例1:化合物ia的合成
[0097][0098]
取化合物1a(500mg,0.912mmol)与催化剂四(三苯基膦)钯(52.7mg,0.046mmol)于反应瓶,置换氮气,在氮气条件下加入甲苯(约10ml)与碳酸钾溶液(151.26mg,1.09mmol,溶于2ml水中,反应体系甲苯:水体积比约为5:1),置换氮气,将反应置于110℃搅拌下缓慢滴加化合物2a的甲苯溶液(652.89mg,0.912mmol),110℃加热回流反应12-16h。tlc检测反应完全后,将反应冷却至室温,旋蒸除去大部分甲苯,将剩余反应液用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,无水硫酸镁干燥,过滤,旋干大部分溶剂,加入硅胶拌样过柱,得到化合物3a 241.04mg,粗产率为25%。
[0099]
取中间体化合物3a(200mg,0.189mmol)溶于二氯甲烷与甲醇溶液体系(二氯甲烷与甲醇体积比为10:1),在冰浴条件下加入锌粉(1583.05mg,22.68mmol)与氯化铵(363.95mg,6.804mmol)水溶液。反应条件从0℃至室温,反应时间约为4h。旋干大部分溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,用无水硫酸镁干燥,过滤,旋干除去溶剂,得到化合物4a,直接用于下一步反应。
[0100]
取化合物4a(100mg,0.109mmol)与噻吩偶姻(36.45mg,0.164mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物ia,102.34mg,产率为85%。
[0101]1h nmr(400mhz,cdcl3)δ7.99(d,j=6.6hz,1h),7.70(d,j=6.8hz,1h),7.66
–
7.53(m,6h),7.33(dd,j=4.8,1.8hz,1h),7.20(ddd,j=20.3,6.8,4.8hz,3h),7.07
–
6.99(m,
2h),7.00(d,j=0.9hz,7h),4.02(t,j=9.9hz,2h),3.16(s,1h),2.88(tt,j=9.8,0.8hz,4h),2.65
–
2.56(m,4h),0.94(t,j=9.9hz,2h),0.08(s,6h),0.04(s,6h).
[0102]
13
c nmr(101mhz,cdcl3)δ147.92,146.89,145.86,143.67,138.35,131.86,129.39,129.13,129.08,128.75,128.10,127.61,127.60,127.58,127.01,126.71,126.43,117.00,112.85,66.11,64.64,53.57,34.60,30.21,30.14,8.77,6.15.
[0103]
maldi-tof-ms:计算m.w:1103.26.实测:约1103.281
[0104]
实施例2:化合物ib的合成
[0105][0106]
取化合物ia(100mg,0.091mmol)溶于20ml二氯甲烷,在冰浴条件下滴加体积约5ml左右的三氟乙酸(tfa),反应温度从0℃至室温,反应时间约为6h。tlc监测反应结束后,旋蒸除去二氯甲烷和三氟乙酸,得到中间体化合物2a,为墨绿色粉末,产率为98%。
[0107]
取中间体化合物2b(10mg,0.011mmol)、n-羟基丁二酰亚胺(nhs,25.32mg,0.22mmol)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edci,25.30mg,0.1322mmol)于反应瓶,加入干燥的二甲亚砜作为溶剂,置换氮气,室温搅拌2h后,将相应长度的nh
2-peg链(m.w.550,15.125mg,0.0275mmol;m.w.2000,55mg,0.0275mmol;m.w.5000,82.5mg,0.0165mmol;m.w.10000,165mg,0.0165mmol)分别加入至反应瓶中,室温条件下反应8h。反应结束用透析袋透析,而后采用c18反向柱纯化。最终产物ib经maldi-tof-ms确认。[ib结构中的p基团可各自代表h或peg链(前提是两个p不同时为h),如以下5种化合物,其中ib 0.5k2表示结构中包含2条分子量为0.5kda的peg链,ib 2k2表示结构中包含2条分子量为2kda的peg链,ib 2k表示结构中包含1条分子量为2kda的peg链,ib 5k表示结构中包含1条分子量为5kda的peg链,ib 10k表示结构中包含1条分子量为10kda的peg链,它们的计算和实测分子量分别如下。]
[0108]
maldi-tof-ms:
[0109]
ib 0.5k2,计算m.w:约1968.实测:约2142
[0110]
ib 2k2,计算m.w:约4868.实测:约4807
[0111]
ib 2k,计算m.w:约2886.实测:约2912
[0112]
ib 5k,计算m.w:约5886.实测:约5898
[0113]
ib 10k,计算m.w:约10886.实测:约10983
[0114]
实施例3:化合物ic的合成
[0115][0116]
取化合物1c(500mg,0.753mmol)与催化剂四(三苯基膦)钯(43.51mg,0.038mmol)于反应瓶,置换氮气,在氮气条件下加入甲苯(约10ml)与碳酸钾溶液(124.89mg,0.904mmol,溶于2ml水中,反应体系甲苯:水体积比约为5:1),置换氮气,将反应置于110℃搅拌下缓慢滴加化合物2a的甲苯溶液(539.07mg,0.753mmol),110℃加热回流反应12-16h。tlc检测反应完全后,将反应冷却至室温,旋蒸除去大部分甲苯,将剩余反应液用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,无水硫酸镁干燥,过滤,旋干大部分溶剂,加入硅胶拌样过柱,得到化合物2c,220.87mg,粗产率为25%。
[0117]
取中间体化合物2c(200mg,0.170mmol)溶于二氯甲烷与甲醇溶液体系(二氯甲烷与甲醇体积比为10:1),在冰浴条件下加入锌粉(1333.96mg,20.4mmol)与氯化铵(327.36mg,6.12mmol)水溶液。反应条件从0℃至室温,反应时间约为4h。旋干大部分溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,用无水硫酸镁干燥,过滤,旋干除去溶剂,得到化合物3c,直接用于下一步反应。
[0118]
取化合物3c(100mg,0.097mmol)与噻吩偶姻(32.41mg,0.146mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物ic,100.53mg,产率为85%。
[0119]
实施例4:化合物id的合成
[0120][0121]
取化合物1a(500mg,0.912mmol)与催化剂四(三苯基膦)钯(52.7mg,0.046mmol)于反应瓶,置换氮气,在氮气条件下加入甲苯(约10ml)与碳酸钾溶液(151.26mg,1.09mmol,溶于2ml水中,反应体系甲苯:水体积比约为5:1),置换氮气,将反应置于110℃搅拌下缓慢滴加化合物1d的甲苯溶液(657.04mg,0.912mmol),110℃加热回流反应12-16h。tlc检测反应完全后,将反应冷却至室温,旋蒸除去大部分甲苯,将剩余反应液用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,无水硫酸镁干燥,过滤,旋干大部分溶剂,加入硅胶拌样过柱,得到化合物2d,242.20mg,粗产率为25%。
[0122]
取中间体化合物2d(200mg,0.188mmol)溶于二氯甲烷与甲醇溶液体系(二氯甲烷与甲醇体积比为10:1),在冰浴条件下加入锌粉(1475.20mg,22.56mmol)与氯化铵(362.02mg,6.768mmol)水溶液。反应条件从0℃至室温,反应时间约为4h。旋干大部分溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,用无水硫酸镁干燥,过滤,旋干除去溶剂,得到化合物3d,直接用于下一步反应。
[0123]
取化合物3d(100mg,0.108mmol)与噻吩偶姻(36.01mg,0.162mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物id,101.87mg,产率为85%。
[0124]
实施例5:化合物ie的合成
[0125][0126]
取化合物4a(100mg,0.109mmol)与化合物1e(88.37mg,0.164mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物ie,131.67mg,产率为85%。
[0127]
实施例6:化合物if的合成
[0128][0129]
取化合物1a(500mg,0.912mmol)与催化剂四(三苯基膦)钯(52.7mg,0.046mmol)于反应瓶,置换氮气,在氮气条件下加入甲苯(约10ml)与碳酸钾溶液(151.26mg,1.09mmol,溶于2ml水中,反应体系甲苯:水体积比约为5:1),置换氮气,将反应置于110℃搅拌下缓慢滴加化合物1f的甲苯溶液(274.65mg,0.912mmol),110℃加热回流反应12-16h。tlc检测反应
16h。反应结束后,加入水搅拌1h淬灭,随后除去溶剂,用半制备高效液相质谱分离纯化得到ih,产率约为90%。
[0138]
实施例9:化合物ii的合成
[0139][0140]
取化合物1i(500mg,0.637mmol)与催化剂四(三苯基膦)钯(36.98mg,0.032mmol)于反应瓶,置换氮气,在氮气条件下加入甲苯(约10ml)与碳酸钾溶液(151.26mg,1.09mmol,溶于2ml水中,反应体系甲苯:水体积比约为5:1),置换氮气,将反应置于110℃搅拌下缓慢滴加化合物2a的甲苯溶液(456.02mg,0.637mmol),110℃加热回流反应12-16h。tlc检测反应完全后,将反应冷却至室温,旋蒸除去大部分甲苯,将剩余反应液用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,无水硫酸镁干燥,过滤,旋干大部分溶剂,加入硅胶拌样过柱,得到化合物2i,205.99mg,粗产率为25%。
[0141]
取中间体化合物2i(200mg,0.155mmol)溶于二氯甲烷与甲醇溶液体系(二氯甲烷与甲醇体积比为10:1),在冰浴条件下加入锌粉(1216.25mg,18.6mmol)与氯化铵(298.47mg,5.58mmol)水溶液。反应条件从0℃至室温,反应时间约为4h。旋干大部分溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,用无水硫酸镁干燥,过滤,旋干除去溶剂,得到化合物3i,直接用于下一步反应。
[0142]
取化合物3i(100mg,0.087mmol)与噻吩偶姻(28.90mg,0.13mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物ii,98.12mg,产率为85%。
[0143]
实施例10:化合物ij的合成
[0144][0145]
取化合物4a(100mg,0.109mmol)与化合物1j(34.48mg,0.164mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物ij,101.22mg,产率为85%。
[0146]
实施例11:化合物ik的合成
[0147][0148]
取化合物4a(100mg,0.109mmol)与化合物1k(34.80mg,0.164mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物ik,101.41mg,产率为85%。
[0149]
实施例12:化合物il的合成
[0150][0151]
取化合物4a(100mg,0.109mmol)与化合物1l(34.80mg,0.164mmol)溶于醋酸,置换氮气,将反应置于110℃反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物il 99.36mg,产率为85%。
[0152]
实施例13:化合物im的合成
[0153][0154]
取化合物4a(100mg,0.109mmol)于反应瓶,置换氮气,加入溶剂吡啶后再次置换氮气,随后加入n-亚磺酰苯胺(151.71mg,1.09mmol)再次换氮气,加入三甲基氯硅烷(118.42mg,1.09mmol),将反应置于80℃下反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物im,41.26mg,产率为40%。
[0155]
实施例14:化合物in的合成
[0156][0157]
取化合物3d(100mg,0.108mmol)于反应瓶,置换氮气,加入溶剂吡啶后再次置换氮气,随后加入n-亚磺酰苯胺(150.31mg,1.08mmol)再次换氮气,加入三甲基氯硅烷(117.33mg,1.08mmol),将反应置于80℃下反应12-16h。反应结束后,将反应冷却至室温,将反应液旋蒸至少量溶剂,用乙酸乙酯萃取,合并有机相,用水和饱和食盐水洗涤,随后无水硫酸镁干燥,过滤,旋干,加入硅胶拌样过柱,得到化合物in,41.10mg,产率为40%。
[0158]
实验例
[0159]
实验例1:化合物ia和ib(0.5k2,2k2,2k,5k,10k)的紫外吸收光谱
[0160]
将ia溶解在四氢呋喃中,ib(0.5k2,2k2,2k,5k,10k)溶解在去离子水中。由uv2600(shimadzu)紫外分光光度计、1cm石英比色皿测定,记录波长范围为550-1000nm,化合物ia和ib(0.5k2,2k2,2k,5k,10k)的吸收峰值在740nm左右(图1)。
[0161]
实验例2:化合物ia和ib(0.5k2,2k2,2k,5k,10k)的荧光发射光谱
[0162]
将ia溶解在四氢呋喃中,ib(0.5k2,2k2,2k,5k,10k)溶解在去离子水中。由荧光光谱仪(ihr320,horiba scientific)、808nm激光器、1cm石英比色皿测定,记录波长范围为850-1500nm,化合物ia和ib(0.5k2,2k2,2k,5k,10k)发射峰落在近红外二区900-1400nm,聚乙二醇化的水溶性探针ib(0.5k2,2k2,2k,5k,10k)发射有略微的红移现象(图2)。
[0163]
实验例3:化合物ib(0.5k2,2k2,2k,5k,10k)在正常小鼠体内生物分布图
[0164]
实验所用小鼠由上海实验动物中心批准后购买,动物实验根据中国科学院上海药
物研究所动物保护和使用委员会(iacuc)指导方针进行。实验使用的是6周的正常的balb/c雌性小鼠。ib(0.5k2,2k2,2k,5k,10k)溶解在pbs中,经尾静脉注射至小鼠体内。用近红外二区相机研究体内成像,808nm激光器激发,功率为220mw/cm2,滤光片为1400nm长通滤光片。
[0165]
结果如图3所示,荧光强度集中在肝脏、肠道以及血管,表明探针经肝肠代谢,具有长的血液循环时间,可用于血管成像以及血管功能的检测。另外,探针在小鼠的胫骨和脊柱有明显的吸收,可用于小鼠骨成像以及骨疾病的相关成像。
[0166]
实验例4:化合物ib(2k,10k)在肿瘤小鼠中的成像
[0167]
实验所用小鼠由上海实验动物中心批准后购买,动物实验根据中国科学院上海药物研究所动物保护和使用委员会(iacuc)指导方针进行。取6周的balb/c雌性小鼠,在其后腿皮下部位接种肿瘤鼠源乳腺癌细胞4t1,成瘤后用游标卡尺测量肿瘤径线长度,根据公式肿瘤体积v=(长
×
宽2)/2计算肿瘤体积,待肿瘤长至150mm3后使用,尾静脉注射ib(2k,10k)用于nir-ii活体成像,使用808nm激光器激发,功率220mw/cm2,1000nm长通滤光片。
[0168]
结果如图4所示,小鼠肿瘤组织呈现出高吸收,随着时间的推移对比度也逐渐增加,可以实现长时间窗口的荧光成像肿瘤切除手术。
[0169]
实验例5:化合物ib(10k)在小鼠淋巴系统中的成像
[0170]
实验所用小鼠由上海实验动物中心批准后购买,动物实验根据中国科学院上海药物研究所动物保护和使用委员会(iacuc)指导方针进行。取6周正常的balb/c雌性小鼠,将探针ib(10k)注射于小鼠右肢趾间,轻轻按摩注射部位,使其能更快的扩散。结果如图5a,将小鼠置于近红外二区成像系统,能看到小鼠右侧两个淋巴结。使用高倍成像装置,能清晰得看到四根淋巴管,其中直线截面的荧光强度分布图,包含四根淋巴管的信号,如图5b,成像结果说明该探针的具有量子产率高、生物利用度高的特点,说明能用于淋巴系统相关疾病的成像研究,并具有临床转化的潜力。
[0171]
实验例6:探针ib(0.5k2,2k2,2k,5k,10k)在808nm激光下的升温曲线。
[0172]
取探针ib(0.5k2,2k2,2k,5k,10k)配置成100um的水溶液,将其置于功率为1w/cm2的808nm激光下照射5min,利用红外相机每30s记录下温度,得到了探针的升温曲线。图6结果显示探针均具有光热效果,可以用于光热治疗。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1