一种用于血管支架材料表面内皮细胞动力学测试的微流控体外循环系统
1.本发明属于生物医学工程领域,涉及一种用于血管支架材料表面内皮细胞动力学测试的微流控体外循环系统,是基于血流动力学原理、动脉系统血流动力学特性的集中参数模型、微流控技术及自动控制技术设计的由体外内皮细胞培养腔、流体加载装置及细胞生理信息采集与反馈的闭环控制系统,用于测试不同生理、病理的脉动血流动力学条件下血管支架材料表面血管内皮细胞的铺展(spreading)、粘附(adhesion)、迁移(migration)、增殖(proliferation)等动力学行为。
背景技术:
2.目前,血管支架植入手术是治疗心脑血管疾病最为重要的手段之一。支架植入术后,使内皮细胞快速铺展、粘附、迁移、增殖并覆盖支架材料表面,抑制平滑肌细胞迁移和增殖,预防支架部位血栓形成,已成为临床上防止血管支架术后再狭窄的重要治疗策略。
3.血管支架材料表面内皮细胞的动力学行为除了受材料本身性质和结构的影响,还受到脉动血流所产生的壁面剪切力、血压等血流动力学信号刺激。内皮细胞能通过细胞膜表面的受体及感受器识别这些微环境因素变化,并将信号通过一系列的信号通路级联反应传递到细胞内部引起基因和蛋白表达的变化,最终影响细胞铺展、粘附、迁移、增殖等细胞动力学行为。
4.动物模型与人体临床实验测试是研究血管支架对血管内皮细胞粘附、迁移和增殖的影响最直接的方式。但是,动物和人体的动脉内皮细胞处于非常复杂的流体环境之下,并且会受到呼吸、神经调节因子等其他各种生理因素的影响,同时存在动物与人体差异较大、所需成本高、观察周期长、以及伦理学争议等问题。相比于动物和人体实验,微流控系统具有成本低、易集成、易于光学检测及良好的生物适应性等优势,是测试血管支架材料表面内皮细胞动力学理想的研究平台。然而,截止目前,集成于微流控芯片的支架材料测试系统不能精确地模拟动脉内皮细胞的在体血流动力学微环境。因此,迫切需要一种能够精确模拟在体动脉内皮细胞脉动流生理条件、用于血管支架材料表面细胞动力学测试的微流控体外循环系统。
5.本发明通过建立更加契合在体真实动脉系统血流动力学特性的集中参数模型,指导设计和构建耗材更少的微流控体外模拟循环系统,既可以实现对内皮细胞所处生理血流动力学微环境的精准加载和控制,又能监测不同血流动力学微环境及支架材料表面特性协同作用下的血管内皮细胞动力学行为,为血管支架材料的选择和合理使用提供科学依据,从而提高血管支架术对心血管疾病的治疗与康复效果。
技术实现要素:
6.本发明的目的在于:以模拟在体靶动脉内皮血流动力学微环境中血压和壁面剪应力信号为目标,利用血流动力学相似原理,根据靶动脉部位后负荷系统的输入阻抗计算得
到微流控细胞培养腔后负荷系统的输入阻抗(如图4所示);通过建立符合微流控细胞培养腔后负荷系统的输入阻抗特性的集中参数模型;进一步指导设计和构建微流控体外模拟循环系统;该系统既能实现血流动力学信号的精准加载控制,又能对细胞培养腔底部血管支架材料表面内皮细胞的动力学行为进行监测分析,用于研究不同生理、病理状态对应的血流动力学信号与支架材料表面特性协同调控内皮细胞动力学行为的规律及其机制。
7.本发明的技术方案如下:
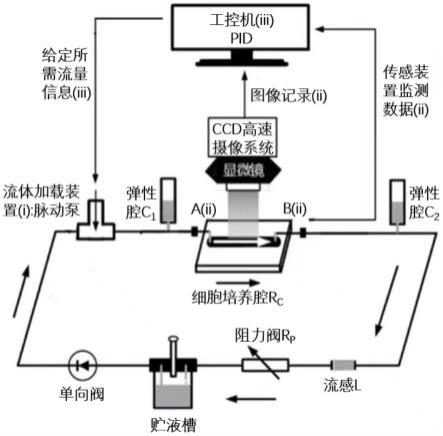
8.一种用于血管支架材料表面内皮细胞动力学测试的微流控体外循环系统,所述微流控体外模拟循环系统包括三个基本单元:
9.第一个基本单元是由微流控的细胞培养腔以及外围的多元件后负荷流体力学循环回路组成,包括:依次通过管道连接的放置可更换血管支架材料样本的细胞培养腔rc、流感l、阻力阀r
p
,以及弹性腔c;弹性腔c包括弹性腔c1和弹性腔c2,弹性腔c1和弹性腔c2分别位于细胞培养腔的流体输入、输出管道上。流体通过管道流入缓冲凹槽进入细胞培养腔,通过嵌入pc板的血管支架材料能够在细胞培养腔底端观察内皮细胞在不同支架血管支架材料,不同生理流动条件下的变化。
10.第二个基本单元是以贮液槽和脉动泵为基础的可以为细胞培养腔精准加载不同生理流动的外围设备。其中,阻力阀r
p
、贮液槽、脉动泵、弹性腔c1依次通过弹性管道连接,使得细胞培养腔与贮液槽构成闭合循环回路,气体由脉动泵加载后进入贮液槽用于形成不同的生理流动。
11.第三个基本单元是对细胞培养腔中血管支架材料表面内皮细胞进行观测的外围检测与反馈控制系统,包括ccd高速相机、压力传感器、流量传感器、荧光显微镜和工控机。其中,压力传感器设置在细胞培养腔两侧,流量传感器设置在细胞培养腔一侧,通过实时采集细胞培养腔的流入流量波形或两端的压力波形对血流动力学信号进行观测,外围的荧光显微镜与ccd高速相机可以对内皮细胞的动力学行为进行监测,工控机处理后形成控制指令,精准控制脉动泵在细胞培养腔内产生目标靶动脉内皮血流动力学微环境中的血压和壁面剪应力信号。
12.所述基于微流控的细胞培养腔中可更换的血管支架材料固定在pc板底端,血管支架材料上表面与pc板上表面齐平,液体可由培养腔流体通道的缓冲凹槽流过,再流过培养腔中接种在血管支架材料上的内皮细胞,通过血管支架材料可以在细胞培养腔底端观察内皮细胞在不同血管支架材料,不同生理流动条件下的变化。真实且精确的再现目标靶动脉内皮血流动力学微环境中的血压和壁面剪应力信号。
13.细胞培养腔的长度lc、宽度wc和高度hc满足:hc《《wc且hc《《lc。当流体受压力驱动时,培养在细胞培养腔底部血管支架材料上的内皮细胞同时承受动脉压力p(t)和壁面剪应力τw(t)的组合作用。具有上下平行板和高纵横比的微流控细胞培养腔中脉动流动的navier-stokes方程可简化为:
[0014][0015]
式中,uc、pc分别为细胞培养腔腔室中流体沿x轴方向的速度和压力,x、z分别为纵坐标和径向坐标,t表示时间;η
li
、ρ
li
分别为细胞培养腔腔室中流体的粘度和密度。细胞培养腔内脉动流的周期性变化是由压力梯度的周期性脉动变化引起的,通过fourier分解为:
[0016][0017]
在上式中,ac(ωn)是的谐波分量,ωn表示角频率,j=(-1)
1/2
是虚部的符号。求解方程(1)(2)得到速度uc的表达式为:
[0018][0019]
其中是womersley数,于是细胞培养腔腔室的流量qc(t)可表示为:
[0020][0021]
另外,对qc(t)进行fourier分解可得:
[0022][0023]
其中qc(ωn)是qc(t)的谐波分量,由式(3)~(5)可知,uc的表达式可表示为:
[0024][0025]
于是,细胞培养腔底部的壁面剪应力τc(t)表示为:
[0026][0027]
由于细胞培养腔中流动的雷诺数re<<1,womersley数α
nc
<<1,满足准定常流动假设,所以uc、qc和τc(t)可简化为:
[0028][0029][0030]
其中,δp(t)为流体通过细胞培养腔产生的压力降,uc(ωn)和tc(ωn)是uc(ωn)和τc(ωn) 的谐波分量。由式(9)可知,qc(ωn)和tc(ωn)之间的关系可表示为:
[0031][0032]
细胞培养腔后负荷系统的输入阻抗z
ch
(ωn)可表示为:
[0033][0034]
其中pc(ωn)表示细胞培养室中压力pc(t)的谐波分量。根据式(10)和(11),pc(ωn) 与tc(ωn)之间的关系可以表示为:
[0035][0036]
根据式(9)可知,为使细胞培养腔培养的内皮细胞承受的压力波形与在体靶动脉内皮微环境中的动脉压力p(t)波形和壁面剪应力τw(t)相等,压力降δp(t)和流量率q(t)必须满足:
[0037][0038][0039]
所述的细胞培养腔后负荷流体力学回路的设计需使细胞培养腔底部血管支架材料表面培养的内皮细胞承受的压力、壁面剪应力与靶动脉内皮微环境的动脉压力p(t)和壁面剪应力τw(t)波形一致。靶动脉脉动血流的navier-stokes方程可简化为:
[0040][0041]
边界条件为:
[0042][0043]
式中u
vi
为流体沿轴向x方向的流体速度,x和r分别为轴向坐标和径向坐标,η
b1
和ρ
b1
分别为血液的粘度和密度,r为动脉段内半径,p
vi
为体内血压。方程(14) 和(15)可由womersley理论求解。动脉血压梯度可表示为:
[0044][0045]
其中a
vi
(ωn)是的谐波分量,则速度u
vi
可表示为:
[0046][0047]
上式中y=r/ra,是womersley数,j0是第一类零阶bessel函数。于是,流量q
vi
(t)可表示为:
[0048][0049]
上式中,f
10
=[2j1(j
3/2
α
nvi
)]/[j
3/2
α
nvi
j0(j
3/2
α
nvi
)],壁面剪应力τ
wvi
(t)可表示为:
[0050][0051]
其中j1是第一类一阶bessel函数。
[0052]
由式(18)(19)可知,τ
wvi
(t)的谐波分量q
vi
(ωn)与τ
wvi
(t)的谐波分量t
wvi
(ωn)之间的关系可表示:
[0053][0054]
由于p
vi
(t)的谐波分量p
vi
(ωn)和q
vi
(t)的谐波分量q
vi
(ωn)与动脉后负荷系统的输入阻抗z
vi
(ωn)关联,其表达式为:
[0055][0056]
根据公式(20)、(21)容易得到,p
vi
(t)的谐波分量p
vi
(ωn)与τ
wvi
(t)的调和分量t
wvi
(ωn) 之间的关系可表达为:
[0057][0058]
所以由式(22)可知,动脉中的压强p
vi
(t)和壁面剪应力τ
wvi
(t)不是独立作用的,而是相互影响的。
[0059]
通过式(12)和式(22)可知,如果p
vi
(t)等于pc(t),并且τ
wvi
(t)等于τc(t),那么体内输入阻抗z
vi
(ωn)与片上输入阻抗z
ch
(ωn)之比定义为f
hs
,f
hs
应满足
[0060][0061]
由公式(22)可知,如果知道血液粘度η
bl
,液体粘度η
li
,动脉内径ra和细胞培养室的宽度wc、高度hc,那么体内输入阻抗z
vi
(ωn)可“映射”为片上输入阻抗z
ch
(ωn)。将这种“映射”定义为血流动力学相似性原理。
[0062]
根据流体力学回路与电路之间的相似关系,将压力等效为电路中的电压,流量率等效为电路中的电流,顺应性、阻力元件、惯性元件分别等效为电路中的电容、电阻和电感,可采用试凑法构建五元件的集中参数电路网络模型,容易知道所设计电路网络的等效阻抗是一个或多个顺应性c,流感l和流阻 r
p
表示的复函数。利用电路等效阻抗的幅值和相位数值拟合靶动脉输入阻抗z(ωn)的幅值和相位,使得平方残差之和rss:
[0063][0064]
达到最小值,最终确定的集中模型参数元件值是进一步制作流体力学回路中顺应
性c,流感l和阻力阀r
p
元器件的基础,其中,和为等效输入阻抗在ωn处的幅值和相位角。
[0065]
动脉顺应性c可用一个中空的圆柱筒模拟,圆筒中充入一定体积的气体,气体的可压缩性代表动脉的弹性,计算公式如下:
[0066][0067]
式中,v表示空气柱的体积;p表示空气柱内的气压;n是一个多变指数(n≥1),实验过程中在恒定温度下,n=1;ac表示圆柱筒中空部分的横截面积,h表示空气柱的高度;po为大气压,pa为弹性腔内液体作用于弹性腔内空气柱的压力。因此,已知顺应性c以及压力pa,根据式(25)可计算出弹性腔内空气柱的高度h,作为弹性腔尺寸选择参考。
[0068]
流感l用一段连接管道模拟,可以通过如下的公式计算:
[0069][0070]
其中ρ是流体的密度,l’是管道的长度,a’是管道的内截面积。因此,如果已知流感l的值,在管道的内截面积a’已知的情况下,通过式(26)便可计算出管道长度 l’。
[0071]
细胞培养腔的流动阻力rc计算公式为:
[0072][0073]
一旦确定了细胞培养腔下游后负荷系统的所有集中参数元器件,则确定了下游后负荷系统的输入阻抗特性。一旦知道细胞培养腔的输入动脉压力p(t)波形,则可唯一确定流量率q(t)波形,即壁面剪应力τw(t)波形;反之亦然。
[0074]
所述的脉动泵(i)为一种可编程脉动泵,能基于labview平台编写相关程序,在细胞培养腔内产生模拟不同生理和病理状态下的靶动脉内皮微环境血压p(t) 波形(如图5所示),调整后负荷流体力学元件值,使得通过细胞培养腔的流量率波形为q(t),从而根据式(9)可知细胞培养腔中的内皮细胞承受壁面剪应力τw(t) 的作用。
[0075]
所述的信号采集处理系统(ii)与反馈控制系统(iii)如图1所示。信号采集处理系统(ii)包括倒置的荧光显微镜、ccd工业相机、压力传感器和流量传感器,用于实时监测、采集细胞培养腔输入端压力p1(t)和输出端压力p2(t)及流量波形q(t),芯片细胞培养腔内细胞动力学响应的实际状态。采集的信号反馈给工控机(iii),进一步调节脉动泵(i),定量调控作用于五元件循环模拟系统的压力、流量信号幅度和频率的变化,最终在细胞培养腔底部的血管支架材料表面产生压力p(t)、壁面剪应力τw(t)组合作用。压力的计算公式为p(t)=(p1(t)+p2(t))/2,壁面剪应力τw(t) 可通过流量传感器测得的流量波形q(t)和细胞培养腔几何尺寸由式(9)计算得到。此外,内皮细胞的动力学响应过程由显微镜结合ccd摄像机检测记录保存至工控机(iii)。
[0076]
用于研究不同生理、病理状态对应的血流动力学信号与支架材料表面特性协同调控内皮细胞动力学行为的规律及其机制的实验步骤如下:
[0077]
步骤一、血管内皮细胞培养;
[0078]
步骤二、加载不同生理、病理状态下靶动脉内皮微环境中血压、壁面剪应力信号刺
激,并进行细胞动力学响应的实时监测。
[0079]
本发明的有益效果:本发明可方便地开展不同生理、病理状态对应的血流动力学信号与支架材料表面特性协同调控内皮细胞动力学行为及机制实验,精确复制了真实的靶动脉血管内皮细胞外血流动力学微环境,可实时观察采集细胞动力学响应,为研究血流动力学信号与支架材料表面特性协同调控内皮细胞动力学行为及其机制提供高效有力的实验平台。
附图说明
[0080]
图1是血管支架材料表面内皮细胞动力学测试的微流控体外循环系统结构图。
[0081]
图2细胞培养腔结构示意图。
[0082]
图3是混合模型以及集中参数模型示意图,(a)动脉段分布参数模型,(b)流动腔分布参数模型,(c)五元件集中参数模型。
[0083]
图4是靶动脉和细胞培养腔后负荷系统的输入阻抗曲线,其中,(a)体内输入阻抗的振幅和相位,(b)体内与片上输入阻抗的振幅和相位比值,(c)片上输入阻抗的振幅和相位。
[0084]
图5是靶动脉和细胞培养腔内的压力波形、剪切力波形,其中,(a)静息状态下、(b)低等强度运动干预、(c)中等强度运动干预、(d)高等强度运动干预条件下的血压(见子图)与壁面剪切应力波形。
[0085]
图中:1紧固螺钉;2上压板;3聚碳酸酯板;4硅胶垫片b;5血管支架材料;6硅胶垫片a;7凹槽;8pc板;9下压板;10缓冲凹槽。
具体实施方式
[0086]
现针对附着于不同血管支架材料的内皮细胞在不同的颈总动脉血流动力学行为下的模拟,阐述具体实施方案:
[0087]
细胞培养腔包括缓冲凹槽10、下压板9、pc板8、凹槽7、硅胶垫片a6、血管支架材料5、硅胶垫片b4、聚碳酸酯板3、上压板2和紧固螺钉1;所述的下压板9、pc板8、聚碳酸酯板3、上压板2从下至上排布;pc板8上开设凹槽7,用于安装血管支架材料5,血管支架材料5上表面与pc板8上表面齐平;凹槽7两侧的pc板8上开设缓冲凹槽10;血管支架材料5的上下分别设置硅胶垫片b4、硅胶垫片a6密封;pc板8的侧面连接细胞培养腔的输入和输出管道,输入和输出管道分别连接凹槽7两侧的缓冲凹槽10,流体经过输入管道进入一侧的缓冲凹槽10后,流体溢出缓冲凹槽10后进入硅胶垫片b4内部的腔体中,进而流体流经血管支架材料5上表面,最后通过另一侧的缓冲凹槽10经输出管道流出。
[0088]
(1)设计细胞培养腔高度hc、宽度wc和长度lc分别为0.6mm、12mm和 18mm,通常细胞培养液的粘度η为0.001pa
·
s。将静息状态下颈总动脉的血压 p(t)和壁面剪应力τw(t)波形(如图5所示),代入式(13a)计算得到细胞培养腔的输入流量波形q(t),代入式(13b),max(δp(t)/p(t))《《1满足细胞培养腔内压力降要求,进一步将目标血压p(t)和q(t)分别代入公式计算目标输入阻抗z(ωn);
[0089]
(2)对于颈总动脉系统,可以构建五元件集中参数模型,那么细胞培养腔 rc的后负荷输入阻抗由电路理论知识可以表征为:
[0090][0091]
(3)将五元件集中参数模型代表的等效输入阻抗(见式(28))和输入阻抗z(ωn)代入式(24)进行五元件集中参数模型的参数识别,使得rss为最小,得到静息状态对应的流体力学回路各个元件的参数值。
[0092]
(4)本系统所使用的细胞培养腔采用标准化微加工方法进行制作。培养腔使用聚碳酸酯材料,同时培养腔的设计须确保在使用显微镜观察内皮细胞形态结构时可聚焦且方便不同材料支架的放置;细胞培养腔的几何尺寸通过精准模拟在主动脉不同部位内皮微环境中的血压、剪应力波形的实际需要确定;
[0093]
(5)建立如图1所示的体外内皮细胞培养腔及信号收集处理系统。其中,信号采集处理系统由倒置的荧光显微镜、ccd高速摄像系统、压力传感器和流量传感器构成,用来用于实时监测和采集细胞培养腔输入端和输出端的压力及流量波形,以及附着于支架材料的内皮细胞的形态结构及生物化学信号。对于培养腔中内皮细胞的力学生物学响应动态过程由显微镜结合ccd高速摄像机检测记录保存至工控机。
[0094]
(6)用于血管支架材料表面内皮细胞动力学测试的微流控体外循环系统在研究不同的支架材料下与血管内皮细胞力学生物学机制之间定量关系的具体实验步骤如下:
[0095]
步骤一、将原代培养的动脉内皮细胞用内皮细胞专用egm培养基进行传代培养,第2-5代用于实验。实验时将内皮细胞种植于经fibronection包被的位于芯片细胞培养腔rc内的血管支架上,使细胞贴壁且融合度达到90%以上。
[0096]
步骤二、加载不同生理流动条件下颈总动脉处血压、壁面剪应力刺激,并进行细胞力学生物学响应的实时监测并对数据进行集中参数建模分析。
[0097]
本发明可成功地再现不同的血管支架材料植入后内皮细胞所处的生理微环境并可用于研究不同生理、病理状态对应的血流动力学信号与支架材料表面特性协同调控内皮细胞动力学行为的规律及其机制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1