用于鉴定戊糖片球菌的专用引物与试剂盒的制作方法
1.本发明涉及生物技术领域中,用于鉴定戊糖片球菌的专用引物与试剂盒。
背景技术:
2.戊糖片球菌(pediococcus pentosaceus)属革兰氏阳性球菌,广泛分布于发酵植物及麦芽汁中,是一种常见啤酒腐败菌。啤酒中存在戊糖片球菌时会产生酸和黄油味的双乙酰,从而引起啤酒腐败。据了解,啤酒生产中从麦芽制备到啤酒酿造的各个阶段,都存在戊糖片球菌污染风险,戊糖片球菌的快速检测成为啤酒厂质量监控亟待解决的一大问题。
3.常见的戊糖片球菌的检测方法有培养法及分子生物学方法等。培养法经nbb、mrs培养基培养后,根据其菌落形态特征、过氧化氢酶反应及生理生化指标等对菌株进行定性判定,虽然操作简单,但步骤繁琐,耗时较长,难以及时为酒厂提供风险预警。分子生物学方法为近年广受追捧的一种定性检测方法,其依托核酸扩增进行目标物体鉴定,检测效率较高。常用的分子生物学方法主要包括基因芯片技术、聚合酶链式反应及等温扩增技术3种。基因芯片技术是一种融合分子生物学、生命信息学、物理学、计算机学等多种学科交叉形成的综合生物技术,其利用微机械技术,对固体芯片进行微流体单元系统构建,通过将已知序列的特异性寡核苷酸探针接种至芯片表面,实现多种污染菌检测定性。基因芯片技术具有极高的特异性和灵敏度,可实现高通量分析检测,但极容易出现假阳性,技术成本昂贵,无法实现大批量推广。聚合酶链式反应(简称pcr)是分子生物学方法中发展较完善的一种方法,其经反复变温使dna双链拆分与引物杂交形成新dna链。以pcr技术进行核酸扩增后既可通过观察凝胶电泳后的目标条带长度判断产物,也可通过探针和荧光试剂的荧光积累变化判定结果,极大减少了操作步骤,为企业节省了人力时间。但pcr技术依赖于精密的温控设备和检测仪器,对实验室环境和人员素质要求高,不利于酒厂基层检测任务开展。
4.等温扩增方法是近年新兴的一种体外核酸扩增方法。区别于pcr技术,等温扩增对温度变化精密度要求不高,无需特殊仪器设备,极大的解决了基层应用困难的问题,此外,等温扩增特异性强、灵敏度高,0.5h内即可实现目标物体扩增检测,极大提高了检测效率,目前已被广泛应用于病原微生物、转基因物种、动物源性成分分析等领域,并得到国内外学者、企业认可。
技术实现要素:
5.本发明所要解决的技术问题是如何鉴定戊糖片球菌。
6.为解决上述技术问题,本发明首先提供了一个引物组,所述引物组由名称分别为f3、b3、fip、bip、lf和lb的引物组成;
7.所述f3为如下(a1)或(a2):
8.(a1)序列表的序列1所示的单链dna分子;
9.(a2)将序列1经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1具有相同功能的dna分子;
10.所述b3为如下(a3)或(a4):
11.(a3)序列表的序列2所示的单链dna分子;
12.(a4)将序列2经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2具有相同功能的dna分子;
13.所述fip为如下(a5)或(a6):
14.(a5)序列表的序列3所示的单链dna分子;
15.(a6)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的dna分子;
16.所述bip为如下(a7)或(a8):
17.(a7)序列表的序列4所示的单链dna分子;
18.(a8)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的dna分子;
19.所述lf为如下(a9)或(a10):
20.(a9)序列表的序列5所示的单链dna分子;
21.(a10)将序列5经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列5具有相同功能的dna分子;
22.所述lb为如下(a11)或(a12):
23.(a11)序列表的序列6所示的单链dna分子;
24.(a12)将序列6经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列6具有相同功能的dna分子。
25.所述引物组为基于环介导等温扩增的引物组。
26.所述引物组的用途为如下(b1)或(b2):(b1)鉴定或辅助鉴定戊糖片球菌;(b2)检测或辅助检测待测样本中是否含有戊糖片球菌。
27.所述引物组中,f3、b3、fip、bip、lf、lb的摩尔配比依次为1:1:8:8:4:4。
28.本发明还提供了所述引物组的下述任一应用:
29.x1)制备鉴定或辅助鉴定戊糖片球菌试剂或试剂盒;
30.x2)制备检测或辅助检测待测样本中是否含有戊糖片球菌试剂或试剂盒;
31.x3)鉴定或辅助鉴定戊糖片球菌;
32.x4)检测或辅助检测待测样本中是否含有戊糖片球菌。
33.本发明还提供了一种试剂,所示试剂包括所述引物组。
34.所述试剂还可包括进行lamp反应所需的其他试剂。所述其他试剂可为isothermal master mix(中轻检验认证有限公司,货号为iso-004)。
35.所述试剂可由所述引物组与isothermal master mix组成。每11μl所述试剂可包含:外游引物f3 2.5pmol、b3 2.5pmol,内游引物fip 20pmol、bip 20pmol,环引物lf 10pmol、lb 10pmol,isothermal master mix7.5μl。
36.所述试剂在鉴定或辅助鉴定戊糖片球菌中的应用,也属于本发明的保护范围。
37.所述试剂在检测或辅助检测待测样本中是否含有戊糖片球菌中的应用,也属于本发明的保护范围。
38.本发明还提供了一种含有所述引物组或所述试剂的试剂盒;所述试剂盒的用途为
如下(b1)或(b2):(b1)鉴定或辅助鉴定戊糖片球菌;(b2)检测或辅助检测待测样本中是否含有戊糖片球菌。
39.所述试剂盒在鉴定或辅助鉴定戊糖片球菌中的应用,也属于本发明的保护范围。
40.所述试剂盒在检测或辅助检测待测样本中是否含有戊糖片球菌中的应用,也属于本发明的保护范围。
41.本发明还提供了一种鉴定或辅助鉴定戊糖片球菌的方法,所述方法包括如下步骤:
42.(1)提取待测微生物的核酸;
43.(2)以步骤(1)提取的核酸为模板,采用所述引物组进行环介导等温扩增;如果所述引物组可以实现以提取核酸为模板的特异性扩增,待测微生物为或候选为戊糖片球菌;如果所述引物组不能实现以提取核酸为模板的特异性扩增,待测微生物为或候选为非戊糖片球菌。
44.本发明还提供了一种检测待测样本中是否含有戊糖片球菌的方法,所述方法包括如下步骤:
45.(1)提取待测样本的核酸;
46.(2)以步骤(1)提取的核酸为模板,采用所述引物组进行环介导等温扩增;如果所述引物组可以实现以提取核酸为模板的特异性扩增,所述待测样本含有或候选含有戊糖片球菌;如果所述引物组不能实现以提取核酸为模板的特异性扩增,所述待测样本不含有或候选不含有戊糖片球菌。
47.上述方法中,所述待测样本可为啤酒样本。
48.采用所述引物组进行环介导等温扩增的反应体系可为(12.5μl):isothermal master mix 7.5μl,所述引物组3.5μl,待测模板溶液1.5μl。3.5μl引物组中,各引物含量为:外游引物f3 2.5pmol、b3 2.5pmol,内游引物fip 20pmol、bip 20pmol,环引物lf 10pmol、lb 10pmol。
49.采用所述引物组进行环介导等温扩增的反应条件可为:65℃、30min。
50.本发明的有益效果:(1)特异性强:基于靶基因6个特异性区域进行引物设计,碱基互补配对更稳定特异;(2)灵敏度高:对某些病原菌的扩增,模板甚至仅需几个拷贝数,优于pcr灵敏度1-2个数量级;(3)快速、高效:无需预热变性及反复变温循环,降低了时间损失,此外两条环引物的引入进一步加快反应速率,使其在等温条件下0.5h即可实现核酸扩增,极大程度保证了扩增效率;(4)产物检测便捷:利用lamp技术进行核酸扩增时会产生大量焦磷酸根离子,其与镁离子结合能生成白色焦磷酸镁沉淀,据此可直接进行产物结果判断。此外也可以应用荧光反应试剂进行目标扩增实时监控,检测方便可靠;(5)操作简单:无需反复生理生化实验验证,仅需一台水浴锅即可实现扩增全过程,可操作性强。
51.本发明利用环介导等温扩增技术扩增戊糖片球菌特异性基因片段,填补了啤酒中戊糖片球菌lamp检测方法的空白,具特异性强、操作简单、快速便捷等优点,可用于啤酒质量监控,适合酒厂基层应用和现场快速检测。
附图说明
52.图1为实施例2中特异性检测的荧光扩增曲线。
53.图2为实施例3中lamp的荧光扩增曲线。
54.图3为实施例3中实时荧光pcr的荧光扩增曲线。
55.图4为对比例中分别采用三个引物组进行lamp反应的荧光扩增曲线。
56.图5为对比例中采用p1引物组进行lamp反应的熔解曲线。
具体实施方式
57.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
58.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna/rna的5
′
末端核苷酸,末位均为相应dna/rna的3
′
末端核苷酸。
59.实施例1、用于鉴定戊糖片球菌的引物组的制备
60.本实施例提供的用于鉴定戊糖片球菌的引物组由六条引物组成,序列如下:
61.外游引物f3(序列表的序列1):5
’‑
cgcagcttgagaaacatca-3’;
62.外游引物b3(序列表的序列2):5
’‑
ggacgcactttagcttgt-3’;
63.内游引物fip(序列表的序列3):5
’‑
atgctcacaaagttgaaatcgaatttgtttgctccatagttgtactc-3’;
64.内游引物bip(序列表的序列4):5
’‑
agtctggacggtagctacctttagtggtgtgaccttagcc-3’;
65.环引物lf(序列表的序列5):5
’‑
cgtaactcccgtaaggttctgg-3’;
66.环引物lb(序列表的序列6):5
’‑
cactttagtagcgttaattccagca-3’。
67.用于鉴定戊糖片球菌的引物组引物组中,外游引物f3、外游引物b3、内游引物fip、内游引物bip、环引物lf与环引物lb的摩尔比为1:1:8:8:4:4。
68.实施例2、特异性
69.供试菌分别为:戊糖片球菌cicc21862(pediococcus pentosaceus)、戊糖片球菌cicc22230(pediococcus pentosaceus)、短乳杆菌cicc20014(lactobacillus brevis)、干酪乳杆菌cicc6117(lactobacillus casei)、植物乳杆菌cicc20261(lactobacillus plantarum)、嗜酸乳杆菌cicc6074(lactobacillus acidophilus)、德氏乳杆菌cicc6047(lactobacillus delbrueckii)、长双岐杆菌cicc6069(bifidobacteriumlongum)、嗜热链球菌cicc6038(streptococcus thermophilus)、乳酸乳球菌cicc6242(lactococcus lactis)、肠膜明串珠菌cicc20714(leuconostoc mesenteroides)、枯草芽孢杆菌cicc24713(bacillus subtilis)、大肠埃希氏菌cicc10003(escherichia coli)、铜绿假单胞菌cicc10204(pseudomonas aeruginosa)。各菌株均为cicc产品,cicc即中国工业微生物菌种保藏管理中心(china center of industrial culture collection),http://sales.china-cicc.org/。
70.1、制备模板溶液
71.取105cfu/ml供试菌菌液,99℃处理5min,以4℃终止反应,收集上清液,得到各菌种核酸模板溶液。
72.2、进行lamp反应
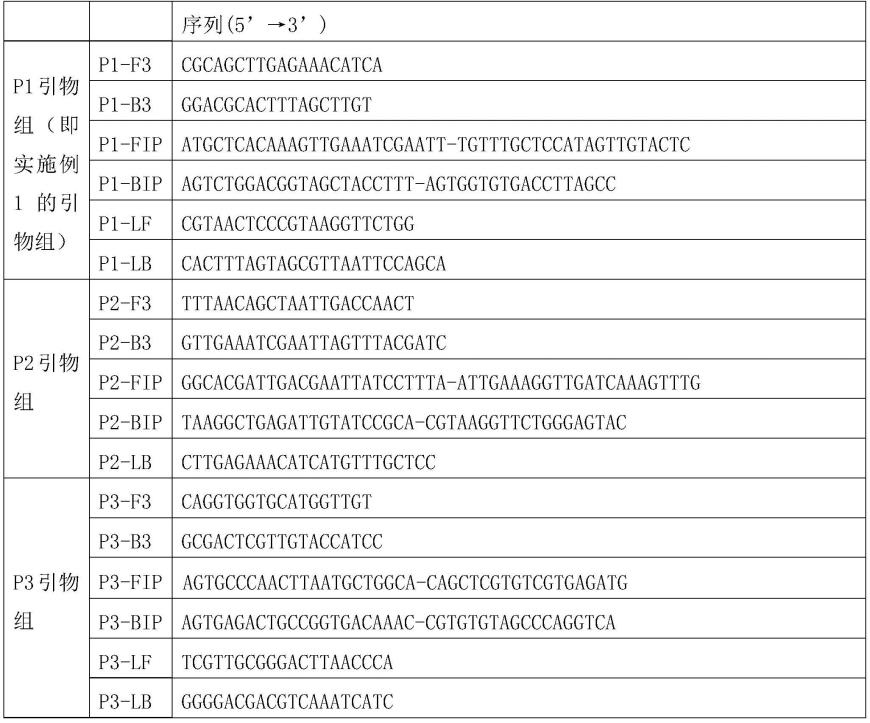
73.利用实施例1的引物组进行lamp反应,环介导等温扩增的反应体系(12.5μl):isothermal master mix 7.5μl,引物组3.5μl,模板溶液1.5μl。3.5μl引物组中,各引物含量为:外游引物f3 2.5pmol、b3 2.5pmol,内游引物fip 20pmol、bip 20pmol,环引物lf 10pmol、lb 10pmol。其中isothermal master mix:中轻检验认证有限公司,货号为iso-004。
74.设置用无菌双蒸水代替模板溶液作为阴性对照。
75.环介导等温扩增的反应条件:65℃、30min。反应在genieⅱ实时荧光检测仪中进行。
76.荧光扩增曲线见图1,图1中戊糖片球菌1和戊糖片球菌2分别为戊糖片球菌cicc21862(pediococcus pentosaceus)、戊糖片球菌cicc22230(pediococcus pentosaceus)。2株戊糖片球菌均能产生荧光扩增曲线,其它供试菌未能产生荧光扩增曲线。结果表明,实施例1的引物组具有很好的特异性。
77.实施例3、灵敏度
78.供试菌为:戊糖片球菌cicc21862。
79.1、制备模板溶液
80.通过平板计数确定供试菌菌悬液浓度,以无菌生理盐水对其进行10倍梯度稀释,得到菌浓度为10
0-105cfu/ml梯度的菌悬液。取菌悬液,99℃处理5min,最终以4℃终止反应,收集上清液,获得戊糖片球菌不同浓度的核酸模板溶液。
81.2、进行lamp反应
82.采用实施例1的引物组进行lamp反应,反应体系同实施例2。
83.设置用无菌双蒸水代替模板溶液作为阴性对照。
84.反应条件:65℃、30min。反应在genieⅱ实时荧光检测仪中进行。
85.荧光扩增曲线见图2。10
2-105cfu/ml浓度菌悬液的核酸可以产生荧光扩增曲线,102cfu/ml及以下浓度的菌悬液均无荧光扩增曲线。表明,经简单核酸提取,特异引物组对戊糖片球菌的检测灵敏度为102cfu/ml。
86.3、进行实时荧光pcr
87.反应体系(20μl):tb green fast qpcr mix(2x)10μl,rox reference dye(50x)0.4μl,实施例1的外游引物f3和b3,模板溶液2μl,余量为水。反应体系中,各引物含量为:外游引物f38pmol、b3 8pmol。
88.反应条件:95℃30s;95℃5s、60℃15s,45个循环。反应在abi7900实时荧光检测仪中进行,对于ct值≤40的扩增结果判定为阳性。
89.荧光扩增曲线见图3。10
3-105cfu/ml浓度菌悬液的核酸可以产生荧光扩增曲线,检测灵敏度为103cfu/ml。结果表明,经同样核酸提取步骤,本发明的lamp检测法比实时荧光pcr的灵敏度高10倍。
90.实施例4、制备用于检测戊糖片球菌的lamp检测试剂
91.检测试剂:isothermal master mix 7.5μl,实施例1的引物组的各条引物。11μl检
测试剂中各引物含量为:外游引物f3 2.5pmol、b3 2.5pmol,内游引物fip 20pmol、bip 20pmol,环引物lf 10pmol、lb 10pmol。
92.检测试剂的使用方法:取11μl检测试剂,加入1.5μl待测样本的核酸模板,于genieⅱ实时荧光检测仪进行lamp反应。反应条件:65℃、30min。反应结果通过荧光扩增曲线判定。
93.对比例、不同引物组的效果比较
94.发明人还检测了其他两个lamp引物组(p2引物组、p3引物组)对戊糖片球菌的检测效果,各引物组的序列如表1所示,检测步骤具体如下:
95.表1
[0096][0097]
供试菌为:戊糖片球菌cicc21862。
[0098]
1、取105cfu/ml供试菌菌液,99℃处理5min,以4℃终止反应,收集上清液,得到戊糖片球菌核酸模板溶液。
[0099]
2、进行lamp。
[0100]
分别采用三个引物组进行lamp反应,环介导等温扩增的反应体系(12.5μl):isothermal master mix 7.5μl,引物组3.5μl,模板溶液1.5μl。3.5μl引物组中,各引物含量均为:外游引物f3(表1中的p1-f3、p2-f3或p3-f3)2.5pmol、b3(表1中的p1-b3、p2-b3或p3-b3)2.5pmol,内游引物fip(表1中的p1-fip、p2-fip或p3-fip)20pmol、bip(表1中的p1-bip、p2-bip或p3-bip)20pmol,环引物lf(表1中的p1-lf、p2-lf或p3-lf)10pmol、引物lb(表1中的p1-lb、p2-lb或p3-lb)10pmol。
[0101]
环介导等温扩增的反应条件:65℃、30min。反应在genieⅱ实时荧光检测仪中进行。
[0102]
每个引物组均设置用无菌双蒸水代替模板溶液作为阴性对照。
[0103]
三个引物组lamp反应的荧光扩增曲线结果见图4。无论是扩增时间还是荧光值,p1引物组均优于其他引物组。p1引物组的退火温度为86℃(见图5)。
[0104]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1