一种枯草芽孢杆菌及其应用的制作方法
1.本技术涉及农作物培育的的技术领域,更具体地说,涉及一种枯草芽孢杆菌及其应用。
背景技术:
2.影响农作物收成的因素包括农作物自身的发育、生长情况以及农作物的生长环境。其中,农作物自身的发育、生长包括农作物的种子萌发情况以及植株的生长情况;农作物的生长环境包括土壤中的营养物质以及土壤中的病原菌。
3.通常情况下,促进种子萌发的方法主要是对种子进行预处理:先将种子在臭氧中浸泡,并对浸泡后的种子催芽,之后再放入包膜剂中搅拌,取出晾干即可。但种子预处理所用的时间较长,且操作复杂。促进农作物植株生长的方法主要是施肥,但是,当土壤中高浓度复合肥料的添加量超过土壤所能够保持的量时,肥料就会随雨水流入周围的水中,造成水体富营养化,导致藻类滋生,继而造成水环境的破坏,形成农业污染。另外,抑制植株生长环境中病原菌的方法则是施用药剂或高温处理,然而药剂会残留在植株上,甚至会间接进入人体,对人体产生较大的危害,高温处理则操作较为复杂,给操作人员带来较大的不便。
4.基于上述相关技术中存在的缺陷,需要提供一种新的方法来改善农作物自身的发育、生长情况以及农作物的生长环境。
技术实现要素:
5.本技术提供了一种枯草芽孢杆菌及其应用,本技术提供的枯草芽孢杆菌能够促进植物种子的萌发以及植株的生长,同时还能够抑制病原真菌及其他真菌的生长、繁殖。
6.第一方面,本技术提供一种枯草芽孢杆菌,采用如下的技术方案:
7.一种枯草芽孢杆菌,保藏于北京微生物中国典型培养物保藏中心(cgmcc),保藏编号:cgmcc n0.24391,保藏时间为:2022年02月11日。
8.本技术通过在多年连作土豆的土壤上,从其无连作障碍的区域(以下简称“无连作障碍土壤”)筛选获得了一种枯草芽孢杆菌。该枯草芽孢杆菌能够使农作物在具有连作障碍田间仍然保持正常生长,说明该枯草芽孢杆菌能够改善连作障碍田间农作物的培育。经过探究发现,本技术提供的枯草芽孢杆菌能够促进种子萌发和植株生长,同时还能够抑制病原菌的生长、繁殖。通过使用枯草芽孢杆菌来改善植株自身的生长发育情况以及植株的生长环境,不但可以避免施肥和农药对环境造成污染,而且操作简单、方便。同时,将枯草芽孢杆菌释放到土壤中,还可以丰富自然界菌群结构,提高自然界菌群多样性。
9.所述枯草芽孢杆菌呈杆状、圆端,多数为单个、少数成对或链状排列,经过革兰氏染色显阳性;平板培养时菌落表面粗糙不透明,污白色或黄色,边缘形成皱醭,挑取为粘稠状或冻状。
10.优选的,所述枯草芽孢杆菌的培养条件如下:温度为28-32℃,ph为6.5-7.5,摇床的转速为130-190r/min。
11.在一个具体的实施方案中,所述枯草芽孢杆菌的培养温度可以为28℃、30℃、32℃。
12.在一些具体的实施方案中,所述枯草芽孢杆菌的培养温度还可以为28-30℃、28-32℃、30-32℃。
13.在一个具体的实施方案中,所述枯草芽孢杆菌的ph可以为6.5、7或7.5。
14.在一些具体的实施方案中,所述枯草芽孢杆菌的培养ph还可以为6.5-7、6.5-7.5、7-7.5。
15.在一个具体的实施方案中,所述枯草芽孢杆菌的培养转速可以为130r/min、160r/min或190r/min。
16.在一些具体的实施方案中,所述枯草芽孢杆菌的培养转速还可以为130-160r/min、130-190r/min、160-190r/min。
17.通过探究不同培养条件下本技术提供的枯草芽孢杆菌的增殖情况可以知道,将枯草芽孢杆菌的培养条件控制如下:温度为28-32℃,ph为6.5-7.5,摇床的转速为130-190r/min,在此培养条件下,能够促进枯草芽孢杆菌快速繁殖。
18.第二方面,本技术提供了一种培养物,所述培养物包括上述枯草芽孢杆菌。
19.第三方面,本技术提供了一种发酵液,所述发酵液包括上述枯草芽孢杆菌。
20.第四方面,本技术提供了一种菌悬液,所述菌悬液包括上述枯草芽孢杆菌。
21.第五方面,本技术提供了一种发酵上清液,所述发酵上清液包括上述枯草芽孢杆菌。
22.第六方面,本技术提供的枯草芽孢杆菌在促进种子萌发,促进植株生长以及抑制多种病原菌生长、繁殖方面的应用。
23.进一步地,枯草芽孢杆菌的菌含量为(1-4)
×
108cfu/g。种子萌发率提高了17%-25%,使植株根长增长率提高了59-126%,植株的鲜重增长率为66-166%。
24.进一步地,枯草芽孢杆菌可以抑制病原真菌及其他真菌的繁殖,抑制率为40.61-54.33%。其中,对病原菌禾谷镰孢菌抑制作用可达到54.33%。
25.综上所述,本技术具有以下有益效果:
26.1.本技术提供一种枯草芽孢杆菌,该枯草芽孢杆菌保藏于北京微生物中国典型培养物保藏中心(cgmcc),保藏编号:cgmcc n0.24391,保藏时间为:2022年02月11日。
27.2.本技术提供的枯草芽孢杆菌,在土壤中的菌含量为(1-4)
×
108cfu/g时,能够提高种子的萌发率、促进植株的生长,种子萌发率提高了17-25%,使植株根长增长率提高了59-126%,植株的鲜重增长率为66-166%。
28.3.本技术提供的枯草芽孢杆菌对多种病原菌的抑制率为40.61-54.33%。
29.4.本技术提供的枯草芽孢杆菌添加到土壤中,不会对人体、动物体以及植物产生危害,也不会对环境造成污染。
30.5.枯草芽孢杆菌菌体被释放到土壤中,可以丰富自然界菌群结构,提高自然界菌群多样性。
附图说明
31.图1为实施例1提供的枯草芽孢杆菌在营养琼脂培养中的培养结果。
32.图2为实施例1提供的枯草芽孢杆菌在光学显微镜
×
1000(油镜)下的照片。
33.图3为实施例2提供的枯草芽孢杆菌基于16s rdna序列构建的系统发育树。
34.图4为枯草芽孢杆菌对多种真菌的抑制效果(a为枯草芽孢杆菌对禾谷镰孢菌的抑制效果;b为枯草芽孢杆菌对炭黑曲霉的抑制效果;c为枯草芽孢杆菌对黄曲霉的抑制效果;d为枯草芽孢杆菌对黑曲霉的抑制效果)。
具体实施方式
35.本技术提供了一种枯草芽孢杆菌,并提供了该菌株的分离、纯化及培养方法。该菌株经过革兰氏染色显阳性,菌株呈杆状、圆端,多数为单个、少数成对或链状排列,平板培养时菌落表面粗糙不透明,污白色或黄色,边缘形成皱醭,挑取为粘稠状或冻状。本技术还提供了利用枯草芽孢杆菌制备的培养物、发酵液、发酵上清液、菌悬液。
36.上述枯草芽孢杆菌的分离、纯化,采用如下方法:
37.(1)取样:在无连作障碍土壤采集土壤样品;
38.(2)目标菌初分离:向步骤(1)获得的土壤样品中加入生理盐水,振荡,取上清液稀释至不同浓度,并进行平板涂布培养,直至平板上有菌落生长;
39.(3)将步骤(2)生长的菌落进行划线培养,重复进行多次纯化,最终获得单一菌种,保存。
40.对上述菌株进行16s rdna序列测序,其16s rdna的序列如seq id no.1所示;经过鉴定,判定该菌株为枯草芽孢杆菌。另外,本技术还提供了枯草芽孢杆菌在促进种子萌发方面的应用、在促进植物生长方面的应用、以及在抑制多种病原菌生长、繁殖方面的应用。
41.本技术提供的枯草芽孢杆菌采集自宁夏固原市西吉县红耀乡(东经105
°
30
′
37
″
,北纬36
°
02
′
20
″
)无连作障碍土壤,采用16s rdna鉴定该菌株为枯草芽孢杆菌(bacillus subtilis),其命名为枯草芽孢杆菌bgb-99r,保藏于北京微生物中国典型培养物保藏中心(cgmcc),保藏编号:cgmcc n0.24391,保藏时间为:2022年02月11日。
42.本技术所用的培养基配方如下:
43.1.营养液体培养基的配方为:蛋白胨10g/l、牛肉膏5g/l、nacl10g/l,溶剂为蒸馏水;
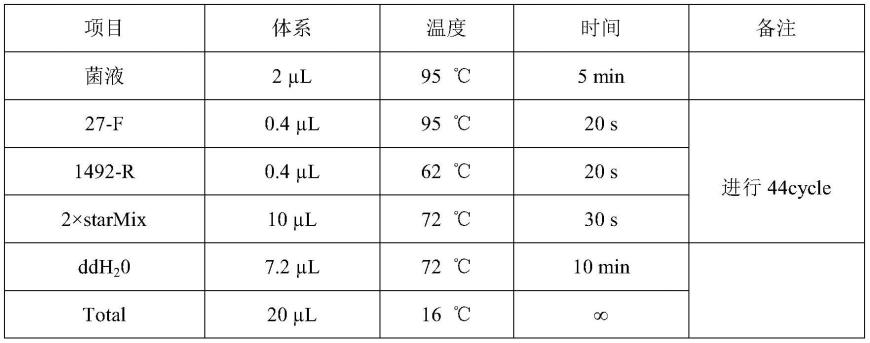
44.2.营养固体培养基的配方为:蛋白胨10g/l、牛肉膏5g/l、nacl10g/l、琼脂20g/l,溶剂为蒸馏水;
45.3.营养琼脂培养基的配方为:甘露醇10g/l、mgso4·
7h2o0.2g/l、nacl0.1g/l、酵母粉3g/l、k2hpo40.25g/l、caco33g/l、琼脂25g/l,溶剂为蒸馏水;
46.上述各培养基的制备方法如下:取各组分混合均匀,并溶于1l蒸馏水中,并调节体系ph为7,在121℃下灭菌30min,即可获得所需培养基。
47.4.pda培养基的配方为:土豆200g、葡萄糖20g、琼脂18g,水1000ml,自然ph值。
48.pda培养基的制备方法为:称取去皮土豆200g,土豆切成小块放入锅中,加蒸馏水1000ml,在加热器上加热至沸腾,维持20-30min,用6层纱布趁热在烧杯上过滤,取上清液并加入葡萄糖20g、琼脂18g,充分溶解后用蒸馏水定容1l,121℃,30min灭菌,倒板,放置备用。
49.本技术所用的营养土的制作方法为:将土壤调理剂、珍珠岩、蛭石、椰糠按照重量比3:1:2:4混合配置成营养土,并灭菌。其中,灭菌后营养土中的营养指标(干基)为:有机质
65%,氮1.45%,磷0.37%,钾0.16%。
50.本技术所用的土壤调理剂为北京嘉博文生物科技有限公司沃美克土壤调理剂。
51.珍珠岩采购自:广东居隆农业有限公司。
52.蛭石采购自:灵寿县蛭石产销经营部。
53.椰糠采购自:佛山市顺德区欣兴捷贸易商行。
54.以下结合附图1-4、实施例1-18以及检测试验对本技术作进一步详细说明。
55.实施例
56.实施例1
57.菌株的分离、纯化
58.(1)土壤样品采集:采集自宁夏固原市西吉县红耀乡(东经105
°
30
′
37
″
,北纬36
°
02
′
20
″
)无连作障碍土壤。
59.(2)目标菌初分离:将采集的样品在低温环境下保藏送至实验室,称取上述采集的样品10g,无菌条件下加入到预先灭菌的盛有100ml生理盐水的三角瓶中,在28℃条件下,充分振荡30min,静置15min。取上清液进行稀释,稀释浓度依次为10-3
、10-4
、10-5
,分别吸取各稀释浓度的溶液0.2ml添加至营养琼脂培养基平板上,进行涂布,待液体吸尽,将其置于28℃的恒温培养箱中倒置培养20h。观察可见,营养琼脂培养基平板上有菌落生长。
60.(3)纯化:用灭菌的牙签从营养琼脂培养基平板上挑取单菌落,并转移至新的营养琼脂培养基平板上进行划线,并置于28℃的恒温培养箱中培养20h。重复上述纯化步骤,直至营养琼脂培养基平板上为一种菌,获得纯化后的菌种。将该菌种用营养琼脂斜面培养基置于4℃的条件下保存,备用。
61.实施例2
62.菌株的鉴定
63.对菌株单菌落菌液进行pcr特异性扩增,引物分别为27f和1492r,酶选用2
×
star mix。引物序列如下:
64.正向引物27f:5
’‑
agagtttgatcctggctcag-3’;
65.反向引物1492r:5
’‑
tacggctaccttgttacgactt-3’。
66.pcr反应体系如表1所示:
67.表1 16srdna 2
×
starmix酶反应体系
[0068][0069]
将纯化扩增后的产物进行测序,获得正反向测序结果,再从ncbi(genbank)数据库
中获取多个参比菌株序列,运用软件bioedit和mega11对本技术菌株和参比菌株的16s rdna序列全长分析比对,构建本技术菌株与参比菌株的系统发育树,并确定菌株系统发育相关的属。
[0070]
检测结果一
[0071]
形态学特征
[0072]
利用显微镜观察实施例1分离、纯化的菌种,并进行革兰氏染色。
[0073]
通过观察可见,上述菌株的菌落表面粗糙不透明,污白色或黄色,边缘形成皱醭,挑取为粘稠状或冻状。革兰氏染色呈阳性。上述菌株在营养琼脂培养基中的形态如图1所示。
[0074]
在光学显微镜下
×
1000(油镜)下观察菌株,该菌株的单菌落的营养细胞呈杆状、圆端,多数为单个、少数成对或链状排列,具体如图2所示。
[0075]
经过上述观察,上述菌株的特征与芽孢杆菌属菌种的特征接近,初步判断该菌株为芽孢杆菌。
[0076]
鉴定
[0077]
实施例2提供的系统发育树如图3所示。
[0078]
通过系统发育树可知,本技术提供的菌株和bacillus subtilis strain表现的亲缘关系最近,可信度为99%。基于菌株的16s rdna系统发育分析,确定筛选得到的菌株为枯草芽孢杆菌(bacillus subtilis),并将其命名为bgb-99r。其16s rdna测序结果如seq id no:1所示。将该枯草芽孢杆菌bgb-99r保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏编号:cgmcc n0.24391,保藏时间为:2022年02月11日。
[0079]
实施例3-7
[0080]
实施例3-7分别提供了一种枯草芽孢杆菌bgb-99r的培养方法。上述实施例的不同之处在于:枯草芽孢杆菌bgb-99r的培养温度。具体如表2所示。
[0081]
枯草芽孢杆菌bgb-99r的培养方法如下:
[0082]
利用实施例1获得的菌株进行活化,并将活化后的菌株接种于50ml营养液体培养基中,置于28℃、160r/min的摇床中进行培养24h,营养液体培养基的ph为7,获得接种液。
[0083]
将接种液按照5%的接种量加入于新的营养液体培养基中,将营养液体培养基置于一定温度恒温摇床中进行培养,培养时间为24h,营养液体培养基的ph为7。培养完成后,检测培养后的枯草芽孢杆菌bgb-99r的菌种浓度od
600
。
[0084]
表2实施例3-7的培养温度
[0085]
实施例培养温度318428530632735
[0086]
实施例8-11
[0087]
实施例8-11分别提供一种枯草芽孢杆菌bgb-99r的培养方法。
[0088]
上述各实施例与实施例4的不同之处在于:营养液体培养基的ph值,具体如表3所
示。
[0089]
表3实施例4、实施例8-11的培养基的ph值
[0090]
实施例培养ph值478696.5107.5118
[0091]
实施例12-15
[0092]
实施例12-15分别提供一种枯草芽孢杆菌bgb-99r的培养方法。
[0093]
上述各实施例与实施4的不同之处在于:培养方法中所用摇床的转速,具体如表4所示。
[0094]
表4实施例4、实施例12-15提供的方法中摇床的转速
[0095]
实施例转速r/min416012100131301419015220
[0096]
检测结果二
[0097]
对实施例3-15分别提供的培养方法培养获得的枯草芽孢杆菌bgb-99r的菌种浓度od
600
进行检测,结果如表5所示。
[0098]
表5实施例3-15培养的枯草芽孢杆菌bgb-99r的菌种浓度
[0099]
[0100][0101]
结合表2和表5,对比实施例3-7可知,当温度为28-32℃时,枯草芽孢杆菌bgb-99r的菌种浓度较高,大于当温度为18℃或35℃时枯草芽孢杆菌bgb-99r的菌种浓度。由此可知,本技术提供的枯草芽孢杆菌bgb-99r在温度为28-32℃的条件下,能够提高枯草芽孢杆菌bgb-99r的繁殖速度,即能够提高枯草芽孢杆菌bgb-99r的发酵速率。
[0102]
结合表3和表5,对比实施例4、实施例8-11可知,将枯草芽孢杆菌bgb-99r的ph的范围控制在6.5-7.5的范围内时,枯草芽孢杆菌bgb-99r的菌浓度较高,大于当ph值小于6.5或者大于7.5时枯草芽孢杆菌bgb-99r的菌浓度。由此可知,本技术提供的枯草芽孢杆菌bgb-99r在ph范围为6.5-7.5范围内,能够提高枯草芽孢杆菌bgb-99r的繁殖速度,即能够提高枯草芽孢杆菌bgb-99r的发酵速率。
[0103]
结合表4和表5,对比实施例4、实施例12-15可知,将摇床的转速控制在130-190r/min范围内时,枯草芽孢杆菌bgb-99r的菌浓度较高,大于当摇床的转速小于100r/min或者大于220r/min时枯草芽孢杆菌bgb-99r的菌浓度,由此可知,本技术提供的枯草芽孢杆菌bgb-99r在摇床转速为130-190r/min范围内时,能够提高枯草芽孢杆菌bgb-99r的繁殖速度。
[0104]
综上所述,本技术提供的枯草芽孢杆菌bgb-99r的最适生长温度为28-32℃,最适生长ph为6.5-7.5,摇床的最佳转速为130-190r/min。在此生长条件下,枯草芽孢杆菌bgb-99r生长繁殖的最快。
[0105]
实施例16
[0106]
实施例16提供了一种枯草芽孢杆菌bgb-99r的发酵液。
[0107]
上述发酵液的制备方法为:将实施例1提供的菌株进行活化,并转接于营养液体培养基中培养20h,培养温度为28℃,培养基的ph值为7,获得发酵液。
[0108]
实施例17
[0109]
实施例17提供了一种枯草芽孢杆菌bgb-99r的发酵上清液。
[0110]
上述发酵上清液的制备方法如下:将实施例16获得的发酵液进行离心,离心完毕
获得上清液与沉淀物,该上清液即为发酵上清液。
[0111]
实施例18
[0112]
实施例18提供了一种枯草芽孢杆菌bgb-99r的菌悬液。
[0113]
上述菌悬液的制备方法如下:将实施例16获得的发酵液进行离心,离心完毕获得上清液与沉淀物,该沉淀物为枯草芽孢杆菌bgb-99r菌体,用无菌水对枯草芽孢杆菌bgb-99r菌体进行稀释,获得菌悬液。
[0114]
检测试验
[0115]
一.枯草芽孢杆菌bgb-99r拮抗多种真菌试验
[0116]
用于检测试验的真菌类型包括禾谷镰孢菌、炭黑曲霉、黄曲霉、黑曲霉。
[0117]
(1)制备真菌菌饼和枯草芽孢杆菌bgb-99r菌饼。
[0118]
将真菌进行活化,并转接于pda培养基中培养96h,培养温度为30℃,获得真菌平板,利用5mm无菌打孔器打孔,获得5mm真菌菌饼。
[0119]
将枯草芽孢杆菌bgb-99r进行活化,并转接于营养固体培养基中培养24h,培养温度为30℃,获得枯草芽孢杆菌bgb-99r平板,利用5mm无菌打孔器打孔,获得5mm枯草芽孢杆菌bgb-99r菌饼。
[0120]
(2)将枯草芽孢杆菌bgb-99r菌饼放置于距离pda培养基中心2.5cm的位置,取真菌菌饼放置于距离pda培养基中心2.5cm且距离另一菌饼5cm的位置,作为处理组。
[0121]
另外,取5mm真菌菌饼放置于新的pda培养基上,作为对照组。将处理组和对照组均置于32℃条件下培养72h。
[0122]
(3)观察抑菌效果,计算抑菌率;
[0123]
计算公式如下:
[0124]
抑菌率(%)=(rp-rt)/rp
×
100%
[0125]
其中,rp表示对照组真菌菌丝生长半径;rt表示处理组真菌菌丝生长半径。
[0126]
上述处理组和对照组的培养结果如图4所示。分析获得的枯草芽孢杆菌bgb-99r对真菌的抑制效果如表6所示。
[0127]
表6枯草芽孢杆菌bgb-99r对真菌的抑制效果
[0128][0129]
结合图4和表6,可以看出,枯草芽孢杆菌bgb-99r对禾谷镰孢菌、炭黑霉菌、黄曲
霉、黑曲霉具有显著的抑制作用,抑制率为40.61-54.33%,对病原菌禾谷镰孢菌抑制作用最强为54.33%。
[0130]
二.种子萌发试验
[0131]
将实施例18获得的枯草芽孢杆菌bgb-99r菌悬液分别稀释至2
×
10
10
、4
×
10
10
、6
×
10
10
、8
×
10
10
cfu/ml,进行种子萌发试验。
[0132]
种子萌发试验的方法如下:
[0133]
(1)将已灭菌的营养土2kg放置于育苗盘中,分别用上述浓度的枯草芽孢杆菌bgb-99r菌悬液10ml将营养土浇透,即营养土此时菌含量分别为1
×
108、2
×
108、3
×
108、4
×
108cfu/g,作为试验组;另外,利用相同体积的水将营养土浇透,作为对照组。
[0134]
(2)将步骤(1)处理后的育苗盘放置于28℃温室中12h,利用0.2%次氯酸钠处理黄瓜种子2min,并用无菌水洗5次,按照穴播的方式种植于步骤(1)的育苗盘中,10d后观察黄瓜种子萌发情况。
[0135]
(3)萌发率的检测
[0136]
通过计数的方式计算萌发率。检测结果如表7所示。
[0137]
表7种子萌发的试验结果
[0138][0139]
结合表7,通过分析上述试验结果,对比试验组以及对照组的萌发率,可以看出,向营养土中加入枯草芽孢杆菌bgb-99r菌悬液,能够促进种子的萌发,萌发率至少提高了17%。因此,将枯草芽孢杆菌bgb-99r的菌含量控制在(1-4)
×
108cfu/ml的范围内,能够有效提高种子的萌发率,促进种子萌发。
[0140]
进一步地,对比使用不同浓度枯草芽孢杆菌bgb-99r菌悬液时的种子萌发率,可知,当枯草芽孢杆菌bgb-99r的菌含量为(1-3)
×
108cfu/ml时,种子的萌发率为93.45%以上;尤其是当枯草芽孢杆菌bgb-99r的菌含量为2
×
108cfu/ml时,种子的萌发率为98.27%,比对照组的萌发率提高了25%。而当枯草芽孢杆菌bgb-99r的菌含量为4
×
108cfu/ml时,种子的萌发率为90.23%。因此,将枯草芽孢杆菌bgb-99r的菌含量控制在(1-3)
×
108cfu/ml的范围内,能够进一步提高种子的萌发率,进一步促进种子萌发。
[0141]
三.植株生长试验
[0142]
将实施例18获得的枯草芽孢杆菌bgb-99r菌悬液分别稀释至2.5
×
10
10
、5
×
10
10
、7.5
×
10
10
、10
×
10
10
cfu/ml,进行植株生长试验。
[0143]
植株生长试验的方法如下:
[0144]
(1)将已灭菌的营养土2.5kg放置于育苗盘中,分别用上述浓度的枯草芽孢杆菌
bgb-99r稀释菌悬液10ml将营养土浇透,即营养土此时菌含量分别为1
×
108、2
×
108、3
×
108、4
×
108cfu/g,作为试验组;另外,利用相同体积的水将营养土浇透,作为对照组。
[0145]
(2)将步骤(1)处理后的育苗盘放置于28℃温室中12h,将“二、种子萌发试验”中空白对照组培养的黄瓜幼苗分别移植于步骤(1)的育苗盘中,将移栽好的幼苗放置于人工生长室(光周期为:日/夜=16h/8h;温度为:日/夜=30℃/24℃)进行培养,培养30d后检测植株根长(cm)和植株鲜重(g)。
[0146]
(3)植株根长(cm)和植株鲜重(g)的检测:检测结果如表8所示。
[0147]
其中,根长增长率(%)=(实验组根长-对照组根长)/对照组根长
×
100%;鲜重增长率(%)=(实验组鲜重-对照组鲜重)/对照组鲜重
×
100%。
[0148]
表8植株生长的试验结果
[0149][0150]
结合表8,通过分析上述试验结果,对比试验组以及对照组的植株生长情况,可以看出,向营养土中加入枯草芽孢杆菌bgb-99r菌悬液,能够促进植株的生长,其中根长至少增长了59%,鲜重至少增加了66%。因此,将枯草芽孢杆菌bgb-99r的菌含量控制在(1-4)
×
108cfu/ml的范围内,能够有效促进植株的生长。
[0151]
进一步地,对比使用不同浓度枯草芽孢杆菌bgb-99r菌悬液时的植株生长情况,可知,当枯草芽孢杆菌bgb-99r的菌含量为(2-4)
×
108cfu/ml时,植株的根长在13.26cm以上,鲜重在3.28g以上。大于当枯草芽孢杆菌bgb-99r的菌含量为1
×
108cfu/ml时,植株的根长为和鲜重。尤其是当枯草芽孢杆菌bgb-99r的菌含量为2
×
108cfu/ml时,植株的根长为18.23cm,鲜重为4.78g,比对照组植株的根长以及鲜重均提高了一倍以上。因此,将枯草芽孢杆菌bgb-99r的菌含量控制在(2-4)
×
108cfu/ml的范围内,能够进一步的促进植株的生长。
[0152]
可以理解的是,以上实施方式仅仅是为了说明本发明的原理而采用的示例性实施方式,然而本发明并不局限于此。对于本领域内的普通技术人员而言,在不脱离本发明的精神和实质的情况下,可以做出各种变型和改进,这些变型和改进也视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1