一种联芳氧基烯酸酯类化合物的合成方法
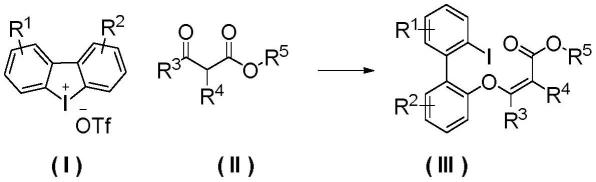
1.本发明涉及一种联芳氧基烯酸酯类化合物的合成方法,即通过二芳基环状碘鎓盐类化合物与1,3-二羰基类底物反应,高效的合成联芳氧基烯酸酯类化合物的方法。
背景技术:
2.芳氧基烯酸酯和类似化合物构成一类重要的有机化合物。它们被广泛地用作合成许多有机产品的主要结构单元或关键中间体。(stewart,g.w.;shevlin,m.;yamagata,a.d.g.;gibson,a.w.;et al.org.lett.,2012,14,5440.dai,j.;krohn,k.;draeger,s.;schulz,b.;et al.eur.j.org.chem.2009,1564.)。此外,这些烯酸酯中的极性碳碳双键是一个潜在的高反应性位点,可用于合理设计新的合成物反应。芳氧基烯酸酯及其衍生物是合成具有药用价值的含氧杂环化合物的重要中间体,如苯并呋喃和色酮等,芳氧基烯酸酯也是参与不对称氢化反应的有用底物。
3.联芳基化合物在医药、农药、染料、新材料等领域被广泛应用,例如常见的消炎镇痛药物氟比洛芬和芬布芬,降血压药物氯沙坦,重磅抗心衰药物沙库必等都含有联芳基关键结构。传统合成方法存在步骤多、废物排放多等缺陷。长期以来,发展简便、高效的联芳基化合物合成方法一直是有机合成研究的热点问题。然而,联芳氧基烯酸酯类化合物的合成方法并不多见。
4.目前,合成芳氧基烯酸酯化合物的常用的方法是以2,3-丁二烯酸乙酯和苯酚为原料,dabco为催化剂,通过进行迈克尔加成反应合成。本合成方法以二芳基环状碘鎓盐和含有1,3-二羰基类化合物的底物为原料,在碘化亚铜催化下一步通过开环反应生成联芳基化产物。无论是从原料来源的丰富性,反应的原子经济性,合成方法的简捷性还是从合成产物的结构新颖性、多样性和广泛的应用性上来讲,都是一个比较大的突破。因此,具有一定的应用价值。
技术实现要素:
5.本发明提供了一种通过二芳基环状碘鎓盐类化合物与含有1,3-二羰基类底物反应高效的合成联芳氧基烯酸酯类化合物的方法,该方法操作简单,后处理方便。
6.本发明的技术方案如下:
7.一种联芳氧基烯酸酯类化合物(iii)的合成方法,所述合成方法为:
8.将二芳基环状碘鎓盐类化合物(i)、含有1,3-二羰基的化合物(ii)、碘化亚铜、氧化钙与四氢呋喃混合,在室温(20~30℃)下搅拌反应4~12h,之后反应液经后处理,得到产物联芳氧基烯酸酯类化合物(iii);
9.所述二芳基环状碘鎓盐类化合物(i)、含有1,3-二羰基的化合物(ii)、碘化亚铜、氧化钙的物质的量之比为1:1~1.5:0.01~0.1:2~4;
10.所述四氢呋喃的体积用量以含有1,3-二羰基的化合物(ii)的物质的量计为5~15ml/mmol;
11.所述后处理的方法为:反应结束后,反应液经浓缩进行柱层析,以石油醚与乙酸乙酯体积比100~5:1的混合液作为洗脱剂,收集含目标化合物的洗脱液,蒸除溶剂并干燥得到产物(iii);
12.反应通式如下:
[0013][0014]
式(i)、式(ii)、式(iii)中,
[0015]
r1、r2各自独立为所在苯环上的一个或多个取代基,所述取代基各自独立为:芳基或取代芳基、直链烷基、支链烷基、环状烷基、含杂烷基、不饱和烷基、硝基、三氟甲基、羟基、酯基或卤素;优选r1、r2各自独立为所在苯环上的一个或两个取代基,所述取代基各自独立为:c1~c4烷基、氟或氯;
[0016]
r3、r4、r5各自独立为:h、(含杂)芳基或取代(含杂)芳基、直链烷基、支链烷基、环状烷基、含杂烷基、不饱和烷基、硝基、酯基或卤素;优选r3、r4、r5各自独立为:h、c1~c4烷基、c2~c4不饱和烷基、氟或氯。
[0017]
本发明具有以下优点:反应体系简单,反应条件温和,原料特别是含有1,3-二羰基的化合物容易得到,底物无需多步制备,后处理简单,总收率较高。本发明的创新点在于,在空气中于一定温度下使用含有1,3-二羰基的化合物和二芳基环状碘鎓盐一步就能得到联芳基化合物。本发明所得联芳基化合物收率最高为92%。
具体实施方式
[0018]
下面通过具体实施例进一步描述本发明,但本发明的保护范围并不仅限于此。
[0019]
实施例1:
[0020]
(z)-3-((2'-碘-6,6'-二甲基-[1,1'-联苯]-2-基)氧)-2-丁烯酸乙酯的合成
[0021]
将乙酰乙酸乙酯(28.6mg,0.22mmol),2,2'-二甲基-[1,1'-联苯]-环状三氟甲磺酸碘鎓盐(91.2mg,0.2mmol)、碘化亚铜(1.9mg,5mol%)、氧化钙(33.7mg,0.6mmol)溶解在2ml四氢呋喃中,该溶液在室温下搅拌反应6h。浓缩,经硅胶柱层析,石油醚/乙酸乙酯=20:1洗脱,浓缩得到产物80.2mg,收率为92%。
[0022]1h nmr(500mhz,dmso-d6)δ=7.77(d,j=7.6hz,1h),7.34
–
7.28(m,2h),7.12(d,j=7.5hz,1h),7.02(t,j=7.7hz,1h),6.85(d,j=8.1hz,1h),5.39(s,1h),3.96(q,j=7.1hz,2h),2.05(s,3h),1.96(s,3h),1.91(s,3h),1.10(t,j=7.1hz,3h).
13
c nmr(126mhz,dmso)δ163.8,163.1,151.5,141.2,139.0,137.7,136.6,134.2,130.1,129.9,129.2,125.6,115.5,104.9,101.6,59.4,21.4,20.4,19.7,14.7.hrms m/z(esi):calcd for c
20h21
inao3[m+na]
+
459.0427,found 459.0428.产物结构式为:
[0023][0024]
实施例2
[0025]
(z)-3-((2'-碘-6,6'-二甲基-[1,1'-联苯]-2-基)氧)-2-丁烯酸叔丁酯的合成
[0026]
按实施例1所述的方法,不同的是所用1,3-二羰基化合物为乙酰乙酸叔丁酯(34.8mg,0.22mmol),得到产物76.1mg,收率为82%。
[0027]1h nmr(500mhz,dmso-d6)δ=7.77(d,j=7.8hz,1h),7.36
–
7.24(m,2h),7.10(d,j=7.5hz,1h),7.02(t,j=7.7hz,1h),6.82(d,j=8.1hz,1h),5.34(s,1h),2.06(s,3h),1.91(d,j=4.4hz,6h),1.33(s,9h).
13
c nmr(126mhz,dmso-d6)δ163.2,161.5,151.7,141.2,139.0,137.6,136.6,134.0,130.2,129.9,129.2,125.4,115.2,107.1,101.6,79.3,28.3,21.5,20.3,19.7.hrms m/z(esi):calcd for c
22h26
io3[m+h]
+
465.0921,found 465.0929.产物结构式为:
[0028][0029]
实施例3
[0030]
3-((2'-碘-6,6'-二甲基-[1,1'-联苯]-2-基)氧)-5,5-二甲基环己-2-烯-1-酮的合成
[0031]
按实施例1所述的方法,不同的是所用1,3-二羰基化合物为5,5-二甲基-1,3-环己二酮(30.9mg,0.22mmol),得到产物64.3mg,收率为72%。
[0032]1h nmr(500mhz,dmso-d6)δ=7.77(d,j=7.9hz,1h),7.43(t,j=7.9hz,1h),7.32(t,j=7.0hz,2h),7.11(d,j=8.0hz,1h),7.03(t,j=7.7hz,1h),5.07(s,1h),2.05
–
1.99(m,4h),1.99(s,3h),1.97(s,3h),0.82(d,j=2.8hz,6h).
13
c nmr(126mhz,dmso)δ197.8,175.2,149.9,140.2,138.6,138.3,137.0,136.2,130.3,130.0,129.6,128.2,120.0,105.5,101.6,50.5,41.7,32.5,28.0,27.8,21.3,19.7.hrms m/z(esi):calcd for c
22h24
io3[m+h]
+
447.0816,found 447.0808。产物结构式为:
[0033][0034]
实施例4
[0035]
(z)-3-((2'-碘-6,6'-二甲基-[1,1'-联苯]-2-基)氧)-2-丁烯酸烯丙酯的合成
[0036]
按实施例1所述的方法,不同的是所用1,3-二羰基化合物为乙酰乙酸烯丙酯
(31.3mg,0.22mmol),得到产物60.1mg,收率为67%。
[0037]1h nmr(500mhz,dmso-d6)δ=7.77(d,j=7.9hz,1h),7.31(t,j=6.5hz,2h),7.13(d,j=7.6hz,1h),7.02(t,j=7.7hz,1h),6.86(d,j=8.2hz,1h),5.84(ddt,j=16.0,10.5,5.4hz,1h),5.42(s,1h),5.18(dd,j=29.6,13.9hz,2h),4.46(d,j=5.1hz,2h),2.04(s,3h),1.99(s,3h),1.91(s,3h).
13
c nmr(126mhz,dmso-d6)δ163.7,163.4,151.5,141.1,139.1,137.8,136.6,134.3,133.5,130.2,129.9,129.2,125.7,117.8,115.7,104.3,101.6,64.0,21.4,20.5,19.7.hrms m/z(esi):calcd for c
21h21
inao3[m+na]
+
471.0427,found 471.0428。产物结构式为:
[0038][0039]
实施例5
[0040]
(z)-3-((6'-碘-2',3',5,6-四甲基-[1,1'-联苯]-2-基)氧)-2-丁烯酸乙酯的合成
[0041]
按实施例1所述的方法,不同的是所用碘鎓盐底物为1,2,8,9-四甲基二苯并[b,d]三氟甲磺酸碘鎓盐(96.8mg,0.2mmol),得到产物83.5mg,收率为90%。
[0042]1h nmr(500mhz,dmso-d6)δ=7.64(d,j=8.0hz,1h),7.19(d,j=8.3hz,1h),6.92(d,j=8.1hz,1h),6.78(d,j=8.2hz,1h),5.25(s,1h),3.94(q,j=7.1hz,2h),2.24(d,j=17.4hz,6h),1.93(d,j=16.6hz,6h),1.81(s,3h),1.10(t,j=7.1hz,3h).
13
c nmr(126mhz,dmso)δ163.8,163.6,149.6,141.1,137.8,136.9,136.0,135.9,135.5,132.1,131.2,130.2,115.8,103.5,98.5,59.2,20.5,20.3,20.1,18.1,16.6,14.7.hrms m/z(esi):calcd for c
22h26
io3[m+h]
+
465.0921,found 465.0930。产物结构式为:
[0043][0044]
实施例6
[0045]
(z)-3-((4,4'-二氯-2'-碘-6,6'-二甲基-[1,1'-联苯]-2-基)氧)-2-丁烯酸乙酯的合成
[0046]
按实施例1所述的方法,不同的是所用碘鎓盐底物为3,7-二氯-1,9-二甲基二苯并[b,d]三氟甲磺酸碘鎓盐(104.8.mg,0.2mmol),得到产物66.5mg,收率为66%。
[0047]1h nmr(500mhz,dmso-d6)δ=7.84(s,1h),7.46(s,1h),7.24(s,1h),6.93(s,1h),5.54(d,j=0.9hz,1h),4.00
–
3.95(m,2h),2.06(s,3h),1.97(s,3h),1.91(s,3h),1.11(t,j=7.1hz,3h).
13
c nmr(126mhz,dmso-d6)δ163.5,162.0,152.4,140.7,139.9,139.3,135.5,133.5,133.1,131.9,130.0,125.2,114.8,106.7,102.2,59.6,21.1,20.2,19.5,14.6.hrms m/z(esi):calcd for c
20h20
cl2io3[m+na]
+
526.9648,found 526.9656。产物结构式为:
[0048][0049]
实施例7
[0050]
(z)-3-((2',6-二氯-6'-碘-[1,1'-联苯]-2基)氧)-2-丁烯酸乙酯的合成
[0051]
按实施例1所述的方法,不同的是所用碘鎓盐底物为1,9-二甲基二苯并[b,d]三氟甲磺酸碘鎓盐(99.2mg,0.2mmol),得到产物74.2mg,收率为78%。
[0052]1h nmr(500mhz,dmso-d6)δ=7.94(d,j=7.9hz,1h),7.61(d,j=8.1hz,1h),7.48(t,j=8.2hz,1h),7.39(d,j=8.1hz,1h),7.18(t,j=8.0hz,1h),7.07(d,j=8.3hz,1h),5.47(s,1h),3.97(q,j=7.1hz,2h),1.96(s,3h),1.10(t,j=7.1hz,3h).
13
c nmr(126mhz,dmso)δ163.7,161.7,152.9,138.6,137.9,134.0,133.5,132.3,131.9,131.2,129.5,124.7,117.2,106.2,102.3,59.6,20.0,14.7..hrms m/z(esi):calcd for c
18h15
cl2inao3[m+na]
+
498.9336found 498.9335。产物结构式为:
[0053][0054]
实施例8
[0055]
(e)-2-氯-3-((2'-碘-6,6'-二甲基-[1,1'-联苯]-2-基)氧)-2-丁烯酸乙酯的合成
[0056]
按实施例1所述的方法,不同的是所用1,3-二羰基化合物为2-氯乙酰乙酸乙酯(0.36mg,0.22mmol),得到产物66.7mg,收率为71%。
[0057]1h nmr(500mhz,dmso-d6)δ=7.78(d,j=7.7hz,1h),7.32(t,j=8.0hz,2h),7.13(d,j=7.6hz,1h),7.03(t,j=7.7hz,1h),6.83(d,j=8.1hz,1h),4.09(dd,j=7.1,5.4hz,2h),2.13(s,3h),2.00(s,3h),1.90(s,3h),1.10(t,j=7.1hz,3h).
13
c nmr(126mhz,dmso-d6)δ161.8,157.5,151.6,141.0,138.6,137.9,136.7,133.6,130.2,130.0,129.4,125.7,114.7,113.1,101.6,61.9,21.3,19.6,18.8,14.4.hrms m/z(esi):calcd for c
20h20
clinao3[m+na]
+
493.0038found 493.0039。产物结构式为:
[0058]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1