用于CO2封存的方法和装置
用于co2封存的方法和装置
1.本技术是申请日为2015年12月18日提交的申请号为201580076509.7,发明名称为“用于co2封存的方法和装置”的申请的分案申请。
发明领域
2.本公开内容涉及用于co2封存(co
2 sequestration)的方法和装置。
3.发明背景
4.二氧化碳(co2)构成大气的约0.04%(百万分之400)。尽管其相对小的总浓度,但co2是强有力的温室气体,其在调节地球的表面温度方面起着重要作用。目前,人为的co2产生正在以大于其被消耗和/或储存的速率发生,这导致大气中co2浓度在增加。存在的越来越多的担心是,co2在地球的大气中的上升的水平可能呈现重大的环境挑战。因此,在开发用于从排放物流和大气中除去co2并以防止其将来释放到大气中的方式将其储存的方法方面存在越来越多的兴趣。这种捕获和储存被统称为co2封存。
5.发明简述
6.本公开内容大体上涉及用于经由新颖的催化系统捕获和封存co2的装置和方法。
7.许多实施方案涉及用于二氧化碳封存的方法,方法包括:
8.·
将二氧化碳溶解到水溶液中以形成由矿物欠饱和水平(mineral undersaturation level)界定的二氧化碳水溶液;
9.·
将二氧化碳水溶液与封存剂组合;
10.·
将水合催化剂滴定(titrate)到二氧化碳水溶液中,使得至少在第一催化区域内形成催化剂和二氧化碳水溶液的混合物,所述第一催化区域包围第二界面催化区域,所述第二界面催化区域位于在混合物与碳酸盐封存剂之间的界面处的层流边界层内;以及
11.·
使二氧化碳水溶液与催化剂在第一催化区域内反应,以在第二界面催化区域附近产生质子,使得质子溶解封存剂;
12.·
使在二氧化碳水溶液内的二氧化碳与在第二界面催化区域内的溶解的封存剂反应,以产生至少包含碳酸氢盐的流出物;并且
13.·
其中在第二界面催化区域内,封存剂的溶解被增强,使得在催化区域内的封存剂的总溶解速率高于当暴露于具有相同的矿物欠饱和水平的二氧化碳水溶液时的封存剂的未催化溶解速率。
14.在一些其他实施方案中,封存剂选自由金属碳酸盐或硅酸盐矿物组成的组。
15.在仍其他实施方案中,封存剂是碳酸钙,并且催化剂是碳酸酐酶或碳酸酐酶类似物中的一种。
16.在还其他实施方案中,碳酸盐封存剂的总溶解速率比当暴露于具有相同的矿物欠饱和水平的二氧化碳水溶液时的碳酸盐封存剂的未催化溶解速率高至少一个数量级。
17.在还又其他实施方案中,矿物欠饱和水平保持在小于0.5。
18.在还又其他实施方案中,该方法还包括将至少第一催化区域和第二界面催化区域放置于至少500psi的压力下,使得封存剂的溶解速率相对于处于相同的矿物欠饱和度
(mineral undersaturation)的封存剂的非加压溶解速率被增加。
19.在还又其他实施方案中,该方法包括将至少第二界面催化区域保持在不大于200℃的温度。
20.在还又其他实施方案中,还包括使水溶液与调节剂(condition agent)反应,以减少在二氧化碳水溶液中的表面中毒离子(surface poisoning ion)。
21.在还又其他实施方案中,水溶液具有接近中性的ph。
22.在还又其他实施方案中,水溶液是盐水溶液。
23.在还又其他实施方案中,二氧化碳水溶液以测量的等分部分被组合,使得矿物欠饱和水平保持在恒定水平。
24.在还又其他实施方案中,该方法还包括在至少第一催化区域内搅拌水溶液,使得形成混合区,其中二氧化碳水溶液和催化剂互相混合,并且其中混合区在第一催化区域内。
25.在还又其他实施方案中,搅拌形成围绕第二界面催化区域的扩散边界层,所述扩散边界界定围绕封存剂的界面区域约10微米的体积。
26.在还又其他实施方案中,该方法还包括使封存剂的表面粗糙化,使得封存剂的粒度不大于100μm。
27.在还又其他实施方案中,该方法还包括收集和过滤来自反应的流出物以捕获催化剂或未反应的二氧化碳水溶液中的至少一种,以及将催化剂和未反应的二氧化碳水溶液重新引入第一催化区域中。
28.在还又其他实施方案中,催化剂起作用以至少催化水溶液中的水的质子传递作用并使溶液内的co2水合。
29.在还又其他实施方案中,溶解速率是受扩散速率限制的。
30.在还又其他实施方案中,存在压力被增加或温度被降低中的至少一种,以增加矿物欠饱和度。
31.许多其他实施方案涉及用于封存二氧化碳的装置,装置包括:
32.·
至少一个反应器容器,其界定封闭的体积;
33.·
催化剂、封存剂、co2气体和水溶液的至少一个源;
34.·
至少一个输入端,其在至少一个源和至少一个反应器容器的封闭的体积之间流体连通;和
35.·
至少一个输出端,其与至少一个反应器容器的封闭的体积流体连通;
36.·
其中所述至少一个输入端被布置成使得co2气体和水溶液组合以形成二氧化碳水溶液,并且其中二氧化碳水溶液和催化剂作为混合物在至少一个反应器的封闭的体积内、在包围第二界面催化区域的第一催化区域内被递送,所述第二界面催化区域围绕封存剂设置并且位于在混合物和碳酸盐封存剂之间的界面处的层流边界内。
37.在其他实施方案中,封存剂和催化剂中的至少一种被物理地限制在第一催化区域内。
38.在还其他实施方案中,封存剂是碳酸钙,并且催化剂是碳酸酐酶或碳酸酐酶类似物。
39.在还其他实施方案中,封存剂是非碳酸盐封存剂。
40.在还又其他实施方案中,水溶液是盐水溶液或淡水中的一种。
41.在还又其他实施方案中,该装置还包括被配置成至少过滤穿过其中的催化剂的至少一个酶分离过滤器,所述分离过滤器与至少一个反应器容器的至少一个输出端流体连通。
42.在还又其他实施方案中,该装置还包括至少一个颗粒过滤系统,所述颗粒过滤系统被配置成至少过滤穿过其中的封存剂,所述颗粒过滤系统与至少一个反应器容器的至少一个输出端流体连通。在一些这样的实施方案中,颗粒过滤系统包括与至少一个反应器容器流体连通的沉降室。
43.在还又其他实施方案中,封存剂被形成为100微米或更小的晶粒(grain)。
44.在还又其他实施方案中,该装置还包括第一反应器容器和第二反应器容器,并且其中第二反应器容器的输入端与第一反应器容器的至少一个输出端流体连通,第二反应器容器布置成使得来自第一反应器容器的流出物在第二反应器容器的封闭的体积内被递送到第二容器催化区域,其中设置第二催化剂,所述第二催化剂包围位于在流出物和第二碳酸盐封存剂之间的界面处的层流边界内的第二容器界面催化区域。在一些这样的实施方案中,两个反应器容器的温度、压力和ph是独立地可变的。在一些其他这样的实施方案中,第二反应器容器具有比第一反应器容器更低的温度。
45.在还又其他实施方案中,该装置还包括混合室,混合室与至少一个反应容器的入口流体连通,并且其中co2气体输入和水溶液输入在引入少一个反应容器中之前被混合。
46.在还又其他实施方案中,来自至少一个输出端的至少包含未反应的co2的流出物被重新引入反应容器的至少一个输入端中的一个。
47.在还又其他实施方案中,来自至少一个输出端的流出物具有低于引入至少一个输入端中的co2的分压的co2的分压。
48.本技术提供了以下内容:
49.1).一种用于二氧化碳封存的方法,包括:
50.将二氧化碳溶解到水溶液中以形成由矿物欠饱和水平界定的二氧化碳水溶液;
51.将所述二氧化碳水溶液与封存剂组合;
52.将水合催化剂滴定到所述二氧化碳水溶液中,使得至少在第一催化区域内形成催化剂和二氧化碳水溶液的混合物,所述第一催化区域包围第二界面催化区域,所述第二界面催化区域位于在所述混合物和所述碳酸盐封存剂之间的界面处的层流边界层内;以及
53.使所述二氧化碳水溶液与所述催化剂在所述第一催化区域内反应,以在所述第二界面催化区域附近产生质子,使得所述质子溶解所述封存剂;
54.使在所述二氧化碳水溶液内的所述二氧化碳与在所述第二界面催化区域内的所溶解的封存剂反应,以产生至少包含碳酸氢盐的流出物;并且
55.其中在所述第二界面催化区域内,所述封存剂的溶解被增强,使得在所述催化区域内的所述封存剂的总溶解速率高于当暴露于具有相同的矿物欠饱和水平的二氧化碳水溶液时的所述封存剂的未催化溶解速率。
56.2).如1)所述的方法,其中所述封存剂选自由金属碳酸盐或硅酸盐矿物组成的组。
57.3).如1)所述的方法,其中所述封存剂是碳酸钙,并且所述催化剂是碳酸酐酶或碳酸酐酶类似物中的一种。
58.4).如1)所述的方法,其中所述碳酸盐封存剂的总溶解速率比当暴露于具有相同
的矿物欠饱和水平的二氧化碳水溶液时的所述碳酸盐封存剂的未催化溶解速率高至少一个数量级。
59.5).如1)所述的方法,其中所述矿物欠饱和水平保持在小于0.5。
60.6).如1)所述的方法,还包括将至少所述第一催化区域和所述第二界面催化区域放置于至少500psi的压力下,使得所述封存剂的溶解相对于处于相同的矿物欠饱和度的所述封存剂的非加压溶解速率被增加。
61.7).如1)所述的方法,还包括将至少所述第二界面催化区域保持在不大于200℃的温度。
62.8).如1)所述的方法,还包括使所述水溶液与调节剂反应以减少在所述二氧化碳水溶液中的表面中毒离子。
63.9).如1)所述的方法,其中所述水溶液具有接近中性的ph。
64.10).如1)所述的方法,其中所述水溶液是盐水溶液。
65.11).如1)所述的方法,其中所述二氧化碳水溶液以测量的等分部分被组合,使得所述矿物欠饱和水平被保持在恒定水平。
66.12).如1)所述的方法,还包括在至少所述第一催化区域内搅拌所述水溶液,使得形成混合区,其中所述二氧化碳水溶液和所述催化剂互相混合,并且其中所述混合区在所述第一催化区域内。
67.13).如12)所述的方法,其中所述搅拌形成围绕所述第二界面催化区域的扩散边界层,所述扩散边界界定围绕所述封存剂的界面区域约10微米的体积。
68.14).如1)所述的方法,还包括使所述封存剂的表面粗糙化,使得所述封存剂的粒度不大于100μm。
69.15).如1)所述的方法,还包括收集和过滤来自所述反应的所述流出物以捕获催化剂或未反应的二氧化碳水溶液中的至少一种;以及
70.将所述催化剂和所述未反应的二氧化碳水溶液重新引入所述第一催化区域中。
71.16).如1)所述的方法,其中所述催化剂起作用以至少催化所述水溶液中的水的质子传递作用并且使所述溶液内的co2水合。
72.17).如1)所述的方法,其中所述溶解速率是受扩散速率限制的。
73.18).如1)所述的方法,其中所述压力被增加或所述温度被降低中的至少一种,以增加矿物欠饱和度。
74.19).一种用于封存二氧化碳的装置,包括:
75.至少一个反应器容器,其界定封闭的体积;
76.催化剂、封存剂、co2气体和水溶液的至少一个源;
77.至少一个输入端,其在所述至少一个源和所述至少一个反应器容器的所述封闭的体积之间流体连通;以及
78.至少一个输出端,其与所述至少一个反应器容器的所述封闭的体积流体连通;
79.其中所述至少一个输入端被布置成使得所述co2气体和所述水溶液组合以形成二氧化碳水溶液,并且其中所述二氧化碳水溶液和所述催化剂作为混合物在所述至少一个反应器的所述封闭的体积内、在包围第二界面催化区域的第一催化区域内被递送,所述第二界面催化区域围绕所述封存剂设置并且位于在所述混合物和所述碳酸盐封存剂之间的界
面处的层流边界内。
80.20).如19)所述的装置,其中所述封存剂和所述催化剂中的至少一种被物理地限制在所述第一催化区域内。
81.21).如19)所述的装置,其中所述封存剂是碳酸钙,并且所述催化剂是碳酸酐酶或碳酸酐酶类似物。
82.22).如19)所述的装置,其中所述封存剂是非碳酸盐封存剂。
83.23).如19)所述的装置,其中所述水溶液是盐水溶液或淡水中的一种。
84.24).如19)所述的装置,还包括被配置成至少过滤穿过其中的催化剂的至少一个酶分离过滤器,所述分离过滤器与所述至少一个反应器容器的至少一个输出端流体连通。
85.25).如19)所述的装置,还包括至少一个颗粒过滤系统,所述颗粒过滤系统被配置成至少过滤穿过其中的封存剂,所述颗粒过滤系统与所述至少一个反应器容器的至少一个输出端流体连通。
86.26).如25)所述的装置,其中所述颗粒过滤系统包括与所述至少一个反应器容器流体连通的沉降室。
87.27).如19)所述的装置,其中所述封存剂被形成为100微米或更小的晶粒。
88.28).如19)所述的装置,还包括至少第一反应器容器和第二反应器容器,并且其中所述第二反应器容器的输入端与所述第一反应器容器的所述至少一个输出端流体连通,所述第二反应器容器被布置成使得来自所述第一反应器容器的流出物在所述第二反应器容器的所述封闭的体积内被递送到第二容器催化区域,其中设置第二催化剂,所述第二催化剂包围位于在所述流出物和第二碳酸盐封存剂之间的界面处的层流边界内的第二容器界面催化区域。
89.29).如28)所述的装置,其中所述两个反应器容器的温度、压力和ph是独立地可变的。
90.30).如28)所述的装置,其中所述第二反应器容器具有比所述第一反应器容器更低的温度。
91.31).如19)所述的装置,还包括混合室,所述混合室与所述至少一个反应容器的入口流体连通,并且其中co2气体输入和水溶液输入在引入所述至少一个反应容器中之前被混合。
92.32).如19)所述的装置,其中来自所述至少一个输出端的至少包括未反应的co2的流出物被重新引入所述反应容器的所述至少一个输入端中的一个。
93.33).如19)所述的装置,其中来自所述至少一个输出端的流出物具有低于引入所述至少一个输入端中的co2的分压的co2的分压。
94.另外的实施方案和特征部分地在下面的描述中被阐述,并且部分地将在查阅说明书之后对于本领域技术人员变得明显或可以通过本发明的实践来了解。本发明的性质和优点的进一步理解可以通过参考说明书的剩余的部分和形成本公开内容的一部分的附图来实现。
95.附图简述
96.参考以下附图和数据图将更充分地理解本描述,所述附图和数据图被提供作为本发明的示例性实施方案并且不应被解释为对本发明的范围的完整叙述,其中:
97.图1提供方解石的溶解速率针对ph的示意图。
98.图2提供根据本发明的实施方案的碳封存工艺的示意性流程图。
99.图3提供根据常规的封存方法和根据本发明的实施方案绘制封存速率相对于方解石欠饱和度的数据图。
100.图4a提供绘制对于不同碱度(alk)值的pco2相对于溶解无机碳(dic)的数据图;并且
101.图4b提供绘制矿物欠饱和度相对于溶解无机碳(dic)的数据图。
102.图5提供绘制方解石的溶解速率相对于ph的根据cubillas(cubillas等人,chem.geo.,216:59(2005))调整的数据图。
103.图6提供绘制碳酸盐的溶解度相对于mg的摩尔%的数据图。
104.图7提供绘制方解石溶解速率相对于矿物欠饱和度(1-ω)的数据图。
105.图8提供绘制方解石溶解度作为co2的温度和压力的函数的根据barnes(barnes(编辑),barnes(编辑),hydrothermal ore deposits,(1997),其公开内容通过引用并入本文)调整的数据图。
106.图9提供绘制方解石的溶解速率作为饱和状态和磷酸盐浓度的函数的数据图。
107.图10a提供绘制压力对方解石饱和状态的影响的数据图。
108.图10b解释对于给定的欠饱和度的压力对溶解速率的影响。
109.图11提供绘制方解石溶解度作为盐度的函数的根据coto等人(coto等人fluid phase equilibria 324:1-7(2012),其公开内容通过引用并入本文)调整的数据图。
110.图12提供根据常规的系统的碳封存工艺的示意性流程图。
111.图13a提供根据本发明的实施方案的单容器碳封存装置的示意图。
112.图13b提供根据本发明的实施方案的双容器碳封存装置的示意图。
113.图14提供根据本发明的实施方案的用于碳封存的工艺中的酶分离过滤器的示意图。
114.发明详述
115.现在转向附图,提供了根据本发明的实施方案的利用受控催化的封存剂反应用于碳封存的工艺和装置。在许多实施方案中,用于碳封存的系统和方法包括对封存剂例如矿物封存剂(例如碳酸钙)的溶解的受控催化,以提供来自气相的co2的容易且永久的封存。包括根据许多实施方案的受控催化的工艺和装置允许产生流出的流出物(effluent outflow),其中co2的浓度低于在反应物流入物中发现的浓度。在实施方案中,受控催化工艺和装置产生的封存剂溶解速率至少大于处于相同的矿物欠饱和度的未催化系统的封存剂溶解速率。在多个实施方案中,受控催化工艺和装置产生的封存剂溶解速率比处于相同的矿物欠饱和度的未催化系统的封存剂溶解速率大至少一个数量级。在其他实施方案中,封存剂溶解速率比处于相同的溶液矿物欠饱和度的未催化系统的封存剂溶解速率大至少两个数量级。在还其他实施方案中,封存剂溶解速率比处于相同的溶液矿物欠饱和度的未催化系统的封存剂溶解速率大至少三个数量级。在多个实施方案中,矿物欠饱和度被保持在接近平衡。在一些这样的实施方案中,封存剂溶解涉及碳酸盐至碳酸根离子的溶解。在其他这样的实施方案中,溶解可以包括一种或更多种封存剂,包括例如方解石、文石、白云石和球霰石、硅酸盐矿物等。
116.用于碳储存的方法还可以至少包括溶解的co2与封存剂(比如例如碳酸钙、文石、白云石、球霰石等)在受控催化条件下的反应,以增加封存剂在固定的矿物欠饱和度的溶解速率。在实施方案中,可以调整在这样的反应中的催化剂的浓度以使封存剂表面处的局部质子最大化,以加速封存剂的溶解,这是比如例如经由从在封存剂附近的含水的co2储器或h2o储器补充1)结合的质子例如水合co2(即碳酸);或2)游离的质子(例如,来自水的质子传递作用)中的一者或二者来进行的。在许多这样的实施方案中,该方法包括质子的受控催化形成以加速封存剂溶解,并因此加速封存剂与溶解的co2的封存反应。
117.方法和装置的许多实施方案包括形成双受控催化区域(two-controlled catalysis region)。在许多这样的实施方案中,催化材料(例如,酶,诸如碳酸酐酶)可以以受控的方式作为催化剂被引入到含有封存剂和含水co2的原料的反应器容器,以产生包围靠近封存剂(例如,在封存剂的界面处和/或在围绕封存剂的层流边界层内)的第二界面催化区域的第一催化区或第一催化区域,使得在催化区域和界面催化区域之间的屏障最小化。
118.在包含这样的双受控催化区域的实施方案中的封存反应的动力学可以根据可以独立地被控制的多个参数进行配置。在如此设计的催化方法的一些实施方案中,催化剂在催化区域或界面催化区域中的任一个或二者中的浓度可以被配置以优化在界面催化区域处的局部质子浓度,所述优化比如例如是通过从co2含水储器补充h2co3(溶解的co2)和/或最大化水的质子传递作用中的一者或二者。在其他实施方案中,可以增加在催化区域和/或界面催化区域内的温度和/或压力,以增加封存剂在固定的矿物欠饱和度的溶解速率,如上文所描述的。在一些实施方案中,各种反应物(例如质子和co2)的浓度梯度可以被配置成使得在界面催化区域内递送最大量的反应物,使得在一些实施方案中,反应是受反应物在界面催化区域内的递送、而不是其从界面催化区域中的除去的扩散限制。
119.转向封存剂,在一些实施方案中,封存剂可以是矿物材料,例如诸如碳酸盐(例如,金属碳酸盐)、硅酸盐等。合适的钙碳酸盐可以包括任何数目的此类矿物碳酸盐物质,例如诸如方解石、文石、白云石、球霰石等。在多个实施方案中,可以组合使用一种或更多种此类封存剂。因此,许多实施方案使用金属碳酸盐封存剂,而一些实施方案使用非碳酸盐封存剂,例如诸如硅酸盐矿物,并且在一些另外的实施方案中,封存剂包括各种矿物掺混物。最后,在还其他实施方案中,封存剂是碳酸盐固体和非碳酸盐固体的组合。不管使用的特定封存剂,封存剂的粒度可以被配置以优化材料的表面积,使得例如表面积被增加以增加界面催化区域至催化区域的暴露,并且从而增加矿物的溶解,并使催化区域和界面区域之间的边界层最小化。示例性实施方案使用这样的封存剂材料的毫米级或微米级颗粒。最后,在其他实施方案中,封存剂的矿物欠饱和度可以通过操纵在催化区域和界面催化区域中的一者或二者内的温度、压力、盐度和/或co
2(水溶液)
浓度来调整,如将在下文更详细地讨论的。
120.在许多实施方案中,可以使用装置来实施如上文所描述的碳封存工艺。在多个实施方案中,该装置可以包括至少一个监测和调节相关参数的控制系统和至少一个反应器,所述至少一个反应器的输入端可以至少包括溶解在水溶液中的co2、碳酸盐和催化剂,其中反应器适于形成双区域受控催化区(two-region controlled catalysis zone),其中含有受控浓度的催化剂的第一催化区域包围在封存剂附近(例如环绕封存剂的层流边界层)的第二界面催化区域,使得碳的水合和封存的动力学速率是可控的。在许多这样的实施方案
中,反应器和催化区域与界面催化区域适于催化在封存剂(例如,碳酸钙、金属碳酸盐、硅酸盐、矿物粘土等)附近的质子(例如结合的质子或游离的质子)的产生,以增加封存剂的溶解速率和伴随的封存剂离子(例如来自诸如碳酸钙的金属碳酸盐的碳酸根离子)的产生。在若干实施方案中,该装置被配置成在质子(即,游离的或结合的例如碳酸)的存在下催化碳酸钙的溶解以形成钙和碳酸氢盐。在许多实施方案中,催化可以起作用以增加反应容器中水的质子传递作用和/或溶解的co2(即,碳酸)的形成。
121.可以针对每种特定的封存催化来进一步优化反应物和此类装置的配置。因此:
122.·
在一些实施方案中,水溶液可以至少包括淡水或海水,并且可以具有接近中性的ph。
123.在另外的实施方案中,催化剂可以包括适合用于从co2水溶液中产生质子的任何材料,包括例如镍材料和酶例如碳酸酐酶或改性的碳酸酐酶,比如可以是本领域中已知的。
124.·
在反应器内,可以存在混合区,其中环绕封存剂(例如碳酸盐)的扩散边界层被减少(例如通过搅拌、混合水溶液和/或将其放置于流化床中)。
125.·
实施方案可以包含不同尺寸的封存剂的颗粒。在一些示例性实施方案中,可以使用微米级的封存剂颗粒;而在其他实施方案中,可以形成较大的封存剂板(sequestration agent slab)或封存剂床(sequestration agent bed)。
126.·
在一些实施方案中,金属碳酸盐、矿物粘土或硅酸盐可以被用作封存剂。
127.·
一些实施方案可以包括反馈回路,所述反馈回路控制并且连续地调节矿物欠饱和度以及催化剂、co2和封存剂(例如诸如caco3)的输入,使得两个受控的且活性的催化区域被维持在封存剂附近(例如,在界面处或在其界面周围并环绕这样的界面区域的层流边界层内)的反应容器内,并且在这样的催化区域内的封存速率效率(sequestration rate efficiency)被最大化。
128.·
在反应器和任选的反馈回路中,在本发明的实施方案中,至少还可以监测诸如ph、催化剂浓度和co2浓度的参数。
129.在这些系统的许多实施方案中,可以调节这样的工艺参数中的一个或更多个,使得实现仅受碳酸根离子的扩散速率限制的碳封存的速率,即反应受产物输送限制。在其他实施方案中,可以控制参数以提供过量的质子:结合的,例如以水合co2的形式(例如碳酸);或游离的,例如来自水的质子传递作用,使得封存反应速率受限于质子和co2向封存剂表面的扩散,即反应受限于反应物输送。
130.另外,本发明的一些实施方案还可以包括第二反应器,该第二反应器被单独地参数化以对任何残余的co2进一步中和或脱气。在使用该第二反应器的实施方案中,输入可以是从第一反应器排出的水溶液。在一些实施方案中,可以监测并且单独地控制包括至少co2浓度、水溶液输入、碳酸盐饱和度和催化剂输入的第二反应器参数。在还其他实施方案中,该装置可以包含任何数目或任何配置的反应容器,根据实施方案,所述反应容器中的任一个或更多个可以设置有双催化区域配置。
131.在另外的实施方案中,过滤器和其他设备被用于将封存剂和/或催化剂保留在反应器容器内。对于封存剂保留,在一些实施方案中,使用颗粒过滤系统通过过滤流出水来保留封存剂。在还其他实施方案中,使用沉降室保留封存剂,沉降室允许反应物沉降,使得可以排出不含固体的流出水。在这样的实施方案中,沉降室可以是反应器容器的一部分,或可
以是单独专用的容器。在还另外的实施方案中,可以使用封存剂保留策略的组合。在许多实施方案中,使用各种过滤系统保留催化剂。在一些实施方案中,催化剂被附接到自由浮动的固体珠(free-floating solid bead),所述自由浮动的固体珠使用颗粒过滤系统或沉降室被保留在反应器中,如上文关于封存剂所描述的。在一些其他实施方案中,使用酶分离技术保留溶解的催化剂。在还其他实施方案中,使用可以位于反应容器内或反应容器外部的催化剂表达生物体(catalyst-expressing organism)来补充催化剂。这样的实施方案还可以包括用于除去/过滤可能包含在流出物内的有害金属或其他污染物的方法和装置。
132.在多个实施方案中,根据实施方案反应的富含co2的原料产生具有降低的co2分压的流出物(outflow)。在其他实施方案中,反应器流出物可以具有稍微增强的碱度,这可能是环境有利的。在使用海水的实施方案中,此流出物可以被排出到沿海环境中,这可以减轻有害的“酸化”水。在使用淡水和/或盐水(例如海水)的实施方案中,流出物可以任选地被用于农业用途或商业用途。在其他实施方案中,催化剂可以被结合到固体表面,使得催化剂不与来自反应的产物一起被排出到环境中,或可选择地催化剂可以从流出物中被过滤出来。在一些实施方案中,允许活性催化剂中的一些或全部保留在流出物中。在其他实施方案中,催化剂保留在流出物中,但通过加热或其他手段被去活化。在一些实施方案中,流出物被排出到环境中。在还其他实施方案中,流出物可以再富集有co2并返回至反应容器一次或多次,然后其被最终排出。
133.最后,根据本发明的还其他实施方案,可以通过一种或更多种方法改变对于含水的(或溶解的)co2的co2水合速率,所述方法包括但不限于引入催化剂、改变入口气体流(即co2)的流动以及增加水溶液与给定体积的气态co2接触的表面积。
134.碳封存方法综述
135.碳封存包括两个步骤:碳捕获(从大气中暂时性除去碳)和碳储存(从大气中永久性除去)。为了缓解co2的上升的水平,碳封存的规模必须与排放物水平相称。目前,人为碳排放物每年约为400亿吨(40gt)的二氧化碳。由于排放物的此量级,为了使封存策略可行,必须能够跟上人为排放物的速率。目前可用的碳封存策略不能以足以匹配人为二氧化碳排放物的量的速率永久性地封存碳。
136.许多碳封存策略是不足够的,因为虽然它们提供临时捕获co2的方法,但它们不提供永久性地储存co2以防止其释放回到大气中的方法。因为碳封存需要碳捕获和碳储存二者,所以这些策略不能说是真正地封存碳。捕获并且仅暂时性储存co2的碳封存策略的实例是主要涉及气态co2的溶解和含水co2的水合的碳封存策略。将co2气体溶解在水中对于封存是无效的,因为一旦储存水接触大气,溶液中的co2就将开始脱气离开溶液。此外,这个过程相对迅速,在某些情况下发生数月到数周到数小时的时间。因此,并且如下文将更详细地讨论的,这种迅速脱气需要二次储存要求,例如诸如地下水注入(ground water injection)以防止碳释放回到环境中。
137.对于捕获co2的许多常规方法的临时性质的原因涉及它们如何试图“储存”co2的性质。特别地,在这些方法中的一般策略是增加co2的“水合”(即,co2到溶液中的溶解),从而增加在理论上正从大气被带出的co2的量。在真正的水合中,碳根据下文的反应、作为碳酸(h2co3)被捕获,
138.139.然而,将co2溶解到溶液中的反应动力学是复杂的,并且co2至碳酸(h2co3)的真正水合是整个反应中的相对较小的部分。具体地,co2的水合(即碳酸的形成)非常缓慢,并且这种水合也比co2的脱水即碳酸逆转至co
2(水溶液)
缓慢得多。这是因为反应热力学对于形成h2co3是高度不利的。因此,水合co2的溶液通常主要含有co
2(水溶液)
,具有非常少量的h2co3。例如,在25℃和1个大气压下,对于h2co3和co
2(水溶液)
的k
eq
值为0.0015。因此,co
2(水溶液)
:h2co3在室温下的比率为约670。为此,专注于“水合”的封存策略主要产生co2的溶液
(水溶液)
。因此,术语h2co3*通常被用于描述通过这样的水合反应形成的co2和h2co3的含水混合物,其中h2co3*是其他两种物质的总和。简而言之,专注于水合的许多封存策略涉及h2co3*而不是h2co3的形成。
140.此外,由于热力学是如此不利的,如果溶液含有大量的co
2(水溶液)
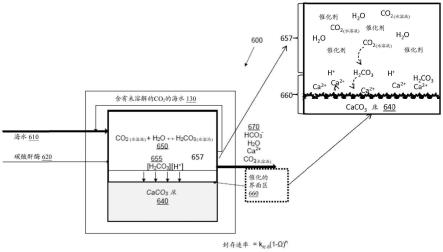
,为了驱动水合的目的,则可能发生脱气。因此,很可能的是,当co
2(水溶液)
接触大气时,co
2(水溶液)
将离开溶液并返回到气态co2。此外,随着[co
2(水溶液)
]由于脱气而降低,动力学也成为使水合甚至更不有利的因素。因此,co2至溶液中的溶解或co2的“水合”本身并不构成封存,因为它是一种动态过程,其中co2恒定地溶解到并且释放回环境中,并且因此不以永久的方式有效地储存反应的co2,除非流体被永久性地与环境隔离,例如通过被注入不可渗透的储存储器中。此类系统的缺点是它们经历泄漏,并且因此需要持续的监测和缓解措施来检测和防止泄漏回到环境中。
[0141]
为了更有效地将co2永久地储存,可以使其与某些物质反应以化学地固定co2。以这种方式封存co2的实例包括有机碳固定(即光合作用)和与封存剂比如石灰石的反应。来自光合作用的碳固定是在被称为卡尔文循环(calvin cycle)的一系列反应中固定气态co2。然而,即使这种光合反应也不提供固定碳的永久方式,因为co2所储存于其中的树木或植物将最终死亡,并且当它们死亡时,储存在植物物质中的碳将通过白蚁和微生物的呼吸返回到大气。相比之下,通过与石灰石(caco3)的反应,地球(planet)将在以下反应中自然地消耗几乎所有的人为co2排放物:
[0142][0143]
在自然界中,这种反应发生在深海中,其中欠饱和的水与含碳酸盐的沉积物接触。然而,这种反应的动力学非常缓慢。在海洋-大气-沉积物系统中存在动力学限制,其中一些与反应物输送有关(archer等人,global biogeochem.cy 12:259-276(1998),其公开内容通过引用并入本文)。最初,co2(g)与co
2(水溶液)
在海洋表面处的交换将花费几百年。接着,在表面处的co
2(水溶液)
必须从表面行进至深海,这个过程花费大约1000年。并且最后,当co
2(水溶液)
达到海洋沉积物时,其必须与caco3反应,其在几千年的时段上发生。总的来说,评估这些过程的e-折时段(e-folding timescale)是6800年(archer等人,1998,上文引用的)。如可以看出的,这两种自然反应过程均具有与反应物输送相关的严重缺点,并且对于解决人为co2排放物所必需的人为时段的类型将不是有效的。
[0144]
除了与自然环境中的反应物输送相关的动力学挑战外,溶解本身也非常缓慢。以下等式说明了co2的水合以及碳酸和碳酸根离子的浓度如何通过简单的酸碱反应紧密地联系:
[0145][0146]
碳酸钙溶解的动力学通常由以下等式描述:
[0147]
速率=k(1-ω)n[0148]
其中ω是矿物的饱和状态,其被定义为有效原位钙浓度和碳酸根离子浓度的乘积除以该矿物的表观溶度积([ca
2+
][co
32-]/k'
sp
);k是速率常数;并且n是反应级数。反应级数没有物理意义或化学意义;其仅描述了在饱和状态和溶解速率之间的经验关系。在这组等式中,热力学势(thermodynamic potential)或矿物欠饱和度(1-ω)驱动溶解速率。
[0149]
已经作出尝试来增加碳酸盐溶解的动力学,但到目前为止还没有成功地设计有效的或可行的解决方案。例如,作出尝试以通过在地球表面处使co2与石灰石反应来增加在水柱中观察到的地质学溶解速率(geological rate of dissolution),从而除去由反应物从海洋的表面到海洋的底部的输送造成的延迟。在美国专利第7,655,193号中描述的工艺中,装载有石灰石小球并设计成保持溶解在海水中的稳定的co2流的反应器可以能够合理地保持30%的矿物欠饱和度(相当于用含有约4,000ppm的约pco2的气体平衡海水),以实现6
·
10-6
g/cm2/天的溶解速率(subhas等人geochimica et cosmochimica acta,第170卷,1(2015),第51-68页,其公开内容通过引用并入本文)。然而,即使使用非常高的[co2]气体(10%v/v)和1-2周的反应时间,美国专利第7,655,193号中公开的工艺只设法实现6
·
10-5
g/cm2/天的溶解速率。(参见,例如,rau,g.h.(2011).environmental science&technology,45(3),1088-1092,其公开内容通过引用并入本文。)
[0150]
在全球范围内操作,前述碳酸盐溶解的速率单单是太慢而不能充分解决目前的co2排放物水平。应用于每年排放物的40gt的co2的封存,这样的系统将需要大量的碳酸钙被溶解在世界各地数万至数十万的反应器工厂中。例如,使用常规系统溶解足以每年滴定40gt的co2的石灰石将需要在每一侧大约2英里的石灰石立方体。每天,这将需要2.5
·
10
14
g的caco3被溶解。使用类似于美国专利第7,655,193号中所描述的反应器,其具有2m3的体积、含有被打碎成1mm3立方体的1m3的caco3以及处于30%的矿物欠饱和度,溶解反应将需要700亿个反应器。为了进一步说明实施以这种速率操作的封存方法的规模,如果将2m3的反应器放置在尺寸为300m
×
600m
×
10m的工厂中,那么将仍然需要767,000个工厂。以在7,655,193号专利中描述的最大速率操作,工厂数只会减少10倍。如从以上说明中可以看出,为了这种封存方法是实用的,待溶解的co2的量的绝对量级(sheer magnitude)需要更快的溶解速率。
[0151]
矿物欠饱和可以通过增加[co
2(水溶液)
]、降低溶液温度、增加溶液压力和/或将加压的co2气体泵送到水溶液中以允许co2更大的溶解来实现。然而,存在与单独依靠高浓度的co
2(水溶液)
增加反应速率有关的其他不切实际性。特别地,所需类型的冷的、加压的、高[co
2(g)
]气体流需要大量的能量输入来产生。为了节约能量,封存可以被整合到现有的工业过程中。然而,在工业环境中,由于大部分富含co2的流出物流不太可能是冷的,所以不太可能遇到冷的、加压的、高[co
2(g)
]气体流出物流。另一方面,采用高温流,难以将co2保持在溶液中而不耗费大量的能量,这可能抵消与碳排放物相关的封存策略的任何益处。因此,单独依靠气体欠饱和来驱动封存将导致非常低效且不切实际的工艺。
[0152]
本发明的实施方案涉及在水合co2和封存剂之间的界面反应区处使用精心设计的催化反应以增加封存剂溶解速率以用于更快速封存的系统、方法和工艺,这提供了可行的封存剂溶解的方式。在所提出的发明的一些实施方案中,可以使封存速率独立于矿物的饱和状态,使得远离平衡矿物欠饱和对于将反应速率增加至显著高于目前在本领域中描述的
反应速率不是必需的。因此,本发明的实施方案可以比需要高矿物欠饱和度的其他实施方案更实际地被实施。
[0153]
催化的封存参数的描述
[0154]
封存的机理和速率通常由碳酸盐产生的速率界定。如图1中所示,碳酸盐溶解在海水中的速率直接取决于溶液的碱度/ph/dic(例如矿物欠饱和度)。在低碱度(低ph,例如区域1和以下),碳酸盐产生的速率仅限于质子攻击。相比之下,随着碱度:dic比率增加(其中矿物欠饱和度不是如此高,并且co2与碱性水平衡,例如,区域2),非催化溶解速率开始独立于输送控制下降。在“接近中性的”ph范围(例如,在区域2和区域3之间),存在极度下降,这通常防止在这些高ph(例如接近平衡的欠饱和度)状况内co2的有效封存。在本发明的实施方案中,已经发现,质子,并且更具体地引入在封存剂附近的催化反应区域中的游离的(例如来自水的质子传递作用)或结合的(例如碳酸)质子的存在,增加了封存剂的溶解速率,并且特别是在如海水的环境中在co2的永久封存中起着重要的机械学作用,使得可以增加封存速率,使得在一些实施方案中,即使在平衡欠饱和状况(例如接近中性的ph范围)中质子也是输送限制的。换句话说,现在已经发现,通过利用根据实施方案的受控催化方法和装置可以增强区域3中的溶解速率,以表现得更像在区域1和区域2中的溶解速率。
[0155]
常规的机械学模型已经集中在特定的碳酸盐物质及其与矿物表面的相互作用。通常,这些机械学等式由多个项构成,每个项具有一级依赖性。(参见例如,plummer,l.n.,wigley,t.,1976.geochimica et cosmochimica acta 40(2),191-202;shiraki,r.,rock,p.a.,casey,w.h.,2000.aquatic geochemistry 6,87-108;giedhiil,dwighi k.和john w.morse.geochimica et cosmochimica acta 70.23(2006):5802-5813;finneran,david w.和john w.morse.chemical geology 268.1(2009):137-146;arakaki,takeshi和alfonso mucci.aquatic geochemistry 1.1(1995):105-130,其公开内容通过引用并入本文。)方解石在稀溶液中的溶解可以使用三个主要状况来描述:一个由氢离子攻击和扩散所支配的输送控制的状况,以及两个由质子(h2co3(碳酸)或水)攻击所控制的表面控制的状况。如上文关于图1所描述的,不同的封存系统可以利用不同的反应机理。在高ph和低pco2的溶液(例如如海水)中,plummer和wigley的1976年的研究提出,水攻击(water attack)是主要的溶解机理。还认为h2co3攻击在高pco2是有效的。之后,认为其中氢离子、碳酸氢根离子和氢氧根离子在不同ph状况中均用作溶解剂的多组分溶解机理是最好的模型(shiraki,2000)。在海水条件中,占优势的溶解机理被认为是碳酸氢盐攻击,其中碳酸氢根离子充当亲核试剂,并对在矿物表面上的水合钙离子进行亲核攻击。尽管存在h2co3是碳酸盐物质中最酸性的事实,但其不涉及作为标准海水溶解机理的一部分。另一种机械学模型提出,在海水ph的区域内,h2o和h2co3活性决定了方解石的溶解速率(plummer和wigley,1976)。这里再次地,co2水合动力学在溶解速率中的作用未被考虑。
[0156]
特别地,在这些常规方法中,没有考虑co2水合的动力学及其与固相溶解速率的关系。相比之下,在封存系统、封存方法和封存装置的实施方案中,质子物质(游离的或结合的例如h2co3)现在已经被确定为涉及封存剂溶解的占优势的物质,并且提供方法和装置以持续地增加在其附近的现存量(standing stock)。简而言之,质子产生的真正速率(例如,co2至碳酸的水合或水的质子传递作用)被催化性地增强,并且然后质子浓度被维持并直接在封存剂的源处可控地呈现,以在固定的矿物欠饱和度处并且特别是在以前被认为非常接近
平衡以至于太慢的矿物欠饱和度处使溶解速率最大化。因此,在其中封存剂是碳酸盐例如诸如caco3的实施方案中,在机械学上,碳酸盐封存剂的溶解可以表示为:
[0157]
caco
3(s)
+h2co3→
ca
2+
+2hco
3-[0158]
取决于原位ph和其他因素,反应产物可以包括碳酸氢根离子(hco
3-)或可选择地金属碳酸盐(例如诸如碳酸氢钙(ca(hco3)2))。为了本技术的目的,碳酸根离子和碳酸氢盐可以互换地使用。
[0159]
这种反应的化学支撑在概念和应用二者中都与以前在二氧化碳封存方面的尝试根本不同。使用设计的催化方案,系统、工艺和装置的实施方案增加在封存剂的源处的co
2(水溶液)
和水到活性溶解剂(即质子)的转化速率,而不一定需要矿物欠饱和度的伴随的增加,允许可实现的co2封存的总体速率的大幅增加。
[0160]
虽然质子(游离的或结合的)的存在现在已经令人惊奇地发现是参与碳酸盐溶解的占优势的物质,但由于如上文所描述的,水合是非常缓慢的动力学步骤,所以质子经常供应不足。水合反应可以通过以下等式来表示:
[0161][0162]
在一些条件下,在水溶液中未催化的脱水速率已经显示超过水合速率~1000倍(wang,xiaoguang等人,the journal of physical chemistry a 114.4(2009):1734-1740,其公开内容通过引用并入本文)。然后在热力学上,存在h2co3解离为co
2(水溶液)
的很强的倾向性,并且如果暴露于大气,则存在co
2(水溶液)
脱气为co
2(g)
的很强的倾向性。碳酸还可以经历酸碱反应,以形成碳酸氢根(hco
3-)和碳酸根(co
32-)离子。因此,对于固定浓度的h2co3*,co
2(水溶液)
的平衡丰度(equilibrium abundance)超过了h2co3的丰度很多倍。
[0163]
因此,专注于增加h2co3*用于封存的系统将不能以更高的速率封存碳,并且由于热力学,h2co3的现存量将可能非常低。如果封存剂(例如碳酸盐)的溶解消耗h2co3比其产生的快得多,则现存量甚至将更低。在这个实例中,h2co3的相对低的现存量将防止较高的碳酸盐溶解速率,并且从而降低封存的动力学速率。
[0164]
某些酶已经显示催化co2的水合。这些酶包括但不限于碳酸酐酶。silverman和lindskog(1988)显示了碳酸酐酶的本质上催化水的质子传递作用的真实机理:
[0165][0165][0166]
其中“酶”是碳酸酐酶,但可以是进行这组化学转换的任何分子或材料。酶将质子远离活性位点输送到溶液,其中酶可以随后与新形成的碳酸氢根离子反应。因此,酶进行了至少四件关键的事情:(1)其将水质子化为氢氧根离子和质子;(2)其将质子远离活性位点输送到本体溶液;(3)其使二氧化碳与氢氧根离子反应以形成碳酸氢盐;以及(4)其释放碳酸氢盐以便后来重新组合以形成碳酸。这给予碳酸盐的反应机理两种选择。在一种选择中,碳酸盐(例如诸如碳酸钙)通过与酶(例如诸如碳酸酐酶)的相互作用溶解,例如:
[0167]
caco
3(s)
+h2co3→
ca
2+
+2hco
3-[0168]
在另一种选择中,碳酸盐通过与质子在接近中性的ph相互作用而溶解,例如:
[0169]
caco
3(s)
+h
+
+hco
3-→
ca
2+
+2hco
3-[0170]
鉴于上文,所提出的本发明的实施方案依赖于碳酸盐溶解的新颖的动力学和机械学形成,以提供具有提高的碳酸盐溶解速率的设计系统。提供了并入催化方案的实施方案、
方法和装置,所述催化方案被配置成在封存剂例如诸如碳酸盐附近提供高浓度的质子(例如游离的质子或结合的质子,例如水合co2),使得水合和碳酸盐溶解的动力学被增强,而矿物欠饱和度(1-ω)保持固定(即,不需要高的欠饱和水平或远离平衡的欠饱和水平)。在一些实施方案中,碳酸和/或游离的质子的浓度在靠近封存剂(例如,碳酸盐表面)界面(例如,在封存剂表面的层流边界层内)的界面催化区域中被微调。这将与常规的co2水合系统形成对比,常规的co2水合系统依赖于以下的假设:溶解仅由co2水溶液的气体饱和状态(gaseous saturation state)驱动,即通过试图增加矿物欠饱和度驱动。因此,使用双区域受控催化方法的当前系统的方法和装置的实施方案即使在没有强的矿物欠饱和度的情况下也能驱动co2封存的反应速率。
[0171]
催化的封存工艺实施方案
[0172]
本发明的许多实施方案涉及通过在封存剂(例如caco3)附近产生至少两个受控催化区域而提供增加的碳封存速率的封存工艺。根据利用caco3封存剂的实施方案的工艺的图解在图2中提供并且将在下文更详细地讨论。在这些实施方案中,例如,水合和溶解的缓慢反应步骤被增强,以在封存剂的界面区域处提供过量的呈碳酸的形式的水合co2,以使处于固定的矿物欠饱和度的矿物溶解速率最大化。在该系统的实施方案中,由可控地引入反应容器中的合适的催化剂例如诸如碳酸酐酶的存在所驱动的反应,被用于提高质子产生(例如,水的质子传递作用和co2水合)的速率并且增加特定催化区域中的溶液中的质子的体积浓度(bulk concentration),使得存在于第二界面催化区域(在一些实施方案中被界定为环绕固体封存剂的区域,并且在其他实施方案中被界定为封存剂的层流边界层)内的质子的浓度足以使封存剂的溶解独立于矿物欠饱和度(例如,在平衡矿物欠饱和度)最大化。
[0173]
为了理解这些方法和装置的实施方案后面的操作原理,必需理解常规的未催化的co2封存方式与根据实施方案的公开的方式之间的差异。图3提供了这些差异的图解例证。如所示的,在海水中,通过在合适的催化剂(例如诸如碳酸酐酶)的存在下进行溶解,即通过产生在碳酸盐封存剂和co2溶液之间的界面附近的受控催化区域,可以将碳酸盐溶解的速率提高若干数量级。其他系统使用如碳酸酐酶的催化剂以简单地增加溶解的二氧化碳的浓度,但在这些系统中存在脱气的可能,因为在水合后不立即发生封存。所要求保护的工艺的实施方案以根本上不同的方式使用催化。代替使用催化来增加[h2co3*],催化被用于在环绕封存剂的界面催化区域内产生质子(游离的和呈水合co2的形式二者),从而增加封存剂的矿物溶解速率,而不需要增加矿物欠饱和度(例如,远离平衡的矿物欠饱和度)。
[0174]
更详细地检阅图3中的数据,其示出,未催化的溶解可以被外推至完全的矿物欠饱和度(complete mineral undersaturation),以获得2.5
·
10-3
g/cm2/天的最大可能速率。碳酸根离子输送限制为~3
·
10-3
g/cm2/天(假设边界层厚度为10微米)。因此,该数据表明,使用不具有根据实施方案的碳酸盐催化系统和方法的常规封存方案,必须存在完全的矿物欠饱和度(其是不可能的,如将在下文更详细地讨论的)以有效地封存co2。
[0175]
相比之下,图3示出,根据实施方案的碳酸盐催化系统和方法的溶解速率在远不是完全的矿物欠饱和度(例如从0.5至低至0.1)的矿物欠饱和度(1-ω)值处接近1
·
10-4
g/cm2/天至1
·
10-3
g/cm2/天。因此,使用所描述的催化系统和方法的实施方案,催化速率可以接近天然水中可能的物理最大值。因此,该数据表明,使用催化系统和方法并且通过在界定
的催化区域内进行这样的催化,使得催化的反应物可以在封存剂附近的界面催化区域内相互作用而使反应物输送最小化,该系统和方法封存碳比以前观察到的快得多。实际上,反应速率以其他封存方法、特别是强调co2溶解和水合的封存方法完全不能达到的方式接近扩散极限。不受理论束缚,但在一些实施方案中,有可能通过在所描述的系统中使用催化来实现达到扩散极限的封存速率(例如,在一些实施方案中超过2.5
·
10-3
g/cm2/天的溶解速率)。在许多实施方案中,催化可以在平衡矿物欠饱和度(例如,4.5或更高的ph,并且在一些实施方案中高达6或更高的ph)处进行,并且实现从1
·
10-4
g/cm2/天至1
·
10-3
g/cm2/天的溶解速率。
[0176]
如上文所描述的,在常规封存系统中,必需接近完全的矿物欠饱和度(即,1-ω值为1),以实现使用本催化系统的实施方案获得的封存速率。图4a和图4b提供了示出在海水中实现完全的矿物欠饱和度的困难的计算。在矿物欠饱和的标准海水范围,溶解动力学是缓慢的(1e-6至1e-5g/cm2/天)。为了实现高得多的溶解速率,1-ω必须接近1。图4a和图4b中的计算数据示出,这在物理上不是可能的。在固定碱度,如在海水中发现的那样,如利用co2注射在理论计算中所观察到的(图4a),随着dic增加,饱和状态平稳到较低但非零的ω值(图4b)。即使处于非常大的dic富集(高pco2)(图4a),完全的矿物欠饱和度通过仅仅将气态co2溶解到海水中是不可能的。因此,试图通过仅增加溶液中co2浓度(即,气体欠饱和度)来增加封存速率的常规系统不能达到在本发明的实施方案中描述的系统、方法和装置中提供的封存速率。
[0177]
如上文参考图1所描述的,通常,关于反应产物远离表面的输送计算扩散极限。在根据系统、方法和装置的实施方案中,可以关于封存剂(例如,金属碳酸氢盐,即碳酸氢钙)远离表面封存剂的输送来计算扩散极限。如果代替地,反应可以被反应物向封存剂表面的输送所限制,如在根据本发明的系统和方法的一些实施方案中,则将可以更进一步地加速碳的封存。尽管在其他研究中已经描述了这样的反应物输送限制,但这些研究对于通过与水合氢离子反应的碳酸盐溶解通常需要极低的ph(如图5中所示出和描述的,取自cubillas,p.,kohler,s.,prieto,m.,chairat,c.,oelkers,e.h.,2005.chemical geology 216(1-2),59-77,其公开内容通过引用并入本文)。如图5中进一步示出的,在低ph(低于5)时,碳酸盐的溶解速率与h
+
浓度线性相关,并且通常被解释为h
+
至矿物表面的输送限制。图5图示了在大于5的ph值驱动高溶解速率的难度。因此这表明,最佳地,为了增加溶解(和因此的封存)速率,应尽可能降低ph,优选地低于5。
[0178]
实际上,单独添加气态co2几乎不可能将海水ph驱动至小于5的值。因此,在强调在与碳酸盐反应之前使溶液中[h2co3*]最大化的其他系统中,溶解速率将是缓慢的,这与接近中性的溶液的溶解速率一致。此外,在如海水这样的介质中,难以将矿物饱和值(ω)驱动到小于0.2。实际上,如图4b中所示出和描述的,即使添加酸(较低的碱度),也不可能达到完全的矿物欠饱和度。因此,在常规的封存系统中,必须存在完全的矿物欠饱和度以有效地封存co2。然而,如所讨论的,使用如在系统、方法和装置的实施方案中所描述的受控催化系统,有可能通过代替地设计下述的方法和/或装置来实现高的碳封存速率,而不需要高水平的矿物欠饱和或极低的ph:在所述方法和/或装置中,封存反应在催化区域内发生,由此质子(例如,游离的质子或以碳酸形式的结合的质子)存在于环绕封存剂的界面催化区域处(例如,矿物碳酸盐的表面),从而增加矿物溶解,减少对大量反应物输送的需求并降低碳酸脱
水以及co2从溶液中脱气的可能性,即使在接近平衡的矿物欠饱和状况下。
[0179]
因此,虽然描述了根据实施方案的方法和装置的具体实施方案,不管反应容器和设置在反应容器内的催化区域的具体设计如何,受控催化方法和装置形成两个催化区域:第一催化区域,其中催化剂和co
2(水溶液)
可以以受控的方式组合;以及第二界面催化区域,其由封存剂的表面与周围溶液之间的界面(例如,在封存剂表面处的层流边界层)所界定。在这样的双催化区域设置中,催化剂的浓度、co2(水溶液)、温度和压力、流量(flow rate)、co2(气态)注射速率等可以被调整,以便:1)最大化矿物的溶解速率,以及2)从第一界面催化区域到第二界面催化区域最大化质子(例如,来自水的质子传递作用的游离的质子和/或来自co
2(水溶液)
储器的h2co3)的补充。使用这样的双区域催化区反应方法和容器,递送到封存剂的溶液中的质子的浓度可以在封存剂(例如,碳酸盐、矿物粘土、硅酸盐等)表面处被最大化和补充。在许多实施方案中,这样的工艺和装置在界面催化区域内产生的封存剂的溶解速率大于在相同矿物欠饱和度的未催化系统中的封存剂的溶解速率。在许多实施方案中,这样的工艺和装置在界面催化区域内产生的封存剂的溶解速率比在相同矿物欠饱和度的非催化系统中的封存剂的溶解速率大至少一个数量级。在其他实施方案中,在界面催化区域内的封存剂溶解速率比在相同矿物欠饱和度的未催化系统的封存剂溶解速率大至少两个数量级。在还其他实施方案中,在界面催化区域内的封存剂溶解速率比在相同矿物欠饱和度的未催化系统的封存剂溶解速率大至少三个数量级。在任何以上实施方案中,系统的矿物欠饱和度可以被保持为接近平衡。在还其他实施方案中,系统可以在接近中性的条件(例如,在大于4.5的ph,并且在一些实施方案中,从ph 4.5至ph 7的ph)中运行。
[0180]
这些原理被应用在图2中图示的工艺(600)的示例性实施方案中,其中所选择的封存剂是caco3(640)。在图2中,进入系统中的主要输入是海水(610)、催化剂(620)和封存剂(例如,金属碳酸盐,例如碳酸钙,640),但是应当理解,在其他实施方案中,可以提供包括例如降低污染物、温度、压力等的添加剂的另外的输入(如上文所描述的),如将在下文更详细描述的。在示例性实施方案中,将海水输入610预混合以含有co2水溶液。应当理解,在实施方案中预期改进水和co2的混合以形成co2水溶液的许多机构。例如,海水可以被雾化,和/或可以提供搅动机构或其他搅拌机构。此外,还可以根据需要控制反应容器的压力和温度以增加反应速率。同样地,尽管参照图2讨论了特定的封存剂和催化剂,但将会理解,可以选择这些输入的等效可选方案,如下文将进一步讨论的。
[0181]
如先前所讨论的,由于水合的热力学,海水含有约千分之一的量的作为co
2(水溶液)
的h2co3。在该工艺的实施方案中,催化剂(例如碳酸酐酶)与海水在第一催化区域(657)中组合,第一催化区域(657)环绕第二界面催化区域(660),第二界面催化区域(660)至少界定在第一催化区域(657)中的溶液与固体封存剂(在本实施例中,碳酸盐)的表面之间的界面,以形成受控的或设计的界面催化区域(660)。在第一催化区域(657)内,组合的海水、催化剂(650)和封存剂用于将在界面催化区域处的大部分质子(例如[h
+
]和[h2co3])(655)的补充增加至高于在不存在碳酸酐酶的情况下发现的水平,如上文关于在未催化的h2co3*中的h2co3和co
2(水溶液)
的标准比率所讨论的。第一催化区域被进一步设计以递送和补充在第二界面催化区域内的质子的浓度,使得封存剂的溶解速率可以独立于在平衡处或接近平衡处的矿物欠饱和度被最大化。特别地,在许多实施方案中已经发现,合适的催化剂例如诸如碳酸酐酶的添加,如果该催化剂在环绕第二界面催化区域(例如,在一些实施方案中由封存剂的
层流边界层界定)的第一催化区域内被递送,可以操作以平衡co
2(水溶液)
和质子(例如h
+
和h2co3)的池,并且驱动封存剂的溶解速率比天然热力学和动力学快多至3个数量级,允许固定的矿物欠饱和水平。因此,装置和方法的实施方案提供了以下系统:该系统用于在海水溶液和caco3封存剂之间的界面处界定的界面催化区域(660)处、以受控的方式将催化剂例如诸如碳酸酐酶引入含有溶解的co2的溶液,以大大提高caco3溶解动力学(k
封存
)。
[0182]
根据实施方案,其中相对高浓度的质子紧邻封存剂(例如诸如碳酸钙)存在的受控催化区域的形成还降低反应物输送时间。反应物输送是反应过程中另一个缓慢的步骤。通过在封存剂的存在下通过例如水的质子传递作用和水合co2来减少反应物输送,碳酸盐溶解的两个缓慢步骤被减少,并且反应速率被大大增加。因此,在许多实施方案中,该系统和方法需要形成至少含有水和co2的水溶液以及将该co2水溶液受控引入至少含有催化剂的第一设计催化区域中,所述催化剂适合用于催化来自水的质子传递作用的质子产生和/或co2水溶液水合成碳酸。第一催化区域又包围靠近合适的封存剂源例如诸如碳酸盐的第二界面催化区域。通过将第一催化区域和第二催化区域设计成使得质子可以在区域之间被递送(即,从第一催化区域到第二界面催化区域),形成co2水合、碳酸盐溶解和这些反应物的扩散一起的良性循环(630)。
[0183]
如所描述进行的设计的co2封存提供了在别处未观察到的或采用其他方法不可能的、大大提高的封存速率,因为通过催化增强了水合的缓慢步骤,并且通过在相同容器中以受控的方式在催化区域内同时进行这两个反应也使反应物输送的要求最小化。在这样的实施方案中,系统输出(670)是溶解反应的产物,例如在caco3封存剂的情况下,钙离子和碳酸氢根离子(ca
+2
和hco
3-)。
[0184]
转向封存剂,在一些实施方案中,封存剂可以是矿物材料,例如诸如碳酸盐(例如,金属碳酸盐)、硅酸盐等。合适的钙碳酸盐可以包括任何数目的此类矿物碳酸盐物质,例如诸如方解石、文石、白云石、球霰石等。在多个实施方案中,可以组合使用一种或更多种此类封存剂。因此,许多实施方案使用金属碳酸盐封存剂,而一些实施方案使用非碳酸盐封存剂,例如诸如硅酸盐矿物,并且在一些另外的实施方案中,封存剂包括各种矿物掺混物。最后,在还其他实施方案中,封存剂是碳酸盐固体和非碳酸盐固体的组合。
[0185]
因此,尽管上文讨论了碳酸钙封存剂,但一种或更多种封存剂的选择可以基于其溶解度特性来作出,以允许进一步控制受控催化工艺和装置的封存潜力。更多的可溶性矿物将在平衡时留下具有较少矿物和较高碳酸根离子浓度的混合物。反过来,较高的碳酸根离子浓度相当于较大的总中和作用以及因此较大的潜在的co2储存。如图6中所示,方解石是最不溶性的矿物。文石比方解石更可溶约两倍,并且球霰石还更可溶(即约五倍)。同时白云石跨越广泛的溶解度范围,并且在某些形式中可溶性可以比方解石少很多,而无序白云石比文石和方解石二者都更可溶。如图6中进一步所示,镁对碳酸钙的溶解度具有强烈的影响。实际上,在图中可以观察到,随着mg含量增加,方解石的溶解度增加。因此,在其他实施方案中,可以调整方解石的mg含量,使得当将要使用高度可溶性矿物时,可以使用高mg含量的方解石。
[0186]
此外,如之前所讨论的,封存剂,不管材料如何,可以以许多不同的形式被并入系统中,但在一些实施方案中,其可以最佳地被形成以最大化暴露于海水-催化剂溶液的表面积。例如,其可以被形成为1mm3立方体,或其可以被压碎成更小的颗粒或形状以最大化粗糙
度以增加表面积。可选择地,封存剂可以被并入具有挡板或井式梁结构(waffle)或其他高表面积构造的大流体路径/高表面积流化床反应器中。通常,如本领域技术人员将理解的,较大的封存剂表面积允许较大的反应物扩散、更多的溶解和因此更高的碳封存速率。
[0187]
在一些实施方案中,提供了其中溶解和封存的催化是受扩散限制的系统、方法和装置。在这样的实施方案中,在达到驱动反应速率的催化的极限的情况下,对碳的捕获和封存的唯一剩下的限制是扩散以将新的反应物从第一催化区域递送到在封存剂表面处的第二界面催化区域的能力,其可以被概念化为扩散反应通量(diffusive reaction flux)。扩散反应通量可以从遍及已知厚度的边界层的产物和反应物的梯度来计算,并被定义为:
[0188][0189]
其中d[c]是在封存剂(在这种情况下作为碳酸盐被提供)表面附近的界面催化区域中和在本体溶液中的反应产物的浓度差,dx是边界层的厚度,并且d是碳酸根离子的分子扩散系数。在该系统的一些实施方案中,术语d[c]=[co
32-]
饱和-[co
32-]
本体
,其中[co
32-]
饱和
是在矿物表面处的溶度积(除以[ca
+2
]),并且[co
32-]
本体
是本体溶液中的浓度。扩散反应边界层可以充当用于扩散反应通量的屏障。在合理的搅拌速率下,扩散反应边界层可以是约10微米。在达到扩散极限的本发明的实施方案中,输送可以仅受限于边界层的厚度dx。
[0190]
简而言之,对于诸如碳酸盐矿物的固体封存剂,扩散限制通常被概念化为对于将产物输送远离矿物表面所计算的反应物通量。相比之下,在其中达到扩散极限的系统、方法和装置的实施方案中,反应可以被反应物到矿物表面的输送限制。因此,在许多实施方案中,提供了方法和系统以增加催化区域内的反应物到封存剂的输送,以改进扩散以将新反应物递送到催化剂区域的能力(例如,通过在第一催化区域和第二催化区域之间产生可能最薄的边界层和/或将最大量的反应物从第一催化区域递送到第二界面催化区域中)。
[0191]
在另外的实施方案中,可以采用方法来在第一催化区域和界面催化区域之间产生可能最薄的边界层。这样的方法可以包括增加浓度梯度以将最大量的反应物递送到界面催化区域。这样的方法还可以包括混合或搅拌反应物,或将反应物和封存剂靠近放置成穿过高表面积构造例如流化床反应器。在实施方案中,用于碳封存的系统、方法和装置还可以包括改变封存剂的表面积和形态(conformation)。已经表明,封存剂的表面积影响溶解和co2中和将发生的速率,因为较小的晶粒相对于较大的晶粒每质量具有更大的表面积。图7提供了数据图,其示出了对于给定程度的矿物欠饱和(图7)的粒度(直径,以μm)和溶解速率之间的关系。曲线表明溶解速率随粒度按比例缩放(scale)。因此,在多个实施方案中,较小的粒度可能对于驱动溶解是合意的。在一些实施方案中,关于粒度的考虑涉及权衡若干因素,包括但不限于压碎封存剂材料用于反应器中的能量和成本与该定尺寸的材料将需要多快被补充以及co2封存可以多快地发生之间的平衡。在多个实施方案中,封存剂颗粒可以是毫米或微米尺寸的。因此,材料粒度在驱动co2溶解中是可调节且可控的参数。封存剂的表面还可以被粗糙化以增加界面催化区域的表面积,并且从而使第一催化区域至第二界面催化区域的暴露最大化。
[0192]
如上文所讨论的,各种非碳酸盐封存剂可以在添加铁载体样化合物(siderophore-like compound)或其他催化化合物(例如碳酸酐酶)的情况下在用于co2封存的系统、方法和装置中被使用。在一些实施方案中,非碳酸盐封存剂是硅酸盐矿物。地球
表面上的风化反应(weathering reaction)以以下一般化的反应封存co2:在所述一般化的反应中,硅酸盐矿物被改变成碳酸氢盐、阳离子和溶解的二氧化硅。
[0193][0194]
含si矿物的不均匀风化导致反应器中随时间逐渐变慢的溶解动力学,然而对反应器晶粒的搅动和如在添加铁载体样化合物或其他化合物(例如碳酸酐酶)的情况下催化地实现的快速动力学将增强矿物溶解和co2封存。因此,在多个实施方案中可以使用包括非碳酸盐矿物的各种矿物掺混物。
[0195]
在用于碳封存的系统、方法和装置中,温度控制将取决于期望的动力学和热力学效应。例如,当温度增加时,方解石变得在热力学上较不可溶(图8),但由于动力学,随着温度增加,其变得更可溶。图8描绘了图示方解石溶解度作为温度和压力的函数的数据图。在这些图中,曲线表明随着温度增加而降低的溶解度和随着co2的压力增加而增加的溶解度(图8)。因此,在某些实施方案中,例如使用方解石作为封存剂的实施方案中,在确定合适的溶解温度中可能必需平衡热力学和动力学过程。考虑到由于所选择的封存剂可能引起的这些竞争性关注,温度可以任选地基于增加的溶解度对溶解速率的损害或增加的溶解速率对溶解度的损害来确定。
[0196]
在本发明的一些实施方案中,封存剂与表面中毒离子之间的接触通过添加调节剂而减少。表面离子如磷酸盐的抑制作用已经被证明并且是众所周知的。对于方解石,磷酸根离子的表面中毒是至少以下的函数:(1)溶液中磷酸根离子的浓度,(2)磷酸盐可以吸附到的方解石的可用表面积(available surface area)。图9图示了在比较作为饱和状态和磷酸盐浓度的函数的方解石的溶解速率中表面中毒离子的抑制作用。图9指示,低于阈值(在一些实施方案中,0.2的欠饱和度,并且在某些情况下为0.3),降低磷酸盐浓度将溶解速率增加至接近平衡。因此,在图9中的数据图至少也是方解石的量和可用方解石的表面积的函数,并且表明,降低每平方米方解石表面积所吸附的抑制剂的量增加了反应速率。为了增强co2封存,系统、方法和装置的多个实施方案引入调节剂以降低所吸附的抑制剂或与封存剂表面接触的表面中毒离子的量。
[0197]
还可以控制本发明的实施方案以在各种压力下操作。在多个实施方案中,对于许多封存剂,压力的增加与溶解度的增加成比例。例如,众所周知,压力增加caco3的溶解度;从环境表面压力增加至400巴使溶解度增加了两倍(图10)。相比于在环境压力下对于相同矿物饱和状态的溶解动力学,在压力下,caco3溶解的动力学对于给定的饱和状态是有效更大的(图10b)。因此,在压力下的溶解由于更大的溶解度而驱动更快的溶解速率(图10a),并且还增加溶解的动力学(速率)(图10b)。较高的压力与较高的溶解速率成比例,具有更加远离平衡的更大的作用。因此,在一些实施方案中,使用压力作为可调节的参数中的一种来控制溶解速率。在许多这样的实施方案中,使用至少500psi的压力,在其他实施方案中,至少1000psi的压力,在还其他实施方案中至少1500psi的压力,以及在又其他实施方案中至少2000psi的压力。
[0198]
本发明的实施方案可以使用各种水溶液。这些溶液的盐度可以影响各种封存剂的溶解度。例如,与淡水相比,caco3的溶解度在咸水(假定nacl作为溶液中的主要盐)中更大。响应于增加的溶液盐含量,溶解度的相应变化是非线性的,并且基于nacl的浓度存在最大的溶解度(图11)。因此,在一些实施方案中,盐水溶液的使用可以被用于产生比在淡水中将
发生的更快的溶解。因此,在一些实施方案中,nacl的浓度以1-6m nacl形成,在其他实施方案中以1-5m nacl形成,在还其他实施方案中以1-4m nacl形成,并且在又其他实施方案中为2-3m nacl形成。
[0199]
尽管在这一点上的讨论在碳封存方法的多个实施方案中已经集中于碳酸酐酶催化剂,但可以以足以产生催化区的多种形式提供一种或更多种催化剂。因此,在许多实施方案中,可以使用适合用于以下的任何催化剂:(1)增加水的质子传递作用以形成oh-和h
+
,和/或(2)增加氢氧根离子(oh-)的局部活性,和/或(3)增加氢离子(h
+
)的局部活性,和/或(4)增加oh-和h
+
之间的物理分离,全部都没有溶液的本体ph的变化。这样的催化剂的示例性实施方案可以包括例如碳酸酐酶、碳酸酐酶类似物和/或具有碳酸酐酶活性位点的材料,并且尤其是镍,例如镍纳米颗粒。在其他实施方案中,催化剂可以被固定于反应器容器内的表面或在一些实施方案中被固定到表面,然后该表面被进料到反应器容器中。在多个实施方案中,催化剂被溶解。在另外的实施方案中,使用酶分离技术回收在流出物流中的溶解的催化剂。在又其他实施方案中,为了分离酶,使用酶过滤。酶过滤可以使用膜层、膜孔或中空纤维使用聚醚砜(pes)、乙酸纤维素(ca)、磺化聚醚砜(spes)或聚偏二氟乙烯(pvdf)纳滤膜或超滤膜的任何组合来实现。在另外的实施方案中,膜过滤被设置为相对于过滤膜周期性地逆转流动方向或利用非结垢膜。用于提供和保留催化剂的这些技术的任何组合可以被用于另外的技术中。
[0200]
尽管上文参照图2至图11讨论了通过在封存剂附近利用催化方案用于碳封存的具体的系统、方法和工艺,但利用与根据特定应用的要求合适的封存剂组合的催化方案用于进行碳封存的多种系统、方法和/或工艺中的任一种可以根据本发明的实施方案被利用。因此,例如,在可以使用多种反应物的许多实施方案中,可以使用多种封存剂,包括但不限于单独使用或组合使用的碳酸盐化合物例如碳酸钙和非碳酸盐化合物。在其他实施方案中,可以利用多种催化方案以在封存剂附近提供高浓度的水合co2。此外,水溶液不限于如上文所描述的海水,而是可以是盐水或淡水。在若干实施方案中,溶液可以包括但不限于中性ph、接近中性ph或酸性ph的水溶液。此外,对于若干实施方案,应当清楚的是,[co
2(水溶液)
]可以变化。虽然关于工艺和方法描述了单个反应,但在其他实施方案中,可以重复方法步骤,使得仍然含有未溶解的co2的海水可以进一步水合以更充分地封存碳。用于碳封存的实施方案、系统、方法和装置还可以涉及若干参数的调节。在实施方案中,这些参数至少包括封存剂的表面积、形态或类型、封存剂至表面中毒离子的暴露、压力、温度和盐度。调整矿物欠饱和度以及扩散系数的方法还可以包括改变催化区域中的一个或两个内的温度、压力和/或盐度。可选择地,还可以控制系统的温度和/或压力,以增加饱和剂(saturation agent)在固定矿物欠饱和度的溶解。
[0201]
与常规封存系统的比较
[0202]
其他封存策略使用碳酸盐溶解,但这些策略与在一些重要方面描述的方法和实施方案不同。常规的co2水合系统通常描述了涉及分开的水合步骤和溶解步骤的两步法,如图12中所示。在第一步的水合中,输入是气态co2(905)和水(910),并且输出是co2贫化的气体流(915)、从水合溶液中释出的co2(g)(脱气的h2co3和co2)(920)以及含有混合物h2co
3*
的水溶液(925),混合物h2co
3*
包含h2co3和数量级更大量的co
2(水溶液)
。在封存步骤中,使含有h2co
3*
的溶液(925)与封存剂(930)例如金属碳酸盐反应,以产生金属和碳酸氢盐产物。在常规系
统中,该工艺的第一步(水合)的主要目的之一是通过将高浓度的co2溶解到溶液中来增加溶液中的h2co
3*
的量,从而增加溶液中的碳酸。在这样的系统中,通常优选的是,碳酸溶液的ph低至由操作温度、进气流的pco2、co2与其水合的水体积以及化学添加剂(如果有的话)的作用所允许的那样。co2输入或气体流可以被再循环用于进一步的co2除去。在封存工艺的第二步中,使碳酸与金属碳酸盐反应,以得到金属和碳酸氢盐产物。
[0203]
在这些常规的封存方法中,强调的是溶解反应的第一步-水合步骤。这样的方法要求将尽可能多的co2溶解到溶液中(以增加co
2(水溶液)
)以实现最高可能的浓度碳酸。然而,关于此以及强调增加h2co
3*
以总体上封存碳的问题是,在这样的溶液中相对于co
2(水溶液)
存在少量的h2co3,并且还存在co
2(水溶液)
从溶液中脱气的强烈趋势。
[0204]
在系统、方法和工艺的许多实施方案中,这些问题通过新颖的催化方法来解决,凭借该催化方法,富含质子(例如,h
+
和h2co3)的受控催化区域紧邻封存剂(例如,碳酸盐矿物)被形成。如上文所描述的,这样的系统、方法和工艺消除了与溶解的co2的输送及其脱气相关的潜在问题,因为大量的co2未被迫使进入溶液中以增加h2co
3*
水平。如图2至图11中所示,对于利用催化的碳酸盐反应区域的系统和方法的实施方案,在水合期间,对于海水不需要另外的co2溶解在接近中性的ph溶液中。脱气被进一步最小化,因为反应物输送是最小的,因为在催化区域内,水合co2在质子形成后几乎立即与碳酸盐反应。因此,用于碳封存的系统和方法的实施方案通过减少对高水平的气态co2的需求并且还使反应物输送最小化来消除与co2脱气相关的问题。结果是一种碳封存方法,该方法在接近平衡时操作,并且相比于需要远离平衡矿物欠饱和度以在相当的速率操作的工艺快得多。
[0205]
催化的封存装置实施方案
[0206]
虽然已经描述了根据实施方案的碳封存的系统和方法,但应当理解,还预期体现这些新颖的系统和方法的装置。图13a和图13b提供了如在许多可能的装置实施方案中应用的示例性封存系统。
[0207]
如图13a中所示,本发明的多个实施方案可以包括(但不限于):反应器容器(705)、co2输入(710)、水溶液输入(715)、封存剂输入(720)、水合催化剂输入(725)和/或碳酸氢盐溶液输出流(745),如在示例性装置700中所图示的。在这些实施方案中,各种输入、输出和反应物被布置成使得至少促使封存剂、催化剂和co2溶液靠近反应以形成在反应物容器内的两个受控催化区域(735和735')或受控催化区。
[0208]
在许多实施方案中,第一催化区域(735)被形成在环绕封存剂的区域中,在所述区域中,co
2(水溶液)
溶液和催化剂被引入到一起。该第一催化区域又包围围绕封存剂的至少界面区域(例如,在封存剂的层流边界层处)形成的第二界面催化区域或第二界面催化区,使得催化循环被形成,由此来自在界面区域处的溶液中(co2水合和水的水解)的质子补充的速率被提高。在一些实施方案中,界面催化区域被界定为至少在封存剂的扩散反应边界层内的反应容器内的体积。在其他实施方案中,界面催化区域可以由封存剂的层流边界层来界定,从而允许增加溶液本体中的质子浓度,这可以用来增加在接近平衡或处于平衡的矿物欠饱和度的封存剂(例如,碳酸根离子)的溶解。在许多实施方案中,该装置在受控催化区域内产生的封存剂溶解速率大于在相同溶液欠饱和度的未催化系统的封存剂溶解速率。在许多实施方案中,该装置在受控催化区域内产生的封存剂溶解速率比在相同矿物欠饱和度的未催化系统的封存剂溶解速率大至少一个数量级。在其他实施方案中,在受控催化区域内
的封存剂溶解速率比在相同矿物欠饱和度的未催化系统的封存剂溶解速率大至少两个数量级。在还其他实施方案中,在受控催化区域内的封存剂溶解速率比在相同矿物欠饱和度的未催化系统的封存剂溶解速率大至少三个数量级。
[0209]
在许多实施方案中,输入进料流在各个点流入反应器中并在各个点流出反应器,使得催化区域在整个封存工艺中被形成和维持。仍然,在其他实施方案中,可以校准输入流和输出流以在稳定状态下操作。在又其他实施方案中,进料流不在稳定状态下操作。在其他实施方案中,催化区由反应容器内的分开的结构形成和维持,该结构界定了受控催化区(例如,较大反应器容器内的可渗透容器、流化床、流动路径、井式梁结构或挡板构造等)。
[0210]
在一些实施方案中,反应器容器具有足够的体积,使得第一催化区域围绕在co
2(水溶液)
溶液-封存剂界面处(例如,在封存剂的层流边界层处)的第二界面催化区域形成。可以在反应器中的各个点处添加催化剂以增强在co
2(水溶液)
溶液-封存剂界面处催化区的形成。在另外的实施方案中,反应器可以具有使得形成混合区的尺寸和/或体积,其中各种输入本身可以混合在一起,并且另外与封存剂混合。应当理解,这样的混合区域可以或可以不延伸到第一催化区和/或第二催化区外部,使得反应物由于混合而被运送到至少第一催化区和/或第二催化区中以用于封存。此外,反应器可以具有被本领域技术人员认为足以容纳反应器输入、封存剂和反应器输出的任何尺寸。本发明的多个实施方案涉及由本领域技术人员确定的适合用于本发明所描述的实施方案的形状的反应器容器。
[0211]
在一些实施方案中,反应器容器将具有至少一个输入端,其可以包括至少包含co2、水溶液和/或催化剂的混合物;以及至少一个输出端,其至少包括富含碳酸氢盐的溶液。
[0212]
本发明的多个实施方案将具有输入流的不同配置,使得流在反应器中组合以产生受控催化区域。在图13a中,示出的示例性装置700的实施方案具有至少五个输入流,包括(但不限于):co2(710)、h2o(715)、caco3(720)、化学添加剂(即催化剂和抗中毒的材料)和再循环的组分(740)。在所描述的实施方案中,使用碳酸钙(caco3)(720)作为封存剂,但应理解,其他封存剂可以被代替。此外,化学添加剂被描述为至少一种催化剂,例如碳酸酐酶,但本领域技术人员将认识到,其他催化剂可以被代替。因此,本发明的实施方案可以具有用于每种反应物进料流的独有的输入端,即用于co2、水溶液、催化剂和封存剂的分开的流。可选择地,在其他实施方案中,应当理解的是,可能存在较少的输入流,特别是当多个反应物组合成单个流时。例如,co2和水溶液可以组合成单个流,并且这还可以进一步与封存剂组合。第二输入流可以包含催化剂。两个流可以在反应器中组合,使得两个催化区域围绕溶液-封存剂界面形成。本领域技术人员将认识到,可以使用一个、两个或三个输入流,并且可以在多个反应物的情况下组合成单个输入流。
[0213]
输入流和输出流的位置可以在反应器中的各个位置处。反应物和催化剂可以通过输入端流入反应器中,输入端位于至少部分地确保包围第二界面催化区域的第一催化区的形成的点处,第二界面催化区域在围绕封存剂的界面区域处。输出(745)可以位于除去碳酸氢盐产物同时保持环绕封存剂的催化区域(735)的存在的反应器上的点处。
[0214]
如上文所描述的,在反应器内部,输入可以以多种方式组合以促进催化区域的形成。如在图13a中所描述的示例性实施方案中所示的,可以在反应器混合区中组合包括(但不限于)co2(710)、水溶液(715)、包括催化剂(725)和/或封存剂(720))的化学添加剂的输
入,这导致形成第一催化区域(735)和被第一催化区域环绕并设置在封存剂(caco3)床的界面处的第二界面催化区域(735')。根据实施方案,封存剂可以以各种形态存在,即毫米级颗粒,以增加催化区表面积。在多个实施方案中,co2可以至少与反应器内的水溶液组合。例如,在一些实施方案中,催化区域(735)可以例如被形成为在较大反应器容器(705)内的单独的可渗透容器。在这样的实施方案中,催化区域可以沿其表面将入口调整大小,使得催化剂和封存剂材料被限制在其中,但其中反应中的其他要素(例如水溶液和co2)被允许与催化剂和封存剂材料自由地互相混合、或在加压流中从其中移动,从而产生并实施第一催化区域和第二催化区域。
[0215]
在反应器中,除了催化(下文更详细讨论的)之外,co2水合可以通过涉及(但不限于)以下的技术来增强:增加与给定体积的气态co2接触的水溶液的表面积和/或鼓泡,增加进气流的pco2,增加co2气体流的压力以及通过降低温度增加co2的溶解度。在其他实施方案中,co2和水溶液可以在达到反应器之前组合。例如,co
2(水溶液)
可以已经存在于一些溶液即海水中,或其可以在进入反应器容器之前在混合容器中混合。
[0216]
根据如所陈述的本发明的实施方案,反应器可以被保持在各种压力下以改变封存剂的溶解速率,如本领域技术人员确定的。在一些实施方案中,可以通过在压力下注射气体(例如co2)或在压力下注射溶液(例如水)来增加反应器压力。在另外的实施方案中,通过止回阀释放压力。在又其他实施方案中,通过相对于流入压力调节流出压力来释放压力。
[0217]
催化剂可以以足以使得第一催化区形成为在封存剂和溶液的界面处包围第二界面催化区域的量被添加。在这样的实施方案中的催化剂的浓度可以被调整成以下中的一者或二者:1)最大化来自从反应容器的co
2(水溶液)
储器中产生的h2co3的结合的质子的补充;和2)最大化游离的质子从水的质子传递作用中的产生。在一些实施方案中,溶液可以在封存剂的床上和/或与封存剂的颗粒混合,以增加表面积并减少第一催化区域和第二催化区域之间的边界层。当达到扩散极限时,可以添加催化剂,使得在第一催化区域中存在现存量的碳酸,使得最大量的反应物被递送到第二界面催化区域中。
[0218]
反应器中使用的封存剂可以涉及多种物理形态。为了增强封存,多个实施方案可以利用封存剂的具有增加的表面积的形态。在一些实施方案中,关于粒度的考虑涉及权衡若干因素,包括但不限于压碎封存剂用于反应器中的能量和成本与知道该尺寸的材料将需要多快被补充以及co2封存可以多快地发生的平衡。在多个实施方案中,封存剂颗粒可以是毫米尺寸或微米尺寸。
[0219]
颗粒可以根据需要进料到反应器中。或可选择地,在其他实施方案中,颗粒可以被分批替换。在又其他实施方案中,封存剂可以作为反应器内的床存在。催化区可以在床的表面上形成,因为催化剂和co
2(水溶液)
溶液分布在床的表面上。封存剂材料可以具有不同的尺寸和粗糙度以增加表面积。可选择地,封存剂可以被并入到具有挡板或井式梁结构或其他高表面积构造的大流体路径/高表面积流化床反应器中。
[0220]
反应器可以保持在本领域技术人员认为适合于进行封存工艺以及适合于封存剂的溶解速率和扩散系数被优化的温度。
[0221]
含有co2的淡水或盐水可以被进料到反应器中。在一些实施方案中,所述水是淡水。在许多实施方案中,入口水是海水或另一种盐水溶液。在一些实施方案中,盐水溶液将产生较大的溶解速率。
[0222]
反应器还可以保持在中性、接近中性或酸性的ph或使得封存工艺根据如由本领域技术人员确定的、如所陈述的本发明的实施方案进行的ph水平。在其他实施方案中,反应器可以包括搅拌器以减少环绕封存剂材料的边界层,特别是当封存速率达到扩散极限时。
[0223]
在许多实施方案中,反应器可以在多个点处具有监测器(750),以监测多种参数,包括反应物、催化剂、压力、盐度、表面中毒离子、产物、ph和温度。在多个实施方案中,监测器可以位于多个输入流和输出流处,在所述流流入反应器中的点处。其他实施方案可以涉及位于反应器内的监测器。更具体地,可以在反应器内放置监测器以检测和测量催化和封存的区。
[0224]
在本发明的多个实施方案中,输入流将co2、水溶液和催化剂中的至少一种流进料到反应器中。在一些实施方案中,另外的封存剂进料可以替换在反应器容器内的贫化的封存剂。在其他实施方案中,封存剂可以分批地补充到反应器。输入流可以包括在达到反应器之前被组合的反应物的组合。多个实施方案可以涉及例如(但不限于)至少包含组合的co2、水溶液和封存剂的一个输入流,以及至少包含足以确保形成催化活性区的催化剂的另外的输入流。一些实施方案可以另外包括混合容器以在输入流达到反应器之前组合所述输入流。例如,该混合容器可以在添加催化剂之前将气态co2溶解到水溶液中。此外,封存剂可以以单独的流被进料到反应器中。这些混合输入流中的一些可以包含从流出物流中再循环的组分(740)该流出物流包含水溶液、封存剂和催化剂中的至少一种。
[0225]
在本发明的一些实施方案中,反应器的输出(745)可以至少包括富含碳酸氢盐的溶液。此外,输出可以包括(但不限于):过量水溶液、co2、催化剂和/或封存剂。在许多实施方案中,输出可以以至少一个流离开反应器,只要在溶液和封存剂之间的界面区域处存在催化区。另外,在多个实施方案中,输出可以在各个点离开反应器,使得保留在界面区域处的催化区被保持。输出流的放置和/或流动还可以被设计成确保保留在界面区域处的催化区被保持。以上变量还可以被优化以最大化催化区。
[0226]
任选地,一些实施方案可以具有过滤器(755),输出流(745)中的各种组分可以从该过滤器中被提取出、被保留或被再循环,这得到流出物流(730)。
[0227]
许多实施方案采用多种机构用于将封存剂保留在反应位点(755)处(图13a)。在一些实施方案中,使用颗粒过滤系统过滤流出水(图14)。在另外的实施方案中,任选地添加沉降室,其中反应物可以沉降到底部,并且流出的、不含固体的水可以从室的顶部被吸走(sip)或排出。沉降室可以是主反应容器或二次反应室。在又其他实施方案中,可以使用用于保留封存剂的机构的组合。
[0228]
任选地,一些实施方案可以具有一个或更多个反应器,所述一个或更多个反应器从第一反应器被进料,以水合并且封存保留在溶液中的任何co
2(水溶液)
。作为示例性实施方案的图示,图13b示出了位于第一反应器下游的第二反应器(780),所述第二反应器具有可以主要包括来自第一反应器的输出(745)的输入,特别是水溶液和未溶解的co2以及催化剂。离开第一反应器的该主流进料第二反应器,该第二反应器被单独地参数化(782),以便将任何残留的co2完全中和或脱气。在其他实施方案中,第二反应器的另外的输入可以包括催化剂(784),即如图13b中所示的碳酸酐酶或本领域技术人员认为合适的其他催化剂。在其他实施方案中,封存剂可以分批存在,例如如图13b中所示的碳酸盐床(786),或封存剂可以以稳定的状态或如通过任选的监测被认为必要时被补充。在许多实施方案中,在第二反应器
中发生的二次反应可以提供co
2-中性的、碱溶液作为流出物。所得到的流出物可以与周围的环境流体比如海水混合。在采用两阶段反应器的一些实施方案中,其中封存剂是逆向可溶的(retrograde soluble),温度可以在第一阶段中是高的并且在第二阶段中被降低,使得第一反应器具有最快的溶解速率,但第二反应器增加经较长时间溶解的碳酸盐的总量。在使用这样的双容器布置的实施方案中,第一容器或第二容器中的一者或二者可以包括上文描述的双催化区域构造。这两个反应器的尺寸可以根据期望的反应时间而变化。
[0229]
在装置的许多实施方案中,装置使用反馈回路(790)控制和连续地调节反应器设备中的矿物欠饱和度。在反馈回路中,控制系统可以监测和调节例如各种参数的输入,特别是在接近中性的ph(在6.5和7之间)进入反应器中的催化剂和co2,如图13a和图13b中所示。在一些实施方案中,控制系统操作以确保该装置以最大的催化溶解速率操作,每单位反应时间中和尽可能多的co2。在多个实施方案中,控制系统可以处理监测的输入参数并且可以适当地调节其他工艺参数。
[0230]
在许多实施方案中,控制系统(760)从多个监测点监测过程。本发明的一些实施方案可以涉及在反应器装置中在多个点处的监测器。监测器可以检测参数(765),包括但不限于ph、温度、压力、盐度、表面中毒离子、pco2、tco2、流量和/或反应物输入,包括封存剂和催化剂输入。多个实施方案在反应器内具有监测器(770)。在反应器内,监测器在某些情况下可以位于输入流和/或输出流处。可选择地,监测器还可以被放置在催化区附近(例如,在封存剂的界面区域内)。
[0231]
在多个实施方案中,可以采用催化剂保留策略,使得催化剂在碳封存工艺中被适当提供并且被保留。催化剂的保留最小化潜在的环境影响并降低催化剂成本。反应器实施方案利用各种催化剂保留方法(图14)。在一些反应器实施方案中,催化剂被固定到自由浮动的固体(即,珠)表面的表面,并且使用与保留反应物材料(805)相同的方法来保留这些固体。在又一些更多的实施方案中,催化剂被固定到反应器容器内的表面。催化剂可以被固定至的表面包括但不限于反应器的壁、膜、棒、片材或可以被固定到反应器室中的任何物体。在另外的实施方案中,溶解的催化剂可以使用酶分离技术以及将富含催化剂的流返回到反应容器,而与不含固体的流出物流分离和被保留。对于酶过滤,可以采用使用膜层、膜孔或中空纤维的pes、ca、spes、pvdf或等效纳滤膜或超滤膜(810)的任何组合。在多个实施方案中,膜过滤被设置为相对于过滤膜周期性地逆转流动方向或利用非结垢膜。在另外的实施方案中,可以使用表达碳酸酐酶的生物体来补充催化剂。此外,可以使用多种阀来控制输出和流出物流的速率和方向。另外的其他实施方案使用设计的生物体来产生催化剂。生物体可以位于反应容器内或外部。在一些实施方案中,可以将催化剂保留策略组合。
[0232]
简而言之,本发明的若干实施方案涉及一种反应器,在所述反应器内,co2、水溶液、封存剂和催化剂被组合,使得第一受控催化区域被形成为包围封存剂的表面近侧的第二界面催化区域(例如,层流边界层),以提高碳酸盐封存速率。本领域技术人员将认识到,该说明不是对本发明的完整描述,并且输入和输出可以以多种方式在第二反应器中组合以产生这样的催化区。
[0233]
数据采集
[0234]
以下提供关于用于进行产生图3中提供的数据的示例性研究的方法的信息,其示出了使用根据实施方案的系统和工艺获得的出乎意料地改进的封存速率。将理解的是,该
数据和所附的实施例仅作为说明而提供,并且不意图限制整个公开内容描述的系统、方法和装置的范围。
[0235]
方法与材料
[0236]
在本公开内容特别地关于图3所提供的观察中,使用高精度稳定同位素测量、普遍存在的地球化学和化学海洋学。实验方法利用碳
13
c的稳定同位素作为从矿物到溶液的传质的直接示踪剂。通常,富含
13
c的碳酸钙被放置在欠饱和海水的封闭系统中。然后,该海水的不断发展的δ
13
c通过离散取样来随时间测量,从而获得随时间溶解的摩尔数的曲线。
[0237]
富含
13
c的碳酸钙虽然相当便宜且丰富,但由于其烧结性质而不是理想的。需要良好成形的材料,其可以作为在一定粒度范围内的无机固体被操纵。为此,碳酸钙在实验室中使用凝胶扩散法来生长,所述凝胶扩散法首先由nickl,h.j.,henisch,h.k.,1969.journal of the electrochemical society solid state science 116(9),1258-1260描述,其公开内容通过引用并入本文。在这种方法中,将玻璃u形管填充有50ml含水凝胶(在这种情况下,ph调节的偏硅酸钠(0.17m)),将30ml的cacl2的储器和na
213
co3的储器(均为0.15m)在管的每个臂中分离。管的端部使用parafilm和橡胶塞密封。在此过程中,碳酸钙晶体的成核受扩散和凝胶孔间隔所限制,这允许大晶粒的缓慢生长。在3-6个月的反应时间后,晶粒通过倒出废储器溶液然后物理分解、超声处理和从碳酸钙晶粒中倾析密度较小的凝胶基质来收获。然后将晶粒在ddw中洗涤三次并在60℃干燥。在此研究中,数据由凝胶生长的方解石提供,该凝胶生长的方解石被干燥筛分至若干粒级(size fraction)。使用picarro crds对少量(0.2mg)等分部分的材料测量同位素标记的程度,所述材料被预先酸化并使用automate liaison自动进样器测量。
[0238]
使用溶解的无机碳和碱度对(alkalinity pairs)约束碳酸盐饱和状态。所有实验在dickson海水参考材料(氯化汞中毒)中进行。2-3l的海水等分部分通过虹吸管转移到5l supelco气密性箔袋中。通过经由将hcl(0.1m)注射穿过箔袋的取样口隔膜来滴定碱度可实现矿物欠饱和。因此,在碱度滴定期间,没有dic损失。dic的确稍有变化,但仅是由于添加的hcl溶液的稀释。
[0239]
通过开放系统格兰氏滴定(open-system gran titration)测定的碱度是在定制的仪器上进行的。使用连接到mettler toledo sevencompact ph计的metrohm(万通)电极。滴定剂(天然海水介质中的0.05-0.1m hcl)由具有5ml滴定管的metrohm 876dosimat plus滴定仪递送。将过滤的16ml海水样品放置于25℃水浴中。在整个测量过程中将样品搅拌并用空气鼓泡。滴定程序从windows笔记本电脑控制滴定。碱度使用如在best practices guide(dickson等人,pices special publication 3,ioccp report第8期.(2007),该文献的公开内容通过引用并入本文)中概述的非线性最小二乘法确定。dickson标准参考材料以及内部的海水碱度标准在每次会话的开始和结束时运行,以确保分析一致性并监测酸和电极漂移。长期碱度精度约为2.5μeq/kg。长期准确度(long-term accuracy)与精度(precision)大致相同;因此长期内的总碱度误差应为大约3μmol/kg。
[0240]
溶解的无机碳(dic)和海水δ
13
c使用具有automate liaison自动进样器的改良的picarro光腔衰荡光谱仪(picarro cavity ring down spectrometer)来测定。将约7ml的过滤的海水从注射器通过橡胶隔膜螺旋帽注射到排空的10ml automate小瓶中。取得样品净重。automate使用10%磷酸将这些样品在线进行酸化,并将所得到的co2在氮气流中通过
nafion脱溶剂管线运送至picarro liaison取样袋。通过在自动进样器和picarro之间的质量流量控制器将流量设置为80
±
0.2立方厘米每分钟(ccm)。dic和δ
13
c二者的漂移在运行过程中并且还在更长的时间内被监测。dic值被校正为参考材料值,并且样品既被空白校正又被标准校正。由于没有可用的海水δ
13
c参考材料,δ
13
c值也被归一化为1%的值(vpdb)。使用在划界标准(bracketing standards)之间的线性插值(在运行的开始、中间和结束时),校正样品的仪器漂移。此外,文献记录了水含量与[
12
co2]之间的负相关。监测样品中的水含量,并且还根据需要进行水校正。漂移几乎从不高于千分之几十,并且所得到的picarro标准通常具有低于0.1%的标准偏差。利用了平行测定dic和alk分析,并且在计算实验ω时使用标准误差。
[0241]
然后使用通过matlab运行的co2sys将碱度和dic对转化为饱和状态。碱度和dic的误差通过蒙特卡洛方法(monte carlo approach)传到ω
方解石
:从正态分布中随机取样alk-dic对,将其相关的标准误差作为标准偏差,并将得到的ω值求平均。以这种方式计算的ω的误差在0.01个单位和0.04个单位之间。碳酸解离常数取自dickson和millero(dickson&millero.deep-sea research 34,1733-43(1987),其公开内容通过引用并入本文)改编的mehrbach的数据(mehrbach等人limnology and oceanography 18,897-907(1973),其公开内容通过引用并入本文)。来自mucci(mucci,am.j.sci.09;283(7)(1983),其公开内容通过引用并入本文)的方解石溶解度数据被用于在co2sys中计算ω。
[0242]
在环境温度(20℃-22℃)在台面(benchtop)上获得所提供的所有溶解速率数据。评估了用于实验的若干不同的材料,因为需要对饱和状态的优良控制。
[0243]
在supelco惰性箔袋中进行实验,并且制造聚碳酸酯取样端口,所述箔袋对于dic是稳定的并且不渗出或除去碱度。这些端口具有内置的过滤器外壳,使得取样的水通过nucleopore膜过滤器(~0.2μm)过滤。将端口通过冲孔安装到袋上,手动拧紧,并用viton o形环密封。使用此设置,碱度和dic空白实验二者经数天至一周均示出没有变化。
[0244]
数据以以下方式获得:supelco袋被切开,并且取样端口穿过箔安装。称出标记的材料(3-5mg),并且倒入箔袋中。然后将打开的袋热密封两次。然后将这些袋排空以除去所有顶部空间。然后将欠饱和的填充水从其大的箔储器虹吸到这些实验袋中。首先,虹吸入约50克,并且晶粒被搅动并冲洗。然后将该水经由注射器通过取样端口除去并丢弃。然后,虹吸入约300克的填充水,称重袋以获得添加的水的精确质量,并且实验被视为开始。在实验已经开始后,将袋放置在60rpm的振动台上。已经测试了振动速率,并且发现在高于60rpm的速度,溶解速率与60rpm的速率相同。低于60rpm,速率显著减慢,这可能是由于围绕晶粒的滞流(stagnation)和边界层的形成。在每个取样点处,称重实验袋。样品经由附接到塑料注射器的聚乙烯管(tygon tube)通过取样端口取得。用约2ml的取样的水来洗涤注射器,并且然后取得完整的7ml样品。如上文所描述的,将该样品通过0.45μm过滤器注入用于picarro分析的预排空的automate小瓶中。最初,取样每天进行2次或3次。然而,随着实验的进行,取样变得越来越不频繁。总实验持续时间为3-10天。由于同时地测量dic和δ
13
c,所以在运行过程内监测dic。进行实验后的碱度测量来检查碱度一致性。
[0245]
通过将碳酸酐酶粉末(sigma aldrich,cas 9001-03-0)溶解到去离子水中并进行连续稀释来制备碳酸酐酶溶液。在高浓度(1mg/ml)处,碳酸酐酶溶液与皂类似,具有粘性的表面和气泡。如上文所描述使用70-100μm的aldrich 13c标记的方解石来准备溶解实验。就
在第一时间点被获得之前,碳酸酐酶溶液经由注射器通过取样端口被添加到实验袋中。然后将袋充分混合并获得第一时间点。
[0246]
流出物表征和环境影响
[0247]
co2中和方案将失效,除非反应物溶液丰富并且使所述方案不具有环境上支持不住的影响。附图中详细描述的系统、方法和装置是基于在海水介质中与co2反应的封存剂,例如碳酸盐固体,但可以应用于淡水。下文讨论两种情况的环境牵连。在所有情况下,根据实施方案提供的系统提供了产生流出的流出物的装置和工艺,该流出的流出物具有比系统的流入物中提供的co2分压更低的co2分压。
[0248]
许多发电厂在单程(single pass)或再循环模式中使用海水作为冷却剂。例如,在英国撤回海水来冷却核电厂以8
·
10
15
l/天的速率发生。如果存在1000个封存反应器,如实施方案中所描述的,每个封存反应器操作以便中和成比例的每日co2排放物,则每个反应器每天将需要溶解2.5
·
10
11
g的caco3。假设海洋表面水具有2100μeq/l的碱度,以上描述的caco3的反应将增加碱度,从而将环境水的碱度增加0.03%,非常小的增加。以低得多的速率冷却水流可能会使流出物中的碱度仅仅提高百分之几。如这些计算表明,很少一部分的冷却水可以被分流到碳酸盐反应器位点并返回到流出物流,其中对流出水品质的影响最小。
[0249]
在稍微增强的碱度的情况下将水返回到表面海洋可能被认为是微不足道且非威胁性的环境结果。例如,3m/天的上升流速率(upwelling rate)可能发生在沿海地区持续几个月以及涵盖数千km的海岸线的广大地区。所评估的沿海上涌(coastal upwelling)以每1000km海岸线1sv(1
·
106m3/秒=8.6
·
10
13
l/天)的速率发生。加利福尼亚沿海外的上升流以3
·
105μeq碱度/天的速率(假设100m水碱度为2120μm,并且表面碱度=2085μm,berelson,未公布的数据)增加海洋表面的碱度。一些反应器(假设存在1000个反应器)的实施方案将仅对沿海海洋增加5
·
10
12
μeq碱度/天。与caco3反应并被倾倒在沿海海洋中的、一天的全球co2排放物的中和将以相当于在沿着1000km的海岸线的上升流期间添加的碱度量的量增加海洋的碱度。换句话说,相比于一个巨大的反应器工厂在一天内可以对海洋增加的碱度,仅沿着1000km的沿海海洋在一天内对表面海洋上涌更多的碱度。基于评估,每1000km的海岸线可能需要约3个反应器,这仍然低于来自深水的自然碱度通量超过2个数量级。此外,因为沿海环境越来越多地遭受腐蚀性和环境有害的“酸化”水,所以向一些沿海环境添加富含碱性的水可能看起来是环境上有利的(feely等人,global biogeochemical cycles 26(3)(2012),其公开内容通过引用并入本文)。存在碱性水的添加可能减轻的对沿海水产养殖的文献记录的影响。
[0250]
淡水反应器也是可行可操作的,并且流出物排出碱度将由流量和溶解反应速率控制。产生碱性淡水对于若干应用可能是环境上和经济上有利的。碱性饮用水作为标准饮用水的健康替代品销售。碳酸盐溶解和co2封存的产物可以是可销售的且经济上有用的消耗品。碱性淡水的另一个重要应用是用于农业目的。高度酸性的土壤,例如东北部和carolinas(卡罗来纳州)的部分地区的土壤,对某些蔬菜(芦笋、西兰花、甜菜、卷心菜、胡萝卜、花椰菜、莴苣、洋葱、豌豆、胡椒和菠菜)不是有利的。因此,使用具有一定碱度的灌溉水将是对酸性土壤的优选的处理或改良。将co2封存工厂结合到农业灌溉系统将产生双方有益的结果。
[0251]
等同原则
[0252]
已经描述了若干实施方案,本领域技术人员将认识到,在不脱离本发明的精神的情况下可以使用各种修改、可选择的构造和等同物。另外,为了避免不必要地模糊本发明,未描述许多众所周知的工艺和元件。因此,上文的描述不应被认为是限制本发明的范围。
[0253]
本领域技术人员将理解,本文公开的实施方案以实施例而非限制的方式来教导。因此,上文的描述中所包含的内容或附图中所示出的内容应被解释为说明性的而不是限制性的含义。以下权利要求意图涵盖本文描述的所有通用和特定的特征以及本发明方法和系统的范围的所有陈述,其作为语言问题可以被称为落在其之间。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1