环状RNAcirc0120175在调控卵巢癌中的应用
环状rnacirc0120175在调控卵巢癌中的应用
技术领域
1.本发明涉及生物工程技术领域,尤其涉及环状rnacirc0120175在调控卵巢癌中的应用。
背景技术:
2.卵巢癌(oc)是女性生殖器官癌症中最致命的恶性肿瘤。截至2018年,oc是全球女性中第七大最常见的癌症;oc早期通常无症状,缺乏有效的早期诊断指标,进展隐匿且迅速;超过80%的oc患者在确诊时处于晚期(iii或iv)阶段;预后差、死亡率高严重威胁女性生命健康;因此,进一步探索oc的发生发展机制,寻找早期诊断的肿瘤生物标志物或潜在的治疗靶点具有重要意义;
3.环状rna(circrna)于1976年代首次在真核生物中发现,被认为是一类具有闭环结构、高丰度、高稳定性和组织特异性的新型非编码rna分子;circrna具有多种不同的生物学功能,如通过调节线性rna转录、下游基因表达和蛋白质产生,在许多生物学过程中发挥重要作用。越来越多的研究表明,circrna同时具有致癌和抑癌功能,在肿瘤发生和进展中发挥核心调节作用,并被建议作为肿瘤诊断或新治疗靶点的生物标志物;如hsa_circ_0005273通过调节yap1-hippo信号通路促进乳腺癌肿瘤发生;circcelsr1通过mir-1252调节foxr2表达来促进oc细胞中的紫杉醇耐药;hsa_circ_0077837与膀胱癌患者的临床病理特征和预后不良显着相关,影响膀胱癌的生物学功能;
4.为了明确如何影响卵巢癌细胞的增殖、迁移和侵袭,为此需要环状rnacirc0120175在调控卵巢癌中的应用。
技术实现要素:
5.本发明提出的环状rnacirc0120175在调控卵巢癌中的应用,解决了现有技术中存在的问题。
6.为了实现上述目的,本发明采用了如下技术方案:
7.一种环状rna在调控卵巢癌中的应用。
8.优选的,所述环状rna为circ_0120175,其核酸序列如seqidno.1所示。
9.优选的,所述hsa_circ_012015作为正调控子参与卵巢癌figo分期和淋巴结转移。
10.一种环状rna在制备卵巢癌诊断的生物制品,包括所述circ_0120175。
11.优选的,所述生物制品包括:试剂、试剂盒、芯片。
12.一种卵巢癌治疗药物,包括:所述circ_0120175,或所述circ_0120175的抑制剂。
13.优选的,所述抑制剂包括:(需要补充具体的名称和序列)。
14.优选的,所述卵巢癌治疗药物至少具有以下功用:
15.抑制卵巢癌figo的分期,和/或,抑制淋巴的结转移。
16.本发明中,通过rna测序(rna-seq)分析来自三对oc和相邻非癌组织样本的总rna,获取大量circrna转录本;确定了hsa_circ_0120175在oc组织中高度表达;随后在大量卵巢
癌标本中验证发现,卵巢癌组织中hsa_circ_0120175的表达水平显着高于相邻卵巢肿瘤组织中的表达水平;之后敲除hsa_circ_0120175后,卵巢癌细胞增殖、迁移和侵袭率均受到抑制,裸鼠成瘤实验进一步验证了hsa_circ_0120175对卵巢恶性肿瘤生长的影响;circrna hsa_circ_0120175是诊断卵巢癌的良好生物标志物和治疗卵巢癌的潜在靶点。
附图说明
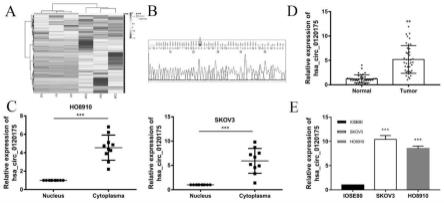
17.图1为circ_0120175在oc组织和细胞系中的表达;其中:
18.图1a为3个正常卵巢组织和3个卵巢癌组织中差异表达的circrna的聚类热图;
19.图1b为通过pcr扩增的hsa_circ_0120175产物的sanger测序显示hsa_circ_0120175为环状结构;
20.图1c为核质分离验证hsa_circ_0120175位于oc细胞质;
21.图1d为hsa_circ_0120175在卵巢癌组织中表达水平上调;
22.图1e为hsa_circ_0120175在人卵巢癌细胞系(ho8910和skov3)中表达上调。
23.图2为circ_0120175表达水平与oc总体生存率之间的关系示意图;
24.图3为circ_0120175对oc细胞生物学功能的影响;其中:
25.图3a为小干扰rna si-circrna在卵巢癌细胞系中的干扰效率;
26.图3b为cck8实验显示干扰hsa_circ_0120175后ho8910和skov3细胞系增殖能力下降;
27.图3c集落形成显示干扰hsa_circ_0120175后ho8910和skov3细胞系集落形成能力下降;
28.图3d-e为transwell实验显示干扰hsa_circ_0120175后ho8910细胞系侵袭迁移能力下降;
29.图3f-g为transwell实验显示干扰hsa_circ_0120175后skov3细胞系侵袭迁移能力下降;
30.图3h-i为划痕试验显示干扰hsa_circ_0120175后ho8910和skov3细胞系增殖迁移能力下降;
31.图4为hsa_circ_0120175对裸鼠皮下异种移植肿瘤生长的影响
32.图4a为干扰hsa_circ_0120175后,裸鼠皮下异种移植肿瘤示意图;
33.图4b为相较对照组,干扰hsa_circ_0120175后皮下肿瘤体积缩小;
34.图4c为裸鼠皮下异种移植肿瘤增长情况的示意图;
35.图4d为相较对照组,干扰hsa_circ_0120175后皮下肿瘤重量下降。
具体实施方式
36.下面结合具体实施例对本发明作进一步解说。
37.本技术人从2017年9月至2018年6月,共从皖南医学院第一附属医院(皖南医学院弋矶山医院)选取80例患者用于本研究。
38.所有患者均未接受术前放疗并在术前签署知情同意书。从这80名患者中获得的样本包括40份oc组织和40份来自正常oc正常部分的对照组织(均来自接受良性卵巢疾病手术的患者)。
39.所有样本均由皖南医学院第一附属医院病理科的2名独立病理学家进行判断,以确认诊断。本研究经皖南医学院第一附属医院(皖南医学院弋矶山医院)伦理委员会批准。
40.下述实施例中所用检测方法如下:
41.1、rna-seq分析和circrna鉴定
42.使用rnaisoplus(takara,日本)从细胞或组织中提取总rna,然后检查总rna样品的质量和数量;然后,使用带有核糖酶(hmr)(illumina,newenglandbiolabs,beverly,ma)的kaparnahyperprep试剂盒构建文库,然后使用novaseq6000(illumina,sandiego,ca)对文库进行测序;
43.最后,将有效读数与人类参考基因组(grch37/hg19)进行比对,以通过生物信息学方法识别circrna。
44.2、细胞培养
45.人卵巢癌细胞株包括skov3和ho8910细胞以及正常卵巢细胞iose-80从上海药物研究所购买获得;skov3细胞系在mccoy's5a培养基(gibco,usa)中培养,ho8910和iose-80细胞系在rpmi1640培养基(gibco,usa)中培养;两种培养基均添加了10%胎牛血清(sigma,st.louis,mo,usa)和1%青霉素-链霉素抗生素;细胞在37℃、5%co2的培养箱中常规培养,并在倒置光学显微镜下常规观察细胞;当细胞生长密度融合度达到80%时,通过edta/胰蛋白酶(货号:252000-056,gibco,usa)消化传代细胞。
46.3、细胞转染
47.sirna阴性对照(si-nc)和靶向hsa_circ_0120175的小干扰rna(sirna)购自geneseed(中国广州);对数生长期的skov3和ho8910细胞接种在6孔板中,每孔1.5
×
105个细胞,置于37℃培养箱中孵育;当细胞密度达到约50%时,按照lipofectamine3000转染试剂(invitrogen,usa)的说明转染卵巢癌细胞。
48.4、rna提取和rt-qpcr
49.通过trizol试剂(invitrogen,usa)和rnaisoplus(货号:9010,takara,japan)提取组织和细胞中的总rna,并通过nanodrop2000(thermofisherscientific,waltham)测定rna样品的纯度和浓度,美国);使用firststrandcdnasynthesiskit(gs0201-2,geneseed,china)将总rna逆转录为cdna;最后,在abi7900ht测序仪(thermofisherscientific,waltham,ma)上使用sybrgreenqpcrmix(gs0201-3,geneseed,china)对cdna进行定量逆转录聚合酶链反应(qrt-pcr);实验结果采用2-δδct
方法计算;实验重复3次;使用了以下引物:
50.正向引物(hsa_circ_0120175-f1):5'-atgatagtaaaagtttgcggacaat-3';
51.反向引物(hsa_circ_0120175-r1):5'-gtgcaccaactgaagtacac-3'。
52.5、核质分离
53.根据制造商的方案,使用核/细胞质分级分离试剂盒(目录号:am1921;lifetechnologies;carlsbad,ca,usa)分离细胞成分;使用胰蛋白酶消化细胞,在pbs中洗涤并在细胞分级缓冲液中孵育;离心后,上清液为细胞质部分,使用核提取缓冲液提取核部分。
54.6、细胞活力测定
55.将skov3和ho8910细胞接种在96孔板中,每孔4
×
104个细胞,并在细胞培养箱中孵育;分别在第1天、第2天、第3天和第4天向每个孔中加入10μlcellcountingkit-8(cck-8,
wst-8,dojindo,japan);然后,在培养箱中培养2小时后,在分光光度酶标仪(biotek,vt,usa)上测量450nm处的吸光度(od)。
56.7、菌落形成试验
57.将细胞(每孔200个细胞)接种在6孔板中;随后转染细胞并在使用前在37℃、5%co2的培养箱中培养2周;每3天更换一次培养基,用pbs(solarbio,beyotimetechnology,china)洗涤细胞,用多聚甲醛(beyotimetechnology,china)固定菌落30分钟,然后用结晶紫(millipore,usa)染色15分钟;使用以下公式计算集落形成率:(克隆数/接种细胞数)
×
100%。
58.8、transwell检测
59.transwell室(corning,24孔插入物,8微米孔径)分别用于检测细胞迁移和侵袭;各组待测细胞在transwell小室中传代培养,密度为1
×
105细胞/ml,在无血清培养基中,下层加入正常培养基;24小时后,膜底面的细胞被0.1%结晶紫(millipore,usa)染色,并在显微镜下以五个高倍随机视野计数。
60.9、划痕试验
61.将待检查的细胞组重新悬浮并接种在六孔板上(每孔5x105个细胞),当细胞达到90-100%融合时,使用200μl移液器尖端在每个孔中进行垂直划痕;使用pbs冲洗掉多余的悬浮细胞,然后将2ml无血清培养基添加到每个孔中,并在5%co2、37℃的培养箱中培养;在划痕后0、12和24小时对细胞进行拍照,并使用imagej软件(美国国立卫生研究院,贝塞斯达,马里兰州,美国)测量划痕面积。
62.10、皮下异种移植肿瘤形成模型
63.将5周大的雌性balb/c裸鼠(南京生命科学研究所,南京,中国)在无病原体环境中饲养;将沉默或未沉默的hsa_circ_0120175的skov3细胞(1
×
107)皮下注射到每只裸鼠的右侧腹壁;然后,每周测量和计算每只裸鼠的肿瘤体积;6周后对裸鼠拍照,进行颈椎脱位,剥离肿瘤;肿瘤切除后称重;体积按公式计算:体积(mm3)=宽
×
长
×
高;本研究经皖南医学院第一附属医院(弋矶山医院)动物伦理委员会批准。
64.11、统计分析
65.采用spss24.0软件进行统计分析,绘图工具使用graphpad5.0;使用t检验或单向方差分析(anova)方法进行统计比较;使用kaplan-meier方法和对数秩检验计算生存曲线;在p《0.05时差异被认为具有统计学意义。
66.实施例一:
67.利用rna-seq分析了3个卵巢癌组织和3个正常卵巢组织中去核糖体rna后的总rna,发现了一个显着上调的circrna,称为hsa_circ_0120175,如图1a所示;
68.为了验证环的形成并确定hsa_circ_0120175的环化位点,对hsa_circ_0120175的pcr产物进行sanger测序,sanger测序证实了hsa_circ_0120175的环化位点,如图1b所示;
69.由于hsa_circ_0120175亚细胞定位尚不清楚,因此进行了核质分离实验,数据显示hsa_circ_0120175主要位于细胞质中,如图1c所示
70.同时通过rna-seq发现hsa_circ_0120175在oc组织中上调,然后我们通过qrt-pcr验证了hsa_circ_0120175在40个oc组织、正常卵巢组织和oc细胞系中的表达;结果显示,oc组织中hsa_circ_0120175的表达水平明显高于正常卵巢组织,如图1d所示;
71.与正常卵巢细胞系iose80相比,hsa_circ_0120175在oc细胞系(sk0v3和ho8910)中显着过表达,如图1e所示。
72.实施例二:
73.为了探讨了hsa_circ_0120175表达水平与oc患者临床病理特征之间的关系;
74.根据oc组织中hsa_circ_0120175表达的中位水平(低表达《中位,高表达≥中位)将患者分为两组,见表1;
75.表1为oc患者的hsa_circ_0120175表达和临床病理特征:
[0076][0077][0078]
hsa_circ_0120175的表达水平与figo分期和淋巴结浸润显着相关,但与肿瘤大小或肿瘤等级没有显着相关性;
[0079]
kaplan-meier生存曲线显示,hsa_circ_0120175高表达的oc患者生存率相对较差,如图2所示。
[0080]
实施例三:
[0081]
为了明确hsa_circ_0120175在oc中的生物学功能,用sirna转染ho8910和skov3细胞;随后通过qrt-rcr检测其在oc中的表达以确认沉默;结果表明,si-circrna组中hsa_circ_0120175的表达水平低于空白对照组和si-nc组,如图3a所示;
[0082]
其中,空白对照组和si-nc组之间没有显着差异,如图3a所示;然后,通过集落形成试验、cck8试验、transwell试验和划痕试验评估oc细胞的增殖、迁移和侵袭;在cck8测定和
划痕测定中,hsa_circ_0120175干扰组的细胞增殖能力受到显着抑制,如图3b-c所示;
[0083]
通过transwell和matrigeltranswell分析表明,干扰hsa_circ_0120175后显着抑制h08910和skov3的迁移和侵袭能力,如图3d-g所示;
[0084]
在划痕试验中干扰hsa_circ_0120175后细胞的愈合能力明显低于si-nc对照细胞,如图3h-i所示;从而表明,hsa_circ_0120175在体外促进oc的增殖、侵袭和迁移。
[0085]
实施例四:
[0086]
通过裸鼠皮下异种移植肿瘤形成检测hsa_circ_0120175对oc进展的影响;与si-nc组相比,si-circrna组的肿瘤生长明显受到抑制,肿瘤异种移植物的体积和重量较对照组减少,如图4a-d所示其中p《0.05;从而表明,hsa_circ_0120175在体内可促进oc的生长。
[0087]
综上所述通过rna测序(rna-seq)分析来自三对oc和相邻非癌组织样本的总rna,获取大量circrna转录本;确定了hsa_circ_0120175在oc组织中高度表达;随后验证了在一大群样本中,卵巢癌组织中hsa_circ_0120175的表达水平显着高于相邻卵巢肿瘤组织中的表达水平;之后敲除hsa_circ_0120175后,卵巢癌细胞增殖、迁移和侵袭率均受到抑制,裸鼠成瘤实验进一步验证了hsa_circ_0120175对卵巢恶性肿瘤生长的影响;从而表明circrna hsa_circ_0120175是诊断卵巢癌的良好生物标志物和治疗卵巢癌的潜在靶点。
[0088]
在本发明的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”、“顺时针”、“逆时针”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的设备或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
[0089]
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
[0090]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1