一种调控/降低乙酰辅酶A支路代谢高效合成7-脱氢胆固醇的方法与流程
一种调控/降低乙酰辅酶a支路代谢高效合成7-脱氢胆固醇的方法
技术领域
1.本发明涉及一种,特别涉及一种调控/降低乙酰辅酶a支路代谢高效合成7-脱氢胆固醇的方法。
背景技术:
2.维生素d3(cholecalciferol,vd3)是一种人体必需的脂溶性维生素,调节人体中的钙、磷代谢,因此,常作为于治疗佝偻病、软骨病和维持钙稳态等方面的药物。一般成年健康的人类可以通过将体内摄入的胆固醇转化为vd3,而不需要额外补充vd3。但是随着全球老龄化人口的增加,老年人户外活动减少,并且随着年纪的增长,人体吸收能力的降低和内脏功能的退化,便会出现因vd3缺乏而导致的骨质疏松等疾病。不光是老年人需要补充vd3,婴幼儿由于刚出生吸收能力还未完全成熟,并急需供应身体快速生长所需要的营养物质,因此,同样需要额外补充vd3。7-脱氢胆固醇(7-dehydrocholestero,7-dhc)是合成vd3的重要前体物质,它经过紫外照射转化为vd3。7-dhc是一种重要的甾体激素类药物中间体,不光能合成vd3,同时也是合成雄甾烯二酮(4ad)等甾体药物的中间体。为了满足全球vd3的巨大市场,工业上将获得的7-dhc,在230-300nm的高压汞灯照射下转化为vd3,因此,生产vd3的核心问题在于7-dhc的合成。
3.传统的工业化7-dhc的制备方法主要有提取法(鱼肝油为原料)和化学合成法,因容易受到过敏反应的影响,提取法目前已逐步被化学合成法所替代。化学合成法是以羊毛脂胆固醇为原料,经过氧化、溴化、消除和水解反应合成7-dhc。化学合成法中底物羊毛脂胆固醇的质量直接决定了最终产物7-dhc的质量,因此,为了获得高品质的羊毛脂胆固醇,通常也需要进行酸化等处理。化学合成的方法虽然是目前工业化生产中常用的方法,但是其能耗高,反应条件苛刻且后处理繁琐,并对环境污染严重。利用微生物发酵法生产7-dhc具有绿色可持续的优势,并且微生物(如酿酒酵母)是一种安全可靠,具有巨大工业化应用潜力的微生物,是生产7-dhc和vd3优秀的底盘细胞。
4.7-dhc的微生物合成主要集中在已知合成路径中基因的增强和分支路径的阻断,但所需强化的基因同样也适合生产其他产物。利用微生物进行7-dhc的生产时,强化和阻断的基因虽然对合成目标产物具有一定的效果,但是由于7-dhc的合成涉及多个合成路径,往往会造成代谢通量失衡,给生产菌株带来负面影响。vd3的微生物合成主要集中于菌株的筛选方面,但是菌株的筛选费时费力,不仅要确定高效的筛选方法,还需要花费大量金钱进行大规模后期筛选与发酵检测,才能获得vd3产量极低的菌株。如中国专利cn103275997a、美国专利us2007/0204059a1、中国专利cn107075551b、中国专利cn104988168a。
5.中国专利cn104988168a是通过增强乙酰辅酶a的合成通量,进而提升7-dhc的合成,强化的基因有:acs、adh2、acl和ald6。但是使用组成型启动子对乙酰辅酶a的合成进行强化,会造成菌体代谢压力过高。中国专利cn104988168a和中国专利cn103275997a通过敲除erg5和erg6基因,进一步增强7-dhc的合成,但是敲除erg5和erg6会造成酿酒酵母合成麦
角甾醇受阻。麦角甾醇是一种决定膜的流动性和渗透性的重要物质,直接阻断其合成,会导致细胞生长缓慢,不利于目标产物7-dhc的合成。专利cn202110160871将7-dhc合成路径中的部分酶使用氧化酶体和线粒体定位标签定位在酿酒酵母中各区室化中,形成相对独立的7-dhc合成途径,同时也增加了7-dhc合成所需前体物质的储存空间,也减少了反馈作用,在同一区室中,酶与酶之间的转化效率提高,减少作用底物的损失,最终实现7-dhc产量提升4倍,达到53.31mg/l,但是同一区室中产物的传质传递效率降低,阻止了生产效率的提高。中国专利cn202110562366设计了动态调控系统,实现代谢通量更大限度的流向目标产物,同时也不会影响菌体的生长繁殖,最终使7-dhc的产量达到156mg/l,但是其副产物的生成并没有得到有效的弱化,7-dhc的产量无法进一步提升,且产物组分不利于分离过程。
6.通过上文分析可知,传统技术通过增强乙酰辅酶a的方式,对于提升7-脱氢胆固醇的的合成具有一定助益,但实际上仍不能达到理想效果,因为前体物质的强化对于其下游路径上的供应都会提升,而并不能因此提高7-dhc的合成竞争力。该问题亟待本领域技术人员解决。
技术实现要素:
7.针对现有技术中的不足之处,本发明利用一类有关乙酰辅酶a分解代谢的关键基因降低乙酰辅酶a分解,同时平衡细胞内氧化还原力,进而高效合成7-脱氢胆固醇的方法。该方法克服了传统的只通过增强乙酰辅酶a用于提升7-脱氢胆固醇的技术,而是提供有关7-脱氢胆固醇合成相关的基因,并通过对这些基因的过表达和敲除,进而增强乙酰辅酶a的合成,同时降低乙酰辅酶a消耗,达到增强7-脱氢胆固醇在微生物中合成的目的。
8.本发明第一方面提供了一种调控/降低乙酰辅酶a支路代谢高效合成7-脱氢胆固醇的方法,包括利用一类有关乙酰辅酶a分解代谢的关键基因,在工程菌内进行基因重组,以降低乙酰辅酶a分解;从而增强7-脱氢胆固醇合成。
9.进一步地,所述的在7-dhc合成中有重要的作用的一类有关乙酰辅酶a分解代谢的关键基因包括:
10.进一步地,编码天冬氨酸转氨酶的基因aat1(seq id no.41)、磷酸甘油酸途径的磷酸丝氨酸磷酸酶基因ser2(seq id no.42)、nadp(+)依赖性谷氨酸脱氢酶基因gdh1(seq id no.44)、nadp(+)依赖性谷氨酸脱氢酶基因gdh3(seq id no.43)、cdp-二酰基甘油-丝氨酸o-磷脂酰转移酶基因cho1(seq id no.45)。
11.进一步地,所述天冬氨酸转氨酶(酶的ec编号——ec:2.6.1.1)用于催化草酰乙酸转化为天冬氨酸;所述磷酸丝氨酸磷酸酶(ec:3.1.3.3)参与丝氨酸和甘氨酸的生物合成;所述谷氨酸脱氢酶(ec:1.4.1.4)是催化氨和α-酮戊二酸合成谷氨酸;所述cdp-二酰基甘油-丝氨酸o-磷脂酰转移酶(ec:2.7.8.8)是在磷脂的生物合成中起作用。
12.进一步地,所述利用有关乙酰辅酶a分解代谢的关键基因的方法是敲除这些基因。
13.进一步地,所述高效合成7-脱氢胆固醇的方法,不仅包括利用上文所述的一类有关乙酰辅酶a分解代谢的关键基因,还包括利用增加乙酰辅酶a合成的基因,在工程菌内进行基因重组,从而增强7-脱氢胆固醇合成的方法。
14.进一步地,所述的增加乙酰辅酶a合成的基因包括:线粒体苹果酸脱氢酶mae1(seq id no.40)、乙醇脱氢酶ii adh2或d-乳酸脱氢酶dld1。
15.进一步地,所述线粒体苹果酸脱氢酶mae1(ec:1.1.1.38)用于催化苹果酸氧化脱羧为丙酮酸;所述d-乳酸脱氢酶dld1(ec:1.1.2.4)用于催化d-乳酸氧化为丙酮酸;乙醇脱氢酶ii adh2(ec:1.1.1.1)用于催化乙醇转化为乙醛。
16.进一步地,所述利用有关乙酰辅酶a合成的关键基因的方法是对增加乙酰辅酶a合成的基因进行增强表达。
17.进一步地,所述的增强表达的途径包括使用下述组成型启动子:p
tdh3
、p
tef1
、p
pgk1
、p
eno2
、p
tpl1
或者使用下述诱导型启动子p
gal1
、p
gal10
、p
gal7
。通常情况下,是指在菌株内进行同源重组时,使用组成型启动子p
tdh3
、p
tef1
、p
pgk1
、p
eno2
、p
tpl1
和诱导型启动子p
gal1
、p
gal10
、p
gal7
表达上述需增强的乙酰辅酶a合成的基因(线粒体苹果酸脱氢酶mae1,乙醇脱氢酶ii adh2或d-乳酸脱氢酶dld1)。
18.进一步地,上文所述的工程菌选自酿酒酵母s288c、酿酒酵母by4742、酿酒酵母y187、毕赤酵母x-33或热带假丝酵母1798。
19.进一步地,本发明通过过表达和敲除相关基因,即:过表达增加乙酰辅酶a合成的基因,且敲除有关乙酰辅酶a分解代谢的关键基因,不仅增加了7-dhc合成前体物质乙酰辅酶a的含量,还对酵母中整体的辅因子nadh/nad+的比例产生影响,更有利于菌体生长和7-脱氢胆固醇的合成;
20.进一步地,通过过表达和敲除相关基因,控制酵母中整体的辅因子nadh/nad+的比例范围一般以微摩尔计,控制nadh/nad+的比例范围是0.3-0.8。
21.以原始的酿酒酵母s288c为出发菌株,导入7-dhc合成模块,同时使用启动子p
tdh3
控制线粒体苹果酸脱氢酶mae1(seq id no.40)的表达,接下来使用cas9分别对编码天冬氨酸转氨酶的aat1(seq id no.41)、nadp(+)依赖性谷氨酸脱氢酶gdh1(seq id no.44)、nadp(+)依赖性谷氨酸脱氢酶gdh3(seq id no.43)和cdp-二酰基甘油-丝氨酸o-磷脂酰转移酶cho1(seq id no.45)基因进行敲除。
22.进一步地,所述的7-dhc合成模块是包括经密码子优化的来源于鸡的dhcr24还原酶基因人工合成基因片段(seq id no.46),内源c-8甾醇异构酶(erg2),内源c-5甾醇去饱和酶(erg3)。
23.进一步地,所述c-8甾醇异构酶erg2(ec:5.3.3.5)用于在甾醇合成过程中,催化delta-8双键异构化到delta-7位置。c-5甾醇去饱和酶erg3(ec:1.14.19.20)用于催化将c-5双键引入表甾醇。
24.进一步地,本发明以原始的酿酒酵母s288c为出发菌株,使用启动子p
tdh3
控制线粒体苹果酸脱氢酶mae1(seq id no.40)的表达,接下来使用cas9分别对编码天冬氨酸转氨酶的aat1、nadp(+)依赖性谷氨酸脱氢酶gdh1(seq id no.44)/gdh3(seq id no.43)和cdp-二酰基甘油-丝氨酸o-磷脂酰转移酶cho1(seq id no.45)基因进行敲除,检测菌株生长状态和7-dhc的产量,最终7-dhc的产量达到269mg/l。
25.具体而言,本发明所述的使用cas9分别对不同的基因进行敲除的方法是本领域的常规技术,通常指按照cas9基因敲除试剂盒的操作进行实验的过程。
26.与现有技术相比,本发明具有如下有益效果:
27.1.本发明确定有助于7-脱氢胆固醇合成的有关乙酰辅酶a分解代谢的关键基因;
28.2.优化了菌株生长状态,降低冗余基因负担,在菌株生物量不降低的条件下提高
7-dhc的产量;
29.通过抑制乙酰辅酶a的分解后,代谢通量大量流入目标代谢产物,目标代谢产物7-脱氢胆固醇的产量得到显著提升,达到269mg/l,并且生物量增多,更有利于后续的基因改造。
30.3.7-dhc的产量,最终7-dhc的产量达到269mg/l;比sc001的7-dhc产量提高了25倍;
31.4.增加7-dhc合成前体物质乙酰辅酶a的同时,优化了路径中整体的辅因子比例,有利于菌体的生长和7-dhc产量的提升。
附图说明
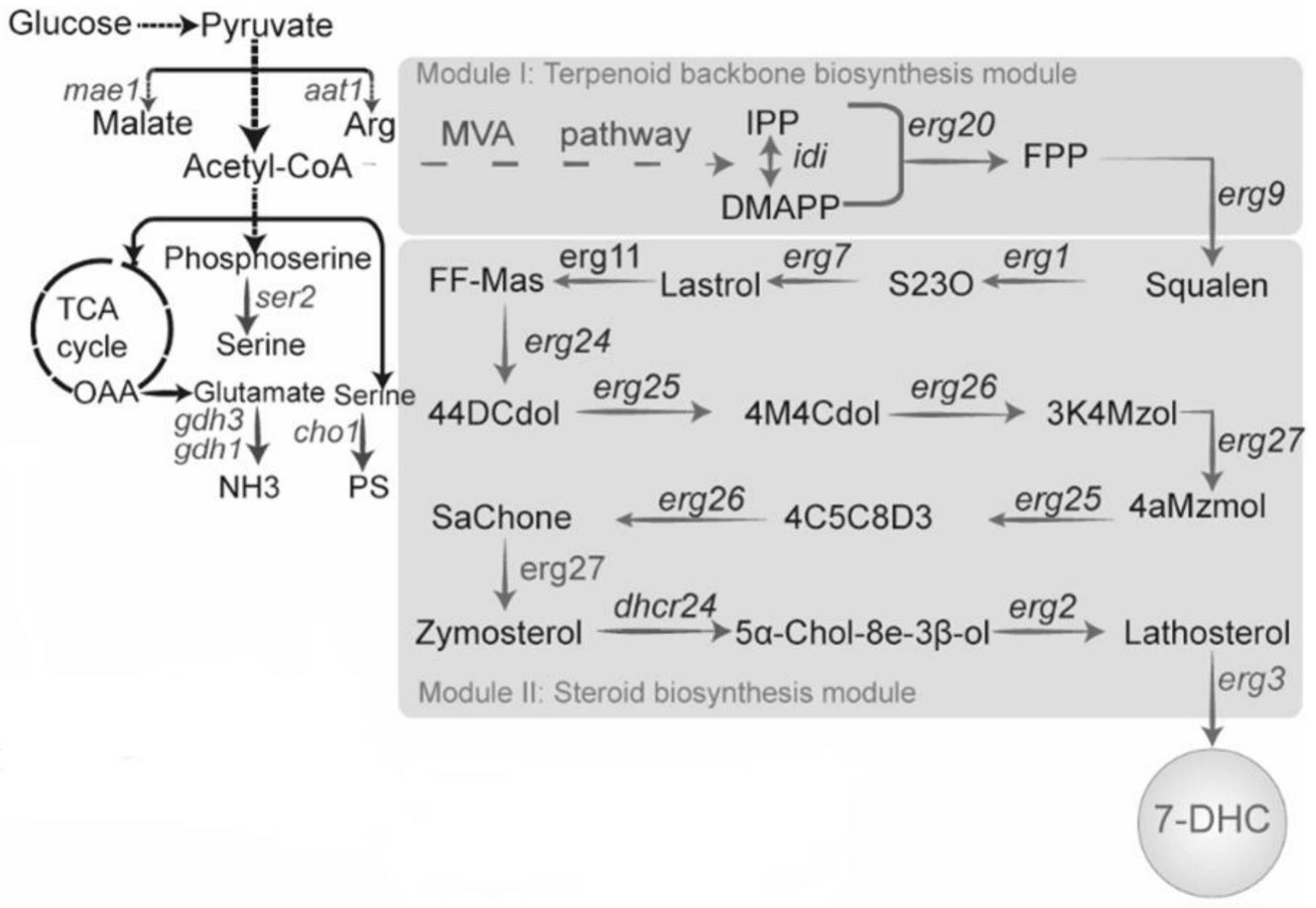
32.图1是整体代谢路径;
33.图2是各个菌株的7-dhc产量;
34.图3a、b、c是各个菌株中总nadh/nad+的值以及标准曲线。
具体实施方式
35.下面结合实施例,对本发明的具体实施方式进行详细地描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
36.本发明中,除非另有其他明确说明,否则百分比、百分含量均以质量计。如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从商业途径购买。
37.实施例1
38.生产7-dhc的重组酿酒酵母菌株的构建
39.如图1所示,图中展示了7-dhc合成的整体代谢路径。(a)以酿酒酵母工程菌s228c基因组为模板,采用引物ho-up-f,ho-up-r扩增得到基因片段ho-up,采用引物ho-down-f,ho-down-r扩增得到基因片段ho-down,片段ho-up和ho-down分别作为整合片段的上、下游同源臂。采用引物tdh3p-f,tdh3p-r扩增得到启动子片段tdh3p。人工合成基因片段鸡来源的c-24还原酶(dhcr24:seq id no.46),使用引物dh24-f、dh24-r扩增得到基因片段dhcr24。
40.(b)使用http://wyrickbioinfo2.smb.wsu.edu/crispr.html.网站进行sgrna的设计,以质粒pml-104为模板,采用引物cas9-ho-f和cas9-ho-r进行质粒环p,得到替换了20bp sgrna的pml-104-ho质粒。
41.(c)将原始酵母菌制成感受态,把步骤(a)和(b)中质粒和片段导入酿酒酵母中,在ura-sd的平板上进行筛选,30℃培养2-3天,使用yz-ho-f和yz-ho-r进行菌落pcr验证,将验证正确的单菌落,在含有5-fao的ypd固体平板上划线培养,消除掉菌体中含有的pml-104质粒,得到的基因工程菌,命名为sc001。
42.引物序列:
43.seq id no.1:ho-up-f:aatgatttcctccctagctgacct
44.seq id no.2:ho-up-r:ggcgagtattgataatgataggttagatcccaggcgtagaac
45.seq id no.3:ho-down-f:taatttgcggccatagtgcgtttagaacgcttcatca
46.seq id no.4:ho-down-r:acgtaggttttgtctcgctaattgc
47.seq id no.5:tdh3p-f:ttaacctatcattatcaatactcgccatttcaaaga
48.seq id no.6:tdh3p-r:agaccaaacggcagacattcgaaactaagttctggtgttttaaaact
49.seq id no.7:dh24-f:agaacttagtttcgaatgtctgccgtttggtct
50.seq id no.8:dh24-r:agcgttctaaacgcactatggccgcaaattaaagccttcgag
51.seq id no.9:cas9-ho-f:tttctagctctaaaactagcatctagcacatactcggatcatttatctttcactgcggag
52.seq id no.10:cas9-ho-r:cgagtatgtgctagatgctagttttagagctagaaatagcaagttaaaataaggctagt
53.seq id no.11:yz-ho-f:tgacaatttatgacctgcagtaca
54.seq id no.12:yz-ho-r:tcctcggtgaatttctcgcagatagac
55.实施例2
56.增强乙酰辅酶a的合成
57.(a)以酿酒酵母工程菌s228c基因组为模板,采用引物mae1-f,mae1-r扩增得到基因片段mae1(seq id no.40),采用引物uperg6-f,uperg6-r扩增得到基因片段uperg6,采用引物downerg6-f,downerg6-r扩增得到基因片段downerg6,采用引物mae1-tdh3p-f,mae1-tdh3p-r扩增得到含有mae1片段重叠区域的启动子片段tdh3p。
58.(b)使用http://wyrickbioinfo2.smb.wsu.edu/crispr.html.网站进行sgrna的设计,以质粒pml-104为模板,采用引物cas9-erg6-f和cas9-erg6-r进行质粒环p,得到替换了20bp sgrna的pml-104-erg6质粒。
59.(c)将sc001酵母菌制成感受态,把步骤(a)和(b)中质粒和片段导入感受态中,在ura-sd的平板上进行筛选,30℃培养2-3天,使用yz-erg6-f和yz-erg6-r进行菌落pcr验证,将验证正确的单菌落,在含有5-fao的ypd固体平板上划线培养,消除掉菌体中含有的pml-104-erg6质粒,得到的基因工程菌,命名为sc002。
60.引物序列:
61.seq id no.13:mae1-f:aacttagtttcgaatgcttagaaccagactatccgtttccgtt
62.seq id no.14:mae1-r:gtgcattgatgtcgaagaacactacaattggttggtgtgcacc
63.seq id no.15:uperg6-f:cttaccaccggcaactaaaccaac
64.seq id no.16:uperg6-r:atggcgagtattgataatgaaagccacacattcctactataacgtc
65.seq id no.17:downerg6-f:accaaccaattgtagtgttcttcgacatcaatgcactcaaacctg
66.seq id no.18:downerg6-r:aaactaaaaatggctcgtgttcatgc
67.seq id no.19:mae1-tdh3p-f:gtaggaatgtgtggctttcattatcaatactcgccatttcaaaga
68.seq id no.20:mae1-tdh3p-r:atagtctggttctaagcattcgaaactaagttctggtgttttaaaact
69.seq id no.21:cas9-erg6-f:ctagctctaaaacaatttctcaagtacttctgagatcatttatctttcactgcggagaa
70.seq id no.22:cas9-erg6-r:cagaagtacttgagaaattgttttagagctagaaatagcaagttaaaataaggctagtcc
71.seq id no.23:yz-erg6-f:tctctcttgctgggcccccaacac
72.seq id no.24:yz-erg6-r:gtcacgggctagtttcttgttgttagt
73.实施例3
74.抑制乙酰辅酶a的分解代谢和调控整体路径中氧化还原水平
75.(a)使用http://wyrickbioinfo2.smb.wsu.edu/crispr.html.网站进行sgrna的设计,以质粒pml-104为模板,采用引物cas9-aat1-f和cas9-aat1-r进行质粒环p,得到替换了20bp sgrna的pml-104-aat1质粒。采用引物cas9-gdh1-f和cas9-gdh1-r进行质粒环p,得到替换了20bp sgrna的pml-104-gdh1质粒。采用引物cas9-gdh3-f和cas9-gdh3-r进行质粒环p,得到替换了20bp sgrna的pml-104-gdh3质粒。采用引物cas9-cho1-f和cas9-cho1-r进行质粒环p,得到替换了20bp sgrna的pml-104-cho1质粒。
76.(b)将sc002酵母菌制成感受态,把步骤(a)中获得的质粒分别导入感受态中,分别获得菌株sc003、sc004、sc005、sc006,接下来,将上述获得的全部质粒依次导入sc002中,最终获得工程菌sc007,将上述得到的菌株在ura-sd的平板上进行筛选,30℃培养2-3d,sc003菌株使用yz-aat1-f测序验证,sc004菌株使用yz-gdh1-f进行测序验证,sc005菌株使用yz-gdh3-f进行测序验证,sc006菌株使用yz-cho1-f进行测序验证,在含有5-fao的ypd固体平板上划线培养,消除掉菌体中含有的pml-104质粒,得到的基因工程菌,分别命名为sc003x、sc004x、sc005x、sc006x、sc007x,其中sc003x、sc004x、sc005x、sc006x、sc007x分别为在s228c酵母中构建了7-dhc合成模块并增强乙酰辅酶a合成后敲除了天冬氨酸转氨酶的aat1基因、nadp(+)依赖性谷氨酸脱氢酶gdh1基因、nadp(+)依赖性谷氨酸脱氢酶gdh3基因、cdp-二酰基甘油-丝氨酸o-磷脂酰转移酶cho1基因以及同时敲除上述基因的菌株。
77.引物序列:
78.seq id no.25:cas9-aat1-f:ctagctctaaaacgtagggttgtgacaacacgcgatcatttatctttcactgcggagaa
79.seq id no.26:cas9-aat1-r:gcgtgttgtcacaaccctacgttttagagctagaaatagcaagttaaaataaggctagtcc
80.seq id no.27:cas9-gdh1-f:ctagctctaaaacaagaatttcaagatagacaagatcatttatctttcactgcggagaa
81.seq id no.28:cas9-gdh1-r:ttgtctatcttgaaattcttgttttagagctagaaatagcaagttaaaataaggctagtcc
82.seq id no.29:cas9-gdh3-f:ctagctctaaaacagtgagcgcattcttgaagagatcatttatctttcactgcggagaa
83.seq id no.30:cas9-gdh3-r:tcttcaagaatgcgctcactgttttagagctagaaatagcaagttaaaataaggctagtcc
84.seq id no.31:cas9-cho1-f:ctagctctaaaacgtaagcgtaaatctcagacagatcatttatctttcactgcggagaa
85.seq id no.32:cas9-cho1-r:tgtctgagatttacgcttacgttttagagctagaaatagcaagttaaaataaggctagtcc
86.seq id no.33:yz-aat1-f:tggattgagcaattgaaaacctttgc
87.seq id no.34:yz-gdh1-f:aagttgctcaaggttacagagtgc
88.seq id no.35:yz-gdh3-f:ttcaattcagggtcacgtgggaa
89.seq id no.36:yz-cho1-f:catttcagcatgatgaggaatttg
90.实施例4
91.构建成功的重组酿酒酵母菌发酵水平验证
92.在2ml ypd培养基中接种固体ypd平板上的酿酒酵母菌sc007x单菌落,30℃,220rpm培养16-20h后,按接种量2%接入含有25mlypd液体培养基的250ml圆底摇瓶内,30℃,220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
93.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾-甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
94.计算得最终sc007x的7-dhc的产量达到269mg/l(如图2)。
95.实施例5
96.构建成功的重组酿酒酵母菌细胞内总nadh/nad+
97.利用att biorequest公司的nadh/nad+试剂盒进行检测,首先离心取菌体,使用nad+/nadh提取液进行细胞裂解,接下来,进行nadh和nad+标准品曲线的测定,将上述裂解的细胞,分别加入96孔板中,分别对nadh和nad+进行测量,最终与绘制的标准进行比对,计算细胞内总nadh/nad+的值。nadh/nad
+
的标准曲线和检测结果如图3所示,数据显示所构建的不同菌株胞内nadh/nad
+
的含量,证明了胞内nadh/nad
+
的含量在0.3-0.8范围内,可得到较高的7-dhc产量。
98.对比例1
99.出发菌株酿酒酵母s288c的发酵
100.在2mlypd培养基中接种固体ypd平板上的酿酒酵母菌s288c单菌落,30℃,220rpm培养16-20h后,按接种量2%接入含有25mlypd液体培养基的250ml圆底摇瓶内,30℃,220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
101.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾-甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
102.没有检测到7-dhc的产量。
103.对比例2
104.生产7-dhc的重组酿酒酵母sc001的发酵
105.在2mlypd培养基中接种固体ypd平板上的酿酒酵母菌sc001单菌落,30℃,220rpm培养16-20h后,按接种量2%接入含有25mlypd液体培养基的250ml圆底摇瓶内,30℃,
220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
106.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾-甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
107.计算得最终7-dhc的产量仅有10.7mg/l。
108.对比例3
109.增强乙酰辅酶a的合成重组酿酒酵母sc002的发酵
110.在2mlypd培养基中接种固体ypd平板上的酿酒酵母菌sc002单菌落,30℃,220rpm培养16-20h后,按接种量2%接入含有25mlypd液体培养基的250ml圆底摇瓶内,30℃,220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
111.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾-甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
112.计算知最终7-dhc的产量仅有51.6mg/l。
113.对比例4
114.敲除乙酰辅酶a的分解代谢基因重组酵母的发酵
115.在2mlypd培养基中接种固体ypd平板上的酿酒酵母菌sc003x、sc004x、sc005x、sc006x单菌落,30℃,220rpm培养16-20h后,按接种量2%接入含有25mlypd液体培养基的250ml圆底摇瓶内,30℃,220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
116.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾-甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
117.计算得最终sc003x、sc004x、sc005x、sc006x的7-dhc的产量分别达到80mg/l、110mg/l、90mg/l和76mg/l。
118.对比例5
119.敲除其他乙酰辅酶a的分解代谢基因重组酵母的构建及发酵
120.使用http://wyrickbioinfo2.smb.wsu.edu/crispr.html.网站进行sgrna的设
计,以质粒pml-104为模板,采用引物cas9-ach1-f和cas9-ach1-r进行质粒环p,得到替换了20bp sgrna的pml-104-ach1质粒。
121.将sc001酵母菌制成感受态,把步骤(a)中获得的质粒分别导入感受态中,将获得的菌株在ura-sd的平板上进行筛选,30℃培养2-3d,sc001x菌株使用yz-ach1-f测序验证,得到的基因工程菌,分别命名为sc001x。
122.在2mlypd培养基中接种固体ypd平板上的酿酒酵母菌sc002x单菌落,30℃,220rpm培养16-20h后,按接种量2%接入含有25mlypd液体培养基的250ml圆底摇瓶内,30℃,220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
123.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾-甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
124.计算得最终7-dhc的产量仅有23mg/l。
125.引物序列:
126.seq id no.37:cas9-ach1-f:tttctagctctaaaacctattgtctagtaagacggtgatcatttatctttcactgcggagseq id no.38:cas9-ach1-r:accgtcttactagacaataggttttagagctagaaatagcaagttaaaataaggctagtseq id no.39:yz-ach1-f:gagctaaggggagcagttacgcaa
127.对比例6
128.将实施例3(a)得到的质粒pml-104-aat1、pml-104-gdh1和pml-104-gdh3依次导入sc002酵母菌中,得到菌株sc005c,其与sc007x菌株相比,没有敲除cho1基因。将得到的sc005x与sc007x分别按照接种量2%接入含有25mlypd液体培养基的250ml圆底摇瓶内,30℃,220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
129.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
130.计算知sc007x的7-dhc的产量达到269mg/l,sc005c的7-dhc产量仅为115mg/l,7-dhc的产量降低了57%。
131.对比例7
132.使用启动子gal1p对mae1基因进行增强,使用弱启动子frs1p依次对天冬氨酸转氨酶的aat1基因、nadp(+)依赖性谷氨酸脱氢酶gdh1基因、nadp(+)依赖性谷氨酸脱氢酶gdh3基因、cdp-二酰基甘油-丝氨酸o-磷脂酰转移酶cho1基因的表达进行下调,得到菌株sc007c。将sc007c与sc007x菌株按照接种量2%接入含有25mlypd液体培养基的250ml圆底
摇瓶内,30℃,220rpm培养96h。发酵至26h时,加入葡萄糖进行碳源的补充。
133.发酵90-120h后,5000rpm离心,使用10ml无菌水重悬,加入0.5mm的玻璃珠,使用高速匀浆破碎仪进行破碎10min,取出破碎后的混合液,加入1g抗坏血酸和0.5g hbt,混匀,依次加入20ml的无水乙醇,10ml的1.5mol/l的氢氧化钾-甲醇溶液,在80℃的水域中皂化2h,皂化结束后使用萃取液(异丙醇:正己烷=1:3/石油醚)进行超声30min,使用分液漏斗除去下层杂质后,将萃取混合液进行冷冻干燥处理,处理结束后使用甲醇或乙腈或甲醇和乙腈的混合物复溶,0.55μm过滤后进行高效液相色谱分析。流动相使用甲醇和水,比例为90:10或者95:5或者98:2。检测器使用紫外检测器,检测波长为265nm。
134.计算知sc007x的7-dhc的产量达到269mg/l,sc007c的7-dhc产量仅为135mg/l,7-dhc的产量降低了50%。
135.总之,在此本发明通过构建7-dhc合成模块使菌株能够生成7-dhc,增加乙酰辅酶a的合成能够将产量提升约5倍,降低乙酰辅酶a的分解可增强7-脱氢胆固醇合成,大幅提高7-dhc的产量(26倍)。
136.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,本领域的技术人员在本发明披露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书的保护范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1