中和新冠病毒的多特异性抗体
1.本发明涉及一种中和新冠病毒的多特异性抗体或其抗原结合分子,及其同源二聚体,编码该多特异性抗体或其抗原结合分子的核酸分子,包含该核酸分子的载体,包含该载体的宿主细胞,包含该多特异性抗体或其抗原结合分子的重组蛋白或免疫缀合物,以及它们在制备治疗或预防新冠病毒所导致的疾病的药物方面的应用,以及在检测产品方面的应用,属于生物医药领域。
背景技术:
2.新冠病毒(sars-cov-2)引起的新型冠状病毒肺炎(covid-19)疫情给人类健康和全球公共卫生安全带来严峻的挑战。
3.sars-cov-2属于冠状病毒科,与2003年暴发的sars冠状病毒同属β属冠状病毒,氨基酸同源性高达77.2%。sars-cov-2病毒的主要包膜蛋白是刺突蛋白(也称spike蛋白,简称s蛋白)。刺突蛋白在病毒感染过程中被细胞内的蛋白酶水解成s1和s2两部分,其中,s2是跨膜蛋白,s1具有识别并结合细胞受体血管紧张素转换酶-2(ace-2)的受体结合区(receptorbinding domain,简称rbd)。s1和s2构成的刺突蛋白是sars-cov-2病毒特异性识别、结合靶细胞受体,并介导病毒感染的病毒蛋白,因此也是中和抗体的识别靶点。
4.到目前为止,对covid-19的临床治疗多以对症支持治疗为主,新冠肺炎的临床症状的复杂性给医生带来了很大的挑战,研发可治疗新冠肺炎的特效药也已成为当前药物研究领域的热点及前沿。
5.国内外许多研究报道了从新冠患者体内分离的中和抗体,这些中和抗体主要靶向sars-cov-2刺突蛋白上的rbd区域或ntd(n-terminal domain) 区域,阻碍病毒进入细胞而达到保护效果。在动物实验和临床实验中,许多抗体也被证实具有一定预防和治疗新冠病毒感染的作用,部分sars-cov-2 中和抗体已获得fda批准用于covid-19的临床治疗。例如,再生元公司的 regn-cov(casirivimab和imdevimab)组合抗体治疗covid-19可以将住院和死亡的人数降低100%。
6.然而,sars-cov-2属于rna病毒,在传播流行过程中病毒的基因组序列容易产生突变;例如,近期在全球各地出现的alpha英国突变株b.1.1.7, beta突变株b.1.351,gamma巴西突变株p.1等等;特别是,最近还出现了传染性更强的流行毒株,delta突变株b.1.617.2和omicron(奥密克戎) 突变株b.1.1.529。据报道,奥密克戎突变株的刺突蛋白(s蛋白)上有多达30多处变异,并且其中多处变异导致其对目前各国使用的新冠疫苗有更强的抗药性,临床上治疗新冠的抗体也基本都失效。
7.因此,开发能够广谱中和多种新冠病毒突变株的抗体,尤其是能够中和新出现的新冠病毒突变株的抗体,对于本领域的研究学者来说是非常紧迫的研究课题。
8.为了提高中和抗体对新冠病毒的中和广度和中和能力,研究人员们对已有的新冠中和抗体进行基因工程改造,希望构建能够靶向病毒的多个表位 (有效抑制逃逸现象),广谱性和中和活性都更好的抗体。多/双特异性抗体就是一个有前景的研究方向。
9.多特异性抗体,例如双特异性抗体(bispecificantibody,bsab),含有两个或多个特异性抗原结合位点,能够同时结合两个或多个抗原,或者一个抗原上存在的两个或多个不同的表位的人工抗体。bsab不仅能够靶向同一分子的两个表位起到多位点特异性结合的作用,也能够靶向不同靶分子的两个表位起到不同靶分子之间的桥梁作用,因此具有作为治疗药物的巨大潜力。
10.双特异性抗体最初是通过融合两个不同抗体的fab片段以形成双特异性f(ab')2分子,采用杂交瘤技术来制备。由于每个杂交瘤均能够产生不同的免疫球蛋白,融合所得的杂交瘤或四倍体瘤理论上能够产生具有同时第一个亲本杂交瘤和第二个亲本杂交瘤的抗原特异性的抗体,然而这种方法产生的抗体轻重链配对组合复杂,正确配对比率低,无法达到药物生产所期望的效果。科学家们也开发了诸如“结-入-穴”(knob-into-hole)和单基因编码的双特异性抗体的构建方法。
11.因此,本领域技术人员希望通过上述的方法来开发新的能够中和新冠病毒,尤其是中和多种新冠病毒突变株的多/双特异性抗体。
技术实现要素:
12.为解决上述技术问题,本发明第一方面提供了一种多特异性抗体或其抗原结合分子,其中,
13.所述多特异性抗体或其抗原结合分子包含第一抗原结合模块和第二抗原结合模块;
14.所述第一抗原结合模块包含轻链可变区vl-1和重链可变区vh-1;
15.所述第二抗原结合模块包含轻链可变区vl-2和重链可变区vh-2;
16.所述轻链可变区vl-1包含轻链可变区的lcdr1-1序列、lcdr2-1序列和lcdr3-1序列;所述重链可变区vh-1包含重链可变区的hcdr1-1序列、hcdr2-1序列和hcdr3-1序列;其中,
17.所述lcdr1-1序列如seqidno.1所示,所述lcdr2-1序列如seqidno.2所示,所述lcdr3-1序列如seqidno.3所示;所述hcdr1-1序列如seqidno.4所示,所述hcdr2-1序列如seqidno.5所示,所述hcdr3-1序列如seqidno.6所示;以及,
18.所述轻链可变区vl-2包含轻链可变区的lcdr1-2序列、lcdr2-2序列和lcdr3-2序列;所述scfv-2的重链可变区vh-2包含重链可变区的hcdr1-2序列、hcdr2-2序列和hcdr3-2序列;其中,
19.所述lcdr1-2序列如seqidno.9所示,所述lcdr2-2序列如seqidno.10所示,所述lcdr3-2序列如seqidno.11所示;所述hcdr1-2序列如seqidno.12所示,所述hcdr2-2序列如seqidno.13所示,所述hcdr3-2序列如seqidno.14所示;或者,
20.所述lcdr1-2序列如seqidno.17所示,所述lcdr2-2序列如seqidno.18所示,所述lcdr3-2序列如seqidno.19所示;所述hcdr1-2序列如seqidno.20所示,所述hcdr2-2序列如seqidno.21所示,所述hcdr3-2序列如seqidno.22所示。
21.在本发明的一个具体实施方案中,所述轻链可变区vl-1的序列如seqidno.7所示,或者,其与seqidno.7所示序列有80%以上的序列同源性;所述重链可变区vh-1的序列如seqidno.8所示,或者,其与seqidno.8所示序列有80%以上的序列同源性。
22.在本发明的一个优选实施方案中,所述轻链可变区vl-2的序列如seqidno.15所示,或者,其与seqidno.15所示序列有80%以上的序列同源性;所述重链可变区vh-2的序列如seqidno.16所示,或者,其与seqidno.16所示序列有80%以上的序列同源性;或者,
23.所述轻链可变区vl-2的序列如seqidno.23所示,或者,其与seqidno.23所示序列有80%以上的序列同源性;所述重链可变区vh-2的序列如seqidno.24所示,或者,其与seqidno.24所示序列有80%以上的序列同源性。
24.在本发明的一个具体实施方案中,上述轻链可变区vl-1可以上述序列的基础之上进行少量氨基酸的缺失、插入或者氨基酸突变,获得同源性在80%以上的氨基酸序列。少量氨基酸的置换(缺失或插入,或者氨基酸突变,或者相似氨基酸的替代),特别是在构架区部分的保守的氨基酸置换所获得的变体,其与上述序列具有较高的同源性(80%以上的同源性),且保留了轻链可变区原有的性质和功能,即与冠状病毒特异性结合的抗体性质和功能,那么,这些变体也落入本发明的保护范围之内。同样的,上述重链可变区vh-1也可以上述序列的基础之上进行少量氨基酸的缺失、插入或者氨基酸突变,特别是在构架区部分的保守的氨基酸置换所获得的变体,所获得的变体保留了重链可变区原有的性质和功能,即与冠状病毒特异性结合的抗体性质和功能,这些变体也都落入本发明的保护范围之内。同理,上述情况也适用于轻链可变区vl-2和重链可变区vh-2,具体不再赘述。
25.在本发明的一个具体实施方案中,所述第一抗原结合模块选自fv、fab、fab’、dsfv或scfv的任意一种;所述第二抗原结合模块选自fv、fab、fab’、dsfv或scfv的任意一种。
26.优选的,所述第一抗原结合模块和所述第二抗原结合模块选择单链抗体片段(scfv)的结构;具体的,将第一抗原结合模块称为单链抗体片段scfv-1;将第二抗原结合模块称为单链抗体片段scfv-2;所述scfv-1的c端通过第一接头肽与所述scfv-2的n端连接,或者scfv-2的c端通过第一接头肽与所述scfv-1的n端连接。
27.优选的,所述scfv-1从n端到c端依次包含所述轻链可变区vl-1、第二接头肽和所述重链可变区vh-1;或者,所述scfv-1从n端到c端依次包含所述重链可变区vh-1、第二接头肽和所述轻链可变区vl-1;
28.所述scfv-2从n端到c端依次包含所述轻链可变区vl-2、第三接头肽和所述重链可变区vh-2;或者,所述scfv-2从n端到c端依次包含所述所述重链可变区vh-2、第三接头肽和轻链可变区vl-2。
29.优选的,所述第一接头肽的序列为glyser(gly4ser)4模式,第二接头肽和第三接头肽的序列为(gly4ser)3模式。
30.在本发明的另一个替代实施方案中,所述第一和第二抗原结合模块是fab或fab’片段。在本发明的再一个替代实施方案中,所述第一和第二抗原结合模块,其中一个是fab或fab’片段,另一个是fv、dsfv或scfv。
31.在本发明的一个替代实施方案中,本发明的多特异性抗体或其抗原结合分子还可以包含更多的抗原结合模块,它们可以与第一/第二抗原结合模块相同,也可以不同,例如可以是结合其他抗原的抗原结合模块。
32.在本发明的一个替代实施方案中,第一/第二抗原结合模块选自鼠源抗体、人源化
抗体或嵌合抗体。
33.在本发明的一个具体实施方案中,所述多特异性抗体或其抗原结合分子包括重链恒定区;所述重链恒定区优选人igg1、2、3、4的重链恒定区。
34.较佳的,所述重链恒定区为人igg1的fc结构域;所述scfv-1的c端通过第一接头肽与所述scfv-2的n端连接,所述scfv-2的c端通过铰链肽连接人igg1的fc结构域,或者,所述scfv-2的c端通过第一接头肽与所述 scfv-1的n端连接,所述scfv-1的c端通过铰链肽连接人igg1的fc结构域。
35.较佳的,所述人igg1的fc结构域从n端到c端依次包含重链恒定区ch2 和重链恒定区ch3;
36.所述重链恒定区ch2的序列如seq id no.25所示;
37.所述重链恒定区ch3的序列如seq id no.26所示;
38.所述铰链肽的序列如seq id no.27所示。
39.本发明第二方面提供了一种多特异性抗体或其抗原结合分子的同源二聚体,其中,
40.所述多特异性抗体或其抗原结合分子的同源二聚体为:当上述的多特异性抗体或其抗原结合分子在宿主细胞中表达时,所述的重链恒定区的结构域发生同源二聚化所形成的同源二聚体。
41.本发明第三方面提供了一种核酸分子,所述核酸分子编码如上述的多特异性抗体或其抗原结合分子的核酸分子。
42.本发明第四方面提供了一种包含上述核酸分子的载体,即包含编码上述多特异性抗体或其抗原结合分子的核酸分子的载体,特别是表达上述的多特异性抗体或其抗原结合分子的表达载体。
43.术语“载体”一词指的是,可将编码某蛋白的多聚核苷酸插入其中并使该蛋白获得表达的一种核酸运载工具。载体可通过转化、转导或转染宿主细胞,使其携带的遗传物质元件在宿主细胞内得以表达。载体可以包含多种控制表达的元件,例如启动子序列、转录起始序列、增强子序列、选择元件及报告基因等。另外,载体还可含有复制起始位点。载体还有可能包括协助其进入细胞的成分,如病毒颗粒、脂质体或蛋白外壳,但不仅仅只有这些物质。在本发明的实施方案中,载体可以选自,但不限于:质粒、噬菌粒、柯斯质粒、人工染色体(如酵母人工染色体yac、细菌人工染色体bac或p1来源的人工染色体pac)、噬菌体(如λ噬菌体或m13噬菌体)以及用作载体的动物病毒,例如,逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如 sv40)。
44.本发明第五方面提供了一种包含上述载体的宿主细胞。
45.关于“宿主细胞”,可以选择,但不限于:大肠杆菌或枯草菌等原核细胞,酵母细胞或曲霉菌等真菌细胞,s2果蝇细胞或sf9等昆虫细胞,或者纤维原细胞、cho细胞、cos细胞、nso细胞、hela细胞、bhk细胞、hek293细胞等动物细胞模型。优选的,所述宿主细胞为hek293细胞。
46.本发明第六方面再一方面提供了一种生产上述的多特异性抗体或其抗原结合分子的方法,其中,通过培养含有编码上述的多特异性抗体或其抗原结合分子的核酸分子的
宿主细胞,以生产上述多特异性抗体或其抗原结合分子。
47.在本发明的上述的多特异性抗体或其抗原结合分子可以采用上述的重组的方式进行生产,也可以采用杂交瘤的方式进行生产。
48.本发明第七方面提供了一种生产上述的多特异性抗体或其抗原结合分子的同源二聚体的方法,培养上述的宿主细胞,当上述的多特异性抗体或其抗原结合分子在所述宿主细胞中表达时,所述的重链恒定区的结构域发生同源二聚化,以生产所述的多特异性抗体或其抗原结合分子的同源二聚体。
49.本发明的其他方面还提供了上述的多特异性抗体或其抗原结合分子的糖基化变体、经半胱氨酸工程化改造的抗体变体、抗体衍生物以及免疫缀合物等。
50.本发明第八方面提供了一种重组蛋白,所述重组蛋白包含上述的多特异性抗体或其抗原结合分子,或者包含上述的同源二聚体。
51.本发明第九方面提供了一种免疫缀合物,该免疫缀合物包含上述的多特异性抗体或其抗原结合分子,或者包含上述的同源二聚体。
52.优选的,所述免疫缀合物的缀合部分采用1个或多个异源分子,例如采用可以应用于免疫缀合物的、具有细胞毒性的异源分子。
53.本发明第十方面提供了一种药物组合物,其中,所述药物组合物包含上述的多特异性抗体或其抗原结合分子,或者包含上述的同源二聚体,或者包含上述的核酸分子,或者包含上述载体,或者包含上述宿主细胞,或者包含上述的重组蛋白,或者包含上述的免疫缀合物,以及药学上可接受的载剂。
54.本发明第十一方面提供了上述的多特异性抗体或其抗原结合分子、或者上述的同源二聚体,或者上述的核酸分子,或者上述载体,或者上述宿主细胞,或者上述的重组蛋白,或者上述的免疫缀合物,在制备治疗或预防由冠状病毒所导致的疾病的药物方面的用途。
55.在本发明的一个优选实施方案中,所述用途是指在制备治疗或预防 sars-cov-2及其突变株、sars-cov或类sars冠状病毒所导致的疾病的药物方面的用途。
56.在本发明的一个更优选实施方案中,所述sars-cov-2突变株为alpha、 beta、gamma、delta或omicron突变株。
57.本发明第十二方面提供了一种检测产品,其中,所述检测产品包含上述的多特异性抗体或其抗原结合分子,或者包含上述的同源二聚体,或者包含上述的核酸分子,或者包含上述载体,或者包含上述宿主细胞,或者包含上述的重组蛋白,或者包含上述的免疫缀合物。
58.所述检测产品用于检测冠状病毒在样品中的存在或水平。
59.在本发明的一个具体实施方案中,所述检测产品包括,但不限于,检测试剂、检测试剂盒、检测芯片或试纸等。
60.本发明的上述多特异性抗体或其抗原结合分子可以通过化学方法或者基因工程的方法进行标记,标记后的抗体或其抗原结合分子可以用于检测;标记后的抗体或其抗原结合分子,落入本发明的保护范围之内。
61.具体的检测方法,可以采用以下步骤,1)提供样品;2)将所述样品与上述本发明的多特异性抗体或其抗原结合分子进行接触;3)检测样品与抗体或其抗原结合分子之间的免疫反应。
62.本发明再一方面还提供了治疗或预防新冠病毒所导致的疾病的方法,向患者施用治疗有效量的上述的多特异性抗体或其抗原结合分子,或其同源二聚体;或者向患者施用包含有治疗有效量的上述的上述的多特异性抗体或其抗原结合分子,或其同源二聚体的药物组合物。优选的,新冠病毒所导致的疾病是sars-cov-2病毒及其突变株所导致的疾病。更优选的,所述 sars-cov-2突变株为alpha、beta、gamma、delta或omicron突变株。
63.本发明涉及一种中和新冠病毒的多特异性抗体或其抗原结合分子,及其同源二聚体,编码该多特异性抗体或其抗原结合分子的核酸分子,包含该核酸分子的载体,包含该载体的宿主细胞,包含该多特异性抗体或其抗原结合分子的重组蛋白或免疫缀合物,以及它们在制备治疗或预防新冠病毒所导致的疾病的药物方面的应用,以及在检测产品方面的应用;本发明的中和新冠病毒的多特异性抗体或其抗原结合分子对于sars-cov-2病毒、以及包括 alpha、beta、gamma、delta和omicron在内的多种sars-cov-2突变株均具有显著的中和能力,在中和新冠病毒及其突变株方面表现出优良的广谱性,未来有很好的临床应用前景。
具体实施方式
64.除非另外限定,否则本文中所用的全部技术与科学术语具有如本发明所属领域的普通技术人员通常理解的相同含义。本文所提及的全部出版物、专利申请、专利和其他参考文献通过引用的方式完整地并入。此外,本文中所述的材料、方法和例子仅是说明性的并且不意在是限制性的。本发明的其他特征、目的和优点将从本说明书并且从后附的权利要求书中显而易见。
65.为了解释本说明书,将使用以下定义,并且只要适当,以单数形式使用的术语也可以包括复数,并且反之亦然。要理解,本文所用的术语仅是为了描述具体的实施方案,并且不意欲是限制性的。
66.术语“约”在与数字数值联合使用时意为涵盖具有比指定数字数值小5%的下限和比指定数字数值大5%的上限的范围内的数字数值。
67.如本文中所用,术语“包含”或“包括”意指包括所述的要素、整数或步骤,但是不排除任意其他要素、整数或步骤。
68.术语“抗体”在本文中以最宽的含义使用,涵盖各种结构的天然抗体和人工抗体,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)、单链抗体、完整抗体和呈现期望的抗原结合活性的抗原结合分子、抗原结合片段、抗原结合蛋白、融合蛋白、重组蛋白等。
69.术语“抗原结合分子”、“抗体结合片段”在本文中可以互换使用,是指非完整抗体的分子,其为完整抗体的、与抗原结合的特定部分。可以通过重组dna技术、或通过酶或化学切割完整的抗体制备抗原结合分子。
70.术语“多特异性”抗体指具有至少两个抗原结合位点/抗原结合模块的抗体,所述至少两个抗原结合位点/抗原结合模块中的每一个与相同抗原的不同表位或与不同抗原的不同表位结合。
71.术语“抗原结合模块”、“抗原结合位点”,表示抗体分子中与抗原实际结合的区域,包括例如由抗体轻链可变结构域(vl)和抗体重链可变结构域 (vh)组成的vh/vl对。在本发
明的一些实施方案中,提供了双特异性抗体,其具有两个抗原结合位点/抗原结合模块,能够与冠状病毒的两个不同表位结合。
72.在本发明的一些实施方案中,抗原结合模块选自fv、fab、fab’、dsfv 或scfv的任意一种。
73.所述fab片段是一种由vl、vh、cl和ch1结构域组成的单价片段,例如,通过木瓜蛋白酶消化完全抗体能够获得fab片段。所述fab'单体基本上是具有铰链区的fab片段(其它抗体片段的更详细的描述请参见:基础免疫学 (fundamental immunology),w.e.paul编辑,raven press,n.y.(1993))。 f(ab')2是由胃蛋白酶消化整个igg抗体,去除大部分fc区同时保留一些铰链区后得到的,其具有通过二硫键连接在一起的两个抗原结合f(ab)部分; f(ab')2片段为fab’的二聚体,是二价的抗体片段。f(ab')2可以在中性条件下通过破坏铰链区中的二硫键而被还原,由此将f(ab')2二聚体转化为 fab'单体。所述fv片段由抗体单臂的vl和vh结构域组成。另外,虽然fv 片段的两个结构域vl和vh由独立的基因编码,但是使用重组方法,可以将它们通过能够使这两个结构域作为单条蛋白链产生的合成性连接子连接,在所述单条蛋白链中vl区和vh区配对以形成单链fv(scfv,也称单链抗体)。所述dsfv,是指二硫键稳定性抗体(disulfide-stabilized fv,dsfv),是在scfv基础上发展起来的一类新型小分子抗体,它是将vh和vl的各一个氨基酸残基突变为半胱氨酸,通过链间二硫键连接vh和vl可变区的抗体,能增强fv的稳定性。上述的抗原结合模块都可以通过化学方法、重组dna方法或蛋白酶消化法获得。
74.关于双特异性抗体的两个抗原结合模块的组合方式,根据抗原结合模块的结构不同,主要包括fab-fab组合、fab-fv组合和fv-fv组合。
75.其中,fab-fab组合的双特异性抗体,主要包括:通过大鼠和小鼠杂交瘤细胞再次融合技术hybrid hybridomas产生的triomab、利用各种fc异源二聚体技术(如knob-in-hole、电荷配对、seed、beat、luz-y和duobody 等)和避免fab错配技术(如crossmab、共用轻链、单链fab、κλ-body、 orthogonal fab、duetmab和tcr-cαcβ等)产生的各类bsigg、多种fab 串联方式产生的类igg分子(如tandem orthogonal fab-igg、fit-igg和 bixab等)、利用化学交联技术产生的igg-igg以及各类fab交联技术产生的 fab连接分子(如f(ab')2,dock and lock等)。fab-fab双抗在组合两个抗原识别结合域同时,使用fab能完整保留原抗体的高亲和力,结构更接近天然igg,具有较高的稳定性。但为了避免两个不同fab之间重轻链的错配,需要使用共同轻链或引入突变形成有倾向的配对。
76.fab-fv组合的双特异性抗体中,识别抗原或抗原表位的结合域一个为 fab,另一个则为fv。广义的fv可包含单链可变区抗体(scfv)、工程化改造的有特异性识别功能的多肽或蛋白结构域(如anticalins、bicyclicpeptides、darpins、fynomers等)、配体或受体分子及工程化改造的配体或受体分子等。代表结构有:scfv-fab、scfv-igg、dvd-igg、fab-scfv-fc 等。
77.fv-fv组合的双特异性抗体中,识别抗原或抗原表位的结合域均为fv。代表结构有:bite、diabody、dart、tandab、scfv-scfv-fc等。该组合方式非常灵活,能方便地构建多价和多特异性结合分子。
78.上述不同组合方式的双特异性抗体,结构的稳定性可能会有差异,但对于抗原/抗原表位的亲和力、对于病毒的中和能力主要取决于双特异性抗体的“抗原结合模块/位点”;
换句话说,确定了“抗原结合模块/位点”的双特异性抗体可以上述已知的任何一种组合方式存在。
79.在本发明的一个具体实施方案中,提供了scfv-scfv-fc的双特异性抗体方案;本领域技术人员在获知本发明的双抗方案及其抗原结合模块的序列后,可以采用现有的双抗技术将其改造为上述已知的任何一种组合方式,例如fab-fab组合、fab-fv组合或其他fv-fv组合的双特异性抗体。
80.在本发明的一个具体实施方案中,抗原结合模块为scfv,包含重链可变区(vh区)和轻链可变区(vl区)。
81.关于重链可变区(vh区)和轻链可变区(vl区)可以进一步再划分为互补决定区(cdr)和构架区(fr);cdr为超变区,其间插有较保守的fr区。每个vh和vl由三个cdr和4个fr组成,从氨基端到羧基端以如下顺序排列: fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。在一个给定的vh或vl氨基酸序列中,各cdr的精确氨基酸序列边界可以使用许多公知的方案的任一一种或其组合确定,所述方案包括例如:chothia(chothia等人(1989)nature 342: 877-883),kabat(kabat等人,sequences of proteins of immunologicalinterest,第4版,u.s.department of health and human services, national institutes of health(1987)),abm(university of bath)和 contact(university college london)、国际immunogenetics database (imgt)(https://www.imgt.org/)。本发明抗体的cdr可以根据本领域的任何方案或其组合及人为评估确定边界。
82.术语“fc结构域”或“fc区”在本文中用来定义免疫球蛋白重链的含有至少一部分恒定区的c端区域。该术语包括天然序列fc区和变体fc区。天然的免疫球蛋白“fc结构域”包含两个或三个恒定结构域,即ch2结构域、 ch3结构域和可选的ch4结构域。例如,在天然抗体中,免疫球蛋白fc结构域包含源自igg、iga和igd类抗体的两条重链的第二和第三恒定结构域(ch2 结构域和ch3结构域);或者包含源自igm和ige类抗体的两条重链的第二、第三和第四恒定结构域(ch2结构域、ch3结构域和ch4结构域)。除非本文中另外说明,否则fc区或重链恒定区中的氨基酸残基编号根据如kabat等人, sequences of proteins of immunological interes,第5版,public healthservice,national institutes of health,bethesda,md,1991中所述的 eu编号体系(也称作eu索引)进行编号。
83.在某些实施方案中,可在本文中所提供抗体的fc区中引入一个或多个氨基酸修饰,以此产生fc区变体,以便增强有效性。fc区的修饰包括氨基酸变化(置换、缺失和插入)、糖基化或去糖基化、和添加多个fc。对fc的修饰还可以改变治疗性抗体中的抗体的半衰期,从而实现更低频率的给药和因而增加的方便和减少的材料使用。
84.术语“接头肽”是指由氨基酸组成的连接肽,例如单独或组合使用的甘氨酸和/或丝氨酸残基,以连接抗体中的各个可变结构域。在某些实施方案中,所述接头肽可以为约1至约100个氨基酸长,例如,约1至50个氨基酸长。在一个实施方案中,连接肽是g/s连接肽,包括氨基酸序列(ggggs)n、 gs(ggggs)n,其中n是等于或大于1的正整数,例如,n是1-7中的正整数。接头的非限制性实例公开于文献(shen等,anal.chem.80(6):1910-1917 (2008))和专利(wo 2014/087010)中,将其内容全部按引用并入本文中。
85.如本文所用,术语“结合”或“特异性结合”意指结合作用对抗原是选择性的并且可以与不想要的或非特异的相互作用区别。抗原结合模块/位点与特定抗原结合的能力可以
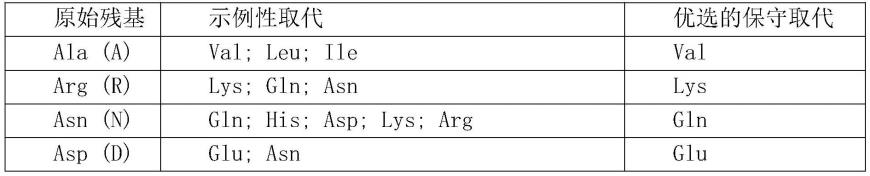
通过酶联免疫吸附测定法(elisa)或本领域已知的常规结合测定法测定。
[0086]“亲和力”或“结合亲和力”指反映结合对子的成员之间相互作用的固有结合亲和力。分子x对其配偶物y的亲和力可以通常由解离常数(kd)代表,解离常数是解离速率常数和缔合速率常数(分别是kdis和kon)的比例。亲和力可以由本领域已知的常见方法测量。用于测量亲和力的一个具体方法是生物膜层干涉技术。
[0087]
术语“抗原”是指引发免疫应答的分子。这种免疫应答可能涉及抗体产生或特异性免疫细胞的活化,或两者兼有。技术人员将理解,任何大分子,包括基本上所有的蛋白质或肽,都可以用作抗原。此外,抗原可以衍生自重组或基因组dna。
[0088]“免疫缀合物”是与一个或多个异源分子(包括但不限于细胞毒性剂)缀合的抗体。
[0089]
关于氨基酸序列的“序列同源性”的百分比,是通过确定两个序列中存在的氨基酸残基的数目来产生匹配位置的数目,将匹配位置的数目除以比较窗口中的位置总数,将结果乘以100从而产生序列的同源性百分比。为了确定序列同源性百分数而进行的最佳比对,可以按本领域已知的多种方式实现,例如,使用可公开获得的计算机软件如blast、blast-2、align或megalign (dnastar)软件。本领域技术人员可以确定用于比对序列的适宜参数,包括为实现正在比较的全长序列范围内或目标序列区域内最大比对所需要的任何算法。
[0090]
在本发明中,就抗体序列而言,氨基酸序列同源性百分数通过将候选抗体序列与参考抗体序列最佳比对后,在一个优选方案中按照kabat编号规则进行最佳比对后,予以确定。在一些实施方案中,就抗体而言,序列同源性可以分布在整个重链可变区和/或整个轻链可变区上,或序列百分数同源性可以仅限定于构架区,而对应cdr区的序列保持100%相同。
[0091]
类似地,就抗体序列而言,基于比对,可以确定相对于参考抗体在目标抗体区域具有氨基酸改变的候选抗体。
[0092]
在本发明中,“保守性取代”是指导致某个氨基酸置换为化学上相似的氨基酸的氨基酸改变。可以通过本领域已知的标准方法,例如定点诱变和pcr 介导的诱变,将氨基酸修饰如取代引入本发明的抗体中。
[0093]
提供功能上相似氨基酸的保守性置换表是本领域熟知的。在一个优选的方面,保守取代残基来自以下的保守替代表,优选地为下表中所示的优选保守取代残基。
[0094]
保守替代表
[0095]
[0096][0097]
术语“n端”指n端的最末氨基酸,术语“c端”指c端的最末氨基酸。
[0098]
抗体cdr区、“互补决定区”或“cdr区”或“cdr”(在本文中与“超变区”、“hvr”可以互换使用),是抗体可变区中主要负责与抗原表位结合的氨基酸区域。重链和轻链的cdr通常被称作cdr1、cdr2和cdr3,从n-端开始顺序编号。位于抗体重链可变结构域内的cdr被称作hcdr1、hcdr2和hcdr3,而位于抗体轻链可变结构域内的cdr被称作lcdr1、lcdr2和lcdr3。
[0099]
本领域公知多种用于在一个给定的vh或vl氨基酸序列中确定其cdr序列的方案。例如,kabat互补决定区(cdr)是基于序列变异性确定的并且是最常用的(kabat等人,sequences of proteins of immunological interest, 5th ed.public health service,national institutes of health,bethesda, md.(1991))。而chothia指的是结构环的位置(chothia和lesk,j.mol.biol. 196:901-917(1987))。abm hvr是kabat hvr和chothia结构环之间的折中,并且由oxford molecular的abm抗体建模软件使用。“接触性”(contact)hvr 基于对可获得的复杂晶体结构的分析。
[0100]
除非另有说明,否则在本发明中,当提及抗体可变区中的残基位置(包括重链可变区残基和轻链可变区残基)时,是指根据kabat编号系统的编号位置。
[0101]
具有不同特异性(即,针对不同抗原的不同结合位点)的抗体具有不同的 cdr。然而,尽管cdr在抗体与抗体之间是不同的,但是cdr内只有有限数量的氨基酸位置直接参与抗原结合。使用kabat,chothia,abm和contact方法中的至少两种,可以确定最小重叠区域,从而提供用于抗原结合的“最小结合单位”。最小结合单位可以是cdr的一个子部分。正如本领域技术人员明了,通过抗体的结构和蛋白折叠,可以确定cdr序列其余部分的残基。因此,本发明也考虑本文所给出的任何cdr的变体。例如,在一个cdr的变体中,最小结合单位的氨基酸残基可以保持不变,而根据kabat或chothia定义的其余cdr残基可以被保守氨基酸残基替代。
[0102]“铰链肽”或“铰链区”,通常是指人igg1的氨基酸glu216至pro230 (参见burton,molec.immunol.22:161-206(1986))。在某些实施方案中,通过将形成重链间s-s键的第一
个和最后一个半胱氨酸残基放置在相同位置,可以将其他igg同种型的铰链区与igg1序列对齐。
[0103]
术语“宿主细胞”指已经向其中引入外源多核苷酸的细胞,包括这类细胞的子代。宿主细胞包括“转化体”和“转化的细胞”,这包括原代转化的细胞和从其衍生的子代。宿主细胞是可以用来产生本发明抗体分子的任何类型的细胞系统,包括真核细胞,例如,哺乳动物细胞、昆虫细胞、酵母细胞;和原核细胞,例如,大肠杆菌细胞。宿主细胞包括培养的细胞,也包括转基因动物、转基因植物或培养的植物组织或动物组织内部的细胞。
[0104]
术语“个体”或“受试者”可互换地使用,是指哺乳动物。哺乳动物包括但不限于驯化动物(例如,奶牛、绵羊、猫、犬和马)、灵长类(例如,人和非人灵长类如猴)、兔和啮齿类(例如,小鼠和大鼠)。特别地,个体是人。
[0105]
实施例1
[0106]
实施例1的双特异性抗体,包含第一抗原结合模块和第二抗原结合模块,它们分别为单链抗体片段scfv-1和scfv-2。
[0107]
在本发明的一个具体实施方案中,所述scfv-1的轻链可变区vl-1包含轻链可变区的lcdr1-1序列、lcdr2-1序列和lcdr3-1序列;所述scfv-1的重链可变区vh-1包含重链可变区的hcdr1-1序列、hcdr2-1序列和hcdr3-1 序列;其中,所述lcdr1-1序列如seq id no.1所示,所述lcdr2-1序列如 seq id no.2所示,所述lcdr3-1序列如seq id no.3所示;所述hcdr1-1 序列如seq id no.4所示,所述hcdr2-1序列如seq id no.5所示,所述hcdr3-1 序列如seq id no.6所示。
[0108]
在本发明的一个优选实施方案中,所述scfv-1的轻链可变区vl-1的序列如seq id no.7所示,或者,其与seq id no.7所示序列有80%以上的序列同源性;所述scfv-1的重链可变区vh-1的序列如seq id no.8所示,或者,其与seq id no.8所示序列有80%以上的序列同源性。
[0109]
具体在本实施例中,所述scfv-1的轻链可变区vl-1的序列如seq idno.7所示,所述scfv-1的重链可变区vh-1的序列如seq id no.8所示。
[0110]
具体来说,本技术实施例1的单链抗体片段scfv-1的轻链可变区vl-1 采用了单抗4l12的轻链可变区的序列,重链可变区vh-1采用了单抗4l12 的重链可变区的序列。关于单抗4l12的技术内容,参见公开号为 cn112159469a的发明专利申请公开文件(即本技术的发明人于2020年09月 30日递交的申请号为202011065506.2的专利申请);根据已公开的信息,单抗4l12为全人源抗体,可以特异性结合sars-cov-2的s1蛋白的受体结合区 rbd。
[0111]
在本发明的一个具体实施方案中,所述scfv-2的轻链可变区vl-2包含轻链可变区的lcdr1-2序列、lcdr2-2序列和lcdr3-2序列;所述scfv-2的重链可变区vh-2包含重链可变区的hcdr1-2序列、hcdr2-2序列和hcdr3-2 序列;其中,所述lcdr1-2序列如seq id no.9所示,所述lcdr2-2序列如 seq id no.10所示,所述lcdr3-2序列如seq id no.11所示;所述hcdr1-2 序列如seq id no.12所示,所述hcdr2-2序列如seq id no.13所示,所述 hcdr3-2序列如seq id no.14所示。
[0112]
在本发明的一个优选实施方案中,所述scfv-2的轻链可变区vl-2的序列如seq id no.15所示,或者,其与seq id no.15所示序列有80%以上的序列同源性;所述scfv-2的重链可变区vh-2的序列如seq id no.16所示,或者,其与seq id no.16所示序列有80%以上
的序列同源性。
[0113]
具体在本实施例中,所述scfv-2的轻链可变区vl-2的序列如seq idno.15所示;所述scfv-2的重链可变区vh-2的序列如seq id no.16所示。
[0114]
具体来说,本技术实施例1的单链抗体片段scfv-2的轻链可变区vl-2 采用了单抗regn10987的轻链可变区的序列,重链可变区vh-2采用了单抗regn10987的重链可变区的序列。关于单抗regn10987的技术内容,参见已发表文献“studies in humanized mice and convalescent humans yield a sars-cov-2antibody cocktail,doi:10.1126/science.abd0827”;根据已公开的信息,单抗regn10987为全人源抗体,可以特异性结合sars-cov-2 的s1蛋白的受体结合区rbd。
[0115]
在本技术的一个具体实施方案中,scfv-1的c端通过第一接头肽与所述 scfv-2的n端连接。在本技术的另一个具体实施方案中,也可以是scfv-2 的c端通过第一接头肽与所述scfv-1的n端连接。
[0116]
在本实施例中,scfv-1的c端通过第一接头肽(linker-a)与scfv-2 的n端连接,且scfv-1从n端到c端依次包含轻链可变区vl-1、第二接头肽(linker-b)和重链可变区vh-1,scfv-2从n端到c端依次包含轻链可变区vl-2、第三接头肽(linker-c)和重链可变区vh-2。
[0117]
即,实施例1的双特异性抗体,从n端到c端依次为:scfv-1—linker-a —scfv-2;更具体地,实施例1的双特异性抗体,从n端到c端依次为:vl-1 —linker-b—vh-1—linker-a—vl-2—linker-c—vh-2。
[0118]
当然,在本技术的其他实施方案中,抗体的结构也可以是vh-1— linker-b—vl-1—linker-a—vl-2—linker-c—vh-2、vl-1—linker-b— vh-1—linker-a—vh-2—linker-c—vl-2或者vh-1—linker-b—vl-1— linker-a—vh-2—linker-c—vl-2。
[0119]
在本技术的其他实施方案中,抗体的结构也可以是vl-2—linker-c— vh-2—linker-a—vl-1—linker-b—vh-1、vh-2—linker-c—vl-2— linker-a—vl-1—linker-b—vh-1、vl-2—linker-c—vh-2—linker-a— vh-1—linker-b—vl-1或者vh-2—linker-c—vl-2—linker-a—vh-1— linker-b—vl-1。
[0120]
在本实施例中,scfv-1与scfv-2之间的第一接头肽(linker-a),其序列采用glyser(gly4ser)4模式。
[0121]
在本实施例中,第二接头肽(linker-b)和第三接头肽(linker-c)的序列,均采用(gly4ser)3模式。
[0122]
在本技术的一个具体实施方案中,双特异性抗体还包括人igg1的fc结构域。
[0123]
在本技术的一个具体实施方案中,scfv-1的c端通过第一接头肽与 scfv-2的n端连接,scfv-2的c端通过铰链肽(hinge)连接人igg1的fc 结构域。在本技术的另一个具体实施方案中,也可以是scfv-2的c端通过第一接头肽与所述scfv-1的n端连接,scfv-1的c端通过铰链肽(hinge)连接人igg1的fc结构域。
[0124]
在本实施例中,双特异性抗体的序列,从n端到c端依次为:scfv-1— linker-a—scfv-2—hinge—fc。
[0125]
在本技术的一个具体实施方案中,人igg1的fc结构域从n端到c端依次包含重链恒定区ch2和重链恒定区ch3;
[0126]
即,实施例1的双特异性抗体的序列,从n端到c端依次为:
[0127]
vl-1—linker-b—vh-1—linker-a—vl-2—linker-c—vh-2—hinge— ch2—ch3。
[0128]
其中,重链恒定区ch2的序列如seq id no.25所示;重链恒定区ch3 的序列如seq id no.26所示;铰链肽hinge的序列如seq id no.27所示。
[0129]
实施例1的中和新冠病毒的双特异性抗体的制备
[0130]
步骤1)构建含有fc基因片段的抗体表达载体pcdna3.4-fc
[0131]
通过金斯瑞公司合成全人源igg1信号肽基因sp、铰链肽hinge、重链恒定区ch2和重链恒定区ch3的基因片段,即sp-fc基因。在信号肽和铰链肽基因之间插入agei和bamhi酶切位点,中间由gtacgc序列间隔开来,即合成sp-agei-bamhi-fc序列将sp-agei-bamhi-fc基因通过ta克隆的方式连接到pcdna3.4载体上,最终得到pcdna3.4-fc表达载体,其中pcdna3.4载体购自赛默飞世尔科技有限公司,其具体的质粒图谱参见公开号为 cn113461811a的发明专利申请公开文件。
[0132]
步骤2)合成抗体基因序列
[0133]
如上所述,实施例1的单链抗体片段scfv-1的轻链可变区vl-1采用了单抗4l12的轻链可变区的序列(如seq id no.7所示),重链可变区vh-1 采用了单抗4l12的重链可变区的序列(如seq id no.8所示);两者之间的第二接头肽(linker-b)氨基酸序列为(gly4ser)3。
[0134]
与之对应的,编码scfv-1的核酸序列,参见公开号为cn112159469a的发明专利申请公开文件。
[0135]
实施例1的单链抗体片段scfv-2的轻链可变区vl-2采用了单抗regn10987的轻链可变区的序列(如seq id no.15所示),重链可变区vh-2 采用了单抗regn10987的重链可变区的序列(如seq id no.16所示);两者之间的第三接头肽(linker-c)氨基酸序列为(gly4ser)3。
[0136]
与之对应的,编码scfv-2的核酸序列,参见上述单抗regn10987的文献。
[0137]
由南京金斯瑞公司,按常规方法合成单链抗体scfv-1—linker-a— scfv-2对应的核苷酸序列。
[0138]
步骤3)构建双特异性抗体基因的表达载体
[0139]
将上述第2)步骤合成的单链抗体scfv-1—linker-a—scfv-2的核苷酸序列的n端和c分别经agei和bamhi酶切后,连接胶纯化回收后的目的片段到上述第1)步骤构建的pcdna3.4-fc表达载体中,并转化dh5α感受态细胞构建最终双特异性抗体的表达质粒,将其命名为pcdna3.4—4l12— regn10987。
[0140]
步骤4)双特异性抗体在哺乳动物细胞293f中的表达
[0141]
双特异性抗体的表达质粒经质粒纯化试剂盒(美基生物)纯化,并利用 ez trans细胞转染试剂(李记生物)共转染hek293f细胞表达。
[0142]
具体转染步骤为:转染前一天将50ml的293f细胞以1.2
×
106个细胞 /ml的密度铺在250ml细胞培养摇瓶中,转染当天用转染试剂ez-trans与步骤3)构建的表达质粒充分混合(质量体积比为dna:ez-trans=1:3)溶于无血清的opm培养基中得到en-trans混合物(即60μg dna和180μl ez-trans溶于4ml培养基),静置15分钟后将ez-trans-dna混合物以雨滴状均匀加入hek293f细胞中,转染六天后离心获取细胞培养上清用于后续的双特异性抗体
的提取和纯化步骤。(附注:当抗体在宿主细胞中表达时,人 igg1的fc结构域会发生同源二聚化形成同源二聚体;经后续的提取和纯化后,进行鉴定。)
[0143]
步骤5)抗体的提取和纯化
[0144]
将上述步骤4)收集的细胞上清液用0.45μm滤膜过滤,用结合缓冲液1
ꢀ×
pbs稀释上清,利用protein-g柱(天地人和生物科技公司,常州)纯化上清中的含igg1 fc的双特异性抗体,纯化方法参照protein-g柱的使用说明。纯化获得的双特异性抗体,将其命名为双抗4l12—regn10987。
[0145]
利用nanodrop2000(thermofisher)测定280nm吸光值并计算抗体浓度。亲和纯化后抗体通过sds-page进行纯度分析和鉴定,取5μl纯化后的样品与 20μl 5
×
上样缓冲液混合,放入100℃的金属水浴锅中加热10分钟,取加热后的样品混合液10μl上样于page gels(南京金斯瑞生物科技有限公司),经电泳将样品按分子量大小分离,分离完样品的凝胶经考马斯亮蓝r250染色 3小时后,用脱色液进行脱色,于geldoc go gel imaging system(bio-rad) 拍照获得表达纯化的双特异性抗体的sds-page检测结果。
[0146]
实施例2
[0147]
实施例2的抗体的序列结构,从n端到c端依次为:scfv-2—linker-a —scfv-1;更具体的,vl-2—linker-c—vh-2—linker-a—vl-1—linker-b —vh-1—hinge—ch2—ch3。
[0148]
其中,单链抗体片段scfv-1的vl-1和vh-1序列同实施例1的对应序列,即单抗4l12的轻链可变区序列和重链可变区序列。
[0149]
单链抗体片段scfv-2的vl-2和vh-2序列同实施例1的对应序列,即单抗regn10987的轻链可变区序列和重链可变区序列。
[0150]
实施例2抗体的其他技术内容同实施例1,具体不再赘述。
[0151]
实施例2的抗体制备过程,除了步骤2)按照实施例2的抗体序列进行合成以外,其他步骤基本同实施例1,具体不再赘述。
[0152]
实施例2的抗体,命名为双抗regn10987-4l12。
[0153]
实施例3
[0154]
实施例3的中和新冠病毒的双特异性抗体,包含两个单链抗体片段 scfv-1和scfv-2。
[0155]
实施例3的单链抗体片段scfv-1,与实施例1的相同,即4l12的单链抗体片段;
[0156]
在本发明的一个具体实施方案中,单链抗体片段scfv-2的轻链可变区 vl-2包含轻链可变区的lcdr1-2序列、lcdr2-2序列和lcdr3-2序列;所述 scfv-2的重链可变区vh-2包含重链可变区的hcdr1-2序列、hcdr2-2序列和 hcdr3-2序列;其中,所述lcdr1-2序列如seq id no.17所示,所述lcdr2-2 序列如seq id no.18所示,所述lcdr3-2序列如seq id no.19所示;所述 hcdr1-2序列如seq id no.20所示,所述hcdr2-2序列如seq id no.21所示,所述hcdr3-2序列如seq id no.22所示。
[0157]
在本发明的一个优选实施方案中,所述scfv-2的轻链可变区vl-2的序列如seq id no.23所示,或者,其与seq id no.23所示序列有80%以上的序列同源性;所述scfv-2的重链可变区vh-2的序列如seq id no.24所示,或者,其与seq id no.24所示序列有80%以上的序列同源性。
[0158]
具体在本实施例3中,所述scfv-2的轻链可变区vl-2的序列如seq idno.23所示,所述scfv-2的重链可变区vh-2的序列如seq id no.24所示。
[0159]
具体来说,本技术实施例3的单链抗体片段scfv-2的轻链可变区vl-2 采用了单抗16l9的轻链可变区的序列,重链可变区vh-2采用了单抗16l9 的重链可变区的序列。关于单抗16l9的技术内容,参见公开号为 cn112159469a的发明专利申请公开文件(即本技术的发明人于2020年09月 30日递交的申请号为202011065506.2的专利申请);根据已公开的信息,单抗16l9为全人源抗体,可以特异性结合sars-cov-2的s1蛋白的受体结合区 rbd。
[0160]
实施例3的双特异性抗体的序列,从n端到c端依次为:scfv-1— linker-a—scfv-2;具体的,vl-1—linker-b—vh-1—linker-a—vl-2—linker-c—vh-2—hinge—ch2—ch3。
[0161]
其中,重链恒定区ch2的序列如seq id no.25所示;重链恒定区ch3 的序列如seq id no.26所示;铰链肽hinge的序列如seq id no.27所示。
[0162]
实施例3的抗体制备过程,除了步骤2)按照实施例3的抗体序列进行合成以外,其他步骤基本同实施例1,具体不再赘述。
[0163]
实施例3的抗体,命名为双抗4l12-16l9。
[0164]
效果数据
[0165]
一、sars-cov-2及其突变株alpha、beta、gamma、delta、omicron假病毒的生产
[0166]
sars-cov-2及其突变株alpha、beta、gamma、delta、omicron假病毒是表面分别具有各自相应的刺突膜蛋白(spike,s),携带荧光素酶报告基因的非复制缺陷型逆转录病毒颗粒,可以模拟sars-cov-2及其突变株病毒对宿主细胞(如人肝癌细胞系huh-7、稳定表达人ace2受体的293t细胞系 293t-ace2)的感染过程,并在感染细胞内表达荧光素酶报告基因。由于假病毒感染不会产生具有感染能力的病毒颗粒,因此可以安全地在生物安全二级实验室内进行相关操作。
[0167]
sars-cov-2及其突变株的假病毒分别通过各自的s蛋白表达质粒和带荧光素酶报告基因的hiv env缺陷的骨架质粒(pnl4-3.luc.r-e-)共转染293t 细胞获得。
[0168]
sars-cov-2的s基因序列根据ncbi genbank序列nc_045512设计,基因序列经密码子优化后,由南京金斯瑞公司合成,并连接到pcdna3.1真核表达载体构建成sars-cov-2蛋白表达质粒。其中,sars-cov-2突变株假病毒 alpha、beta、gamma、delta、omicron需要对s蛋白表达质粒进行相应的点突变和缺失突变。pnl4-3.luc.r-e-骨架质粒源自美国nih aids reagentprogram。所有质粒通过转化dh5α感受态细胞扩增,并利用美基生物生产的质粒纯化试剂盒纯化,纯化操作过程参照试剂盒说明书。
[0169]
293t细胞在含10%胎牛血清(gibco)的dmem培养基培养,转染前接种到10cm细胞平皿中。培养24小时后,利用eztrans细胞转染试剂(李记生物)将骨架质粒(pnl4-3.luc.r-e-)与表达sars-cov-2及其突变株表达质粒以3:1的比例共转染293t细胞,详细转染方法参见ez trans细胞转染试剂的使用说明书。转染48小时后,收取含有假病毒的上清液,2500转离心 10分钟去除细胞碎片后并分装冻存于-80℃冰箱,用于中和抗体的检测。
[0170]
二、本技术实施例1-3的双特异性抗体对sars-cov-2及其突变株(alpha、 beta、gamma、delta和omicron)的假病毒的中和活性的检测
[0171]
在96孔细胞板上测试不同浓度的双特异性抗体抑制假病毒感染huh-7 细胞来检
测其对sars-cov-2及其突变株的中和能力。
[0172]
检测方法大致如下:1)huh-7细胞接种于96孔细胞板,每孔接种1
×
104个,37℃,5%co2细胞培养箱培养24小时;2)将实施例和对比例抗体以细胞培养基稀释成不同浓度,与等体积含100tcid50的假病毒稀释液混合,在37℃孵育1小时;3)弃掉细胞培养液,每孔加入50μl病毒抗体复合物,设置复孔,同时设置无抗体组,无病毒组及阳性抗体对照组;4)培养12小时后,每孔加入150μl维持液,37℃继续培养48小时;5)利用荧光素酶检测试剂盒(luciferase assay system,promega cat.#e1500)裂解细胞并检测每孔的荧光素酶活性,具体检测方法参照试剂盒说明书;利用多功能酶标仪(perkin elmer)检测每孔化学发光rlu值;6)根据抗体与病毒对照rlu 值的比例计算不同浓度抗体对假病毒的中和抑制百分比,并利用prism7软件 (graphpad)计算出抗体抑制病毒的半数抑制剂量ic50(单位μg/ml)。
[0173]
实施例1-3:本技术实施例1-3的双特异性抗体4l12-regn10987、 regn10987-4l12和4l12-16l9;
[0174]
对比例1:单抗4l12;对比例2:单抗regn10987;对比例3:单抗16l9;检测结果如下表1所示:
[0175]
表1
[0176][0177]
表1为实施例1-3的双特异性抗体(4l12-regn10987、regn10987-4l12 和4l12-16l9),以及对照例抗体1-3(单抗4l12、单抗regn10987和单抗16l9) 对sars-cov-2病毒及其突变株的中和ic50结果。
[0178]
从表1可以看出:
[0179]
1)实施例1-3的双特异性抗体(4l12-regn10987、regn10987-4l12和 4l12-16l9),对于sars-cov-2病毒及其突变株alpha、beta、gamma、delta 具有强效中和能力,证明了实施例1-3的双特异性抗体能够中和sars-cov-2 病毒及其多种突变株,在中和新冠病毒方面具有较好的广谱性;
[0180]
2)从整体来看,实施例1和2的双特异性抗体(4l12-regn10987和 regn10987-4l12)在中和sars-cov-2病毒及其多种突变株的效果略优于对比例1和2(即它们对应的单抗4l12和单抗regn10987);
[0181]
3)从整体来看,实施例3的双特异性抗体(4l12-16l9)在中和sars-cov-2 病毒及其多种突变株的效果略优于对比例1和3(即它们对应的单抗4l12和单抗16l9);
[0182]
4)令人惊喜的发现是,对于最近刚出现的omicron突变株,对比例1 和2(单抗4l12和单抗regn10987)的ic50值均大于10μg/ml,然而它们组合后的双特异性抗体(4l12-regn10987)的ic50值却为0.0152μg/ml。这说明单抗4l12和单抗regn10987各自对于omicron突变株的中和效果很差,但是它们组合后形成的双特异性抗体(4l12-regn10987)却意外表现出显著的中和能力;
[0183]
5)令人惊喜的发现是,对于最近刚出现的omicron突变株,对比例1 和3(单抗4l12和单抗16l9)的ic50值均大于10μg/ml,然而它们组合后的双特异性抗体(4l12-16l9)的ic50值却为0.158μg/ml。这说明单抗4l12 和单抗16l9各自对于omicron突变株的中和效果很差,但是它们组合后形成的双特异性抗体(4l12-16l9)却意外表现出显著的中和能力。
[0184]
这一发现,让发明人也感觉到非常的意外和惊喜,也希望能够及时的公开并进行临床推广,为防控omicron突变株所引发的新一轮疫情做出贡献。
[0185]
综上,本技术实施例1-3的双特异性抗体(4l12-regn10987、 regn10987-4l12和4l12-16l9)对于sars-cov-2病毒及其多种突变株具有强效中和能力,几何平均半中和浓度(gm ic50)在0.0014至0.0068μg/ml的水平,在中和新冠病毒及其突变株方面表现出优良的广谱性,显著优于目前fda 批准用于covid-19临床治疗的casirivimab和imdevimab等抗体;特别是,对于最近刚出现的omicron突变株,本技术实施例1和3的双特异性抗体 (4l12-regn10987和4l12-16l9)也意外表现出显著的中和能力。
[0186]
在本领域技术人员获得本技术的公开内容和精神实质的基础之上,可以在本技术实施例的双抗序列基础上进行一些简单调整,例如,在实施例1和实施例3的双抗序列基础上调换一下轻链和重链的前后顺序,获得如vh-1— linker-b—vl-1—linker-a—vl-2—linker-c—vh-2、vl-1—linker-b— vh-1—linker-a—vh-2—linker-c—vl-2或者vh-1—linker-b—vl-1— linker-a—vh-2—linker-c—vl-2的抗体。也可以在实施例2的双抗序列基础上调换一下轻链和重链的前后顺序,获得如vh-2—linker-c—vl-2—linker-a—vl-1—linker-b—vh-1、vl-2—linker-c—vh-2—linker-a— vh-1—linker-b—vl-1或者vh-2—linker-c—vl-2—linker-a—vh-1— linker-b—vl-1的抗体;可以合理地推测出它们均具有与实施例1-3双抗类似的效果;这些等同替换方案均落入本技术的保护范围内。
[0187]
本领域技术人员也可以在本技术实施例1-3的双抗序列基础之上,对于接头肽序列、fc结构域序列和铰链肽序列等进行常规的等同替换;本领域技术人员也可以在本发明的双抗序列基础之上做出不影响抗体整体效果的氨基酸插入、替换或缺失处理;这些等同替换方案均落入本技术的保护范围内。
[0188]
在本领域技术人员获得本技术的scfv-scfv的双特异性抗体方案及其抗原结合模块的序列的基础之上,可以采用现有的双抗技术将其改造为 fab-fab组合、fab-fv组合或其他fv-fv组合的双/多特异性抗体。
[0189]
从上述内容可以看出,本发明的中和sars-cov-2病毒的多特异性抗体或其抗原结合分子对于新冠病毒具有优良的广谱、强效中和能力,因此,本领域技术人员在获知这一技术内容的基础上,可以进一步开发对应的重组蛋白、融合蛋白以及免疫缀合物,以及治疗或预防由新冠病毒所导致的疾病的药物,以及用于检测新冠病毒的检测产品。
[0190]
应用例
[0191]
本应用例描述了本技术实施例1-3的双特异性抗体来治疗sars-cov-2 病毒及其突变株所导致的疾病的方法。
[0192]
尽管提供了特定施用方法、剂量和模式,但是本领域技术人员将理解的是可在实质性不影响治疗的情况下作改变。基于本文公开的指导,可通过施用治疗有效量的本文所述的双特异性抗体来治疗或预防冠状病毒感染,从而降低或消除冠状感染。
[0193]
具体的施用方法如下:
[0194]
1)对象的预治疗:在具体实施例中,在施用包括本领域技术人员已知的一种或多种抗病毒药物疗法的治疗剂之前先对对象进行治疗。然而,并不总是要求进行此种预治疗,并可经熟练的临床医生决定。
[0195]
2)治疗组合物的施用:筛选对象之后,将上述的治疗有效剂量的本技术实施例1-3的双特异性抗体施用于对象(如处于感染sars-cov-2病毒风险或已知感染sars-cov-2病毒的成年人或新生婴儿)。可将另外药物如抗病毒剂在施用所公开的药剂同时、之前或之后施用于对象。通过本领域已知的任何方法如口服施用、吸入、静脉、肌肉、腹膜内或皮下来实现施用。为预防、降低,抑制和/或治疗对象的状况,而施用的组合物的量取决于正在治疗的对象、病症的严重程度和治疗对象的施用方式。理想地,药剂的治疗有效量是足以预防、降低、和/或抑制、和/或治疗对象的状况而不引起对象中实质性细胞毒性效应的量。有效量可容易地由本领域技术人员例如用建立剂量应答曲线的常规试验来确定。同样地,这些组合物可用惰性稀释剂或药学上可接受的载体配制。在一个具体实例中,根据sars-cov-2病毒感染的特定阶段,每两周以5mg每kg或每两周10mg每kg施用抗体。在一实例中,连续施用抗体。在另一实例中,以50μg每kg施用抗体,每周两次,持续2-3周。治疗组合物可长期施用(如持续几个月或几年时间)。
[0196]
3)评价:施用一种或多种疗法之后,监控感染sars-cov-2的对象 sars-cov-2病毒水平的降低,或与新冠肺炎疾病相关的一种或多种临床症状的减少。在特定实例中,治疗2天后开始,对对象进行一次或多次分析。采用本领域已知的任何方法监控对象。例如,可获得来自对象的生物样品包括咽拭子,并对sars-cov-2病毒水平的变化进行评估。
[0197]
4)额外治疗:在具体实施例中,如果对象稳定或对治疗有少量的、混合的或部分的应答,可在用他们之前接受了期望时间的相同方案和物质制剂进行再评价之后,进行额外的治疗。
[0198]
应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
[0199]
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方式
或变更均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1