一种幽门螺旋杆菌核心脂多糖寡糖抗原糖链的化学合成方法
1.本发明涉及一种幽门螺旋杆菌核心脂多糖寡糖抗原糖链的化学合成方法,属于糖化学技术领域。
背景技术:
2.幽门螺旋杆菌(helicobacter pylori)是一种螺旋形的、带有鞭毛的革兰氏阴性菌,世界超过50%的人感染了幽门螺旋杆菌。感染幽门螺旋杆菌会引发胃炎、胃溃疡、十二指肠溃疡甚至胃癌,60%以上的胃癌都被认为与幽门螺旋杆菌感染有关。2021年,美国卫生部在第15届致癌因子报告中列为明确致癌因子。目前治疗幽门螺旋杆菌的方法主要为以抗生素和质子泵抑制剂结合的三联疗法和四联疗法,由于耐药菌的不断增加,使用抗生素去除幽门螺旋杆菌感染的效率逐渐降低,世界卫生组织在2017年将幽门螺旋杆菌列为十二种急需优先开发新抗生素的感染细菌。因此,对于幽门螺旋杆菌疫苗的开发一直都是研究的热点。
3.致病菌表面特异性表达的脂多糖是糖类疫苗开发的重要靶点,已有多个上市的糖缀合物疫苗用于疾病的预防和治疗,如肺炎链球菌十三价糖缀合物疫苗、脑膜炎糖缀合物疫苗、沙门氏菌缀合物疫苗。通过提取方法获取致病菌表面寡/多糖抗原无法保证结构的纯度和均一性,且在提取过程中可能会丢失重要的抗原表位,这些因素限制了糖缀合物疫苗的开发和应用。
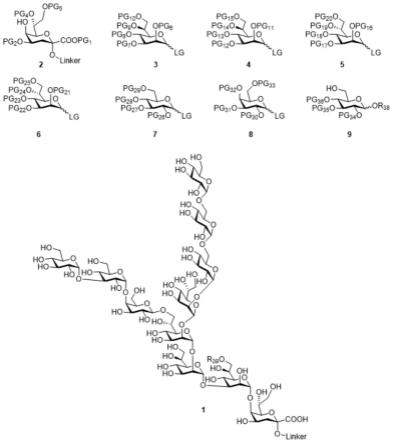
4.脂多糖(lipopolysaccharide,lps)是幽门螺旋杆菌细胞表面主要的抗原组成成分,主要由o-链多糖、核心结构和脂质a三部分组成。幽门螺旋杆菌核心结构由外核心八糖和磷酸化的内核心三糖结构组成,如下所示:
[0005][0006]
幽门螺旋杆菌脂多糖核心寡糖因其结构特异性以及在不同血清型菌株之间的结构保守性,被认为是一个良好的免疫靶点。mario课题组和他的同事研究发现,提取的幽门螺旋杆菌o1,o2,o5脂多糖与载体蛋白结合制成的糖缀合物在小鼠体内产生了较强的igg抗体,同时,这些抗体都可以识别核心寡糖结构。通过化学方法合成结构均一、明确的幽门螺旋杆菌核心寡糖抗原对幽门螺旋杆菌糖抗原表位的确定、幽门螺旋杆菌糖缀合物疫苗的开发具有重要的意义。
技术实现要素:
[0007]
技术问题:本发明解决的技术问题时通过化学方法快速高效的制备幽门螺旋杆菌脂多糖核心寡糖抗原糖链。
[0008]
技术方案:本发明简便易得的葡萄糖,半乳糖,甘露糖为起始原料,经过一系列的化学反应得到八个单糖砌块,这些单糖砌块在邻基参与效应、溶剂效应、温度效应等作用下,基于相应活化试剂的活化,经过一系列糖基化反应得到幽门螺旋杆菌核心寡糖抗原片段;所得到的寡糖片段经脱保护后通过连接臂与芯片结合制成糖芯片,检测最佳的糖抗原表位;将所得的糖抗原片段与载体蛋白结合,制备成糖缀合物,进一步研究糖缀合物的免疫活性,为幽门螺旋杆菌糖缀合物疫苗的开发提供理论基础。
[0009]
本发明第一个目的是提供一种幽门螺旋杆菌脂多糖核心寡糖抗原的化学合成方法,所述方法是利用八个单糖砌块合成幽门螺旋杆菌核心寡糖抗原片段,所述八个单糖砌块分别为化合物2~9,结构如下所示:
[0010][0011]
其中,pg2,pg6,pg8,pg9,pg
12
,pg
13
,pg
14
,pg
15
,pg
17
,pg
18
,pg
19
,pg
22
,pg
23
,pg
25
,pg
26
,pg
28
,pg
29
,pg
30
,pg
34
,pg
35
,pg
36
为氢(h)、苄基(bn)及其衍生物、2-萘甲基(nap)及其衍生物或叔丁基二甲基硅烷基(tbs)、叔丁基二苯基硅烷基(tbdps)或三乙基硅烷基(tes);
[0012]
pg1为氢、甲基(me)、乙基(et)、叔丁基(t-bu)或苄基(bn)中任意一种;
[0013]
pg4,pg5为丙叉基、苄叉基、苄基(bn)及其衍生物、2-萘甲基(nap)及其衍生物或叔丁基二甲基硅烷基(tbs)、叔丁基二苯基硅烷基(tbdps)或三乙基硅烷基(tes)中任意一种;
[0014]
pg7,pg
11
,pg
16
,pg
21
,pg
27
,pg
32
,pg
33
,pg
38
为乙酰基(ac)、氯乙酰基(clac)、苯甲酰基(bz)、新戊酰基、乙酰丙酰基(lev),9-戊甲氧汤基(fmoc)、2-萘甲基(nap)及其衍生物、2-对甲氧基苄基(pmb);
[0015]
pg
10
为乙酰基(ac)、氯乙酰基(clac)、苯甲酰基(bz)、新戊酰基、乙酰丙酰基(lev)或9-戊甲氧汤基(fmoc)中的一种;
[0016]
linker为-(ch2)
n-n-y1y2或者-(ch2)
n-s-y1,其中n=1~10,y1,y2为氢、酰基、苄基及其衍生物、2-萘甲基或苄甲氧羰基(cbz)任意一种;
[0017]
离去基团lg选自三氯乙酰亚胺酯(cnhccl3)、n-苯基三氟乙酰亚胺酯糖苷(cnphccl3)、甲硫基(sme)、乙硫基(set)、苯硫基(sph)、对甲苯硫基(stol)、二苄基磷酸酯基或者氟(f)、氯(cl)、溴(br)、碘(i)任意一种。
[0018]
在本发明的一种实施方式中,所述糖苷键的构建是糖基供体与糖基受体通过活化试剂活化偶联得到。
[0019]
在本发明的一种实施方式中,所述的活化试剂为tmsotf,nis-tmsotf,nis-tfoh,nis-agotf中的一种或多种。
[0020]
在本发明的一种实施方式中,所述的溶剂为无水二氯甲烷、乙醚、甲苯、甲醇、四氢呋喃、n,n-二甲基甲酰胺、水其中的一种或多种。
[0021]
在本发明的一种实施方式中,所述的反应均在氩气的保护下进行搅拌。
[0022]
在本发明的一种实施方式中,所述的糖基化反应浓度为0.02~0.05m。
[0023]
在本发明的一种实施方式中,通过糖砌块供体3和糖砌块受体2进行糖基化反应,得到二糖化合物11,合成路线如下所示:
[0024][0025]
在本发明的一种实施方式中,所述的糖砌块供体3和糖砌块受体2的摩尔比为(1~2):1。
[0026]
在本发明的一种实施方式中,二糖合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷中,加入分子筛,反应温度为-10℃~0℃,加入活化试剂为0.1~0.3当量(相比供体的摩尔当量),反应时间为3-7h。
[0027]
在本发明的一种实施方式中,所述三糖的合成路线如下所示:
[0028][0029]
在本发明的一种实施方式中,所述三糖合成的具体方法包括:二糖11选择性的脱除pg7保护基,得到二糖12;二糖12在促进剂的作用下与糖砌块供体4进行糖基化反应,得到三糖化合物13。
[0030]
在本发明的一种实施方式中,所述的糖砌块供体4和二糖12的摩尔比为(1~2):1。
[0031]
在本发明的一种实施方式中,三糖合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷中,加入分子筛,反应温度为-10℃~0℃,加入活化试剂为0.1~0.3当量(相比供体的摩尔当量),反应时间为3-7h。
[0032]
在本发明的一种实施方式中,所述四糖的合成路线如下所示:
[0033][0034]
在本发明的一种实施方式中,所述四糖合成的具体方法包括:三糖13选择性的脱
除pg
11
保护基,得到三糖14;三糖14在促进剂的作用下与糖砌块供体5进行糖基化反应,得到四糖化合物15。
[0035]
在本发明的一种实施方式中,所述的供体5和三糖14的摩尔比为(1~2):1。
[0036]
在本发明的一种实施方式中,四糖合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷中,加入分子筛,反应温度为-20℃~0℃,加入活化试剂为0.1~0.3当量(相比供体的摩尔当量),反应时间为3-7h。
[0037]
在本发明的一种实施方式中,所述五糖的合成路线如下所示:
[0038][0039]
在本发明的一种实施方式中,所述四糖合成的具体方法包括:四糖15选择性的脱除pg
16
保护基,得到四糖16;四糖16在促进剂的作用下与糖砌块供体6进行糖基化反应,得到五糖化合物17。
[0040]
在本发明的一种实施方式中,所述的糖砌块供体6和四糖16的摩尔比为(1~2):1。
[0041]
在本发明的一种实施方式中,五糖合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷中,加入分子筛,反应温度为-20℃~0℃,加入活化试剂为0.1~0.3当量(相比供体的摩尔当量),反应时间为3-7h。
[0042]
在本发明的一种实施方式中,所述三糖模块21的合成路线如下所示:
[0043][0044]
在本发明的一种实施方式中,所述三糖21合成的具体方法包括:糖砌块供体7与糖砌块受体9在促进剂的催化作用下进行糖基化反应,制备得到二糖18;化合物18选择性脱去pg
29
得到二糖19,化合物19在促进剂的催化作用下与糖砌块供体7继续进行糖基化反应,得到三糖模块20;三糖模块20的端基位经脱除pg
38
后,在碱性催化剂的作用下,端基位羟基与三氯乙腈或者苯基三氟乙酰氯反应可转化为可用于糖基化反应的三糖21。
[0045]
在本发明的一种实施方式中,所述的二糖合成中糖砌块供体和受体的摩尔比为(1~2):1;三糖合成过程中糖砌块供体和受体的摩尔比为(1~2):1。
[0046]
在本发明的一种实施方式中,三糖合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷和乙醚(1:2)中,加入分子筛,反应温度为0℃~室温,加入活化试剂为0.1~0.3当量(相比供体的摩尔当量),反应时间为3-7h。
[0047]
在本发明的一种实施方式中,所述八糖的合成路线如下所示:
[0048][0049]
在本发明的一种实施方式中,所述八糖合成的具体方法包括:五糖17选择性的脱除pg
21
保护基,得到五糖22;五糖22在促进剂的作用下与三糖供体21进行糖基化反应,得到八糖化合物23。
[0050]
在本发明的一种实施方式中,所述的糖砌块供体21和受体22的摩尔比为(1~2):1。
[0051]
在本发明的一种实施方式中,八糖合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷和乙醚(1:3)中,加入分子筛,反应温度为0℃~室温,加入活化试剂为0.1~0.3当量(相比供体的摩尔当量),反应时间为3-7h。
[0052]
在本发明的一种实施方式中,所述二糖模块26的合成路线如下所示:
[0053][0054]
在本发明的一种实施方式中,所述二糖26合成的具体方法包括:糖基供体7与受体24在促进剂的催化作用下进行糖基化反应,制备得到二糖25;化合物25选择性脱去pg
38
,在碱性催化剂的作用下,端基位羟基与三氯乙腈或者苯基三氟乙酰氯反应可转化为可用于糖基化反应的二糖26。
[0055]
在本发明的一种实施方式中,所述的糖砌块供体和受体的摩尔比为(1~2):1。
[0056]
在本发明的一种实施方式中,二糖合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷和乙醚(1:2)中,加入分子筛和噻吩,反应温度为0℃~室温,反应时间为3-7h。
[0057]
在本发明的一种实施方式中,所述十一糖的合成路线如下所示:
[0058][0059]
在本发明的一种实施方式中,所述十一糖30合成的具体方法包括:八糖23选择性的脱除pg
20
保护基,得到八糖27;八糖27在促进剂的作用下与单糖供体8进行糖基化反应,得到九糖化合物28;九糖28选择性脱去保护基pg
32
得到九糖受体29,在促进剂的作用下与糖基供体26进行糖基化反应,得到十一糖30。
[0060]
在本发明的一种实施方式中,所述的糖砌块供体和受体的摩尔比为(2~5):1。
[0061]
在本发明的一种实施方式中,十一糖30合成的糖基化反应条件为:将糖基供体和糖基受体溶于二氯甲烷和乙醚(1:3)中,加入分子筛,反应温度为0℃~室温,加入活化试剂为0.1~0.3当量(相比供体的摩尔当量),反应时间为3-7h。
[0062]
在本发明的一种实施方式中,十一糖30在碱性条件下脱去酰基保护基,在钯碳/氢气条件下脱去芳香保护基,完成脱保护,得到全脱保护的十一糖1;
[0063][0064]
在本发明的一种实施方式中,所述的脱保护使用的氢气压力为4大气压,所使用的溶剂为乙酸乙酯,甲醇,水,醋酸混合溶剂。
[0065]
本发明基于上述方法合成得到了一种组装有连接臂的幽门螺旋杆菌核心抗原类寡糖化合物,结构式如式i所示。
[0066]
本发明还提供了一种用于筛选幽门螺旋杆菌糖抗原片段芯片的制备方法,所使用的核心寡糖结构通过连接臂与芯片通过共价键结合,其通式可表示为糖-linker-芯片。
[0067]
本发明还提供了一种用于制备幽门螺旋杆菌糖蛋白缀合物的方法,核心寡糖分子通过连接臂与载体连接,制备得到糖蛋白缀合物,其通式可表示为糖-linker-载体蛋白;此载体蛋白可为白喉毒素无毒突变蛋白(crm197),血蓝蛋白(klh)、牛血清蛋白(bsa)、脑膜炎炎外膜蛋白(ompc),破伤风类毒素(tt)或者白喉类毒素(dt)中的一种。
[0068]
本发明还提供了上述幽门螺旋杆菌脂多糖核心寡糖抗原、糖芯片以及糖缀合物在制备幽门螺旋杆菌疫苗中的应用。
[0069]
在本发明的一种实施方式中,所述糖芯片的制备方法为:将带有氨基连接臂的寡糖通过共价键与表面修饰了羧基的芯片结合,并进一步与抗体血清结合。
[0070]
在本发明的一种实施方式中,所述糖蛋白缀合物的制备方法为:将带有氨基连接臂的寡糖与载体蛋白中天冬氨酸或者谷氨酸侧链羧基形成酰胺键。
[0071]
有益效果:
[0072]
本发明基于化学法制备幽门螺旋杆菌保守的核心脂多糖抗原片段十一糖。本发明通过优选的保护基策略、温度效应、溶剂效应、优选的糖基组装序列,发现一条高效制备核心寡糖抗原的路线和方法。化学合成得到的核心寡糖抗原还原端装有氨基连接臂,可与芯片或载体蛋白结合,为进一步开发幽门螺旋杆菌糖缀合物疫苗的提供理论基础。
附图说明
[0073]
图1为合成幽门螺旋杆菌核心寡糖抗原所需糖砌块以及目标物十一糖的结构式。
[0074]
图2为糖砌块3*的合成路线图。
[0075]
图3为糖砌块4*的合成路线图。
[0076]
图4为糖砌块5*和6*的合成路线图。
[0077]
图5为糖砌块7*和9*的合成路线图。
[0078]
图6为糖砌块8*的合成路线图。
[0079]
图7为五糖36*的合成路线图。
[0080]
图8为三糖40*的合成路线图。
[0081]
图9为二糖43*的合成路线图。
[0082]
图10为十一糖1的合成路线图。
[0083]
图11为对比例1中通过[2+3]组装策略合成五糖的路线图。
[0084]
图12为对比例1中二糖43*的合成路线。
[0085]
图13为对比例1中二糖50*的合成路线。
[0086]
图14为对比例1中二糖52*的合成路线。
[0087]
图15为对比例2中通过[8+3]组装策略合成十一糖的路线图。
[0088]
图16为对比例1中三糖54*的合成路线。
具体实施方式
[0089]
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购得的常规产品。
[0090]
本年发明的产率计算方法为“产物(mol)/反应原料(mol)*100%”。本发明中化合物结构鉴定的方法为核磁共振图谱测定(400m,600m,700m),高分辨质谱测定,旋光治测定,结果已在每个化合物的具体合成过程中列出。
[0091]
实施例1
[0092]
糖砌块3*的合成如图2所示:
[0093]
以已报道的d,d-庚糖化合物10*为起始原料,经mitsunobu反应实现构型转化,d,d-庚糖10*转化为l,d-庚糖11*,产率为84%。对硝基苯甲酰基在弱碱碳酸钾的条件下脱去得到化合物12*,产率为95%。化合物12*在溴苄和氢化钠的条件下进行苄基化反应,得到化合物13*,产率为85%。使用80%的醋酸处理脱去化合物14*的o2,3-丙叉基,得到化合物14*,产率为94%。使用樟脑磺酸(csa)、苯甲酸三乙原酸酯和80%的醋酸选择性的将化合物14*的c2位引入苯甲酰基保护,得到化合物15*,产率为65%。然后c3位羟基使用乙酰丙酰基保护得到化合物16*,产率为86%。化合物16*经脱除c7位tbdps,而后进行乙酰化得到化合物17*,产率为41%。硫糖苷17*经脱硫,三氟乙酰亚胺酯基化两步反应转化为糖基供体3*,两步产率为92%。
[0094]
具体实验操作和步骤:
[0095]
化合物11*:将化合物10*(2.5g,4.0mmol)溶于thf(50.0ml)中,在室温下加入三苯
基膦(2.1g,8.0mmol),对硝基苯甲酸(1.33g,8.0mmol)和偶氮二甲酸二异丙基(diad)(1.5ml,8.0mmol),反应液在室温下搅拌2小时。待反应原料完全消失后,混合液经减压浓缩后使用硅胶层析柱分离纯化石油醚/乙酸乙酯,20:1)后得到化合物11*(2.5g,3.36mmol,84%)。1h nmr(400mhz,chcl3)δ8.47
–
8.02(m,3h,ar),7.77
–
7.04(m,16h,ar),5.74(ddd,j=7.6,6.3,1.9hz,1h,h-6),5.57(s,1h,h-1),4.80(d,j=11.0hz,1h,arch2),4.43(d,j=11.0hz,1h,ch2),4.37
–
4.34(m,1h,h-5),4.33(m,1h,h-3),4.20(dd,j=5.6,1.0hz,1h,h-2),3.98(dd,j=10.3,7.3hz,1h,h-7),3.84(dd,j=10.3,6.2hz,1h,h-7’),3.51(dd,j=10.2,6.8hz,1h),h-4,2.61
–
2.32(m,2h,sch2ch3),1.40(s,3h,ch3),1.36(s,3h,ch3),1.14(t,j=7.4hz,3h,sch2ch3),1.00(s,9h,tbdps).
13
c nmr(101mhz,chcl3)δ163.7,150.5,137.6,135.6,135.5,133.3,133.0,130.8,129.8,129.7,128.5,128.2,127.7,127.7,123.4,109.5,79.8(c-1),78.7,76.4,75.0,72.9,72.6,67.0,62.1,28.0,26.7,26.4,24.3,19.2,14.2;hrms(esi)m/z calcd for c
42h50
no9ssi[m+h]
+
772.2946,found 772.2947。
[0096]
化合物12*:将化合物11*(2.6g,3.4mmol)溶解于meoh/dcm(20:1,v/v,57.0ml)的混合溶剂中,加入碳酸钾(0.57g,4.1mmol)并在室温下搅拌3小时。tlc监测反应结束后,反应液直接减压浓缩,加入乙酸乙酯溶解后使用饱和食盐水洗涤,有机相使用na2so4干燥,过滤浓缩后粗产品使用硅胶层析柱分离纯化石油醚/乙酸乙酯,15:1)后得到化合物12*(2.0g,3.23mmol,95%)。[α]
22d
=62.7(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.65(m,4h,ar),7.48
–
7.27(m,11h,ar),5.56(s,1h,h-1),4.94(d,j=11.4hz,1h,arch2),4.68(d,j=11.4hz,1h,arch2),4.31(dd,j=7.2,5.7hz,1h,h-3),4.18(dd,j=5.6,0.9hz,1h,h-2),4.12
–
4.04(m,2h,h-5,h-6),3.82(dd,j=10.2,7.3hz,1h,h-4),3.74(dd,j=10.0,7.4hz,1h,h-7),3.63(dd,j=10.0,6.5hz,1h,h-7’),2.58
–
2.29(m,sch2ch3),2.10(br,1h,oh),1.53(s,3h,ch3),1.36(s,1h,ch3),1.16(t,j=7.4hz,3h,sch2ch3),1.07(s,9h,tbdps).
13
c nmr(101mhz,chcl3)δ138.6,135.7,135.6,135.6,133.5,133.3,129.9,129.9,128.4,128.0,127.8,127.7,109.5,79.8(c-1),78.8,76.6,75.7,73.4,69.4,67.9,65.0,28.2,27.0,26.6,24.2,19.4,14.3;hrms(esi)m/z calcd for c
35h46
o6ssina[m+na]
+
645.2677,found 645.2672。
[0097]
化合物13*:将化合物12*(2.5g,4.0mmol)溶解在无水dmf(20.0ml)中,溶液降温到0℃后加入氢化钠(180mg,7.3mmol,60%分散在油中),反应液在0℃搅拌半个小时,加入溴苄(0.86ml,7.3mmol)。反应液在室温下继续搅拌3小时,待反应物完全消失后,溶液冷却至0℃,逐滴加入水淬灭反应。混合液用dcm萃取3次,有机相用无水na2so4干燥,经减压蒸馏浓缩。粗产品使用硅胶柱层析分离纯化(石油醚/乙酸乙酯,20:1),得到化合物13*(2.4g,3.4mmol,85%)。[α]
22d
=102.9(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.73
–
7.59(m,4h,ar),7.47
–
7.08(m,16h),5.63
–
5.46(m,1h,h-1),4.83(d,j=11.6hz,1h,arch2),4.60(d,j=11.8hz,1h,arch2),4.36
–
4.24(m,1h,h-3),4.18(d,j=11.8hz,1h,arch2),4.16
–
4.14(m,2h,h-2,h-5),4.11(d,j=11.6hz,1h,arch2),3.90
–
3.83(m,2h,h-4,h-6),3.81(dd,j=10.1,3.6hz,1h,h-7),3.75(dd,j=10.1,7.0hz,1h,h-7’),2.66
–
2.27(m,2h,sch2ch3),1.57(s,1h,ch3),1.36(s,3h,ch3),1.15(t,j=7.4hz,3h,sch2ch3),1.06(s,9h,otbdps).
13
c nmr(101mhz,cdcl3)δ138.8,138.7,135.9,135.7,133.6,133.5,129.9,129.8,128.3,128.3,128.1,127.9,127.7,127.6,127.5,109.5,79.9(c-1),79.1,77.5,77.2,76.8,76.6,75.7,
73.6,72.2,68.4,63.3,28.1,27.0,26.6,24.1,19.3,14.3;hrms(esi)m/z calcd for c
42h52
o6ssina[m+na]
+
735.3146,found 735.3126。
[0098]
化合物14*:将化合物13*(1.52g,2.13mmol)溶解于80%的醋酸水溶液(28.4ml)中,反应液加热到60℃度并搅拌12小时。tlc板显示原料完全消失后,反应液加入饱和nahco3终止反应,而后反应液使用dcm萃取三次,有机相经na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1),得到化合物14*(1.39g,2.0mmol,94%)。[α]
22d
=100.8(c 1.0,chcl3);1h nmr(700mhz,cdcl3)δ7.72
–
7.64(m,4h,ar),7.50
–
7.15(m,16h,ar),5.34(s,1h,h-1),4.73(d,j=11.7hz,1h,arch2),4.64(dd,j=11.8,1.9hz,1h,arch2),4.34(d,j=11.6hz,1h,arch2),4.29(d,j=9.6hz,1h,h-6),4.26(dd,j=11.9,1.9hz,0h),3.98
–
3.95(m,1h,h-2),3.95
–
3.88(m,3h,h-4,h-5,h-7),3.88
–
3.84(m,1h,h-7’),3.77(td,j=9.3,1.9hz,1h,h-3),2.64
–
2.29(m,2h,sch2ch3),1.82(s,2h,oh),1.19(t,j=6.8hz,3h,sch2ch3),1.10(s,9h,tbdps).
13
c nmr(176mhz,cdcl3)δ138.7,138.1,135.7,135.5,133.4,133.3,129.8,129.8,128.4,128.4,128.1,127.8,127.8,127.7,127.6,127.4,83.8(c-1),75.9,73.8,72.9,72.8,72.6,70.1,62.7,26.9,24.7,19.2,14.4;hrms(esi)m/z calcd for c
39h48
o6ssina[m+na]
+
695.2833,found 695.2819。
[0099]
化合物15*:将化合物14*(1.39g,2.0mmol)溶于无水dcm(20.0ml)中,在室温下加入原苯甲酸三乙酯(635μl,3.0mmol)和催化量的樟脑磺酸(csa)(23.2mg,0.1mmol),反应液继续搅拌3小时后,加入80%醋酸水溶液(1.0ml),反应继续在室温下搅拌1小时。反应结束后,使用dcm萃取3次,有机相经饱和的nahco3洗涤,无水na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1),得到化合物15*(1.0g,1.3mmol,65%)。[α]
22d
=23.6(c 1.0,chcl3);1h nmr(600mhz,cdcl3)δ8.09
–
7.82(m,2h,ar),7.66(ddd,j=8.1,5.7,1.4hz,4h),7.55(tt,j=7.4,1.3hz,1h),7.45
–
7.18(m,19h),5.44(d,j=1.7hz,2h),4.73(d,j=11.6hz,1h),4.70(d,j=11.7hz,1h),4.36(d,j=11.7hz,1h),4.35
–
4.34(m,1h),4.25(d,j=11.7hz,1h),4.23
–
4.20(m,2h),4.03(t,j=9.5hz,1h),3.96
–
3.83(m,3h),2.62
–
2.46(m,3h),2.06(d,j=5.5hz,1h),1.18(t,j=7.4hz,3h),1.08(s,9h).
13
c nmr(151mhz,cdcl3)δ166.1,138.5,138.5,135.7,135.6,135.5,133.4,133.3,133.2,129.9,129.8,129.7,129.7,128.4,128.4,128.3,127.7,127.6,127.6,127.5,127.3,81.9(c-1),77.2,77.0,76.9,76.8,76.0,74.5,74.2,72.7,71.7,70.4,62.5,26.8,25.1,19.2,14.5;hrms(esi)m/z calcd for c
46h52
o7ssina[m+na]
+
799.3095,found 799.3093。
[0100]
化合物16*:将化合物15*(850mg,1.1mmol)溶解于dcm(20.0ml),分别加入乙酰丙酸(192mg,1.65mmol),二环己基碳亚胺(340mg,1.65mmol),n,n-二甲基吡啶(202mg,1.65mmol),反应在室温下搅拌3小时。反应结束后,减压浓缩反应液,粗产品经柱层析分离纯化(石油醚/乙酸乙酯,8:1)得到化合物16*(830mg,0.95mmol,86%)。[α]
22d
=11.3(c 1.0,chcl3);1h nmr(600mhz,cdcl3)δ8.09
–
7.93(m,2h,ar),7.69
–
7.62(m,4h,ar),7.57(tt,j=7.4,1.3hz,1h,ar),7.45
–
7.33(m,6h,ar),7.32
–
7.26(m,11h,ar),7.23
–
7.18(m,1h,ar),5.59(dd,j=3.2,1.7hz,1h,h-2),5.47
–
5.37(m,2h,h-1,h-3),4.66(d,j=11.7hz,1h,arch2),4.58(d,j=11.6hz,1h,arch2),4.45(d,j=9.8hz,1h,h-5),4.24(d,j=11.7hz,1h,arch2),4.20(d,j=11.7hz,1h,arch2),4.18(t,j=9.7hz,1h,h-4),3.96
–
3.86(m,2h,h-6,h-7,h-7’),2.71
–
2.32(m,6h,ch2ch2,sch2ch3),2.06(s,2h,ac),1.18(t,j=7.4hz,2h,
sch2ch3),1.06(s,9h,tbdps).
13
c nmr(151mhz,cdcl3)δ206.2,171.7,165.4,138.5,138.4,135.7,135.5,133.4,133.3,133.2,129.9,129.8,129.7,129.6,128.4,128.3,128.3,127.7,127.6,127.4,127.1,81.7(c-1),74.1,73.4,73.1,72.8,71.8,70.6,62.2,37.8,29.7,27.9,26.8,24.9,19.2,14.4;hrms(esi)m/z calcd for c
51h58
o9ssina[m+na]
+
897.3463,found 897.3469。
[0101]
化合物17*:将化合物16*(210mg,0.24mmol)溶于thf(2.4ml)中,在0℃加入70%的氟化氢/吡啶溶液(6.3μl,2.4mmol),反应液恢复到室温继续搅拌12小时,tlc板监测原料完全消失之后,向反应液加入乙酸乙酯稀释,使用饱和的氯化铵溶液洗涤,有机相使用无水na2so4干燥,经过滤浓缩后粗产品使用硅胶柱层析分离纯化(石油醚/乙酸乙酯,4:1)得到c7羟基裸露的化合物中间体化合物。将中间体化合物溶于吡啶(2.4ml),在0℃加入醋酸酐,反应在室温下搅拌12小时后,反应液用dcm稀释后,加入饱和的nahco3洗涤,经减压蒸馏后用硅胶柱层析分离纯化(石油醚/乙酸乙酯,4:1)得到化合物17*(66.8mg,0.098mmol,41%)。[α]
22d
=38.29(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.14
–
7.85(m,2h,ar),7.68
–
7.57(m,1h,ar),7.48
–
7.21(m,12h,ar),5.64(dd,j=3.1,1.7hz,1h,h-2),5.45(d,j=1.7hz,1h,h-1),5.41(dd,j=8.8,3.1hz,1h,h-2),4.90(d,j=11.6hz,1h,arch2),4.66(d,j=11.3hz,1h,arch2),4.61
–
4.51(m,2h,h-7,arch2),4.35(d,j=11.3hz,1h,arch2),4.33
–
4.22(m,3h,h-7’,h-4,h-5),4.19(ddd,j=7.2,5.8,1.4hz,1h,h-6),2.80
–
2.56(m,4h,ch2ch2),2.52
–
2.33(m,2h,sch2ch3),2.12(s,6h,ch3),1.31(t,j=7.4hz,3h,sch2ch3).
13
c nmr(101mhz,cdcl3)δ206.4,171.9,170.8,165.6,138.2,138.1,133.5,130.0,129.6,128.7,128.7,128.7,128.6,128.6,128.0,127.9,127.9,127.6,82.2(c-1),74.7,73.9,73.5,73.0,73.0,72.0,71.3,62.6,37.9,29.9,28.0,25.3,21.1,14.8;hrms(esi)m/z calcd for c
37h42o10
sna[m+na]
+
701.2391,found 701.2385。
[0102]
化合物3*:将化合物17*(312mg,0.46mmol)溶于thf/h2o(1:1,v/v,4.6ml)溶液中,在0℃加入溴代丁二酰亚胺(245mg,1.38mmol),反应液在室温下搅拌4小时。待反应原料消失后,反应液用dcm稀释,使用经饱和的nahco3洗涤。反应液经无水na2so4干燥,有机相经过滤后浓缩,粗产品使用硅胶柱层析纯化得到半缩醛中间产物(285mg)。将缩醛中间产物溶于干燥的dcm(4.6ml)中,在0℃下加入n-苯基三氟乙酰氯(345μl,2.3mmol)和dbu(206μl,1.38mmol),反应在室温下搅拌5小时,待tlc监测反应原料完全消失后,反应液直接浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,3:1)得到化合物3*(338mg,0.42mmol,91%)。
[0103]
实施例2
[0104]
糖砌块4*的合成如图3所示:
[0105]
化合物12*使用四丁基氟化铵脱去c7位tbdps基团,得到二羟基化合物18*,产率为90%。化合物18*在溴苄和氢化钠的条件下进行苄基化反应,得到化合物19*,产率为93%。使用80%的醋酸处理脱去化合物19*的o2,3-丙叉基,得到化合物20*,产率为95%。c3位羟基在二丁基氧化锡的作用下选择性用苄基保护得到化合物21*,产率为74%。在dmap和dcc的碱性条件下,在化合物21*的c2位引入乙酰丙酰基,得到化合物22*,产率为92%。化合物22*的端基位乙硫基在nbs条件下脱去,而后在dbu和苯基三氟乙酰亚胺氯的条件下引入苯基三氟乙酰亚氨基,得到化合物4*,两步产率为81%。
[0106]
化合物18*:将化合物12*(261mg,0.42mmol)溶于thf(1.4ml)中,在0℃下加入tbaf
(1m的thf溶液,0.42ml,0.42mmol),反应液在室温下继续搅拌12小时。待反应结束后,向反应液加入乙酸乙酯稀释,使用饱和的氯化铵溶液洗涤,有机相使用无水na2so4干燥,经过滤浓缩后粗产品使用硅胶柱层析分离纯化(石油醚/乙酸乙酯,4:1)得到化合物18*(139mg,0.38mmol,90%)。[α]
22d
=83.2(c 1.0,chcl3).1h nmr(400mhz,cdcl3)δ7.61
–
7.10(m,5h,ar),5.57(s,1h,h-1),4.93(d,j=11.2hz,1h,arch2),4.66(d,j=11.2hz,1h,arch2),4.30(dd,j=6.4,6.4hz,1h,h-3),4.20(d,j=5.6hz,1h,h-2),3.95
–
4.07(m,2h,h-5,h-6),3.79(dd,j=10.3,7.3hz,1h,h-7),3.73(dd,j=10.3,5.7hz,1h,h-7’),3.70
–
3.62(m,1h,h-4),2.71
–
2.44(m,2h,sch2ch3),2.24(br,1h,oh),2.09(br,1h,oh),1.54(s,3h,ch3),1.37(s,3h,ch3),1.30(t,j=7.4hz,3h,sch2ch3).
13
c nmr(101mhz,cdcl3)δ138.0,128.4,128.1,127.9,109.5,80.2(c-1),78.5,77.3,77.0,76.7,76.4,75.7,73.3,69.8,69.5,64.8,28.0,26.5,24.5,14.4;hrms(esi)m/z calcd for c
19h28
o6sna[m+na]
+
407.1499,found 407.1495。
[0107]
化合物19*:将化合物18*(950mg,2.47mmol)溶解在无水dmf(12.0ml)中,溶液降温到0℃后加入氢化钠(395mg,9.88mmol,60%分散在油中),反应液在0℃搅拌半个小时,加入溴苄(1.17ml,9.88mmol)。反应液在室温下继续搅拌3小时,待反应物完全消失后,溶液冷却至0℃,逐滴加水淬灭反应。混合液用dcm萃取3次,有机相用无水na2so4干燥,经减压蒸馏浓缩。粗产品使用硅胶柱层析分离纯化(石油醚/乙酸乙酯,20:1),得到化合物19*(1.1g,1.85mmol,75%)。[α]
22d
=65.3(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.45
–
7.13(m,15h,ar),5.63(s,1h,h-1),4.90(d,j=11.4hz,1h,arch2),4.82(d,j=11.8hz,1h,arch2),4.56(s,2h,arch2),4.51(d,j=11.7hz,1h,arch2),4.35(t,j=6.3hz,1h,h-3),4.31(d,j=11.6hz,1h,arch2),4.23(dd,j=5.8,1.4hz,1h,h-2),4.19
–
4.08(m,2h,h-5,h-6),3.90(dd,j=10.0,7.1hz,1h,h-4),3.78(dd,j=9.5,6.5hz,1h,h-7),3.70(dd,j=9.5,5.8hz,1h,h-7’),2.72
–
2.40(m,2h,sch2ch3),1.59(s,3h,ch3),1.41(s,3h,ch3),1.26(t,j=7.4hz,3h,sch2ch3).
13
c nmr(101mhz,cdcl3)δ138.8,138.5,138.4,138.2,128.5,128.5,128.4,128.4,128.0,127.9,127.8,127.7,127.7,127.7,127.7,109.6,80.2(c-1),79.1,77.5,77.2,76.8,75.7,75.6,73.8,73.6,72.5,72.3,70.9,69.5,29.8,28.1,26.6,24.3,14.5,14.3;hrms(esi)m/z calcd for c
33h40
o6sna[m+na]
+
587.2438,found 587.2440。
[0108]
化合物20*:将化合物19*(609mg,1.08mmol)溶解于80%的醋酸水溶液(15.0ml)中,反应液加热到65℃度搅拌8小时。tlc板显示原料完全消失后,反应液经减压浓缩后用dcm稀释,使用饱和nahco3洗涤,有机相经na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1),得到化合物20*(542mg,1.03mmol,95%)。[α]
22d
=89.9(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.71
–
6.90(m,15h,ar),5.33(d,j=1.5hz,1h,h-1),4.85(d,j=11.6hz,1h,arch2),4.81
–
4.73(m,1h,arch2),4.55(d,j=11.6hz,3h,arch2),4.45(d,j=11.4hz,1h,arch2),4.15(s,1h,h-5,h-6),3.93(dd,j=3.2,1.5hz,1h,h-2),3.91
–
3.84(m,2h,h-3,h-4),3.84
–
3.78(m,1h,h-7),3.70(dd,j=9.8,5.6hz,1h,h-7’),2.64
–
2.45(m,4h,sch2ch3,2
×
oh),1.24(t,j=7.4hz,3h,sch2ch3).
13
c nmr(101mhz,cdcl3)δ138.5,138.1,138.0,128.5,128.4,128.4,128.2,127.9,127.7,127.7,127.7,127.6,84.1(c-1),77.3,77.2,77.0,76.7,75.8,75.3,74.1,73.5,73.1,72.8,72.6,71.3,70.7,24.8,14.6;hrms(esi)m/z calcd for c
30h36
o6sna[m+na]
+
547.2125,found 547.2135。
[0109]
化合物21*:将化合物20*(575mg,1.10mmol)溶解于甲苯(5.5ml)中,在反应瓶中加入二丁基氧化锡(409mg,1.65mmol),反应液加热120℃回流3小时后,蒸馏除去一半体积的反应溶剂。冷却至室温后,将氟化铯(250mg,1.65mmol),溴苄(195μl,1.65mmol)分别加入到反应瓶中,反应液在65℃下搅拌12小时,待反应原料完全消失后,反应液使用硅藻土过滤,滤液使用减压浓缩。粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1)得到化合物21*(490mg,0.81mmol,74%)。[α]
22d
=55.2(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.37
–
7.18(m,20h,ar),5.37(d,j=1.5hz,1h,h-1),4.88
–
4.74(m,2h,arch2),4.66(d,j=11.4hz,1h,arch2),4.61(d,j=11.4hz,1h,arch2),4.55
–
4.48(m,3h,arch2),4.33(d,j=11.1hz,1h,arch2),4.18
–
4.10(m,2h,h-5,h-6),4.08(d,j=2.2hz,1h,h-2),4.03(dd,j=9.3,9.3hz,1h,h-4),3.83(dd,j=8.9,3.2hz,1h,h-3),3.81
–
3.76(dd,j=9.77,6.24hz,1h,h-7),3.68(dd,j=9.8,5.6hz,1h,h-7’),2.68(br,1h,oh),2.62
–
2.37(m,2h,sch2ch3),1.21(t,j=7.4hz,3h,sch2ch3).
13
c nmr(101mhz,cdcl3)δ138.8,138.6,138.3,137.8,128.7,128.5,128.5,128.5,128.2,128.2,128.1,127.8,127.7,127.7,127.6,83.8(c-1),81.1,77.5,77.2,76.8,75.3,74.8,74.1,73.6,73.1,72.0,71.8,70.8,69.9,24.9,14.8;hrms(esi)m/z calcd for c
37h42
o6sna[m+na]
+
637.2594,found 637.2598。
[0110]
化合物22*:将化合物21*(377mg,0.61mmol)溶解于dcm(12.3ml)中,加入乙酰丙酸(107mg,0.92mmol),二环己基碳亚胺(190mg,0.92mmol),n,n-二甲基吡啶(113mg,0.92mmol),反应液在室温下搅拌3小时。待反应结束后,反应液直接减压浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1)得到化合物22*(401mg,0.56mmol,92%)。[α]
22d
=62.5(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.63
–
6.81(m,20h,ar),5.44(dd,j=3.2,1.7hz,1h,h-2),5.30(d,j=1.5hz,1h,h-1),4.93
–
4.80(m,2h,arch2),4.65(d,j=11.0hz,1h,arch2),4.53
–
4.41(m,4h,arch2),4.32(d,j=11.1hz,1h,arch2),4.19
–
4.11(m,2h,h-5,h-6),4.03(dd,j=9.1,9.1hz,1h,h-4),3.90(dd,j=9.1,3.2hz,1h,h-3),3.80(dd,j=9.8,6.5hz,1h,h-7),3.66(dd,j=9.7,5.6hz,1h,h-7’),2.76
–
2.63(m,4h,ch2ch2),2.63
–
2.43(m,2h,sch2ch3),2.11(s,3h,ch3),1.20(t,j=7.4hz,3h,sch2ch3).
13
c nmr(101mhz,cdcl3)δ166.3,138.4,138.3,135.9,135.8,133.5,130.0,129.7,128.7,128.6,128.6,128.1,128.1,128.0,127.9,127.8,127.8,82.3(c-1),75.7,75.4,75.3,74.8,74.6,73.2,71.9,71.0,69.6,69.6,69.6,69.5,66.4,66.4,25.5,14.8;hrms(esi)m/z calcd for c
42h48
o8sna[m+na]
+
735.2962,found 735.2951。
[0111]
化合物4*:将化合物22*(71.2mg,0.10mmol)溶解于thf/h2o(1:1,v/v,1.0ml),加入溴代丁二酰亚胺(53.3mg,0.3mmol),反应液在室温下搅拌4小时。待反应原料消失后,反应液用dcm稀释,而后经饱和的nahco3洗涤和无水na2so4干燥。有机相经过滤后浓缩,粗产品经柱层析纯化得到缩醛中间产物(48.7mg)。将缩醛中间产物溶于干燥的丙酮(0.8ml)中,在0℃下加入n-苯基三氟乙酰氯(79μl,0.53mmol)和碳酸钾(36.0mg,0.26mmol)。反应在室温下搅拌5小时,反应结束后反应液直接浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,8:1)得到化合物4*(68.8mg,0.081mmol,81%)。1h nmr(700mhz,cdcl3)δ7.37
–
7.11(m,22h,ar),7.03(t,j=7.5hz,1h,ar),6.67(d,j=7.8hz,2h,ar),6.15(br,1h,h-1),5.40(s,1h,h-2),4.81(d,j=10.8hz,1h,arch2),4.77(d,j=11.6hz,1h,arch2),4.64(d,j=10.9hz,1h,arch2),4.52
–
4.42(m,4h,arch2),4.30(d,j=10.8hz,1h,arch2),4.07(dd,j=6.2,
6.2hz,1h,h-6),4.02(dd,j=9.6,9.6hz,1h,h-4),3.97(d,j=9.6hz,1h,h-3),3.84(dd,j=9.7hz,1h.h-5),3.76(dd,j=9.9,6.8hz,1h,h-7),3.61(dd,j=10.1,5.4hz,1h,h-7’),2.72
–
2.45(m,4h,ch2ch2),2.03(s,2h,ch3).
13
c nmr(176mhz,cdcl3)δ206.2,171.9,143.3,138.6,138.4,138.1,137.5,129.6,129.3,128.9,128.9,128.7,128.6,128.5,128.5,128.5,128.4,128.4,128.2,128.1,128.1,127.9,127.9,127.8,127.8,127.8,127.7,127.6,127.1,126.5,124.6,120.6,119.4,118.5,94.2,80.8,78.1,75.1,74.9,74.0,73.7,73.4,73.1,72.2,70.6,67.5,38.0,29.9,28.2;hrms(esi)m/z calcd for c
48h48
f3no9na[m+na]
+
862.3173,found 862.3162。
[0112]
实施例3
[0113]
糖砌块5*和6*的合成如图4所示:
[0114]
以已报道的化合物23*位起始原料,在ddq的作用下脱去o7位2-萘亚甲基,得到化合物24*,产率为92%。c7位羟基在单氯乙酸酐和吡啶作用下用单氯乙酰基保护,得到化合物25*,产率为88%。硫糖苷25*经脱硫反应和酰化反应得到苯基三氟乙酰亚胺酯基供体5*,两步产率为83%。同样将化合物23*经脱硫反应和酰化反应后得到庚糖供体6*,两步产率为87%。
[0115]
化合物25*:将化合物23*(472mg,0.62mmol)溶解于dcm/h2o(9:1,v/v,12.1ml)的混合溶剂中,反应液在室温下加入ddq(211mg,0.93mmol),反应在室温继续反应5个小时。待反应原料完全消失后,反应液用dcm稀释后依次用10%的na2s2o3溶液,饱和的nahco3溶液洗涤,有机相使用na2so4干燥后过滤浓缩。粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1)得到化合物24*(355mg,92%)。将化合物24*(340mg,0.55mmol)溶于dcm(5.5ml),在0℃下加入氯乙酸酐(188mg,1.1mmol)和吡啶(1.1ml),反应在室温下搅拌12小时。tlc监测反应结束后加入dcm稀释,使用饱和nahco3洗涤,过滤浓缩后,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,7:1)得到化合物25*(338mg,0.055mmol 88%)。[α]
22d
=73.3(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.66
–
6.82(m,18h),5.41(t,j=2.3hz,1h),5.24(d,j=1.6hz,1h),4.90(d,j=10.9hz,1h),4.76(d,j=12.0hz,1h),4.72
–
4.46(m,5h),4.36
–
4.25(m,3h),4.00
–
3.87(m,5h),3.83(dd,j=9.5hz,1h),2.82
–
2.48(m,7h),2.16(s,3h),1.31
–
1.23(m,4h).
13
c nmr(101mhz,cdcl3)δ206.3,172.0,167.2,138.2,138.2,137.7,128.6,128.5,128.5,128.4,128.2,128.1,128.0,127.8,82.4(c-1),79.0,76.5,75.1,74.2,72.3,72.0,71.8,70.5,66.4,40.9,38.1,29.9,28.3,25.6,15.0;hrms(esi)m/z calcd for c
89h90o16
clsna[m+na]
+
721.2209,found 721.2213。
[0116]
化合物5*:将化合物25*(95.0mg,0.14mmol)溶解于thf/h2o(v/v,1:1,2.8ml)的混合溶剂中,加入溴代丁二酰亚胺(74.8mg,0.42mmol),反应液在室温下搅拌3小时。待tlc监测反应原料消失后,反应液用dcm稀释,有机相分别使用10%的na2s2o3和nahco3洗涤后,经无水na2so4干燥,有机相经过滤后浓缩,粗产品经柱层析纯化得到缩醛中间产物(85.0mg)。将缩醛中间产物溶于干燥的dcm(1.4ml)中,在0℃下加入n-苯基三氟乙酰氯(113μl,0.70mmol)和dbu(62.8μl,0.42mmol),反应在室温下搅拌3小时,tlc监测反应原料完全消失后,反应液用dcm稀释,饱和nahco3溶液洗涤,有机相用无水na2so4干燥,过滤后直接浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,8:1)得到化合物5*(93.0mg,0.11mmol,81%)。1h nmr(400mhz,cdcl3)δ7.41
–
7.18(m,16h,ar),7.10(t,j=7.4hz,1h,ar),6.79(d,j=
7.8hz,2h,ar),6.19(s,1h,h-1),5.46(t,j=2.6hz,1h,h-2),4.92(d,j=10.7hz,1h,arch2)4.78
–
4.64(m,3h,arch2),4.61
–
4.55(m,2h,arch2),4.35(h,j=7.9hz,2h,h-7,h-7’),4.09
–
3.84(m,6h),2.92
–
2.49(m,4h,ch2ch2),2.15(s,3h,ac).
13
c nmr(101mhz,cdcl3)δ206.0,171.8,167.2,143.2,138.1,137.8,137.5,129.3,128.9,128.6,128.5,128.5,128.4,128.2,128.1,128.0,127.9,124.6,119.5,94.0(c-1),77.9,76.5,75.3,74.4,73.3,72.7,72.3,40.9,38.1,29.9,29.4,28.9,28.1。
[0117]
化合物6*:将化合物23*(101mg,0.13mmol)溶解于thf/h2o(1:1,v/v,2.6ml)的混合溶剂中,加入溴代丁二酰亚胺(69.4mg,0.39mmol),反应液在室温下搅拌3小时。待tlc监测反应原料消失后,反应液用dcm稀释,有机相分别使用10%的na2s2o3和nahco3洗涤后,经无水na2so4干燥,有机相经过滤后浓缩,粗产品经柱层析纯化得到缩醛中间产物(83.5mg)。将缩醛中间产物溶于干燥的dcm(2.6ml)中,在0℃下加入n-苯基三氟乙酰氯(105μl,0.65mmol)和dbu(58.3μl,0.39mmol),反应在室温下搅拌4小时,tlc监测反应原料完全消失后,反应液用dcm稀释,饱和nahco3溶液洗涤,有机相用无水na2so4干燥,过滤后直接浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,5:1)得到化合物6*(100mg,0.024mmol,87%)。[α]
22d
=12.2(c 1.0,chcl3).1h nmr(400mhz,cdcl3)δ7.89
–
7.71(m,4h,ar),7.53
–
7.39(m,5h,ar),7.39
–
7.30(m,9h,ar),7.28
–
7.22(m,4h,ar),7.21
–
7.16(m,2h,ar),7.13
–
7.06(m,1h,ar),6.78(d,j=7.7hz,2h,ar),6.23(s,1h,h-1),5.47(t,j=2.5hz,1h,h-2),4.88(d,j=10.6hz,1h,arch2),4.81(d,j=11.8hz,1h,arch2),4.75(d,j=11.1hz,1h,arch2),4.70(d,j=11.2hz,3h,arch2),4.63(d,j=10.6hz,1h,arch2),4.59(d,j=11.0hz,1h,arch2),4.17
–
3.99(m,4h),3.90
–
3.71(m,2h),2.79
–
2.50(m,4h,ch2ch2),2.12(s,3h,ch3).
13
c nmr(101mhz,cdcl3)δ205.9,171.7,143.2,138.6,138.0,137.5,135.8,133.3,133.0,129.4,129.2,128.7,128.5,128.4,128.3,128.1,128.0,128.0,127.9,127.7,127.7,127.6,127.5,126.4,126.2,126.1,125.8,125.6,124.4,120.4,119.4,118.4,92.9(c-1),78.2,77.8,75.0,74.6,73.7,73.4,72.7,72.1,70.6,67.5,37.8,29.7,27.9。
[0118]
实施例4
[0119]
糖砌块7*和9*的合成如图5所示:
[0120]
化合物26*端基苯甲硫在nbs条件下脱去,半缩醛中间体在tbscl和咪唑的条件下,在c1位羟基引入tbs保护,得到化合物27*,两步产率为82%。c6位苯甲酰基在甲醇钠的条件下脱去,裸露c6位羟基,得到糖基受体9*,产率为87%。将化合物26*经脱硫反应和酰化反应后得到庚糖供体7*,两步产率为88%。
[0121]
化合物7*:将化合物26*(100mg,0.14mmol)溶解于thf/h2o(1:1,v/v,7.0ml),加入溴代丁二酰亚胺(7.5mg,0.042mmol),反应液在室温下搅拌4小时。待反应原料消失后,反应液用dcm稀释,而后经饱和的nahco3洗涤和无水na2so4干燥。有机相经过滤后浓缩,粗产品经柱层析纯化得到缩醛中间产物(78.6mg)。将缩醛中间产物溶于干燥的dcm(3.75ml)中,在0℃下加入n-苯基三氟乙酰氯(97μl,0.365mmol)和,8-二氮杂二环十一碳-7-烯(dbu)(58.0μl,0.39mmol)。反应在室温下搅拌5小时,反应结束后反应液直接浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,20:1)得到化合物7*(96.0mg,0.12mmol,88%)。[α]
22d
=71.3(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.14
–
8.00(m,5h),7.94
–
7.73(m,12h),7.68
–
7.07(m,37h),6.87
–
6.67(m,5h),6.55(br,1h,h-1),5.80(br,1h,h-1),5.27
–
4.80(m,13h,arch),
4.75
–
4.55(m,8h,arch,h-6,h-6),4.26-4.12(m,2h),3.94
–
3.63(m,8h).
13
c nmr(101mhz,cdcl3)δ166.2,166.1,143.5,143.4,137.7,137.6,137.5,137.4,135.8,135.6,133.4,133.3,133.2,133.2,133.1,129.8,129.7,129.1,128.8,128.7,128.6,128.6,128.6,128.5,128.4,128.3,128.3,128.3,128.2,128.2,128.1,128.1,128.0,128.0,128.0,127.8,127.7,127.7,126.9,126.7,126.2,126.2,126.1,126.1,126.0,126.0,125.9,125.3,124.4,124.2,119.4,119.3,97.0(c-1),93.0(c-1),84.5,81.6,80.8,79.5,77.3,76.1,75.9,75.51,75.54,75.3,75.2,73.9,73.4,71.7,63.2,63.0,21.5;hrms(esi)m/z calcd for c
46h40
f3no7na[m+na]
+
798.2649。
[0122]
化合物27*:将化合物26*(1.45g,2.04mmol)溶解于thf/h2o(1:1,v/v,21.0ml)中,加入溴代丁二酰亚胺(1.09g,6.12mmol),反应液在室温下搅拌4小时。待反应原料消失完毕后,反应液使用饱和的nahco3和10%的na2s2o3(1:1,v/v)洗涤,经无水na2so4干燥后浓缩。粗产品经柱层析纯化得到半缩醛中间产物(1.1g)。把中间产物溶于干燥的dcm(12.0ml)中,将反应液冷却至0℃,加入咪唑(495mg,7.3mmol)和tbscl(630mg,3.64mmol),反应液在室温下搅拌12小时,tlc监测反应结束后,反应液用饱和氯化铵溶液淬灭,混合溶液用dcm萃取3遍,有机相经水洗,有机相使用无水na2so4干燥,经减压浓缩后粗产品使用硅胶柱层析纯化(石油醚/乙酸乙酯,50:1)得到化合物27*(1.2g,1.67mmol,两步产率82%)。[α]
22d
=30.3(c 1.0,chcl3).1h nmr(400mhz,cdcl3)δ8.09
–
7.95(m,2h,ar),7.87
–
7.67(m,4h,ar),7.60
–
7.53(m,1h,ar),7.52
–
7.15(m,15h,ar),5.11(d,j=11.0hz,1h,arch2),5.02(d,j=11.0hz,1h,arch2),4.96(d,j=11.1hz,1h,arch2),4.92(d,j=10.9hz,1h,arch2),4.78(d,j=11.0hz,1h,arch2),4.74(d,j=7.5hz,1h,h-1),4.64(d,j=10.9hz,1h,arch2),4.63(dd,j=11.7,2.0hz,1h,h-6),4.42(dd,j=11.7,6.0hz,1h,h-6’),3.76(t,j=9.0hz,1h,h-3),3.69(ddd,j=9.9,6.0,2.1hz,1h,h-5),3.61(dd,j=9.8,8.7hz,1h,h-4),3.48(dd,j=9.3,7.5hz,1h,h-2),0.91(s,9h,otbs),0.14(s,3h,ch3),0.12(s,3h,ch3).
13
c nmr(101mhz,cdcl3)δ166.4,138.5,137.8,136.0,133.4,133.2,133.1,130.0,129.9,128.6,128.5,128.4,128.3,128.2,128.2,128.1,127.8,127.8,126.7,126.2,126.1,126.0,98.4(c-1),84.8,84.2,78.1,76.0,75.2,75.1,73.3,64.0,25.9,18.1,-4.0,-4.9;hrms(esi)m/z calcd for c
44h50
o7sina[m+na]
+
741.3218,found 741.3215。
[0123]
化合物9*:化合物27*(20.0mg,0.028mmol)溶于甲醇中,加入甲醇钠(10mg),在室温下搅拌12小时,反应结束后粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,15:1)得到化合物9*(15.1mg,0.024mmol,87%)。[α]
22d
=12.8(c 1.0,chcl3);1h nmr(600mhz,cdcl3)δ7.84
–
7.78(m,1h,ar),7.78
–
7.75(m,1h,ar),7.75
–
7.71(m,1h,ar),7.70
–
7.68(m,1h,ar),7.50
–
7.43(m,2h,ar),7.42
–
7.38(m,1h,ar),7.36
–
7.32(m,2h,ar),7.32
–
7.21(m,7h,ar),5.07(d,j=11.2hz,1h,arch2),4.99(d,j=11.0hz,1h,arch2),4.95(d,j=11.1hz,1h,arch2),4.89(d,j=11.0hz,1h arch2),4.77(d,j=11.0hz,1h arch2),4.73(d,j=7.5hz,1h,h-1),4.67(d,j=11.0hz,1h arch2),3.86(dd,j=11.8,2.9hz,1h,h-6),3.72(d,j=9.3hz,1h,h-3),3.70(dd,j=7.6,4.3hz,1h,h-6’),3.59(t,j=9.4hz,1h,h-4),3.41(dd,j=9.3,7.4hz,1h,h-2),3.43
–
3.37(m,1h,h-5),0.96(s,9h,otbs),0.17(s,3h,ch3),0.17(s,3h ch3).
13
c nmr(151mhz,cdcl3)δ=138.5,138.2,136.2,133.5,133.1,128.6,128.5,128.2,128.1,128.1,128.1,128.0,127.8,127.8,126.6,126.1,126.1,126.1,125.9,98.3
(c-1),84.6,84.2,77.9,75.8,75.3,75.1,75.1,62.4,25.9,18.2,-3.9,-3.9,-4.7;hrms(esi)m/z calcd for c
37h46
o6sina[m+na]
+
637.2956,found 637.2951。
[0124]
实施例5
[0125]
糖砌块8*的合成如图6所示:
[0126]
化合物28*(67.0mg,0.11mmol)溶解于thf/h2o(1:1,v/v,2.0ml)的混合溶剂中,加入溴代丁二酰亚胺(58.7mg,0.33mmol),反应液在室温下搅拌5小时。待反应原料消失后,反应液用dcm稀释,有机相分别使用10%的na2s2o3和nahco3溶液洗涤,经无水na2so4干燥,有机相经过滤后浓缩,粗产品经柱层析纯化得到缩醛中间产物(55.7mg)。将缩醛中间产物溶于干燥的dcm(2.0ml)中,在0℃下加入n-苯基三氟乙酰氯(82.1μl,0.55mmol)和dbu(49.0μl,0.33mmol),反应在室温下搅拌3小时,tlc监测反应原料完全消失后,反应液用dcm稀释,饱和nahco3溶液洗涤,有机相用无水na2so4干燥,过滤后直接浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,6:1)得到化合物8*(70.2mg,0.096mmol,87%)。1h nmr(400mhz,cdcl3)δ7.96
–
7.84(m,2h,ar),7.63
–
6.92(m,16h,,ar),6.62
–
6.53(m,2h,ar),5.80(s,1h,h-1),5.62(d,j=3.2hz,1h,h-4),5.57
–
5.48(m,1h,h-2),4.58(d,j=12.7hz,1h,arch2),4.48(s,2h,arch2),4.34(d,j=12.7hz,1h,arch2),3.66
–
3.49(m,4h),2.86
–
2.54(m,4h,ch2ch2),2.12(s,1h,ch3).
13
c nmr(101mhz,cdcl3)δ206.3,171.9,165.0,143.1,137.6,137.0,133.3,129.9,129.5,129.4,128.7,128.4,128.4,128.3,128.2,128.0,127.9,127.8,124.4,119.2,95.1(c-1),76.0,73.8,73.6,70.9,70.2,67.6,66.0,38.1,29.8,28.1。
[0127]
实施例6
[0128]
五糖的合成如图7所示:
[0129]
l,d-庚糖供体3*与糖基受体2*在tmsotf的催化作用下进行糖基化反应,成功制备结构单一的α-构型二糖29*,产率为86%。二糖29*上的乙酰丙酰基在醋酸肼的条件下选择性脱除,裸露c3位羟基,得到二糖受体30*,产率为91%。糖基供体4*与糖基受体30*在tmsotf的催化作用下进一步进行糖基化反应,得到结构单一α-构型三糖化合物31*,产率为68%,三糖的中两个l,d-庚糖糖苷键的c1和h1的耦合常数分别为175.5hz和172.0hz。三糖31*中的乙酰丙酰基再次利用醋酸肼选择性的脱去,得到糖基受体32*,产率为83%。d,d-庚糖供体5*与三糖受体32*在tmsotf的催化下进行糖基化反应,得到结构单一的四糖化合物33*(新糖苷键:2j
h1/c1
=174.0hz,δ
h1
=4.66ppm),产率为66%。四糖33*中的乙酰丙酰基保护基在醋酸肼的作用下脱去,得到四糖受体34*,产率为86%。化合物35*乙酰丙酰基再次在醋酸肼条件下选择性脱去,得到化合物36*,产率为89%。
[0130]
化合物29*:将糖基供体3*(1.7g,2.11mmol)和糖基受体2*(1.12g,1.62mmol)与甲苯共沸三次后,溶于无水dcm(10.5ml)中,加入分子筛ms搅拌30分钟。将反应液温度降低到0℃后加入tmsotf(57.9μl,0.32mmol),反应液在0℃下搅拌4小时。tlc检测反应糖基供体完全消失后,使用吡啶终止反应,过滤完分子筛后滤液使用nahco3洗涤,有机相经无水na2so4干燥,过滤浓缩后的粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,4:1)得到化合物29*(1.8g,1.30mmol,86%)。[α]
22d
=3.2(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.09
–
7.91(m,2h,ar),7.60
–
7.51(m,1h,ar),7.44
–
7.09(m,27h),5.61(dd,j=3.3,1.8hz,1h,h-2b),5.56(dd,j=9.7,3.3hz,1h,h-3b),5.30(d,j=2.2hz,1h,h-1b),5.18(d,j=12.6hz,2h,
arch2),4.84(d,j=11.7hz,1h,arch2),4.65(d,j=11.2hz,2h,arch2),4.54
–
4.35(m,7h),4.31(ddd,j=9.2,6.2,4.9hz,1h,h-6b),4.27
–
4.19(m,2h,h-4b,h-8a),4.14(d,j=2.6hz,1h,h-5a),3.97(dd,j=12.1,2.9hz,1h,h-8a’),3.89(s,1h,h-6a),3.79(s,4h,och3,h-4a),3.45
–
3.13(m,5h,h-3a,och2,nch2),2.76
–
2.37(m,4h,ch2ch2),2.37
–
2.30(m,1h,h-2a(e)),2.08(s,3h,ch3),2.06(t,j=12.1hz,1h,h-2a(a)),1.98(s,3h,ac),1.57
–
1.46(m,4h,ch2ch2),1.33(s,3h,ch3),1.29
–
1.18(m,5h,ch3,ch2).
13
c nmr(101mhz,cdcl3)δ206.4,206.3,171.7,170.6,168.6,165.5,138.9,138.5,138.1,137.9,137.0,133.3,130.0,129.9,128.7,128.6,128.5,128.4,128.4,128.3,128.1,128.0,127.7,127.7,127.7,127.6,127.4,109.8,99.0,97.7(c-1b),75.0,74.7,74.5,73.2,72.9,72.7,72.4,72.2,72.1,70.6,70.3,68.1,67.3,66.6,63.7,52.6,52.6,50.7,50.4,47.2,46.3,38.0,32.0,29.8,29.8,29.4,28.2,27.0,24.8,23.6;hrms(esi)m/z calcd for c
74h85o20
nna[m+na]
+
1330.5557,found 1330.5549。
[0131]
化合物30*:将化合物29*(102mg,0.078mmol)溶于dcm/meoh(15:1,v/v,3.9ml)混合溶剂中,在室温下加入醋酸肼(15.2mg,0.15mmol),反应液在室温下搅拌4小时。反应结束后,反应液用dcm稀释,有机相使用nahco3洗涤,经无水na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,4:1)后得到化合物30*(85.9mg,0.71mmol,91%)。[α]
22d
=6.82(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.03
–
7.89(m,2h,ar),7.59
–
7.50(m,1h,ar),7.40
–
7.16(m,27h,ar),5.48(dd,j=3.4,1.7hz,1h,h-2b),5.34(d,j=1.7hz,1h,h-1b),5.18(d,j=12.5hz,2h,arch2),4.84(d,j=11.4hz,2h,arch2),4.68(d,j=11.5hz,1h,arch2),4.53
–
4.44(m,5h,arch2),4.44
–
4.27(m,4h,h-7b,h-3b,h-6b,h-5b),4.24(dd,j=8.5,6.2hz,1h,h-8a),4.14(d,j=2.7hz,1h,h-5a),4.06(t,j=9.6hz,1h,h-4b),3.96(dd,j=12.3,2.3hz,1h,h-7b’),3.88(s,1h,h-6a),3.82
–
3.72(m,5h,och3,h-8a’,h-4a),3.43
–
3.16(m,5h,h-3a,och2,nch2),2.32(dd,j=12.4,4.1hz,1h),2.04(d,j=5.9hz,1h),1.97(s,4h),1.51(s,6h),1.32(s,3h),1.30
–
1.21(m,6h).
13
c nmr(101mhz,cdcl3)δ170.6,168.7,166.2,139.0,138.8,138.1,138.0,133.3,130.0,129.9,128.7,128.6,128.6,128.5,128.5,128.4,128.3,128.1,128.0,127.9,127.8,127.7,127.7,127.6,127.4,109.9,99.0,97.3(c-1b),76.0,75.3,74.9,74.6,73.0,72.9,72.4,72.3,72.0,70.9,70.4,68.2,67.3,67.0,63.7,52.6,47.3,32.1,29.8,29.4,27.0,24.9,23.6,21.2;hrms(esi)m/z calcd for c
69h79o18
nna[m+na]
+
1232.5189,found 1232.5186。
[0132]
化合物31*:庚糖供体4*(71.0mg,0.084mmol)和糖基受体30*(75mg,0.067mmol)与甲苯共沸3次后,溶于无水dcm(4.2ml)中,加入分子筛ms搅拌30分钟。将反应液温度降低至0℃后加入tmsotf(2.3μl,12.6μmol),反应液在0℃下搅拌4小时。tlc检测反应原料完全消失后,使用吡啶终止反应。过滤完分子筛后滤液使用nahco3洗涤,经无水na2so4干燥,过滤浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,3:1)得到化合物31*(86mg,0.047mmol,68%)。[α]
22d
=5.4(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.05
–
7.92(m,2h,ar),7.58
–
7.50(m,1h,ar),7.45
–
6.84(m,47h,ar),5.52(dd,j=3.1,1.8hz,1h,h-2b),5.38(d,j=1.8hz,1h,h-1b),5.40
–
5.33(m,1h,h-2c),5.26(d,j=1.8hz,1h,h-1c),5.18(d,j=13.2hz,2h,arch2),4.85
–
4.77(m,3h,arch2),4.76
–
4.67(m,2h,arch2),4.57(s,2h),4.51(d,j=5.0hz,2h,arch2),4.47
–
4.13(m,13h),4.07
–
3.97(m,2h),3.94
–
3.87(m,4h),3.83
(dd,j=12.6,2.1hz,1h,h-4b),3.77(dd,j=8.5,5.0hz,1h,h-4c),3.75
–
3.67(m,4h,och3,h-8a’),3.62(dt,j=8.6,2.0hz,1h),3.44
–
3.18(m,5h,h-3a,nch2,och2),2.67
–
2.52(m,4h,ch2ch2),2.40(d,j=12.3hz,1h,h-2a(e)),2.11
–
2.04(m,4h,h-2a(a),och3),1.94(s,3h,ac),1.56
–
1.46(m,4h,ch2ch2),1.31(s,3h,ch3),1.23
–
1.20(s,5h,ch3,ch2).
13
c nmr(101mhz,cdcl3)δ206.3,171.7,170.5,168.3,165.6,139.1,139.0,139.0,138.7,138.5,138.1,137.9,137.8,137.0,133.2,130.2,130.0,128.7,128.6,128.5,128.4,128.4,128.4,128.4,128.3,128.3,128.3,128.1,128.0,127.9,127.8,127.7,127.7,127.6,127.6,127.5,127.5,127.4,109.9,100.2(c-1c),99.0,96.7(c-1b),78.0,75.3,75.1,75.0,74.9,74.8,74.2,73.9,73.2,73.1,72.7,72.5,72.3,71.8,71.4,71.2,70.5,69.2,68.0,67.3,52.5,38.1,31.9,29.9,29.5,28.2,27.0,24.8,23.6,21.2;hrms(esi)m/z calcd for c
109h121o26
nna[m+na]
+
1882.8069,found 1882.8057。
[0133]
化合物32*:将化合物31*(67mg,0.036mmol)溶于dcm/meoh(10:1,v/v,1.8ml)混合溶剂中,在室温下加入醋酸肼(6.6mg,0.072mmol),反应液在室温下搅拌5小时。tlc显示反应结束后,反应液用dcm稀释,有机相使用nahco3洗涤,经无水na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1)后得到化合物32*(52.7mg,0.030mmol,83%)。[α]
22d
=10.7(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.07
–
7.93(m,2h,ar),7.54(t,j=7.6hz,1h,ar),7.44
–
7.04(m,47h,ar),5.52(t,j=2.3hz,1h,h-2b),5.37(d,j=1.8hz,1h,h-1b),5.25(s,1h,h-1c),5.18(d,j=12.7hz,1h,arch2),4.86
–
4.75(m,2h,arch2),4.72
–
4.63(m,3h,arch2),4.57
–
4.48(m,4h,arch2),4.47
–
4.26(m,10h),4.21
–
4.12(m,3h),4.06
–
3.79(m,7h),3.79
–
3.66(m,6h),3.65
–
3.57(m,1h),3.49
–
3.14(m,5h,h-3a,nch2,och2),2.37(t,j=9.2hz,1h,h-2a(e)),2.15(s,1h,oh),2.03(t,j=12.1hz,1h,h-2a(a)),1.95(s,3h,ac),1.61
–
1.42(m,4h,ch2ch2),1.30(s,3h,ch3),1.28
–
1.16(m,5h,ch3,ch2).
13
c nmr(101mhz,cdcl3)δ170.4,168.2,165.4,139.0,138.9,138.7,138.5,137.9,133.0,130.2,129.9,128.5,128.4,128.4,128.3,128.2,128.2,128.2,128.1,128.0,128.0,127.9,127.8,127.8,127.6,127.5,127.4,127.4,127.4,127.3,127.2,109.8,102.1(c-1c),98.9,96.7(c-1b),79.9,75.1,74.8,74.0,73.6,72.9,72.8,72.5,71.9,70.3,68.8,67.9,67.2,63.5,52.4,29.3,26.8,24.6,23.5,21.0;hrms(esi)m/z calcd for c
104h115o24
nna[m+na]
+
1784.7701,found 1784.7689。
[0134]
化合物33*:将糖基供体5*(43.8mg,0.053mmol)和糖基受体32*(78.1mg,0.044mmol)与甲苯中共蒸三次,加入无水dcm(2.0ml)和分子筛,混合液在室温下搅拌30分钟后反应液温度降低至-20℃。向反应瓶中加入tmsotf(1.43μl,7.9μmol),反应液缓慢升至0℃,反应总共搅拌4小时。tlc监测糖基供体消失完全后,加入吡啶终止反应。反应液过滤掉分子筛之后,使用nahco3洗涤,有机相经na2so4干燥后过滤浓缩。粗产品经硅胶层析柱分离纯化(石油醚/乙酸乙酯,6:1)后得到化合物33*(71.2mg,0.038mmol,66%)。[α]
22d
=15.6(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.04(d,j=7.7hz,2h,ar),7.56(t,j=7.4hz,1h,ar),7.46
–
6.89(m,62h,ar),5.51(d,j=2.7hz,1h,h-2b),5.43(d,j=4.6hz,2h,h-1d,h-2d,h-1c),5.38(s,1h,h-1b),5.18(d,j=10.6hz,2h,arch2),4.84
–
4.69(m,5h,arch2),4.66(d,j=1.7hz,1h,h-1d),4.62
–
4.42(m,9h),4.41
–
4.20(m,9h),4.16
–
4.06(m,5h),4.03
–
3.83(m,5h),3.80
–
3.74(m,2h),3.74
–
3.64(m,4h),3.80
–
3.52(m,2h),3.38(s,3h,och3),
3.36
–
3.16(m,5h,och2,nch2),2.76
–
2.59(m,4h,ch2ch2),2.13(s,4h,ch3,h-2a(e)),1.93(s,3h,ac),1.86(t,j=12.1hz,1h,h-2a(a)),1.55
–
1.41(m,4h,ch2ch2),1.32
–
1.15(m,8h,ch2,och3,och3);hrms(esi)m/z calcd for c
139h152o33
clnna[m+na]
+
2397.99,found 2397.85。
[0135]
化合物34*:将化合物33*(58.0mg,0.024mmol)溶于dcm/meoh(10:1,v/v,1.2ml)混合溶剂中,在室温下加入醋酸肼(4.4mg,0.048mmol),反应液在室温下搅拌5h。tlc显示反应结束后,反应液用dcm稀释,有机相使用nahco3洗涤,经无水na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1)后得到化合物34*(47.0mg,0.021mmol,86%)。[α]
22d
=13.2(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.97
–
7.91(m,2h,ar),7.48(t,j=7.4hz,1h,ar),7.35
–
6.80(m,62h,ar),5.43(dd,j=3.2,1.7hz,1h,h-2b),5.40(s,1h,h-1c),5.31(d,j=1.7hz,1h,h-1b),5.10(d,j=10.8hz,2h,arch2),4.82
–
4.71(m,2h,arch2),4.72
–
4.59(m,4h,h-1d),4.52
–
4.36(m,10h),4.35
–
4.14(m,9h),4.11
–
3.97(m,8h),3.95
–
3.85(m,4h),3.82
–
3.56(m,11h),3.54
–
3.49(m,2h),3.36(s,3h,och3),3.30
–
3.02(m,5h,och2,nch2),2.08
–
2.02(m,1h,h-2a(e)),1.97(s,3h,ac),1.78(t,j=12.3hz,1h,h-2a(a)),1.48
–
1.32(m,4h,ch2ch2),1.30
–
1.01(m,8h,ch2,och3,och3)。
13
c nmr(101mhz,cdcl3)δ170.5,168.1,167.0,165.7,139.5,139.2,139.0,138.7,138.3,138.3,138.1,138.0,137.7,133.2,130.3,130.0,128.7,128.6,128.6,128.5,128.5,128.5,128.4,128.4,128.3,128.3,128.1,128.0,128.0,127.9,127.6,127.4,127.3,109.9,99.0,96.8,80.8,75.7,75.4,75.1,74.9,74.2,73.8,73.1,72.7,72.4,72.2,72.2,71.8,71.5,71.2,70.9,70.4,68.4,68.0,67.3,66.0,63.6,62.1,52.4,40.8,31.9,31.8,29.4,27.0,24.8,23.6,21.2,19.4,14.1;hrms(esi)m/z calcd for c
134h146o31
clnna[m+na]
+
2322.9460,found 2322.9447。
[0136]
化合物35*:将糖基供体6*(42.0mg,0.053mmol)和糖基受体34*(41.4mg,0.018mmol)与甲苯中共蒸三次,加入无水dcm(3.9ml)和分子筛,混合液在室温下搅拌30分钟后反应液温度降低至-10℃。向反应瓶中加入tmsotf(2.1μl,11.7μmol),反应液缓慢升至0℃,反应总共搅拌5小时。tlc监测糖基供体消失完全后,加入吡啶终止反应。反应液过滤掉分子筛之后,使用nahco3洗涤,有机相经无水na2so4干燥后过滤浓缩,粗产品经硅胶层析柱分离纯化(石油醚/乙酸乙酯,3:1)后得到化合物35*(39.2mg,0.013mmol,71%)。[α]
22d
=34.4(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.07(d,j=7.8hz,2h,ar),7.87
–
7.54(m,6h,ar),7.50
–
6.95(m,79h),5.63
–
5.55(m,2h,h-1c,h-2b),5.51(s,1h,h-2d),5.41(s,1h,h-1b),5.21(d,j=9.9hz,2h,arch2),5.09
–
4.94(m,2h,h-1d,h-1e),4.93
–
4.68(m,7h),4.67
–
4.25(m,15h),4.39
–
4.26(m,7h),4.24
–
4.06(m,5h),4.03
–
3.70(m,15h),3.69
–
3.52(m,5h),3.41(s,3h,och3),3.26(d,j=26.1hz,5h,ch2ch2),2.75
–
2.51(m,4h,ch2ch2),2.18
–
2.06(m,4h,ch3,h-2a(e)),1.96(s,3h,ac),1.88(t,j=12.2hz,1h,h-2a(a)),1.59
–
1.48(m,4h,ch2ch2),1.40
–
1.10(m,8h,ch2,och3,och3).
13
c nmr(101mhz,cdcl3)δ206.1,171.7,170.5,168.1,166.7,165.6,139.4,139.2,139.1,139.0,138.9,138.5,138.5,138.4,138.3,138.3,138.2,138.0,137.6,136.1,133.4,133.1,133.0,130.3,130.0,128.8,128.7,128.6,128.5,128.5,128.4,128.4,128.3,128.3,128.3,128.2,128.2,128.1,128.1,128.0,128.0,127.9,127.8,127.8,127.7,127.7,127.6,127.6,127.5,127.4,127.4,127.3,127.3,127.2,126.1,126.1,125.8,125.6,109.9,101.4(h-1c),101.3(h-1d),99.0
(h-1e),96.8(h-1b),80.5,78.7,78.5,75.6,75.4,75.3,75.0,75.0,74.8,74.3,74.2,73.6,73.4,73.2,73.1,72.9,72.7,72.4,72.3,72.2,71.9,71.7,71.4,71.1,70.6,70.4,68.7,68.0,67.5,67.3,66.0,63.6,52.4,50.6,50.4,47.2,46.3,40.8,38.1,32.1,31.8,29.8,29.6,29.4,29.2,28.2,27.7,27.0,24.9,24.7,23.6,22.8,21.2,14.3;maldi-tof m/z calcd for c
178h190o39
clnna[m+na]
+
3023.2496,found 3023.277。
[0137]
化合物36*:将化合物35*(101mg,0.034mmol)溶于dcm/meoh(10:1,v/v,2.0ml)混合溶剂中,在室温下加入醋酸肼(6.3mg,0.068mmol),反应液在室温下搅拌5小时。tlc显示反应原料消失完全后,反应液用dcm稀释,有机相使用nahco3洗涤,经无水na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,3:1)后得到化合物36*(87.9mg,0.03mmol,89%)。[α]
22d
=24.1(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.09
–
8.02(m,2h,ar),7.81
–
7.49(m,6h,ar),7.48
–
6.92(m,79h),5.62(s,1h,h-1c),5.56(d,j=2.6hz,1h,h-2b),5.39(d,j=1.7hz,1h,h-1b),5.19(d,j=10.5hz,1h,arch2),5.11
–
5.05(m,1h,h-1d,h-1e),4.88
–
4.67(m,7h),4.65
–
4.40(m,18h),4.40
–
4.24(m,9h),4.24
–
4.02(m,11h),4.00
–
3.81(m,14h),3.80
–
3.70(m,5h),3.69
–
3.54(m,6h),3.51(t,j=6.6hz,1h),3.37(s,3h,och3),3.31
–
3.18(m,5h),2.14
–
2.06(m,1h,h-2a(e)),1.95(s,3h,ac),1.86(t,j=12.1hz,1h,h-2a(a)),1.59
–
1.47(m,4h,ch2ch2),1.39
–
1.14(m,8h,ch2,och3,och3).
13
c nmr(101mhz,cdcl3)δ170.6,168.1,166.9,165.6,139.3,139.2,139.1,138.8,138.5,138.5,138.3,138.3,138.1,138.1,138.1,137.6,136.0,133.4,133.2,133.0,130.2,130.0,128.7,128.6,128.6,128.5,128.4,128.4,128.3,128.3,128.3,128.3,128.2,128.1,128.1,128.0,128.0,128.0,128.0,127.8,127.7,127.6,127.6,127.5,127.4,127.3,127.3,127.3,127.2,126.2,126.1,125.8,125.7,109.9,101.5,101.1,99.0,96.8,80.5,78.4.;maldi-tof m/z calcd for c
173h184o37
clnna[m+na]
+
2925.2128,found 2925.262。
[0138]
实施例7
[0139]
三糖的合成如图8所示:
[0140]
将糖基供体7*和糖基受体9*在协同糖基化策略条件下进行糖基化反应,得到单一α-构型二糖37*(新糖苷键:3j
h1/h2
=3.5hz,δ
h1
=5.01ppm),产率为79%。二糖37*使用甲醇钠处理脱去苯甲酰基,得到二糖受体38*,产率为65%。糖基供体7*与受体38*在协同的糖基化条件中进行反应,得到单一α-构型三糖39*(新糖苷键:3j
h1/h2
=3.5hz,δ
h1
=5.09ppm),产率为65%。在tbaf和醋酸的缓冲液中脱去三糖39*端基位的tbs基团,半缩醛中间体在dbu催化下引入苯基三氟乙酰亚胺酯,得到三糖供体40*,两步产率为90%。
[0141]
化合物37*:糖基供体7*(1.47g,1.88mmol)和糖基受体9*(775mg,1.26mmol)溶于dcm/et2o(1:2,94ml),加入噻吩和分子筛搅拌半个小时,温度降至0℃,加入tmsotf(32μl,0.18mmol)的催化作用下进行糖基化反应,反应结束后粗产品经硅胶柱纯化(石油醚/乙酸乙酯,8:1)得到化合物37*(1.2g,1.0mmol,79%)。[α]
22d
=44.8(c 1.0,chcl3)。1h nmr(600mhz,cdcl3)δ8.08
–
7.13(m,39h,ar),5.16(d,j=10.9hz,1h,arch2),5.05(d,j=11.2hz,1h,arch2),5.01(d,j=3.5hz,1h,h-1a),5.00
–
4.82(m,6h,,arch2),4.73(d,j=11.9hz,1h,,arch2),4.69(d,j=7.5hz,1h,h-1b),4.65(dd,j=11.0,6.3hz,3h,,arch2),4.53(dd,j=11.9,2.2hz,1h,h-6a),4.49(dd,j=11.9,4.4hz,1h,h-6a’),4.13(t,j=9.2hz,1h,h-3a),4.04(ddd,j=10.1,4.5,2.2hz,1h,h-5a),3.88(dd,j=11.5,5.1hz,1h,
h-6b),3.74
–
3.67(m,3h,h-3b,h-6b,h-4b),3.65(dd,j=10.0,8.9hz,1h,h-4a),3.64(dd,j=9.6,3.5hz,1h,h-2a),3.55(ddd,j=7.9,3.6,2.7hz,1h,h-5b),3.36
–
3.23(m,1h,h-2b),0.93(s,9h,otbs),0.17(s,3h,ch3),0.16(s,3h,ch3).
13
c nmr(151mhz,cdcl3)δ166.4,138.6,138.6,138.4,138.2,136.4,136.2,133.5,133.5,133.2,133.1,133.1,130.2,129.8,129.1,128.8,128.7,128.6,128.5,128.5,128.5,128.5,128.3,128.2,128.1,128.1,128.1,127.9,127.9,127.8,127.8,127.7,127.0,126.5,126.4,126.1,126.1,125.9,125.9,98.3(c-1b),97.4(c-1a),84.8,84.2,81.8,80.6,78.0,77.8,76.0,75.8,75.2,75.1,74.9,72.5,69.1,66.6,63.6,25.8,18.1,-3.8,-4.9;hrms(esi)m/z calcd for c
75h80o12
sina[m+na]
+
1223.5311,found 1223.5302。
[0142]
化合物38*:化合物38*(58.0mg,0.048mmol)在甲醇钠(33μl,5m)的作用下脱去酯基,反应结束后粗产品经硅胶柱纯化分离(石油醚/乙酸乙酯,5:1)得到化合物38*(51.4mg,0.046mmol,97%)。[α]
22d
=52.2(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ7.69
–
7.03(m,34h,ar),4.97(d,j=11.1hz,1h,arch2),4.87(d,j=10.5hz,1h),4.86(d,j=3.0hz,1h,h-1a),4.83
–
4.67(m,6h,arch2),4.58
–
4.39(m,5h,arch2),3.92(t,j=9.2hz,1h,h-3a),3.69(dd,j=11.7,4.7hz,1h,h-6a),3.64
–
3.47(m,6h),3.44
–
3.37(m,2h,h-2a,h-4a),3.35(ddd,j=9.7,4.7,1.5hz,1h,h-5b),3.11(dd,j=9.1,7.5hz,1h,h-2b),1.50(s,1h,oh),0.77(s,9h,otbs),0.01(s,3h,ch3),-0.00(s,3h,ch3).
13
c nmr(101mhz,cdcl3)δ138.6,138.6,138.5,138.4,136.3,136.3,133.4,133.0,133.0,128.6,128.5,128.5,128.2,128.1,128.0,128.0,127.9,127.9,127.8,127.8,127.8,127.7,127.7,126.8,126.5,126.3,126.1,126.0,125.9,125.9,98.3(c-1b),97.5(c-1a),84.7,84.1,81.5,80.5,77.7,77.3,75.7,75.1,75.1,75.0,72.4,70.9,66.3,62.0,25.8,18.1,-3.8,-5.0;hrms(esi)m/z calcd for c
68h76o11
sina[m+na]
+
1119.5049,found 1119.5035。
[0143]
化合物39*:糖基供体7*(670mg,0.86mmol)和糖基受体38*(770mg,0.64mmol)溶于dcm/et2o(1:2,43ml),加入噻吩和分子筛搅拌半个小时,温度降至0℃,加入tmsotf(16.2μl,0.09mmol)的催化作用下进行糖基化反应,反应结束后粗产品经硅胶柱纯化(石油醚/乙酸乙酯,8:1)得到化合物39*(699mg,0.42mmol,65%)。[α]
22d
=59.4(c 1.0,chcl3);1h nmr(600mhz,cdcl3)δ8.02
–
7.97(m,2h,ar),7.84
–
7.65(m,10h,ar),7.57
–
7.52(m,1h,ar),7.51
–
7.35(m,14h,ar),7.33
–
7.19(m,22h,ar),5.16(d,j=10.9hz,1h,arch2),5.12(d,j=11.1hz,1h,arch2),5.09(d,j=3.5hz,1h,h-1a),5.02(d,j=11.1hz,1h,arch2),5.02(d,j=3.0hz,2h,h-1b),5.01
–
4.87(m,7h,arch2),4.79
–
4.75(m,2h,arch2),4.74
–
4.65(m,4h,arch2),4.64(d,j=7.5hz,1h,h-1c),4.63
–
4.55(m,2h,arch2),4.52(dd,j=12.0,2.1hz,1h,h-6a),4.44(dd,j=12.0,4.4hz,1h,h-6a’),4.12(t,j=9.2hz,1h,h-3a),4.08(t,j=9.2hz,1h,h-3b),4.02(ddd,j=10.2,4.4,2.1hz,1h,h-5a),3.91
–
3.85(m,3h,h-5b,h-6b,h-6c),3.80
–
3.71(m,4h,h-4b,h-4c,h-6b’,h-6c’),3.67(dd,j=9.2hz,1h,h-3c),3.64(dd,j=10.1,8.9hz,1h,h-4a,h-2b),3.61(dd,j=9.6,3.5hz,1h,h-2b),3.48(dd,j=9.6,3.5hz,1h,h-2a),3.48
–
3.42(m,1h,h-5c),3.26(dd,j=9.2,7.5hz,1h,h-2c),0.93(s,9h,otbs),0.16(s,3h,ch3),0.16(s,3h,ch3).
13
c nmr(151mhz,cdcl3)δ166.2,138.7,138.6,138.5,138.4,138.0,136.4,136.3,136.0,133.3,133.3,133.0,133.0,132.9,132.9,130.0,129.6,128.4,128.4,128.4,128.3,128.3,128.3,128.1,128.0,127.9,127.9,
127.9,127.8,127.8,127.7,127.6,127.6,127.6,127.5,127.5,127.4,126.8,126.7,126.3,126.2,126.0,125.9,125.9,125.8,125.7,125.7,98.2(c-1c),97.3(c-1b),96.8(c-1a),84.5,84.1,81.8,81.6,80.6,80.3,77.7,77.6,75.8,75.5,75.1,75.0,74.9,74.9,72.2,72.1,70.7,68.9,66.1,65.7,63.5,25.7,17.9,-3.9,-5.1;hrms(esi)m/z calcd for c
106h110o17
sina[m+na]
+
1705.7404,found 1705.7399。
[0144]
化合物40*:将化合物39*(47.0mg,0.028mmol)溶解于thf(1.5ml)中,在0℃加入乙酸(16.0μl,0.28mmol),而后加入四丁基氟化铵(tbaf)的thf溶液(0.28ml,0.28mmol,1m)。反应溶液在室温下搅拌3小时,tlc监测反应结束后,反应液用乙酸乙酯稀释后使用水洗三次。混合的有机相经无水na2so4干燥,减压浓缩后,粗品使用硅胶柱层析柱分离纯化后得到半缩醛中间产物(40.3mg)。半缩醛中间产物溶解在干燥的dcm(0.5ml)中,反应液冷却至0℃,加入n-苯基三氟乙酰氯(18.6μl,0.13mmol)和dbu(11.2μl,0.075mmol),反应液在室温下搅拌3小时。反应结束后,反应液直接减压浓缩,经硅胶层析柱分离纯化(石油醚/乙酸乙酯,3:1)得到40*(41.2mg,0.025mmol,90%)。1h nmr(400mhz,cdcl3)δ8.06
–
7.97(m,2h,ar),7.90
–
7.66(m,12h,ar),7.60
–
7.15(m,40h),7.08
–
7.01(m,1h,ar),6.88(d,j=7.7hz,1h,ar),5.20
–
5.08(m,3h,h-1a),5.05
–
4.87(m,7h,h-1b),4.82
–
4.59(m,8h),4.57
–
4.49(m,1h),4.47
–
4.40(m,1h),4.13(t,j=9.2hz,1h),4.09
–
3.97(m,2h),3.94
–
3.72(m,7h),3.72
–
3.59(m,2h),3.53
–
3.39(m,2h)。
13
c nmr(151mhz,cdcl3)δ166.2,138.6,138.5,138.5,138.4,138.1,138.0,138.0,137.8,136.4,136.4,136.1,136.0,133.4,133.3,133.0,133.0,132.9,130.0,129.7,129.4,128.7,128.5,128.5,128.5,128.4,128.4,128.4,128.4,128.3,128.1,128.1,128.0,128.0,128.0,127.9,127.9,127.9,127.8,127.8,127.8,127.8,127.7,127.7,127.7,127.6,127.6,127.6,127.5,127.5,127.4,127.3,127.3,127.3,127.2,126.8,126.8,126.7,126.6,126.4,126.3,126.3,126.3,126.2,126.1,126.1,126.1,126.0,125.9,125.9,125.9,125.8,125.8,125.8,125.7,120.4,119.3,97.4(c-1b),96.9(c-1c),81.8,80.5,80.3,75.8,75.8,75.7,75.7,75.6,75.6,75.2,75.1,75.0,72.3,72.3,72.2,72.1,71.0,70.9,70.8,69.0,69.0,65.9,65.6,65.6,65.3,63.5,63.4。
[0145]
实施例8
[0146]
二糖的合成如图9所示:
[0147]
以葡萄糖中间体26*为起始原料,在ddq的条件下脱去o3位的2-萘亚甲基,得到葡萄糖受体41*,产率为90%。葡萄糖供体7*和受体41*在协同糖基化反应条件下进行糖基化反应,得到α-构型单一的二糖42*(新糖苷键:3j
h1/h2
=3.61hz,δ=5.65ppm),产率为51%。二糖42*经过两步反应转化为苯基三氟乙酰亚胺酯基供体43*,产率为81%。
[0148]
化合物41*:将化合物26*(210mg,0.32mmol)溶解于dcm/h2o(9:1,v/v,6.4ml)的混合溶剂中,在室温下加入ddq(145mg,0.64mmol),反应温度恢复室温后继续反应6小时。待反应结束后,反应液用dcm稀释,依次使用10%的na2s2o3溶液和饱和的nahco3溶液洗涤,有机相经na2so4干燥后过滤浓缩。粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,8:1)得到化合物41*(164mg,0.29mmol,90%)。1h nmr(400mhz,cdcl3)δ8.06
–
7.95(m,2h,ar),7.60(td,j=7.3,1.4hz,1h,ar),7.52
–
7.21(m,10h,ar),6.93(d,j=7.9hz,2h,ar),5.02(d,j=11.0hz,1h,arch2),4.84(d,j=11.1hz,1h,arch2),4.67(d,j=10.9hz,3h,h-7,arch2),
4.59(d,j=9.7hz,1h,h-1),4.45(dd,j=11.9,5.6hz,1h,h-7’),3.81(t,j=8.8hz,1h,h-3),3.64(ddd,j=9.9,5.6,2.1hz,1h,h-5),3.50(t,j=9.3hz,1h,h-4),3.35(t,j=9.2hz,1h,h-2),2.51(s,1h,oh),2.27(s,3h,ch3).
13
c nmr(101mhz,cdcl3)δ166.2,138.1,137.9,137.8,133.1,132.8,130.0,129.8,129.6,129.3,128.7,128.6,128.4,128.2,128.1,128.0,87.1(c-1),80.6,78.8,76.8,75.2,74.8,63.8,21.1;hrms(esi)m/z calcd for c
34h34
o6sna[m+na]
+
593.1968,found 593.1963。
[0149]
化合物42*:糖基供体7*(320mg,0.88mmol)和糖基受体41*(455mg,0.81mmol)溶于dcm/et2o(1:2,8.8ml),加入噻吩(1.5ml,8.8mmol)和分子筛搅拌半个小时,温度降至0℃,加入tmsotf(32μl,0.18mmol)的催化作用下进行糖基化反应,反应结束后粗产品经硅胶柱纯化(石油醚/乙酸乙酯,8:1)得到化合物42*(1.2g,0.41mmol,51%)。1h nmr(400mhz,cdcl3)δ8.11
–
8.03(m,2h,ar),8.02
–
7.94(m,2h,ar),7.84
–
7.57(m,5h,ar),7.55
–
7.38(m,11h,ar),7.36(t,j=7.8hz,2h,ar),7.32
–
7.03(m,18h,ar),6.93(d,j=8.0hz,2h,ar),5.65(d,j=3.6hz,1h,h-1b),5.18
–
5.04(m,2h,arch2),5.06
–
4.87(m,3h,arch2),4.81
–
4.71(m,2h,arch2),4.71
–
4.62(m,2h),4.60(d,j=9.7hz,1h,h-1a),4.60
–
4.57(m,1h),4.52(d,j=11.4hz,1h,arch2),4.43(ddd,j=10.3,4.3,2.0hz,1h,h-5a),4.34(dd,j=12.0,5.1hz,1h),4.28(dd,j=12.2,2.0hz,1h),4.19(t,j=9.4hz,1h),4.15
–
4.05(m,2h),2.29(s,3h,ch3).
13
c nmr(101mhz,cdcl3)δ166.1,166.0,138.0,137.9,137.6,137.4,137.4,135.8,133.3,133.1,133.0,132.9,132.9,130.0,130.0,129.8,129.7,129.7,129.3,128.6,128.4,128.4,128.4,128.3,128.3,128.2,128.1,128.1,127.9,127.9,127.8,127.7,127.7,127.1,126.6,126.1,125.9,97.1(c-1b),88.0(c-1a),82.4,79.8,79.7,79.0,78.3,75.8,75.4,75.2,74.1,73.7,69.2,63.4,63.2,21.1。
[0150]
化合物43*:化合物42*(31.0mg,0.028mmol)溶解于thf/h2o(1:1,v/v,1.4ml)的混合溶剂中,加入溴代丁二酰亚胺(14.9mg,0.084mmol),反应液在室温下搅拌4小时。待反应原料消失完全后,反应液用dcm稀释,有机相分别使用10%的na2s2o3和nahco3溶液洗涤,经无水na2so4干燥,有机相经过滤后浓缩,粗产品经柱层析纯化得到缩醛中间产物(25.2mg)。将缩醛中间产物溶于干燥的dcm(1.4ml)中,在0℃下加入n-苯基三氟乙酰氯(20.9μl,0.14mmol)和dbu(12.6μl,0.023mmol),反应在室温下搅拌5小时,tlc监测反应原料完全消失后,反应液用dcm稀释,饱和nahco3溶液洗涤,有机相用无水na2so4干燥,过滤后直接浓缩,粗产品经硅胶柱层析纯化(石油醚/乙酸乙酯,6:1)得到化合物43*(26.5mg,2.5mmol,81%)。[α]
22d
=84.5(c 1.0,chcl3);1h nmr(400mhz,cdcl3)δ8.04
–
7.90(m,4h,ar),7.77
–
7.56(m,4h,ar),7.56
–
7.28(m,11h,ar),7.27
–
6.92(m,21h,ar),6.72
–
6.52(m,2h,ar),5.49(dd,j=19.1,3.6hz,1h,h-1b),5.11
–
4.96(m,2h),4.95
–
4.78(m,2h),4.76
–
4.66(m,2h),4.66
–
4.43(m,6h),4.42
–
4.23(m,2h),4.22
–
4.03(m,3h).
13
c nmr(101mhz,cdcl3)δ166.4,166.3,166.2,166.2,143.5,138.2,138.1,137.9,137.9,137.6,137.5,137.2,137.1,136.0,136.0,133.5,133.3,133.2,133.1,130.2,130.1,129.9,129.9,129.8,128.9,128.8,128.7,128.6,128.6,128.5,128.5,128.4,128.3,128.3,128.1,128.1,128.0,128.0,127.9,127.9,127.9,127.8,127.5,127.3,126.8,126.7,126.2,126.1,126.1,126.0,124.5,119.6,119.4,97.7(c-1b),82.5,82.3,80.2,80.1,79.8,79.2,78.3,78.3,78.2,78.2,77.9,76.0,75.5,75.3,74.9,74.3,74.2,73.6,73.4,71.4,69.5,69.3,63.5,
63.2,63.0。
[0151]
实施例9
[0152]
十一糖的合成如图10所示:
[0153]
将三糖供体40*和五糖受体36*,以乙醚和二氯甲烷作为混合溶剂,在tmsotf催化作用下进行糖基化反应,得到八糖44*(新糖苷键:2j
h1/c1
=168.6hz,δ
h1
=4.96ppm),产率为61%,利用乙醚的溶剂效应,高立体选择性得到α-构型产物。将八糖中的单氯乙酰基(ca)选择性的在硫脲条件下脱去,得到八糖受体45*,产率为92%。半乳糖苯基三氟乙酰亚胺酯供体8*在tmsotf催化下与八糖受体45*行糖基化反应,在c2位苯甲酰基的邻基参与作用下,生成单一β-构型的九糖化合物46*新糖苷键:2j
h1/c1
=161.4hz,δ
h1
=4.49ppm),产率为63%。九糖46*中乙酰丙酰基在醋酸肼的作用下选择性脱除,得到化合物47*,产率为91%。将九糖受体47*与二糖供体43*在tmsotf的催化作用下进行糖基化反应,利用乙醚的溶剂效应,得到α-构型连接的十一糖48*,产率为56%。采用乙硫醇和对甲苯磺酸的方法选择性的脱去十一糖48*上的丙叉基,使用甲醇钠和氢氧化钠脱去糖环上的酰基,最后利用钯碳/氢气脱除糖环上的芳香保护基,得到化合物1,产率为51%。
[0154]
化合物44*:将糖基供体46(56.5mg,0.033mmol)和糖基受体40*(32.0mg,0.011mmol)与甲苯中共蒸三次,加入无水dcm/et2o(3:1,v/v,1.1ml)的混合溶剂和分子筛,混合液在室温下搅拌30分钟后反应液温度降低至0℃。向反应瓶中加入tmsotf(0.05m.60μl,3.0μmol),反应液缓慢升至0℃。tlc监测糖基供体消失完全后,加入吡啶终止反应。反应液过滤掉分子筛之后,使用nahco3洗涤,有机相经无水na2so4干燥后过滤浓缩,粗产品经硅胶层析柱分离纯化(石油醚/乙酸乙酯,4:1)后得到化合物44*(29.9mg,6.6μmol,61%)。[α]
22d
=49.6(c 1.0,chcl3);1h nmr(600mhz,cdcl3)δ8.03(d,j=7.8hz,2h,ar),7.95(d,j=7.7hz,2h,ar),7.80
–
7.63(m,12h,ar),7.62
–
7.52(m,5h,ar),7.50
–
6.90(m,126h),5.57(s,1h,h-1c),5.53(s,1h,h-2b),5.51(d,j=3.5hz,1h,h-1h),5.36(s,1h,h-1b),5.20
–
5.14(m,3h),5.12(s,1h,h-1d),5.09
–
4.84(m,13h,h-1e,h-1f,h-1g,arch2),4.84
–
4.73(m,5h),4.72
–
4.64(m,10h),4.63
–
4.53(m,9h),4.52
–
4.46(m,8h),4.45
–
4.20(m,23h),4.19
–
4.10(m,6h),4.10
–
4.00(m,7h),4.00
–
3.79(m,19h),3.79
–
3.63(m,10h),3.63
–
3.43(m,9h),3.40(dd,j=9.7,3.5hz,1h),3.35
–
3.29(m,5h),3.29
–
3.15(m,5h),2.07
–
2.00(m,1h,h-2a(e)),1.93(s,3h,ac),1.81(t,j=12.3hz,1h,h-2a(a)),1.55
–
1.42(m,4h,ch2ch2),1.26
–
1.06(m,8h,ch2,och3,och3).
13
c nmr(101mhz,cdcl3)δ170.4,168.0,166.7,166.1,165.5,139.1,138.9,138.7,138.6,138.4,138.2,138.0,137.8,137.8,137.5,136.4,136.4,136.0,133.3,133.2,133.0,133.0,132.9,132.8,130.1,129.9,129.9,129.6,128.8,128.5,128.5,128.4,128.4,128.4,128.3,128.3,128.3,128.2,128.2,128.2,128.2,128.1,128.1,128.0,127.9,127.8,127.8,127.7,127.7,127.6,127.6,127.5,127.5,127.4,127.4,127.3,127.2,127.2,127.2,127.1,126.9,126.6,126.4,126.3,126.1,125.9,125.9,125.8,125.8,125.6,125.6,125.5,109.8,101.5(c-1c,c-1e),100.3(c-1d),98.9,97.7(c-1g),97.2(c-1f),96.9(c-1h),96.7(c-1b),82.0,81.6,80.4,75.8,75.5,75.5,75.1,75.0,74.7,74.3,74.1,73.2,73.0,72.8,72.6,72.4,72.1,71.7,71.1,70.3,68.9,67.8,67.4,67.2,65.9,65.5,65.3,63.5,52.3,40.6,31.6,29.7,29.3,26.8,24.6,23.5,22.7,21.1;maldi-tof m/z calcd for c
273h278o53
clnna[m+na]
+
4475.8670,found 4475.581。
[0155]
化合物45*:将化合物化合物44*(23.0mg,0.005mmol)溶于chcl3和meoh(1:1,v/v,1.5ml)中,在室温下加入硫脲(n2h4cs)(3.0mg,0.04mmol)。反应液在60℃下搅拌24小时,tlc显示反应原料消失完全后,反应液用dcm稀释,使用饱和nahco3洗涤,水相用dcm反萃两次,有机相用无水na2so4干燥后过滤浓缩,粗产品经硅胶层析柱分离纯化(石油醚/乙酸乙酯,3:1)后得到化合物化合物45*(20.1mg,4.6μmol,92%)。[α]
22d
=105.0(c 1.0,chcl3);1h nmr(600mhz,cdcl3)δ8.07
–
8.00(m,2h,ar),7.99
–
7.94(m,2h,ar),7.83
–
7.57(m,17h,ar),7.52
–
6.92(m,126h,ar),5.58
–
5.48(m,3h,h-1c,h-2b,h-1h),5.38(d,j=1.7hz,1h,h-1b),5.25
–
5.16(m,4h,h-1d,h-1e,arch2),5.14
–
4.95(m,10h,h-1f,h-1g),4.96
–
4.81(m,8h),4.81
–
4.57(m,19h),4.57
–
4.48(m,9h),4.48
–
4.29(m,22h),4.27
–
4.12(m,9h),4.10
–
3.78(m,32h),3.72(dd,j=19.6,10.7hz,5h),3.67
–
3.46(m,14h),3.46
–
3.36(m,4h),3.32
–
3.16(m,5h),2.24(d,j=11.1hz,1h,h-1a(e)),2.12
–
2.03(m,1h,h-1a(a)),1.96(s,3h,ac),1.54(s,4h),1.38
–
1.09(m,8h,ch2,och3,och3).
13
c nmr(151mhz,cdcl3)δ170.4,168.3,166.1,165.5,156.7,156.2,139.1,139.0,138.8,138.7,138.7,138.6,138.6,138.5,138.4,138.4,138.2,138.1,138.0,138.0,138.0,137.7,136.8,136.4,136.3,136.0,135.9,133.3,133.2,133.0,132.9,132.9,132.8,130.1,129.9,129.9,129.6,128.8,128.8,128.5,128.5,128.4,128.4,128.3,128.3,128.3,128.2,128.2,128.1,128.1,128.0,127.9,127.8,127.8,127.8,127.7,127.6,127.6,127.5,127.5,127.4,127.3,127.3,127.2,127.2,127.2,126.9,126.6,126.5,126.4,126.3,126.3,126.1,126.0,125.9,125.9,125.9,125.9,125.8,125.8,125.7,125.7,125.6,125.5,125.3,109.7,101.3(c-1c,c-1e),100.8(c-1d),99.1,97.7(c-1g),97.2(hc-1f),96.7(c-1h),96.5(c-1b),82.0,81.7,81.6,81.1,80.5,80.3,80.2,79.8,78.7,78.2,75.8,75.8,75.5,75.4,75.2,75.1,75.0,74.9,74.7,74.5,74.2,73.8,73.2,72.8,72.8,72.5,72.3,72.2,72.0,71.8,71.7,71.6,71.4,71.0,70.8,70.2,68.9,67.9,67.4,67.2,65.6,65.3,63.5,63.4,62.6,52.4,50.5,50.2,47.1,46.2,31.6,29.7,29.3,28.0,27.6,26.8,24.6,23.5,22.7,21.1,14;maldi-tof m/z calcd for c
271h277o53
nna[m+na]
+
4399.8954,found 4399.843。
[0156]
化合物46*:半乳糖供体8*(6.2mg,8.4μmol)和八糖受体45*(18.4mg,4.2μmol)与甲苯共蒸三次,加入干燥的dcm(0.8ml)和活化的分子筛。溶液在室温下搅拌30min后冷却至0℃,加入tmsotf(25.0μl,0.05m in dcm,1.3umol),反应液在0℃下继续搅拌3小时,用吡啶终止反应。反应液过滤后,加入dcm稀释,而后使用饱和的nahco3洗涤,有机相用无水na2so4干燥后,经减压浓缩。粗产品经硅胶柱层析纯化分离(石油醚/乙酸乙酯,5:1)得到化合物46*(14.6mg,2.9μmol,71%)。[α]
22d
=32.1(c 0.5,chcl3);1h nmr(600mhz,cdcl3)δ8.07
–
7.91(m,4h,ar),7.80
–
7.64(m,13h,ar),7.60
–
6.69(m,141h,ar),5.58(d,j=3.3hz,1h,h-4i),5.55
–
5.53(m,1h,h-2b),5.46(d,j=3.4hz,1h,h-1h),5.41
–
5.30(m,3h,h-2i,h-1b,h-1c),5.17(d,j=15.1hz,1h,h-1d,arch2),5.12
–
5.04(m,2h,arch2),5.02
–
4.73(m,12h,h-1e,h-1f,h-1g),4.73
–
4.44(m,24h,h-1i),4.42
–
4.18(m,24h),4.17
–
3.80(m,30h),3.79
–
3.49(m,18h),3.49
–
3.11(m,15h),2.55
–
2.39(m,5h,ch2ch2),2.13
–
1.98(m,4h),1.94(s,3h,ac),1.69
–
1.50(m,4h,ch2ch2),1.26(d,j=5.7hz,8h,8h,ch2,och3,och3).
13
c nmr(151mhz,cdcl3)δ206.3,172.0,170.4,168.2,166.1,165.6,165.2,156.7,156.2,139.1,
138.9,138.7,138.7,138.6,138.5,138.4,138.3,138.2,138.1,138.0,137.7,137.4,137.3,136.3,136.3,136.0,135.9,133.3,133.1,133.0,132.9,132.9,132.7,132.7,130.0,129.9,129.9,129.8,129.6,128.5,128.5,128.4,128.3,128.3,128.2,128.2,128.1,128.1,128.0,128.0,127.9,127.9,127.8,127.8,127.7,127.6,127.6,127.5,127.5,127.4,127.4,127.3,127.3,127.3,127.2,127.2,127.1,127.1,126.9,126.9,126.8,126.8,126.7,126.4,126.3,126.3,126.1,126.0,125.9,125.9,125.8,125.7,125.5,125.4,109.8,101.7(c-1c,c-1d,c-1i),101.1(c-1e),99.0,97.6(c-1g),97.2(c-1f),96.6(c-1b),96.4(c-1h),81.9,81.7,81.6,81.1,80.3,80.1,79.1,76.4,75.8,75.5,75.2,75.2,75.1,75.0,75.0,74.9,74.7,74.6,74.3,74.1,73.6,73.2,73.1,72.8,72.6,72.5,72.3,72.0,72.0,71.8,71.6,71.5,71.5,71.1,71.0,70.6,70.3,68.9,67.8,67.4,67.2,66.9,65.9,65.6,65.4,63.5,63.4,52.4,50.5,50.2,47.1,46.2,38.0,31.7,29.7,29.4,29.3,28.0,27.9,27.6,26.8,26.7,24.6,23.5;maldi-tof m/z calcd for c
303h309o60
nna[m+na]
+
4944.1051,found 4944.566。
[0157]
化合物47*:将化合物46*(12.5mg,2.5μmol)溶于dcm/meoh(10:1,v/v,0.8ml)混合溶剂中,在室温下加入醋酸肼(3.0mg,7.5μmol),反应液在室温下搅拌5小时。tlc显示反应原料消失完全后,反应液用dcm稀释,有机相使用nahco3洗涤,经无水na2so4干燥后过滤浓缩,粗产品经硅胶柱层析分离纯化(石油醚/乙酸乙酯,5:1)后得到化合物47*(11.0mg,2.3μmol,91%)。[α]
22d
=45.3(c 0.5,chcl3);1h nmr(600mhz,cdcl3)δ8.07
–
7.92(m,2h,ar),7.87
–
7.67(m,13h,ar),7.63
–
6.77(m,141h,ar),5.55(s,1h,h-2b),5.52
–
5.46(m,2h,h-2i,h-1h),5.42(s,1h,h-1b),5.37(s,1h,h-1c),5.24
–
5.16(m,3h,h-1d,arch2),5.11(d,j=10.9hz,1h,arch2),5.07
–
4.88(m,11h,h-1e,h-1f,h-1g),4.85
–
4.79(m,3h),4.75
–
4.55(m,21h),4.55
–
4.49(m,6h),4.48
–
4.21(m,29h,h-1h),4.19
–
4.03(m,14h),4.02
–
3.71(m,30h),3.70
–
3.48(m,13h),3.47
–
3.12(m,12h),2.43
–
2.26(m,1h,h-2a(e)),2.03(d,j=11.9hz,1h,h-2a(a)),1.96(s,1h,ac),1.34
–
1.17(m,8h,ch2,och3,och3).
13
c nmr(151mhz,cdcl3)δ170.6,168.4,166.3,165.7,165.3,156.3,139.3,139.1,138.8,138.8,138.7,138.5,138.5,138.4,138.3,138.2,138.1,138.1,137.6,137.3,137.0,136.5,136.4,136.1,136.1,133.4,133.3,133.1,133.1,133.0,132.9,132.8,130.2,130.1,130.0,129.8,129.8,129.7,128.7,128.6,128.5,128.5,128.4,128.4,128.3,128.2,128.2,128.1,128.1,128.0,128.0,127.9,127.9,127.7,127.7,127.6,127.6,127.6,127.5,127.5,127.4,127.3,127.2,127.2,127.0,126.9,126.9,126.8,126.7,126.6,126.4,126.4,126.2,126.1,126.0,125.9,125.8,125.7,125.6,109.9,101.8(c-1c,c-1d,c-1i),101.2(c-1e),99.2,97.8(c-1g),97.4(c-1f),96.7(c-1b,c-1h),82.0,81.8,81.8,81.3,80.4,80.3,78.5,77.6,75.9,75.6,75.4,75.3,75.2,75.1,74.9,74.7,74.3,73.7,73.4,73.2,72.9,72.7,72.7,72.6,72.3,72.1,71.9,71.7,71.7,71.2,71.1,70.9,70.7,70.4,69.0,68.0,67.9,67.6,67.3,65.9,65.5,65.3,63.6,63.5,52.6,50.7,50.3,47.3,46.3,32.1,31.8,29.9,29.5,28.2,27.7,27.0,24.7,23.6,22.8,21.2,14.3;maldi-tof m/z calcd for c
298h303o58
nna[m+na]
+
4846.0683,found 4846.260。
[0158]
化合物48*:糖基供体43*(31.8mg,26μmol)和九糖受体47*(21.0mg,4.4μmol)与甲苯共蒸三次,加入干燥的dcm/et2o(1:3,v/v,1.2ml)和活化的分子筛。溶液在室温下搅
拌30min后冷却至0℃,加入tmsotf(78μl,0.05m in dcm,3.9μmol),反应液在0℃下继续搅拌5小时,用吡啶终止反应。反应液过滤后,加入dcm稀释,而后使用饱和的nahco3洗涤,有机相用无水na2so4干燥后,经减压浓缩。粗产品经硅胶柱层析纯化分离(石油醚/乙酸乙酯,4:1)得到化合物48*(14.4mg,2.4μmol,56%)。1h nmr(600mhz,cdcl3)δ8.08
–
7.94(m,10h,ar),7.88
–
7.63(m,18h,ar),7.59
–
7.35(m,40h,ar),7.30
–
6.78(m,127h,ar),5.68
–
5.60(m,2h,h-1h,h-2b),5.59
–
5.50(m,2h,h-2i,h-1d),5.49(d,j=3.4hz,1h,h-1k),5.41
–
5.26(m,3h,h-1b,h-1c,h-1j),5.20(d,j=20.6hz,3h,arch2),5.14
–
4.86(m,22h,h-1e,h-1f,h-1g),4.83
–
4.48(m,31h),4.48
–
4.36(m,26h),4.24
–
4.05(m,12h),4.03
–
3.68(m,33h),3.67
–
3.09(m,21h),2.28
–
2.22(m,1h,h-2a(e)),1.92(t,j=5.9hz,4h,ac,h-2a(a)),1.63
–
1.46(m,8h),1.36
–
1.14(m,9h).
13
c nmr(151mhz,cdcl3)δ170.5,168.2,166.3,166.1,165.6,165.0,156.8,156.3,139.1,138.8,138.8,138.7,138.6,138.5,138.3,138.1,137.9,137.4,136.5,136.4,136.2,136.1,136.0,133.4,133.3,133.1,133.1,133.0,133.0,132.9,132.9,132.6,131.1,130.4,130.3,130.2,130.0,129.9,129.8,129.7,128.9,128.7,128.6,128.5,128.4,128.3,128.3,128.2,128.2,128.2,128.1,128.0,128.0,127.9,127.9,127.8,127.8,127.7,127.7,127.6,127.5,127.5,127.4,127.3,127.3,127.3,127.2,127.2,127.0,126.9,126.8,126.8,126.7,126.5,126.4,126.4,126.2,126.2,126.1,126.0,125.9,125.8,125.7,125.6,125.2,109.9,102.2(c-1i),101.6(c-1c,c-1d,c-1e),99.0,98.2(c-1f),97.8(c-1g),97.4(c-1j),97.2(c-1h),96(c-1k).7,96.5(c-1b),82.2,82.0,81.8,81.7,81.1,80.6,80.4,80.2,80.0,78.1,77.9,77.6,75.9,75.8,75.6,75.3,75.2,75.2,75.1,74.8,74.1,73.6,73.2,72.9,72.6,72.5,72.3,72.1,72.0,71.9,71.8,71.7,71.3,71.1,70.9,70.6,70.3,69.2,69.1,68.4,68.0,67.5,67.3,65.8,65.5,63.5,52.5,50.7,50.3,47.2,46.3,43.0,42.4,41.0,38.9,36.8,36.1,32.3,32.1,31.7,29.9,29.9,29.8,29.8,29.7,29.6,29.5,29.5,29.4,29.1,28.6,28.2,27.7,27.4,27.0,24.7,24.0,23.6,22.8,21.2,20.9,20.7,17.6,17.4,16.1,14.8,14.3,11.1,8.1;maldi-tof m/z calcd for c
363h363o70
nna[m+na]
+
5878.4768,found 5878.833。
[0159]
化合物1:将化合物48*(10.0mg,2.6μmol)溶于dcm(1.2ml)中,在室温下加入乙硫醇(1.5ml,0.14mmol)和一水合对甲苯磺酸(5.0mg)。反应液在室温下搅拌2个小时,tlc显示原料反应完全后,反应液使用dcm稀释后,使用nahco3洗涤,有机相用无水na2so4干燥后过滤。粗产品经硅胶柱层析纯化分离(石油醚/乙酸乙酯,2:1)得到化合物中间体(8.9mg);将中间体溶于thf/meoh(1.0ml),在室温下加入15%的naoh(10.0μl)水溶液,反应液搅拌1小时后,加入甲醇钠(10mg,0.18mmol),反应液继续在室温下搅拌12小时,反应原料完全小时后,加入ir120(h
+
)树脂中和至ph为7。过滤浓缩后,粗产品经快速硅胶柱层析纯化分离,得到半脱保护产物。半脱保护产物溶于thf/t-butanol/h2o(1:2:1,v/v/v,1.5ml)加入20%pd/c(20mg)。混合物在4个大气压的h2压力下反应24小时,反应液经过滤浓缩,粗产物经hplc纯化,只得到很少量的脱保护十三糖1(2.73mg,51%)。maldi-tof m/z calcd for c
77h132o62
n[m-h]-2062.7207,found 2062.713。
[0160]
对比例1采用[2+3]组装策略合成五糖
[0161]
如图11所示。
[0162]
采用[2+3]合成五糖,首先使用端基位为乙硫基的二糖供体49*(1.2当量)与受体
32*(1.0当量)在nis-tmsotf或nis-agotf的共同催化作用下进行糖基化反应,结果未能得到目标五糖51*。
[0163]
使用更加活泼的三氟亚胺酯基供体50*(1.2当量)与同样的受体32*(1.0当量)在tmsotf的催化条件下进行反应,也只生成得到痕量的五糖。
[0164]
采用c2
′
位ca保护,c7位lev保护的三氟亚胺酯基二糖供体52*(1.2当量),同样与受体32*(1.0当量)在tmsotf的条件下进行偶联反应,也只能通过质谱检测到痕量的五糖。
[0165]
上述反应结果如表1所示。
[0166]
表1
[0167][0168]
通过上述反应我们可以看出,[2+3]组装策略无法有效获得五糖目标物。
[0169]
其中,二糖供体49*通过如下方法获得(图12所示):
[0170]
将糖基供体6**与受体5**在tmsotf的催化作用下进行糖基化反应,以53%的产率得到α-单一构型的二糖49*。
[0171]
三氟亚胺酯基供体50*通过如下方法获得(图13):
[0172]
将硫糖苷49*在nbs条件下脱去端基乙硫基,裸露的端基位羟基在dbu的催化作用下,与氯乙酰苯基三氟亚胺酯反应制备得到二糖供体50*,两步产率为83%。
[0173]
三氟亚胺酯基二糖供体52*通过如下方法获得:
[0174]
将硫糖苷49*在三乙胺条件下脱去fmoc基团,而后利用氯乙酸酐和吡啶条件,在2
″
位羟基使用氯乙酰基保护,两步以45%的产率得到化合物51*。将硫糖苷51*在nbs条件下脱去端基乙硫基,裸露的端基位羟基在dbu的催化作用下,与氯乙酰苯基三氟亚胺酯反应制备得到二糖供体52*,两步产率为85%。
[0175]
对比例2采用[3+8]组装策略合成十一糖
[0176]
如图15所示。
[0177]
采用[3+8]合成五糖,使用三糖供体54*与八糖受体45*在tmsotf的催化作用下进行糖基化反应,反应7h小时候,经薄层层析板或质谱都无法检测到目标产物。
[0178]
可以看出,[3+8]组装策略无法有效进行糖基化反应得到十一糖。本发明通过采用[2+(1+8)]的策略合成得到十一糖48*。
[0179]
其中,三糖供体54*通过如下方法获得(图16):
[0180]
糖基供体7*与糖基受体8**在tmsotf的催化作用下,以et2o和dcm作为共同溶剂进行糖基化反应,得到α-单一构型的二糖55*。使用ddq脱去55中的nap保护基得到二糖受体56*。二糖受体56*与供体7*再次在tmsotf的催化作用下进行糖基化反应,已61%的产率得到三糖57*。在四丁基氟化铵的作用下脱去端机位的tbs保护基,裸露的羟基与氯乙酰苯基三氟亚胺酯反应制备得到二糖供体54*,两步产率为87%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1