一种吡咯并嘧啶化合物及其制备方法、药物组合物和应用
1.本发明属于化药领域,具体涉及一种吡咯并嘧啶化合物及其制备方法、药物组合物和在抑制去泛素化酶usp51中的应用。
背景技术:
2.恶性肿瘤是威胁人类生命安全的重大疾病之一。目前,恶性肿瘤的治疗手段主要有:手术,放射治疗以及化学治疗等。传统抗肿瘤药物由于毒副作用大等缺点阻碍了其在临床的进一步应用。大量研究表明,去泛素化酶通过调节蛋白质相互作用、定位和酶活性,从而影响细胞过程,包括转录、dna损伤信号和dna修复、细胞周期进展、氧化应激、凋亡等,发挥极其重要的生理功能。其与肿瘤发生发展关系之密切。去泛素化酶抑制剂也被发现在多种肿瘤临床前研究中发挥出显著的抗肿瘤作用,已成为新型抗肿瘤药物领域研发热点。
3.上皮-间充质转化(emt)及其逆转过程和间充质-上皮转化(met)在肿瘤转移中发挥关键作用。在emt过程中,上皮细胞失去了与邻近细胞保持密切联系的粘附连接和紧密连接。多种转录因子激活emt可诱导肿瘤细胞的迁移、侵袭和转移。而zeb1作为是一种掌控emt诱导转录因子,它可以促进肿瘤侵袭、转移和治疗耐药性。在多种癌症类型中,zeb1的异常表达与侵袭性行为、高肿瘤指数、耐药、高代谢可塑性和转移有关。例如,在乳腺癌患者中,发现三阴性/基底样乳腺癌乳腺癌的肿瘤细胞中出现zeb1高表达。
4.usp51是一种zeb1(zinc finger e-box binding homeobox 1)的去泛素酶,靶向us p51也可能作为一种靶向促癌转录因子zeb1的替代途径。通过对人类去泛素酶文库筛选发现usp51是一种可以结合、去泛素化和稳定zeb1的泛素化酶。间质样乳腺癌细胞中usp51的缺失会导致了zeb1蛋白和间质标记物的下调,钙黏蛋白-e的上调和细胞侵袭的抑制。相反,usp51在上皮细胞中过表达导致zeb1和间叶细胞标记物上调。此外,usp51能够调控zeb1靶基因的表达。重要的是,usp51在乳腺癌患者中过表达,并与生存不良相关。
5.目前usp家族抑制剂的开发主要针对于热点的usp7、usp1、usp9等靶点。usp51作为较为新颖的去泛素酶对其蛋白酶本身及其抑制剂的研究和报道均较少见。且目前开发的去泛素化酶选择性抑制剂仍存在诸多问题:
①
对于去泛素化酶的相关研究集中在usp家族成员,尤其是usp7,但大多数对其报道的抑制剂表现出的抑制活性较弱,或包含不良的化学特征,或对目前已知的去泛素化酶家族的选择性较差。
②
目前,人们对于去泛素化酶蛋白结构及功能底物的了解不充分、不均衡,对于去泛素化酶与肿瘤发生相关的内在机制仍缺少探索认知。这也导致了目前大多数去泛素化酶的小分子抑制剂存在特异性差等缺陷。此外,原有的抑制剂筛选方法与技术也存在与实际生理环境相容性差、易出现假阳性等缺陷。因此,研究并设计合成出结构新颖的、高抑制活性、高选择性、高稳定性的靶向usp51小分子抑制剂具有重要的科研意义。
技术实现要素:
6.有鉴于此,本发明创造旨在发现骨架新颖、活性和选择性更好的usp51小分子抑制
剂,提出一种吡咯并嘧啶化合物及其制备方法、药物组合物和其在制备防治癌症药物中的应用。
7.为达到上述目的,本发明创造的技术方案是这样实现的:
8.一种如式(i)所示的化合物或其药学上可接受的盐:
[0009][0010]
其中,r1选自芳基、取代芳基、烷基酰胺、芳基酰胺中的任意一种;r2选自h、烷基、卤素、芳基、取代芳基中的任意一种;r3选自h、烷基、芳基、取代芳基结构中的任意一种;x选自ch2、o、nh中的一种。
[0011]
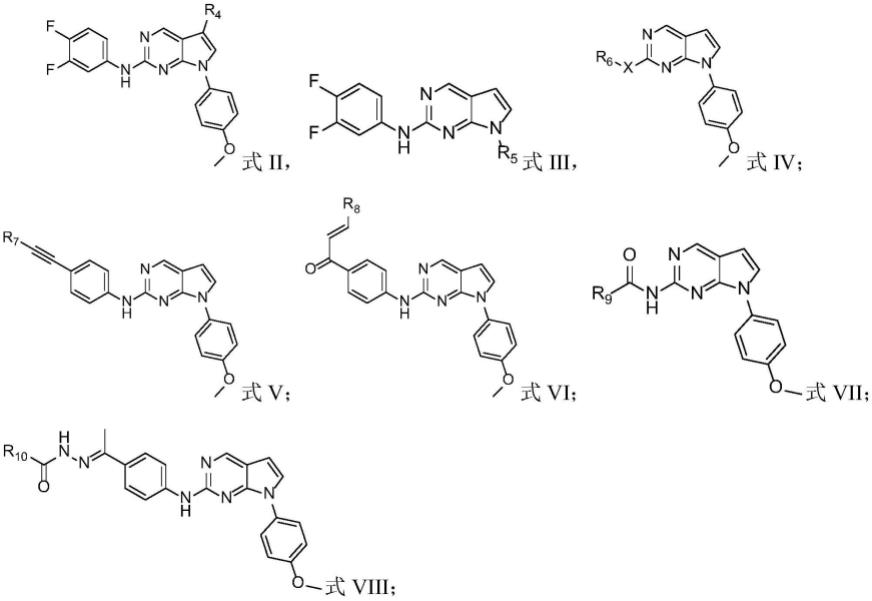
优选的,上述化合物的结构如式ii、式iii、式iv、式v、式vi、式vii或式viii所示:
[0012][0013]
其中,r4的结构为化合物1-4中的一种:
[0014][0015]
r5的结构为化合物5-8中的一种:
[0016][0017]
r6为nh或o;当r6为o时,x的结构为化合物41:
[0018][0019]
当r6为nh时,x的结构为化合物9-40及42-46中的一种:
[0020]
[0021]
[0022][0023]
r7的结构为化合物49-54中的一种:
[0024][0025]
r8的结构为化合物55-58中的一种:
[0026][0027]
r9的结构为化合物59-60中的一种:
[0028][0029]r10
的结构为化合物61-62中的一种:
[0030][0031]
本发明还提供了上述化合物或其药学上可接受的盐的制备方法,其制备路线为路线一、路线二、路线三、路线四、路线五、路线六、路线七或路线八;
[0032]
路线一:
[0033][0034]
路线二:
[0035][0036]
路线三:
[0037][0038]
路线四:
[0039][0040]
路线五:
[0041]
[0042]
路线六:
[0043][0044]
路线七:
[0045][0046]
路线八:
[0047][0048]
优选地,各路线中所述cat.(催化剂)取自pd2(dba)3、pd(oac)2、pd(pph3)4、pd(pph3)2cl2、pd(dppf)cl2、cui、cubr、cucl中的一种;ligand(配体)取自brettphos、xphos、sp hos、xantphos、ruphos、pph3、trans-cyclohexane-1,2-diamine中的一种;base(碱)取自k3po4、k2co3、cs2co3、ko
t
bu、na2co3中的一种;sol.(溶剂)取自dioxane、h2o、thf、dmf、dmso、dcm、mecn、toluene中的一种或两种。
[0049]
上述化合物或其药学上可接受的盐可用于制备抑制去泛素化酶usp51药物,以及用于制备预防和/或治疗与去泛素化酶usp51相关的癌症的药物中。
[0050]
上述癌症包括:妇科癌类,例如:卵巢癌、子宫颈癌、阴道癌、阴部癌、子宫/子宫内膜癌、妊娠滋养细胞肿瘤、输卵管癌、子宫肉瘤;内分泌癌类,例如:肾上腺皮质癌、脑垂体癌、胰癌、甲状腺癌、副甲状腺癌、胸腺癌、多发性内分泌肿瘤;骨癌类,例如:骨肉瘤、尤因肉瘤、软骨肉瘤等;肺癌类,例如:小细胞肺癌、非小细胞肺癌;脑和cns肿瘤,例如:神经母细胞瘤、听神经瘤、神经胶瘤和其他脑肿瘤,脊髓肿瘤、乳癌、结肠直肠癌、晚期结肠直肠腺癌;胃肠癌类,例如:肝癌、肝外胆管癌、胃肠类癌性肿瘤、胆囊癌、胃癌、食道癌、小肠癌;泌尿生殖器癌类,例如:阴茎癌、翠丸癌、前列腺癌;头和颈部肿瘤类,例如:鼻癌、鼻窦癌、鼻咽癌、口腔癌、唇癌、唾腺癌、喉头癌、下咽癌、正咽癌;血癌类,例如:急性骨髓性白血病、急性淋巴性白血病、儿童白血病、慢性淋巴性白血病、慢性骨髓性白血病、发状细胞性白血病、急性早幼粒细胞白血病、血浆细胞性白血病;骨髓癌血液病症,例如:骨髓分化不良症候群、骨髓增生性病症、范禾尼贫血、再生障碍性贫血、特发性巨球蛋白血症;淋巴癌类,例如:霍奇金病、非霍奇金氏淋巴瘤、周围t-细胞林巴瘤、皮肤型t-细胞淋巴瘤、aids相关性淋巴瘤;眼癌类,包括:视网膜母细胞瘤、葡萄膜黑色素瘤;皮肤癌类,例如:黑色素瘤、非黑色素瘤皮肤癌、梅克尔细胞癌;软组织肉瘤类,例如:卡波希肉瘤、儿童软组织肉瘤、成人软组织肉瘤、泌尿系统癌症,例如:肾癌维尔姆斯肿瘤、膀肤癌、尿道癌和转移性细胞癌。优选用于乳腺癌、结直肠
癌、卵巢癌、前列腺癌、肺癌的治疗。
[0051]
本发明还提供了一种包括上述化合物或其药学上可接受的盐的药物组合物,该药物组合物还可以包括一种或多种药学上可接受的赋形剂。该药物组合物的剂型为药学上可接受的任一剂型。
[0052]
本发明的有益效果为:相对于现有技术,本发明的化合物或其在药学上可接受的盐具有高效的抑制去泛素化酶usp51的效果,为拓宽对usp家族的认知、去泛素化酶usp51参与蛋白去泛素化的过程相关机制研究以及新型抗肿瘤小分子药物的开发提供了新的视野和思路。
具体实施方式
[0053]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整的描述,以充分地理解本发明的目的、方案和效果。需要说明的是,除有定义外,以下实施例中所用的技术术语具有与本发明创造所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
[0054]
实施例1:化合物1的制备
[0055]
化合物s1、s2、s3、s5-1,s6-1和1的结构如下所示:
[0056][0057]
1)化合物s2的制备:
[0058]
在冰浴和氩气保护的环境下,将化合物s1(3g,19.53mmol)溶解在乙腈(100ml)中,加入n-碘代丁二酰亚胺(5.28g),5分钟后撤去冰浴,室温搅拌。2小时后,将瓶内的液体用旋转蒸发仪浓缩,用饱和nacl溶液洗反应液,乙酸乙酯萃取(3
×
150ml),有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=5:1至3:1)得化合物s2(白色固体,4.50g,产率:72%)。
[0059]
2)化合物s3的制备:
[0060]
在冰浴和氩气保护的环境下,将化合物s2(4g,15.21mmol)溶解在四氢呋喃(130ml)中,加入二碳酸二叔丁酯(3.40g,18.56mmol),三乙胺(1.42g,16.42mmol)和n,n-二甲基哌啶(135mg,1.08mmol)。5分钟后撤去冰浴,室温搅拌。3小时后,将瓶内的液体用旋转蒸发仪浓缩,用饱和nacl溶液洗反应液,乙酸乙酯萃取(3
×
100ml),有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=6:1至4:1)得化合物s3(白色固体,5.87g,产率:75%)。
[0061]
3)化合物s5-1的制备:
[0062]
将化合物s3(600mg,1.6mmol)溶解于(二氧六环:水=2:1)(12ml)中,在冰浴下,加入3,4二甲氧基苯硼酸(298mg,1.74mmol)和[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(118mg,催化量),碳酸钾(444mg,3.20mmol)。5分钟后撤去冰浴,转至油浴升温至80℃加热。3小时后,将瓶内的液体用旋转蒸发仪浓缩。用饱和nacl溶液洗反应液,乙酸乙酯萃取(3
×
150ml),有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(二氯甲烷:甲醇=60:1至40:1)得化合物s4-1。在冰浴和氩气保护条件下,将化合物s4-1重新溶解在二氯甲烷(5ml)中,并加入三氟乙酸(5ml),5分钟后撤去冰浴,在室温中搅拌1小时后,将瓶内的液体用旋转蒸发仪浓缩,用饱和碳酸氢钠溶液洗反应液,乙酸乙酯萃取(3
×
50ml),有机相使用无水硫酸钠进行干燥,浓缩,将得到脱保护基产物s5-1(白色固体,356mg,产率:67%)。
[0063]
4)化合物s6-1的制备:
[0064]
将化合物s5-1(300mg,1.03mmol)溶解在1,4-二氧六环(5ml)中,加入4-碘苯甲醚(294mg,0.49mmol),加入碘化亚铜固体(18mg,0.08mmol,催化量),加入反式-1,2-环己二胺(120mg,0.70mmol)和磷酸钾(500mg,3.01mmol)。放入油浴中,加热至110℃,回流3小时后,用硅藻土过滤,将瓶内的液体用旋转蒸发仪浓缩将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=5:1至3:1)得化合物s6-1(白色固体,310mg,产率:70%)。
[0065]
5)化合物1的制备:
[0066]
将化合物s6-1(100mg,0.26mmol)溶解在1,4-二氧六环(2ml)中,加入3,4-二氟苯胺(45mg,0.34mmol),加入醋酸钯(3mg,0.01mmol),加入1,1'-联萘-2,2'-双二苯膦(15mg,0.02mmol)和碳酸铯(130mg,0.35mmol)。放入油浴中,加热至110℃,回流8小时后,用硅藻土过滤,将瓶内的液体用旋转蒸发仪浓缩将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=4:1至1:1)得化合物1(白色固体,109mg,产率:65%)。对化合物1进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.97(s,1h),8.09(s,1h),7.68(d,j=8.9hz,2h),7.35(s,1h),7.22(d,j=8.5hz,2h),7.15(s,1h),7.09(d,j=9.0hz,2h),7.05(d,j=6.5hz,2h),7.01(s,1h),3.95(s,6h),3.90(s,3h).
13
c nmr(100mhz,cdcl3)δ214.0,213.8,158.5,155.9,154.8,154.0,152.0,150.6,149.5,148.4,130.4,128.9,128.5,126.4,125.1,125.1,122.3,119.4,116.8,114.6,114.6,111.9,110.3,107.7,56.1,56.1,55.6.hrms(esi)calculated for c
27h23
f2n4o
3+
[m+h]
+
:489.1733,found:489.1750.
[0067]
实施例2:化合物2的制备
[0068]
化合物2的结构如下所示:
[0069][0070]
使用4-甲氧基苯硼酸按照化合物1的合成步骤获得化合物2(白色固体,242mg,产率:61%)。对化合物2进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.97(s,
1h),8.09(s,1h),7.68(d,j=8.9hz,2h),7.35(s,1h),7.22(d,j=8.5hz,2h),7.15(s,1h),7.09(d,j=9.0hz,2h),7.05(d,j=6.5hz,2h),7.01(s,1h),3.95(s,6h),3.90(s,3h).
13
c nmr(100mhz,cdcl3)δ214.0,213.8,158.5,155.9,154.8,154.0,152.0,150.6,149.5,148.4,130.4,128.9,128.5,126.4,125.1,125.1,122.3,119.4,116.8,114.6,114.6,111.9,110.3,107.7,56.1,56.1,55.6.hrms(esi)calculated for c
27h23
f2n4o
3+
[m+h]
+
:489.1733,found:489.1750.
[0071]
实施例3:化合物3的制备
[0072]
化合物s5-2和3的结构如下所示:
[0073][0074]
1)化合物s5-3的制备:
[0075]
将化合物s3(500mg,1.30mmol)溶解于(二氧六环:水=2:1)(10ml)中,在冰浴下,加入3,5-二甲氧基苯乙炔(260mg,1.50mmol)和[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(103mg,催化量),碳酸钾(350mg,2.70mmol)。5分钟后撤去冰浴,转至油浴升温至80℃加热。3小时后,将瓶内的液体用旋转蒸发仪浓缩。用饱和nacl溶液洗反应液,乙酸乙酯萃取(3
×
150ml),有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(二氯甲烷:甲醇=60:1至40:1)得化合物s5-2(白色固体,580mg,产率:63%)。
[0076]
2)化合物3的制备:
[0077]
使用化合物s5-2按照化合物s6-1的合成步骤获得化合物s6-3,使用化合物s6-3按照实施例1所述化合物1的合成步骤获得化合物3(白色固体,242mg,产率:61%)。对化合物3进行检测,其检测结果如下:1h nmr(400mhz,dmso-d6)δ9.76(s,1h),9.56(s,1h),8.85(s,1h),8.17(s,2h),7.74(d,j=8.1hz,2h),7.64(d,j=3.3hz,3h),7.40(d,j=3.3hz,1h),7.30(d,j=9.8hz,1h),6.68(d,j=3.7hz,1h),3.33(s,3h),1.51(d,j=9.8hz,7h).
13
c nmr(100mhz,dmso-d6)δ156.0,153.3,151.7,151.2,151.2,150.6,138.5,138.2,134.4,133.6,131.9,131.9,131.5,127.1,124.2,124.2,123.1,119.0,119.0,118.9,113.6,113.6,107.2,101.9,101.9,79.7,31.6,28.6,28.6.hrms(esi)calculated for c
29h23
f2n4o
3+
[m+h]
+
:513.1733,found:513.1745.
[0078]
实施例4:化合物4的制备
[0079]
化合物s6-4和4的结构如下所示:
[0080][0081]
1)化合物s6-4的制备:
[0082]
使用化合物s3按照化合物6-1的合成步骤获得化合物s6-4。
[0083]
2)化合物4的制备:
[0084]
使用化合物s6-4按照化合物1的合成步骤获得化合物4(白色固体,142mg,产率:57%)。
[0085]
实施例5:化合物5的制备
[0086]
化合物s7-5和5的结构如下所示:
[0087][0088]
1)化合物s7-5的制备:
[0089]
在冰浴和氩气保护的环境下,将化合物s1(150mg,0.97mmol)溶解在四氢呋喃(9ml)中,加入4-甲氧基苄醇(203mg,1.47mmol),偶氮二甲酸二异丙酯(237mg,1.47mmol)和三苯基膦(384mg,1.47mmol)。5分钟后撤去冰浴,室温搅拌。5小时后,将瓶内的液体用旋转蒸发仪浓缩,用饱和nacl溶液洗反应液,乙酸乙酯萃取(3
×
100ml),有机相使用无水硫酸钠进行干燥,浓缩,将得到的粗品用硅胶柱层析进行纯化(二氯甲烷:甲醇=50:1至30:1)得化合物s7-5(白色固体,160mg,产率:75%)。
[0090]
2)化合物5的制备:
[0091]
具体制备方法为:将化合物s7-5(130mg,0.41mmol)溶解在1,4-二氧六环(4ml)中,加入3,4-二氟苯胺(80mg,0.62mmol),加入醋酸钯(6mg,0.02mmol),加入1,1'-联萘-2,2'-双二苯膦(35mg,0.02mmol)和碳酸铯(260mg,0.73mmol)。放入油浴中,加热至110℃,回流8小时后,用硅藻土过滤,将瓶内的液体用旋转蒸发仪浓缩将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=4:1至1:1)得化合物5(白色固体,40mg,产率:31%)。对化合物5进行检测,其检测结果如下:1h nmr(400mhz,methanol-d4)δ8.18(s,1h),7.57(s,1h),6.90(d,j=8.3hz,1h),6.82(d,j=8.3hz,3h),6.71(q,j=5.7,4.3hz,1h),6.49
–
6.39(m,3h),6.01(s,1h),4.51(s,3h),4.10(s,1h),2.90(s,1h).
13
c nmr(100mhz,methanol-d4)δ159.32,159.11,155.44,151.50,149.92,133.26,129.49,129.21,128.57,128.23,126.78,116.21,113.81,113.44,106.83,99.69,63.52,54.24.hrms(esi)calculated for c
20h17
f2n4o
+
[m+h]
+
:367.1365,found:367.1389.
[0092]
实施例6:化合物6-7的制备
[0093]
化合物6-7的结构如下所示:
[0094][0095]
(1)化合物6的制备:使用对甲氧基苯乙醇按照化合物5的合成步骤获得化合物6(白色固体,60mg,产率:40%)。对化合物6进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.62(s,1h),8.13(s,1h),7.12(d,j=33.4hz,4h),6.83(s,3h),6.37(s,
1h),5.30(s,1h),4.35(d,j=14.7hz,2h),3.77(s,3h),3.09(d,j=14.7hz,2h).
13
c nmr(100mhz,cdcl3)δ158.5,151.6,150.0,150.0,130.2,129.8,129.8,126.8,116.8,114.1,114.1,114.1,113.8,113.6,113.2,107.7,107.5,99.8,55.3,46.6,35.7.hrms(esi)calculated for c
21h19
f2n4o
+
[m+h]
+
:281.1521,found:381.1537.
[0096]
(2)化合物7的制备:使用四氢-2h-吡喃-4-醇按照化合物5的合成步骤获得化合物7(白色固体,57mg,产率:47%)。对化合物7进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.63(s,1h),8.04(s,1h),7.43(s,1h),7.15-7.03(m,3h),6.44(s,1h),4.83(s,1h),4.18(d,j=14.0hz,2h),3.64(d,j=14.0hz,2h),2.22-1.96(m,4h).
13
c nmr(100mhz,cdcl3)δ155.2,151.3,150.6,137.3,137.2,123.1,117.0,116.9,113.6,107.7,107.5,100.3,67.3,67.3,50.8,32.9,32.9.hrms(esi)calculated for c
17h16
f2n3o
+
[m+h]
+
:316.1256,found:316.1267.
[0097]
实施例7:化合物8的制备
[0098]
化合物s8、s9和8的结构如下所示:
[0099][0100]
1)化合物s8的制备:
[0101]
使用叔丁基(4-碘苯基)氨基甲酸酯按照化合物s6-1的合成步骤获得化合物s8。
[0102]
2)化合物s9的制备:
[0103]
使用化合物s8按照化合物1的合成步骤获得化合物s9。
[0104]
3)化合物8的制备:
[0105]
在冰浴和氩气保护的环境下,将化合物s9(250mg)溶解在二氯甲烷(5ml)中,加入适量三氟乙酸(5ml)。5分钟后撤去冰浴,室温搅拌。1小时后,将瓶内的液体用旋转蒸发仪浓缩,用饱和碳酸氢钠溶液洗反应液,乙酸乙酯萃取(3
×
50ml),有机相使用无水硫酸钠进行干燥,浓缩,将得到脱保护基化合物粗品。将粗品溶解在dmf(3ml)中,加入碳酸钾(170mg,0.86mmol)、ki(10mg,0.07mmol,催化量),加热至60℃搅拌3小时后,加水(10ml)淬灭反应,用乙酸乙酯(20ml)萃取三次,合并有机相,浓缩后柱层纯化(石油醚:乙酸乙酯=3:至1:1)得化合物8(白色固体,158mg,产率:57%)。
[0106]
实施例8:化合物9的制备
[0107]
化合物s11和9的结构如下所示:
[0108][0109]
1)化合物s11的制备:
[0110]
使用4-碘苯甲醚(294mg,0.49mmol)按照化合物s6-1的合成步骤获得化合物s11。
[0111]
2)化合物9的制备:
[0112]
将化合物s11(150mg,0.58mmol)溶解在1,4-二氧六环(6ml)中,加入4-甲基苯胺(93mg,0.87mmol),加入醋酸钯(6.5mg,0.03mmol),加入1,1'-联萘-2,2'-双二苯膦(36mg,0.06mmol)和碳酸铯(282mg,0.87mmol)。放入油浴中,加热至110℃,回流8小时后,用硅藻土过滤,将瓶内的液体用旋转蒸发仪浓缩将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=4:1至2:1)得化合物9(白色固体,162mg,产率:63%)。对化合物9进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.69(s,1h),7.67(d,j=14.3hz,2h),7.61-7.54(m,2h),7.43(s,1h),7.16(s,1h),7.10(d,j=11.5hz,2h),7.01(s,2h),6.52(s,1h),3.85(d,j=14.3hz,3h),2.31(s,3h).
13
c nmr(100mhz,cdcl3)δ158.1,156.4,151.8,151.0,137.9,131.0,130.9,129.3,129.3,125.8,124.9,124.9,118.6,118.6,114.4,114.4,113.2,101.3,55.6,20.8.hrms(esi)calculated for c
20h19
n4o
+
[m+h]
+
:331.1553,found:331.1552.
[0113]
实施例9:化合物10-46的制备
[0114]
化合物10-46的结构如下所示:
[0115]
[0116]
[0117][0118]
(1)化合物10的制备:使用4-二甲胺基苯胺按照化合物9的合成步骤获得化合物10。对化合物10进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.58(s,1h),7.60(d,j=9.0hz,2h),7.46(d,j=9.0hz,2h),7.19(s,1h),7.08(s,1h),6.96(d,j=9.0hz,2h),6.69(d,j=6.9hz,2h),6.44(s,1h),3.90-3.66(m,3h),2.84(s,6h).
13
c nmr(100mhz,cdcl3)δ156.9,155.9,151.0,149.9,145.7,130.0,129.8,124.5,123.8,123.6,120.0,119.6,113.4,113.3,112.8,112.8,111.9,100.2,54.6,40.4,28.7.hrms(esi)calculated for c
21h22
n5o
+
[m+h]
+
:360.1819,found:360.1820.
[0119]
(2)化合物11的制备:使用3,4-亚甲二氧基苯胺按照化合物9的合成步骤获得化合物11。对化合物11进行检测,其检测结果如下:1h nmr(400mhz,dmso-d6)δ8.80(s,1h),7.77(s,2h),7.63(s,1h),7.37(s,1h),7.31(s,1h),7.15(d,j=10.2hz,2h),7.01(s,1h),6.86(s,1h),6.67(s,1h),6.01(s,2h),4.04(s,3h).
13
c nmr(100mhz,dmso-d6)δ153.4,151.6,146.2,143.0,137.6,130.2,126.1,121.2,120.2,119.3,110.2,109.7,108.5,106.7,103.7,97.3,97.0,96.4,50.9,25.0.hrms(esi)calculated for c
20h17
n4o
3+
[m+h]
+
:361.1295,found:361.1294.
[0120]
(3)化合物12的制备:使用苯胺按照化合物9的合成步骤获得化合物12。对化合物12进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.73(s,1h),7.69(s,2h),7.68
–
7.63(m,2h),7.46(s,1h),7.32(s,2h),7.20(s,1h),7.05-7.01(m,2h),6.98(s,1h),
6.53(s,1h),3.87(s,3h).
13
c nmr(100mhz,cdcl3)δ158.1,156.2,151.7,151.0,140.4,130.9,128.8,128.8,126.0,124.9,124.9,121.5,118.4,118.4,114.4,114.4,113.4,101.3,55.6.hrms(esi)calculated for c
19h17
n4o
+
[m+h]
+
:317.1397,found:317.1398.
[0121]
(4)化合物13的制备:使用喹啉-8-胺按照化合物9的合成步骤获得化合物13。对化合物13进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ9.88(s,1h),8.95(s,1h),8.82(s,2h),8.14(s,1h),7.73(d,j=3.3hz,2h),7.51(s,1h),7.41(s,1h),7.34(s,1h),7.24(s,1h),7.07(s,2h),6.61(s,1h),3.89(d,j=34.5hz,3h).
13
c nmr(100mhz,cdcl3)δ158.2,156.0,151.7,151.0,147.6,138.6,136.8,136.1,131.0,128.2,127.5,126.2,125.1,125.1,121.4,118.3,114.4,114.4,113.4,113.4,101.3,55.6.hrms(esi)calculated for c
22h18
n5o
+
[m+h]
+
:368.1506,found:368.1530.
[0122]
(5)化合物14的制备:使用(z)-4-(苯基二氮烯基)苯胺按照化合物9的合成步骤获得化合物14。对化合物14进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.76(s,1h),7.97-7.82(m,6h),7.67(d,j=2.7hz,2h),7.54(s,2h),7.45(d,j=24.5hz,2h),7.25(d,j=1.1hz,2h),7.09(s,2h),6.59(s,1h),3.91(s,3h).
13
c nmr(100mhz,cdcl3)δ158.4,155.5,152.9,151.4,151.0,147.1,143.3,130.7,130.2,129.0,129.0,126.7,125.1,125.1,124.3,124.3,122.5,122.5,117.8,117.8,114.5,114.5,113.9,101.4,55.7.hrms(esi)calculated for c
25h21
n6o
+
[m+h]
+
:421.1771,found:421.1769.
[0123]
(6)化合物15的制备:使用3,5-双三氟甲基苯胺按照化合物9的合成步骤获得化合物15。对化合物15进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.77(s,1h),8.21(d,j=12.3hz,3h),7.59(d,j=9.0hz,2h),7.45(s,1h),7.27(s,1h),7.06(d,j=8.9hz,2h),6.60(s,1h),3.89(s,3h).
13
c nmr(100mhz,chloroform-d)δ158.45,155.14,151.14,151.08,141.71,132.13,131.80,130.32,127.22,127.22,125.02,125.02,124.82,122.12,117.42,114.76,114.76,114.32,114.16,101.35,55.58.hrms(esi)calculated for c
21h15
f6n4o
+
[m+h]
+
:453.1145,found:453.1151.
[0124]
(7)化合物16的制备:使用9-乙基-9h-咔唑-4-胺按照化合物9的合成步骤获得化合物16。对化合物16进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.72(s,1h),8.63(s,1h),7.88(s,1h),7.67(d,j=8.9hz,2h),7.37(s,1h),7.35(s,1h),7.32(s,1h),7.24(s,1h),7.18(s,1h),7.12(d,j=5.1hz,2h),6.99(d,j=8.9hz,2h),6.48(s,1h),4.29(d,j=7.1hz,2h),3.80(s,3h),1.35(t,j=7.2hz,3h).
13
c nmr(100mhz,cdcl3)δ171.2,158.1,156.9,151.1,140.4,135.9,132.5,130.9,128.8,125.6,125.5,125.0,124.4,123.1,120.7,118.6,118.2,114.9,114.5,112.9,110.9,109.0,108.4,101.3,60.4,59.6,55.6.hrms(esi)calculated for c
27h24
n5o
+
[m+h]
+
:434.1975,found:434.1971.
[0125]
(8)化合物17的制备:使用3,4-二氟苯胺按照化合物9的合成步骤获得化合物17。对化合物17进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.79(s,1h),8.41(s,1h),7.72(d,j=8.8hz,2h),7.37(s,2h),7.33(s,2h),7.17(d,j=9.8hz,2h),6.65(s,1h),3.96(s,3h).
13
c nmr(100mhz,cdcl3)δ158.3,155.2,151.1,149.1,139.8,132.6,130.5,130.1,129.8,126.6,124.9,124.9,119.5,117.5,114.7,114.7,113.5,101.4,55.6.hrms(esi)calculated for c
19h15
cl2n4o
+
[m+h]
+
:385.0617,found:385.0625.
[0126]
(9)化合物18的制备:使用3,4-二甲氧基苯胺按照化合物9的合成步骤获得化合物
18。对化合物18进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.73(s,1h),7.61(s,1h),7.59(s,2h),7.16(s,1h),7.00(d,j=8.8hz,2h),6.96(s,2h),6.53(s,1h),6.11(s,1h),3.85(s,3h),3.68(s,6h).
13
c nmr(100mhz,cdcl3)δ161.0,158.3,156.2,151.7,150.9,142.2,142.1,130.8,126.5,125.5,125.4,114.4,114.4,113.3,101.2,96.5,96.4,94.2,94.2,55.6,55.3,55.3.hrms(esi)calculated for c
21h21
n4o
3+
[m+h]
+
:377.1608,found:377.1623.
[0127]
(10)化合物19的制备:使用二苯并[b,d]呋喃-3-胺按照化合物9的合成步骤获得化合物19。对化合物19进行检测,其检测结果如下:1h nmr(400mhz,dmso-d6)δ9.91(s,1h),8.85(s,1h),8.52(s,1h),7.97(d,j=28.5hz,2h),7.82(d,j=8.5hz,2h),7.68(s,1h),7.62(s,2h),7.38(s,1h),7.32(s,1h),7.17(s,2h),6.68(s,1h),3.87(d,j=20.0hz,3h).
13
c nmr(100mhz,dmso)δ158.2,157.0,156.3,155.9,153.1,151.7,151.4,141.8,130.9,128.9,127.2,126.3,125.4,124.6,123.4,121.1,120.5,114.9,114.8,113.4,111.7,101.8,100.9,100.5,56.0.hrms(esi)calculated for c
25h19
n4o
2+
[m+h]
+
:407.1503,found:407.1516.
[0128]
(11)化合物20的制备:使用苯并[d]噻唑-5-胺按照化合物9的合成步骤获得化合物20。对化合物20进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.77(s,1h),8.21(s,3h),7.59(d,j=15.7hz,2h),7.42(s,1h),7.28(s,1h),7.07(s,2h),6.60(s,1h),4.07-3.78(m,3h).
13
c nmr(100mhz,cdcl3)δ158.2,156.1,154.5,154.4,151.7,151.0,139.2,130.7,126.3,124.9,124.9,121.5,118.2,114.6,114.6,113.8,112.6,101.3,55.6.hrms(esi)calculated for c
20h16
n5os
+
[m+h]
+
:374.1070,found:374.1070.
[0129]
(12)化合物21的制备:使用3,4-二氯苯胺按照化合物9的合成步骤获得化合物21。对化合物21进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.72(d,j=1.2hz,1h),8.26-7.84(m,1h),7.64(dd,j=9.4,2.8hz,2h),7.31(s,1h),7.24(dd,j=3.8,1.2hz,1h),7.09-6.99(m,4h),6.57(dd,j=3.6,1.2hz,1h),3.89(d,j=1.1hz,3h).
13
c nmr(100mhz,cdcl3)δ158.4,155.6,151.4,151.0,130.6,126.4,125.0,125.0,116.9,116.9,116.8,114.5,114.5,113.7,113.5,107.8,107.5,101.3,55.6.hrms(esi)calculated for c
19h15
cl2n4o
+
[m+h]
+
:385.0617,found:385.0655.
[0130]
(13)化合物22的制备:使用4-炔基苯胺按照化合物9的合成步骤获得化合物22。对化合物22进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.66(s,1h),7.70-7.54(m,4h),7.35(d,j=13.3hz,2h),7.18(d,j=10.8hz,2h),7.01(d,j=15.7hz,2h),6.50(s,1h),3.83(s,3h),2.96(s,1h).
13
c nmr(100mhz,cdcl3)δ158.3,155.6,151.5,151.0,140.9,133.1,132.9,130.7,126.5,125.3,125.0,117.8,117.7,114.6,114.4,114.3,113.7,101.3,84.2,75.8,55.6.hrms(esi)calculated for c
21h17
n4o
+
[m+h
+
:441.1397,found:441.1390.
[0131]
(14)化合物23的制备:使用3,4,5-三甲氧基苯胺按照化合物9的合成步骤获得化合物23。对化合物23进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.71(s,1h),7.56(d,j=21.6hz,2h),7.15(d,j=15.4hz,2h),6.98(s,4h),6.55(s,1h),3.88(s,3h),3.76(d,j=34.0hz,10h).
13
c nmr(100mhz,cdcl3)δ161.0,158.3,156.2,151.7,150.9,142.2,142.1,130.8,126.5,125.5,125.4,114.4,114.4,113.3,101.2,96.5,96.4,94.2,
94.2,55.6,55.3,55.3.hrms(esi)calculated for c
22h23
n4o
4+
[m+h]
+
:407.1714,found:407.1721.
[0132]
(15)化合物24的制备:使用3-苯氧基苯胺按照化合物9的合成步骤获得化合物24。对化合物24进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.71(s,1h),7.75-7.60(m,4h),7.35-7.28(m,2h),7.24(s,1h),7.20(d,j=3.7hz,1h),7.08-6.95(m,7h),6.55(d,j=3.7hz,1h),3.86(s,3h).
13
c nmr(100mhz,cdcl3)δ158.4,158.2,156.2,151.7,151.0,136.4,136.4,130.8,129.6,129.6,126.1,125.0,125.0,122.5,120.2,119.9,119.9,117.8,117.8,114.4,114.4,113.4,101.3,55.6.hrms(esi)calculated for c
25h21
n4o
2+
[m+h]
+
:409.1659,found:409.1665.
[0133]
(16)化合物25的制备:使用五氟苯胺按照化合物9的合成步骤获得化合物25。对化合物25进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.68(s,1h),7.54(d,j=23.6hz,2h),7.23(d,j=18.0hz,2h),6.98(d,j=13.9hz,2h),6.60(s,1h),3.96-3.78(m,3h).
13
c nmr(100mhz,cdcl3)δ158.2,155.5,151.6,151.6,150.9,150.9,130.3,130.3,126.9,126.9,124.8,124.8,114.5,114.3,114.3,114.3,101.3,101.3,55.6.hrm s(esi)calculated for c
19h11
f5n4o
+
[m+h]
+
:406.0853,found:406.0866.
[0134]
(17)化合物26的制备:使用2,3,4-三氟苯胺按照化合物9的合成步骤获得化合物26。对化合物26进行检测,其检测结果如下:1h nmr(400mhz,dmso-d6)δ9.17(s,1h),8.77(s,1h),7.70(d,j=8.9hz,2h),7.60(d,j=14.4hz,2h),7.27(s,1h),7.06(d,j=8.9hz,2h),6.65(s,1h),3.81(s,3h).
13
c nmr(100mhz,dmso)δ158.0,156.5,151.6,151.5,130.8,127.2,127.0,126.9,125.0,125.0,114.7,114.7,113.9,111.8,111.8,111.6,111.6,101.7,55.9.hrms(esi)calculated for c
19h14
f3n4o
+
[m+h]
+
:371.1114,found:371.1119.
[0135]
(18)化合物27的制备:使用4-三氟甲基苯胺按照化合物9的合成步骤获得化合物27。对化合物27进行检测,其检测结果如下:1h nmr(400mhz,dmso-d6)δ9.98(s,1h),8.88(s,1h),8.06(s,2h),7.75(d,j=12.0hz,2h),7.60(d,j=24.0hz,3h),7.17(d,j=3.5hz,2h),6.72(s,1h),3.85(s,3h).
13
c nmr(100mhz,dmso)δ158.3,155.9,151.6,151.2,145.2,130.7,127.7,126.6,126.2,126.2,126.2,125.4,123.9,120.8,120.5,117.9,115.0,113.9,101.7,56.0.hrms(esi)calculated for c
20h16
f3n4o
+
[m+h]
+
:385.1271,found:385.1283.
[0136]
(19)化合物28的制备:使用3-氯甲基苯胺按照化合物9的合成步骤获得化合物28。对化合物28进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.84(s,1h),8.60(s,1h),8.49(s,1h),7.70(s,1h),7.59(s,1h),7.54(s,2h),7.08(s,2h),6.96(s,2h),6.44(s,1h),3.75(s,3h).
13
c nmr(100mhz,cdcl3)δ158.2,155.6,151.4,151.0,141.5,134.6,130.6,129.6,126.4,124.8,124.8,121.3,118.1,116.2,114.6,114.6,113.7,101.4,55.6.hrms(esi)calculated for c
19h16
cln4o
+
[m+h]
+
:351.1107,found:351.1112.
[0137]
(20)化合物29的制备:使用3,4,5-三氟苯胺按照化合物9的合成步骤获得化合物29。对化合物29进行检测,其检测结果如下:1h nmr(400mhz,dmso-d6)δ9.93(s,1h),8.86(s,1h),7.80(d,j=6.5hz,1h),7.78-7.69(m,2h),7.63(s,1h),7.13(d,j=4.6hz,2h),6.69(s,1h),3.84(s,3h).
13
c nmr(100mhz,dmso)δ171.5,167.7,158.3,158.0,155.7,151.8,151.1,130.6,127.9,127.8,125.6,124.4,115.7,114.9,113.8,113.3,102.2,102.0,
101.8,55.9.hrms(esi)calculated for c
19h14
f3n4o
+
[m+h]
+
:371.1114,found:371.1122.
[0138]
(21)化合物30的制备:使用3,-甲氧基苯胺按照化合物9的合成步骤获得化合物30。对化合物30进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.72(s,1h),7.7-7.57(m,3h),7.34(s,1h),7.17(d,j=4.8hz,2h),7.04(d,j=5.9hz,3h),6.53(d,j=14.4hz,2h),3.90(s,3h),3.71(d,j=19.1hz,3h).
13
c nmr(100mhz,cdcl3)δ160.2,158.2,156.1,151.7,150.9,141.7,130.8,129.4,126.3,125.3,125.3,114.4,114.4,113.3,110.7,107.3,103.9,101.0,54.9,29.9.hrms(esi)calculated for c
20h19
n4o
2+
[m+h]
+
:347.1503,found:347.1521.
[0139]
(22)化合物31的制备:使用3-甲基-4-氟苯胺按照化合物9的合成步骤获得化合物31。对化合物31进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.70(s,1h),8.33(s,1h),7.59(s,2h),7.36(s,1h),7.25(s,1h),7.21(s,1h),7.05-6.95(m,3h),6.55(s,1h),3.90(d,j=9.2hz,3h),2.41(d,j=1.5hz,3h).13c nmr(100mhz,cdcl3)δ158.2,156.4,151.7,151.0,139.7,130.7,126.7,126.4,126.0,125.9,124.8,124.6,123.2,120.2,120.1,120.1,114.4,113.8,101.3,55.6,50.7.hrms(esi)calculated for c
21h18
f3n4o
+
[m+h]
+
:399.1427,found:399.1438.
[0140]
(23)化合物32的制备:使用4-氟苯胺按照化合物9的合成步骤获得化合物32。对化合物32进行检测,其检测结果如下:1h nmr(400mhz,chloroform-d)δ8.70(s,1h),7.7-7.57(m,4h),7.21(d,j=6.2hz,2h),7.09-6.94(m,4h),6.55(s,1h),3.89(d,j=37.8hz,3h).
13
c nmr(100mhz,cdcl3)δ159.1,158.2,156.7,156.2,151.7,151.0,136.4,130.8,126.1,125.0,125.0,120.0,115.4,115.2,114.4,114.4,113.5,101.3,55.6.hrms(esi)c alculated for c
19h16
fn4o
+
[m+h]
+
:345.1303,found:345.1324.
[0141]
(24)化合物33的制备:使用3-氟苯胺按照化合物9的合成步骤获得化合物33。对化合物33进行检测,其检测结果如下:1h nmr(400mhz,dmso-d6)δ9.81(s,1h),8.86(s,1h),8.00(s,1h),7.77(d,j=8.9hz,2h),7.62(s,1h),7.48(s,1h),7.26(s,1h),7.12(s,2h),6.70(s,2h),3.85(s,3h).
13
c nmr(100mhz,cdcl3)δ160.1,155.6,151.0,141.5,134.6,130.6,126.4,125.1,124.9,124.8,121.3,121.3,118.1,116.3,116.2,114.6,114.6,101.4,55.6.hrms(esi)calculated for c
19h16
fn4o
+
[m+h]
+
:355.1303,found:355.1326.
[0142]
(25)化合物34-40的制备:使用4-(1,2,2-三苯基乙烯基)苯胺按照化合物9的合成步骤获得化合物34。使用4-腈基苯胺按照化合物9的合成步骤获得化合物35。使用9h-芴-2-胺按照化合物9的合成步骤获得化合物36。使用4-乙烯基苯胺按照化合物9的合成步骤获得化合物37。使用1-(4-氨基苯基)乙-1-酮按照化合物9的合成步骤获得化合物38。使用(e)-4-苯乙烯基苯胺按照化合物9的合成步骤获得化合物39。使用4-氨基苯甲酸乙酯按照化合物9的合成步骤获得化合物40。
[0143]
(26)化合物41的制备:将紫檀茋(90.0mg)溶于dmf中,向反应体系中加入碳酸钾(68.0mg,0.470mmol)随后室温搅拌2小时,加水(10ml)淬灭反应,用乙酸乙酯(20ml)萃取三次,合并有机相,浓缩后柱层纯化(石油醚:乙酸乙酯=3:1至1:1)得化合物41(白色固体,158mg,产率:53%)。
[0144]
(27)化合物42-46的制备:使用芘-2-胺按照化合物9的合成步骤获得化合物42。使用蒽-2-胺按照化合物9的合成步骤获得化合物43。使用萘-2-胺按照化合物9的合成步骤获
得化合物44。使用苯并呋喃-6-胺按照化合物9的合成步骤获得化合物45。使用3-氨基苯并呋喃-2-羧酸甲酯按照化合物9的合成步骤获得化合物46。
[0145]
实施例10:化合物49的制备
[0146]
化合物s12-49和49的结构如下所示:
[0147][0148]
具体制备方法为:
[0149]
1)化合物s13-49的制备:
[0150]
在n2保护下,将对炔基苯胺(300mg,2.56mmol)溶于thf(16ml),随后向反应体系中加入三乙胺(1.53ml,5.12mmol)、碘化亚铜(48.8mg,0.256mmol)、双三苯基膦二氯化钯(180mg,0.256mmol)和碘苯(891mg,3.84mmol),随后室温反应过夜,反应结束后,旋蒸蒸除溶剂,然后用水(10ml)和乙酸乙酯(20ml)萃取,合并并有机相随后柱层析纯化(石油醚:乙酸乙酯=3:1)获得化合物s13-49。
[0151]
2)化合物49的制备:
[0152]
将化合物s11(150mg,0.580mmol)溶解在1,4-二氧六环(6ml)中,加入s13-49(122mg,0.551mmol),加入醋酸钯(6.50mg,0.0290mmol),加入1,1'-联萘-2,2'-双二苯膦(36.0mg,0.0580mmol)和碳酸铯(282mg,0.870mmol)。放入油浴中,加热至110℃,回流8小时后,用硅藻土过滤,将瓶内的液体用旋转蒸发仪浓缩将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=4:1至2:1)得化合物49(白色固体,192mg,产率:71%)。
[0153]
实施例11:化合物50-54的制备
[0154]
化合物50-54的结构如下所示:
[0155][0156]
化合物50-54的制备:使用4-腈基碘苯按照化合物49的合成步骤获得化合物50。使用4-碘苯甲醛按照化合物49的合成步骤获得化合物51。使用3-碘-2-甲氧基吡啶按照化合物49的合成步骤获得化合物52。使用2-乙酰基-6-碘吡啶按照化合物49的合成步骤获得化合物53。使用4-羟基碘苯按照化合物49的合成步骤获得化合物54。
[0157]
实施例12:化合物55的制备
[0158]
化合物55和s15-55的结构如下所示:
[0159][0160]
具体制备方法为:
[0161]
1)化合物s15-55的制备:
[0162]
在n2保护下,将4-乙酰基苯胺(300mg,2.22mmol)溶于etoh(6ml),随后向反应体系中加入氢氧化钠(266mg,6.66mmol),10分钟后加入苯甲醛(349mg,2.66mmol),随后室温反应过夜,反应结束后,旋蒸蒸除溶剂,然后用水(10ml)和乙酸乙酯(20ml)萃取,合并并有机相随后柱层析纯化(石油醚:乙酸乙酯=3:1)获得化合物s15-55。
[0163]
2)化合物55的制备:
[0164]
将化合物s11(150mg,0.580mmol)溶解在1,4-二氧六环(6ml)中,加入s15-55(144mg,0.551mmol),加入醋酸钯(6.50mg,0.0290mmol),加入1,1'-联萘-2,2'-双二苯膦(36.0mg,0.0580mmol)和碳酸铯(282mg,0.870mmol)。放入油浴中,加热至110℃,回流8小时后,用硅藻土过滤,将瓶内的液体用旋转蒸发仪浓缩将得到的粗品用硅胶柱层析进行纯化(石油醚:乙酸乙酯=4:1至2:1)得化合物55(白色固体,135mg,产率:52%)。
[0165]
实施例13:化合物56-58的制备
[0166]
化合物56-58的结构如下所示:
[0167][0168]
化合物56-58的制备:使用4-腈基苯甲醛按照化合物55的合成步骤获得化合物56。使用肉桂醛按照化合物55的合成步骤获得化合物57。使用2-萘醛按照化合物55的合成步骤获得化合物58。
[0169]
实施例14:化合物59的制备
[0170]
化合物59和s17的结构如下所示:
[0171][0172]
具体制备方法为:
[0173]
1)化合物s17的制备:
[0174]
在n2保护下,将化合物s16(7h-吡咯并[2,3-d]嘧啶-2-胺)(250mg,1.86mmol)溶于dioxane(6ml),随后向反应体系中加入碘化亚铜(36.0mg,0.186mmol)、反式-1,2-环己二胺(213mg,1.86mmol)、磷酸钾(792mg,3.73mmol)和4-甲氧基碘苯(464mg,1.96mmol),随后回流反应过夜,反应结束并冷却至室温后,用硅藻土过滤,旋蒸蒸除溶剂,随后柱层析纯化(二氯甲烷:甲醇=40:1)获得化合物s17。
[0175]
2)化合物59的制备:
[0176]
将化合物s17(50.0mg,0.208mmol)溶解在二氯甲烷(2ml)中,加入三乙胺(45mg,0.624mmol)、肉桂酰氯(29.0mg,0.229mmol),室温反应过夜,随后然后用水(10ml)和二氯甲烷(20ml)萃取,合并并有机相随后柱层析纯化(石油醚:乙酸乙酯=3:1)得化合物59(白色固体,49.0mg,产率:72%)。
[0177]
实施例15:化合物60的制备
[0178]
化合物58的结构如下所示:
[0179][0180]
具体制备方法为:使用(e)-2-氰基-3-苯基丙烯酰氯按照化合物59的合成步骤获得化合物60。
[0181]
实施例16:化合物61的制备
[0182]
化合物61和s19-61的结构如下所示:
[0183][0184]
具体制备方法为:
[0185]
1)化合物s19-61的制备:
[0186]
在n2保护下,将化合物苯甲酸乙酯(1.00g,6.66mmol)溶于甲(60ml),随后向反应体系中加入水合肼(541mg,8.66mmol),随后回流反应过夜,反应结束并冷却至室温后,旋蒸蒸除溶剂,随后柱层析纯化(二氯甲烷:甲醇=50:1)获得化合物s19-61。
[0187]
2)化合物61的制备:
[0188]
将化合物38(263mg,0.734mmol)溶解在无水乙醇(7ml)中,加入两滴冰乙酸和合物s19-61(100mg,0.734mmol),回流反应过夜,反应结束并冷却至室温后,旋蒸蒸除溶剂,随后然后用水(10ml)和乙酸乙酯(20ml)萃取,合并并有机相随后柱层析纯化(二氯甲烷:甲醇=100:1)得化合物61(白色固体,260mg,产率:74%)。
[0189]
实施例17:化合物62的制备
[0190]
化合物62的结构如下所示:
[0191][0192]
具体制备方法为:使用2-呋喃甲酸乙酯按照化合物61的合成步骤获得化合物62。
[0193]
实施例18:usp51酶学研究
[0194]
利用ub-amc(c-末端-7-酰氨基标记泛素蛋白-4-甲基香豆素标记)法进行usp体外激酶活性测试,检测上述药物小分子与蛋白激酶的直接作用能力,价小分子活性。荧光底物a mc与泛素链结合不发射荧光,当usp将荧光底物amc从泛素链上切割下来后,amc发射荧光,通过检测荧光强度分析usp的抑制程度。同时,选择化合物二氢杨梅(dihydromyric etin,dih)和表没食子儿茶素(epigallocatechin,epi)作为阳性对照,具体测试结果如表1所示。ic
50
在0.01-0.1μm之间,标记为a,ic
50
在0.1-1μm,标记为b,活ic
50
在1-10μm,标记为c,ic
50
在10-30μm标记为d。
[0195]
表1
[0196][0197]
从表1结果可知,化合物17、19、34、39、40、41、42和50均显示出出色且优于阳性对照dhi和epi的抑制usp51的活性,且其中化合物34和42活性远超其他类似物,有望开发成为潜在的usp51小分子抑制剂。
[0198]
以上所述,只是本发明的较佳实施例而已,本发明并不局限于上述实施方式,只要其以相同的手段达到本发明的技术效果,都应属于本发明的保护范围。在本发明的保护范围内其技术方案和/或实施方式可以有各种不同的修改和变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1